Effects of Different Doses of Gastrodin on TLR4/MyD88/NF-κB Inflammatory Signal Pathway in Hippocampus of Methamphetamine Dependent CPP Rats
-
摘要:
目的 探讨不同剂量的天麻素(Gastrodin,Gas)对甲基苯丙胺(Methamphetamine,Meth)依赖条件性位置偏爱(Conditioned place preference,CPP)大鼠海马中TLR4/MyD88/NF-κB通路的作用。 方法 建立Meth(10 mg/kg,ip,14 d)依赖大鼠CPP模型,采用低中高剂量的天麻素(10、30、100 mg/kg)干预14 d后,采用Western blotting和RT-qPCR方法检测TLR4/MyD88/NF-κB信号通路中关键因子的蛋白和mRNA在海马中的表达水平。 结果 天麻素干预后TLR4、MyD88、NF-κB p65、TRAF6的蛋白和mRNA表达呈剂量依赖性降低 (P < 0.001、P < 0.01或P < 0.05)、p-NF-κB p65的蛋白表达呈剂量依赖性降低 (P < 0.01或P < 0.05) 、IκB-α的蛋白和mRNA表达呈剂量依赖性升高(P < 0.01或P < 0.05),天麻素干预后p-IκB-α的蛋白表达降低(P < 0.01)。 结论 天麻素干预对甲基苯丙胺依赖CPP大鼠海马的神经炎症具有保护作用,且与TLR4/MyD88/NF-κB信号通路密切相关。 -
关键词:
- 甲基苯丙胺依赖 /
- 条件性位置偏爱 /
- 海马 /
- 天麻素 /
- TLR4/MyD88/NF-κB信号转导通路
Abstract:Objective To investigate the effects of different dosages of gastrodin onTLR4/ MyD88 / NF-κB signal pathway in the hippocampus of methamphetamine (meth)dependence rats. Methods The conditioned place preference (CPP) model of meth was established, meth (10mg/kg) was administered (i.p, 14 d), and then, different dosages (10, 30, 100 mg/kg) of gastrodin were used to intervene in 14 days. Western blotting and RT-qPCR were used to explore the expression level of protein and mRNA of key factors in TLR4/ MyD88 / NF-κB signal pathway in hippocampus. Results Gastrodin decreased the protein and mRNA expression of TLR4, MyD88, TRAF6, NF-κBp65 in a dose-dependent manner (P < 0.001, P < 0.01 or P < 0.05), and the protein expression of p-NF-κB p65 was reduced with showing a significant dose-response relationship (P < 0.01 or P < 0.05). Gastrodin increased the protein and mRNA expression of IκB-α with showing a significant dose-response relationship (P < 0.01 or P < 0.05). Gastrodin reduced the protein expression of p-IκB-α (P < 0.01). Conclusion Gastrodin intervention has a protective effect against hippocampal neuroinflammation in methamphetamine-dependent CPP rats, and is closely related to the function of TLR4/MyD88/NF-κB signal pathway. -
肝衰竭是临床常见的严重肝病症候群, 病死率极高。治疗方案分为内科治疗,非生物型人工肝治疗及肝移植[1]。肝移植由于费用昂贵,肝源稀缺以及肝植后排异等各种原因,临床治疗肝衰竭难以普及。众多临床研究表明,相比单纯的内科治疗,在内科治疗的基础上联合非生物型人工肝治疗,肝衰竭患者的临床好转率明显提高[2-3]。昆明医科大学第二附属医院消化内科常用的非生物型人工肝模式主要包括血浆置换 (plasma exchange, PE),双重血浆分子吸附系统 (double plasma molecules adsorption system, DP-MAS),介入人工肝治疗的人群类型及总体肝衰竭患者治疗效果仍在不断探索验证中,本研究回顾了非生物型人工肝治疗肝衰竭患者的临床资料,为临床人工肝有效治疗肝衰竭提供依据。
1. 资料与方法
1.1 研究对象
回顾2017年1月至2020年12月于昆明医科大学第二附属医院消化内科住院行非生物型人工肝治疗肝衰竭患者112例,其中男性78例,女性34例,PE治疗有38例,DPMAS治疗57例,PE,DPMAS交替使用治疗17例。对其临床资料进行回顾性研究。研究经昆明医科大学第二附属医院伦理委员会批准。患者及家属知情同意,并签署人工肝治疗书面知情同意书。
1.2 纳入标准
112例患者均符合2018年《肝衰竭诊治指南》[1]中4种肝衰竭的诊断标准;诊治过程予以内科治疗联合非生物型人工肝治疗(血浆置换,双重血浆分子吸附系统 ,血浆置换 + 双重血浆分子吸附系统)。
1.3 排除标准
(1)排除意识及行为无自主性及患有精神类疾病;(2)合并妊娠;(3)合并原发性肾衰竭且规律透析;(4)肝移植患者。
1.4 方法
1.4.1 治疗方法
(1)内科基础治疗 112例患者入院后予以一般支持治疗,对症治疗,病因治疗及并发症内科综合治疗,在此基础上,根据患者病情给予不限次数及类型的非生物型人工肝治疗;(2)血浆置换(PE) 术前使用0.4%肝素钠盐水冲洗管路及血浆分离器,穿刺患者股静脉留置导管,术前使用地塞米松预防血浆过敏并根据患者病情及凝血功能在股静脉静脉端推注适量低分子肝素钠,连接血浆分离器3MUG7851(德国费森尤斯集团生产),每次置换同种异体血浆约2 500~3 000 mL,血液血流量速度为120~150 mL/min,血浆交换率为20~30 mL/min,治疗时间约为2~3 h;(3)双重血浆分子吸附系统(dual plasma molecular adsorption system,DPMAS) 术前使用0.4%肝素钠盐水冲洗管路及血浆分离器3MUG7851(德国费森尤斯集团生产),再使用0.08%肝素钠盐水以及0.4%肝素钠盐水串联冲洗健帆BS330离子交换树脂吸附器(珠海健帆生物科技股份有限公司生产)及HA330-II中性大孔树脂吸附器(珠海健帆生物科技股份有限公司生产)其余操作同血浆置换(PE),血流速度为140~150 mL/min,血浆回路由血泵以25~50 mL/min流速驱动,最后将被吸附血浆与分离出来血细胞混合输回患者体内,治疗时间为2~4 h;(4)血浆置换(PE),双重血浆分子吸附系统(DPMAS)交替使用根据患者病情选用PE或双重血浆分子吸附系统DPMAS,术后关注病情变化,根据患者病情变化,换用PE或DPMAS,间隔时间为2~5 d。
1.4.2 观察指标
收集112例患者姓名、年龄、性别、住院天数、住院费用、非生物型人工肝次数、非生物型人工肝类型、病因分类、肝硬化、肝性脑病以及第1次非生物型人工肝前的血生化指标以及出院前1d的血生化指标,包括:白蛋白(ALB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、胆碱酯酶(CHE)、总胆红素(TBil)、肌酐(CRER)、Na离子、血小板(PLT)、凝血酶原(PT)、国际标准化比例(international standardization ratio,INR)。并且引入终末期肝病模型(MELD 评分)对非生物型人工肝前及非生物型人工肝后的患者的肝脏情况进行评估。MELD分值[4] = 3.8×In[胆红素(10 mg/L)] + 11.2×In[肌酐(10 mg/L)] + 6.4×(病因:胆汁行或酒精行为0;其它为1)。
1.4.3 疗效判定
好转:(1)患者纳差、恶心、呕吐、腹胀、出血倾向等临床症状明显好转,肝性脑病症状消失;(2)黄疸、腹水等体征明显好转;(3)最后1次非生物型人工肝治疗后胆红素较峰值下降50%以上;(4)最后1次非生物型人工肝治疗后PTA > 40%或INR < 1.5。
无效:患者在治疗期间因治疗效果欠佳自动出院、转院或死亡,患者症状及临床表现无明显改善,最后1次非生物型人工肝治疗后PTA > 40%或INR < 1.5。
1.5 统计学处理
采用SPSS 24.0软件进行统计分析。计量资料,服从正态分布的数据采用(
$\bar x \pm s $ )表示;偏态分布的数据,采用中位数(M)表示,正态分布的计量资料采用独立样本t检验进行分析。计数资料采用 χ2检验进行分析,偏态分布的计量资料采用秩和检验进行分析。P < 0.05为差异有统计学意义。2. 结果
2.1 治疗前后患者肝功能、凝血、血常规疗效分析结果
112例肝衰竭患者在接受内科治疗的基础上行非生物型人工肝治疗后,实验室指标中ALB、ALT、AST、CHE、TBIL、DBIL、IBIL、PLT在治疗前后,差异有统计学意义(P < 0.05)。CREA、Na、PT、INR、MELD值,差异无统计学意义(P > 0.05)。其中,ALB、PT、INR值较非生物型人工肝治疗前增高,见表1。
表 1 非生物型人工肝治疗前后实验室指标变化Table 1. Changes of laboratory indexes before and after treatment of non-biological artificial liver实验室指标 治疗前(n = 112) 治疗后(n = 112) t/Z P ALB(g/L) 28.26 ± 4.99 31.36 ± 10.29 −2.970 0.004 ALT(U/L) 132.50 53.50 −8.020 < 0.001 AST(U/L) 162.50 75.50 −7.903 < 0.001 CHE(U/L) 3 039.96 ± 1 474.03 2 451.09 ± 1 123.36 3.896 < 0.001 TBIL(μmol/L) 333.70 209.75 −5.972 < 0.001 DBIL(μmol/L) 249.90 150.15 −5.966 < 0.001 IBIL(μmol/L) 74.10 54.15 −4.054 < 0.001 CREA(μmol/L) 69.00 67.00 −1.271 0.204 Na(mmol/L) 135.51 ± 7.14 135.95 ± 8.43 −0.784 0.435 PLT(×109/L) 118.00 89.50 −6.162 < 0.001 PT(s) 21.05 21.95 −0.666 0.505 INR 1.84 1.94 −0.186 0.853 MELD值 16.36 ± 7.10 14.28 ± 10.20 1.771 0.078 2.2 研究患者基线情况分析结果
根据行非生物型人工肝后的治疗结果,将112例肝衰竭患者分为好转组61例,无好转组51例,对2组一般情况进行统计学分析,除住院天数、预后时间及有无肝性脑病,差异有统计学意义(P < 0.05)外,其余指标,差异无统计学意义(P > 0.05)。其中,在住院费用、行非生物型人工肝次数无统计学差异的情况下,住院时间越长,非生物型人工肝后越长时间复查实验室指标,患者的预后情况越好。相比无好转组,好转组的肝性脑病患者明显较少,见表2。
表 2 基线数据Table 2. Baseline data基本情况 好转组(n = 61 ) 无好转组(n = 51 ) t/χ2 P 性别[n(%)] 0.374 0.541 女(n = 34) 20(58.8) 14(41.2) 男(n = 78) 41(52.6) 37(47.4) 年龄(岁) 50.67 ± 15.24 48.55 ± 13.26 −0.778 0.438 住院天数(d) 22.67 ± 9.10 17.94 ± 7.48 2.969 0.004 住院费用(d) 60296.70 ± 28099.83 60804.67 ± 44115.58 −0.074 0.941 预后时间(d) 6.00 3.00 −2.575 0.010 非生物型人工肝次数(次) 3 3 −0.653 0.514 乙肝[n(%)] 0.275 0.600 无乙肝(n = 71) 40(65.6) 31(60.8) 乙肝(n = 41) 21(34.4) 20(39.2) 肝硬化[n(%)] 0.945 0.331 无肝硬化(n = 36) 22(36.1) 14(27.5) 肝硬化(n = 76) 39(63.9) 37(72.5) 肝性脑病[n(%)] 4.325 0.038 无肝性脑病(n = 98) 57(93.4) 41(80.4) 肝性脑病(n = 14) 4(6.6) 10(19.6) 2.3 疗效指标分析结果
根据行非生物型人工肝后的治疗结果,将112例肝衰竭患者分为好转组61例,无好转组51例,其实验室数据在行非生物型人工肝治疗前,差异无统计学意义(P > 0.05);行非生物型人工肝治疗后,2组间AST、 TBIL、DBIL、IBIL、PT、INR、MELD值,差异有统计学意义(P < 0.05),其中,好转组指标明显低于无好转组,见表3。
表 3 非生物型人工肝治疗后实验室指标变化Table 3. Laboratory index changes after treatment of non-biological artificial liver实验室指标 好转组(n = 61 ) 无好转组(n = 51 ) t/Z P ALB(g/L) 30.90 30.30 −0.890 0.374 ALT(U/L) 52.00 55.00 −0.890 0.374 AST(U/L) 162.50 75.50 −7.903 < 0.001 CHE(U/L) 2223.00 2450.00 −1.540 0.124 TBIL(μumol/L) 174.00 280.90 −3.390 0.001 DBIL(μumol/L) 121.60 233.30 −3.080 0.002 IBIL(μumol/L) 41.00 72.70 −2.610 0.009 CREA(μumol/L) 67.00 67.00 −1.300 0.196 Na(mmol/L) 136.61 ± 4.54 135.17 ± 11.48 −0.904 0.368 PLT(×109/L) 95.00 77.00 −1.151 0.250 PT(s) 19.60 23.10 −2.913 0.004 INR 1.65 2.06 −3.059 0.002 MELD值 11.50 ± 8.58 17.60 ± 11.06 −3.283 0.001 3. 讨论
肝衰竭是指多种因素引起的严重肝脏损害, 导致合成、解毒、代谢和生物转化功能严重障碍或失代偿, 出现以黄疸、凝血功能障碍、肝肾综合征、肝性脑病、腹水等为主要表现的一组临床症候群[1]。临床上,肝衰竭患者病情进展较快,常出现多种并发症,总体预后较差,死亡率可高达70%,常规治疗效果不理想,病死率高达50%~80%[5-6]。非生物型人工肝等同于短期内的“体外肝脏”,暂时处理体内有害物质, 补充必需物质, 改善内环境, 为肝细胞再生及肝功能恢复创造条件或等待机会进行肝移植[1]。本研究中,肝衰竭患者非生物型人工肝前后转氨酶、胆红素明显较治疗前降低,白蛋白明显升高,非生物型人工肝快速改善肝衰竭患者肝功能,改善乏力、黄疸、腹胀等临床症状,与其它临床研究有相同结果[7-9]。从非生物型人工肝治疗肝衰竭疗效方面分析,非生物型人工肝治疗肝衰竭达到临床好转,好转组明显降低胆红素,改善凝血功能。非生物型人工肝临床治疗肝衰竭的疗效毋庸置疑,但治疗好转同时带来的不良反应,也要引起重视,尤其应注意非生物型人工肝介入治疗的时机选择。[10-12]。目前主张对肝衰竭患者的介入人工肝治疗的时间越早越好,尽量在前期、早期介入治疗。
在本研究中,112例肝衰竭患者,在住院费用及非生物型人工肝次数无统计学差异的情况下,非生物型人工肝疗效与住院时间及非生物型人工肝后复查实验室指标时间有关(P < 0.05),好转组的住院时间明显长于无好转组,有关血浆置换的Meta分析认为,血浆置换可以提高非移植慢加急肝衰竭患者的30 d及90 d生存率,同时,与单纯内科治疗相比,提高治疗早、中期肝衰竭的有效率,降低病死率[13-14]。无好转组中的肝性脑病患者明显多于好转组,肝性脑病是肝衰竭患者临床常见的严重并发症,非生物型人工肝用于伴有肝性脑病的患者,应慎重考虑,此外,肝性脑病的严重程度是肝衰竭患者生存影响因素之一,但在乙肝及自身免疫行肝炎引起的肝衰竭患者中,这种预后价值仍有待考证[15]。MELD值用是一个多因素评估模型,常用于肝衰竭患者的短期预后评估。在本研究中,尽管肝衰竭个体患者非生物型人工肝治疗前后MELD值,差异无统计学意义(P > 0.05),但总体对比,好转组的MELD值明显降低,差异有统计学意义(P < 0.05),就整体疗效而言,非生物型人工肝介入治疗可显著降低肝衰竭患者MELD值。有研究表明,MELD值与肝衰竭的病死率成正相关,MELD值越高,病死率越高,对此,可在患者入院时用MELD评估,科学介入非生物型人工肝治疗,降低患者死亡率,另外,MELD值还可指导HBV相关的肝衰竭病人选择非生物型人工肝[16-17]。
综上所述,本研究对非生物型人工肝临床治疗肝衰竭患者的疗效进行研究,非生物型人工肝治疗快速改善肝衰竭患者肝功能及凝血功能,降低胆红素,降低患者MELD值,提高患者短期内的治疗好转率,降低患者病死率。可优先用于胆红素明显升高,凝血指标异常的肝衰竭患者。
-
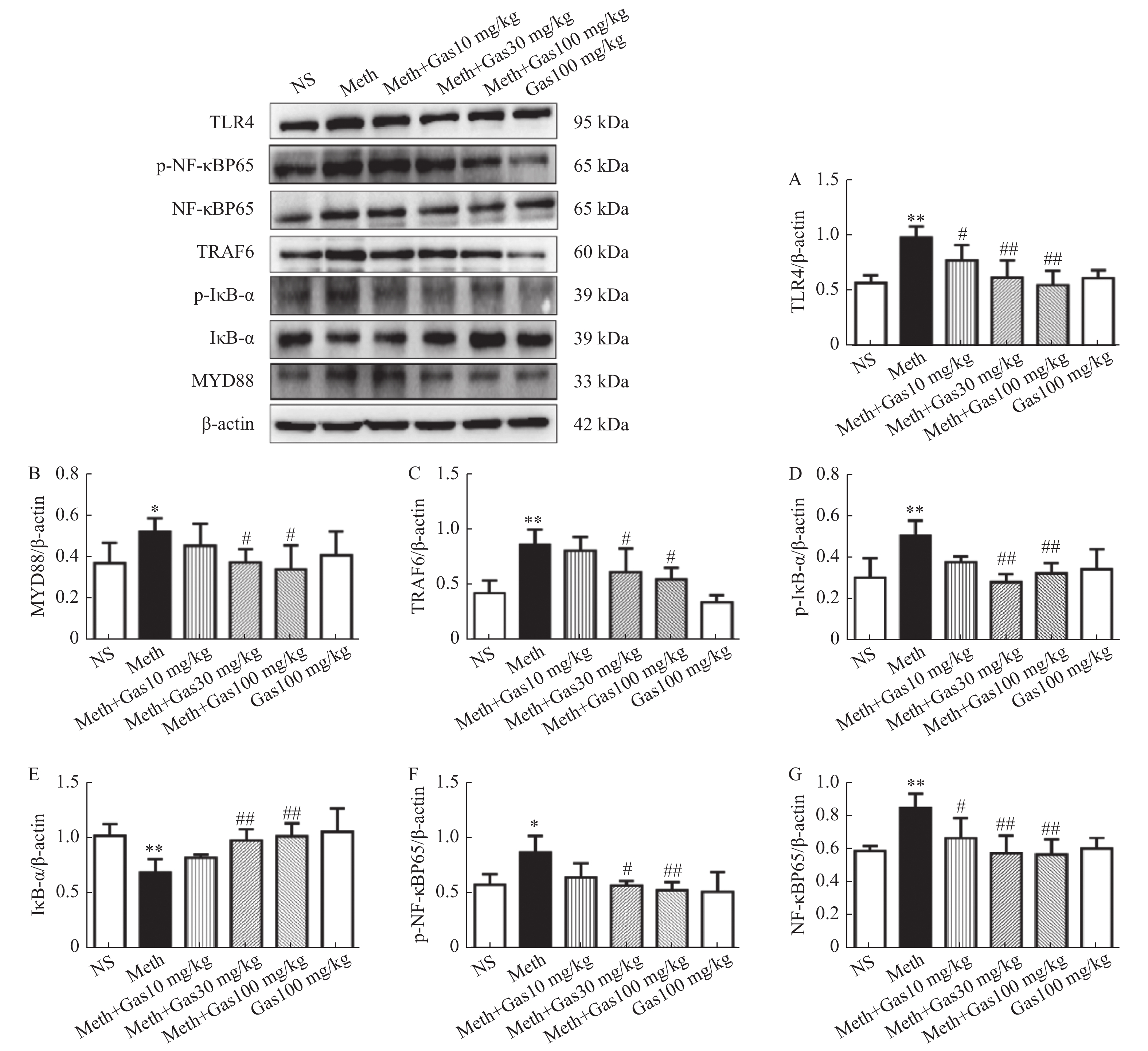
图 1 不同剂量天麻素对甲基苯丙胺依赖CPP大鼠海马TLR4、MyD88、TRAF6、p-IκB-α、IκB-α、NF-κB p65、p-NF-κB p65蛋白表达的影响
A~G:TLR4、MyD88、TRAF6、p-IκB-α、IκB-α、p-NF-κB p65、NF-κB p65蛋白的定量分析。与对照组比较,*P < 0.05;**P < 0.01;与Meth组比较,#P < 0.05, ##P < 0.01。
Figure 1. The effect of different doses of gastrodin on the expression of TLR4,MyD88,TRAF6,p-IκB-α,IκB-α,p-NF-κB p65,NF-κB p65 proteins in the hippocampus of methamphetamine-dependent rats
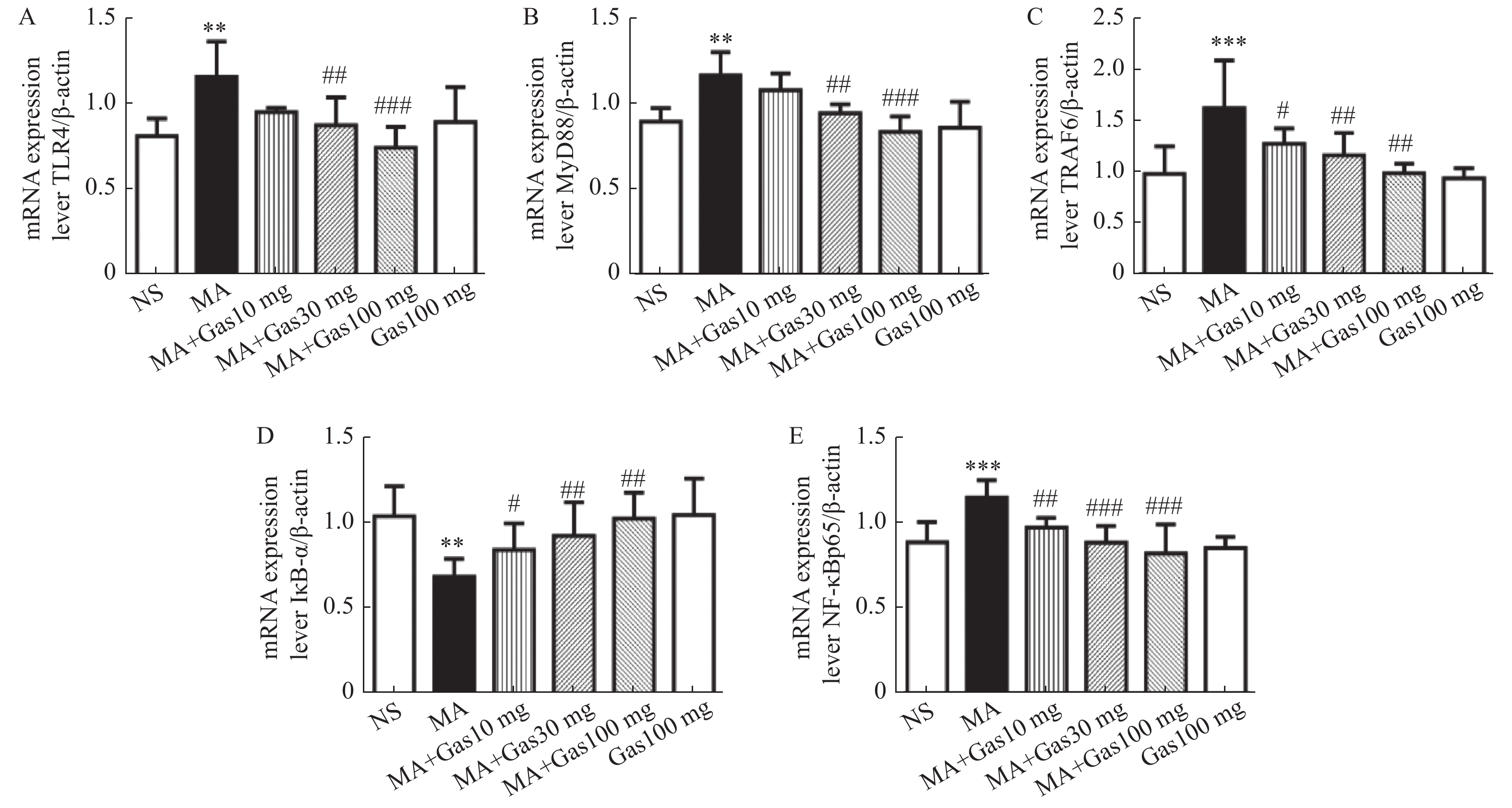
图 2 不同剂量天麻素对Meth依赖大鼠海马TLR4、MyD88、TRAF6、IκB-α、NF-κB p65 mRNA表达的影响
A-E:TLR4、MyD88、TRAF6、IκB-α、NF-κB p65 mRNA的定量分析。与对照组比较,**P < 0.01;***P < 0.001。与Meth组比较,#P < 0.05, ##P < 0.01,###P < 0.001。
Figure 2. The effect of different doses of gastrodin on the mRNA expression of TLR4,MyD88,TRAF6,IκB-α,NF-κB p65 in the hippocampus of meth-dependent rats
表 1 引物序列
Table 1. Primer Sequences
基因名称 引物序列 Tm TLR4 上游引物:5′-TGCCTGAGACCAGGAAGCTTG 3′
下游引物:5′-CTTAAGATCTTCAGGGGGTTG3′54 ℃ MyD88 上游引物:5′-TGAGAAAAGGTGTCGTCGCA3′
下游引物:5′-GGGTCCAGAACCAGGACTTG′54 ℃ TRAF6 上游引物:5′-GCCCATGCCGTATGAAGAGA 3′
下游引物:5′-CGTGACAGCCAAACACACTG3′54 ℃ NF-κB p65 上游引物:5′-GAGACCTGGAGCAAGCCATT3′
下游引物:5′-AGTTCCGGTTTACTCGGCAG3′54 ℃ IκB -α 上游引物:5′-GAATCCTGACCTGGTCTCGC′
下游引物:5′-CACAGTCATCGTAGGGCAACT3′55 ℃ β-actin 上游引物:5′-AGACAGCCGCATCTTGT-3′
下游引物:5′-CTTGCCGTGGGTAGAGTCAT-3′55 ℃ -
[1] Jayanthi S,Daiwile A P,Cadet J L. Neurotoxicity of methamphetamine: Main effects and mechanisms[J]. Experimental Neurology,2021,344(10):113795. [2] Mizoguchi H,Yamada K. Methamphetamine use causes cognitive impairment and altered decision-making[J]. Neurochemistry international,2019,124(3):106-113. [3] Kang E,Wen Z,Song H,et al. Adult Neurogenesis and Psychiatric Disorders[J]. Cold Spring Harbor Perspectives in Biology,2016,8(9):a019026. doi: 10.1101/cshperspect.a019026 [4] 赵敏. 物质依赖与精神疾病的共病问题[J]. 中国药物滥用防治杂志,2013,19(4):187-189. [5] Suleymanova E M. Behavioral comorbidities of epilepsy and neuroinflammation: Evidence from experimental and clinical studies[J]. Epilepsy & Behavior,2021,117(4):107869. [6] Fernández-Arjona María Del Mar,Grondona JM,Fernández-Llebrez P,et al. Microglial activation by microbial neuraminidase through TLR2 and TLR4 receptors[J]. Journal of Neuroinflammation,2019,16(1):1-14. doi: 10.1186/s12974-018-1391-2 [7] Vargas A M,Rivera-Rodriguze DE,Martinez LR. Methamphetamine alters the TLR4 signaling pathway,NF-κB activation,and pro-inflammatory cytokine production in LPS-challenged NR-9460 microglia-like cells[J]. Molecular Immunology,2020,121(5):159-166. [8] Xie X L,Zhou W T,Zhang K K,et al. METH-Induced Neurotoxicity Is Alleviated by Lactulose Pretreatment Through Suppressing Oxidative Stress and Neuroinflammation in Rat Striatum[J]. Frontiers in Neuroscience,2018,12(11):802. [9] 房尚萍,李海源,丁磊,等. 通过调节NF-κB通路中的IκB-α抑制乳腺癌的研究进展[J]. 锦州医科大学学报,2021,42(1):104-108. [10] 朱婷娜,刘鹏亮,董文娟,等. 不同剂量天麻素对甲基苯丙胺依赖大鼠条件位置偏爱及海马小胶质细胞激活的影响[J]. 昆明医科大学学报,2021,42(5):6-11. doi: 10.12259/j.issn.2095-610X.S20210502 [11] Gonçalves J,Baptista S,Martins T,et al. Methamphetamine-induced neuroinflammation and neuronal dysfunction in the mice hippocampus:Preventive effect of indomethacin[J]. The European Journal of Neuroscience,2010,31(2):315-326. doi: 10.1111/j.1460-9568.2009.07059.x [12] Mahmoudiasl G R,Abbaszadeh H A,Rezaei-Tavirani M,et al. Nod-like receptor protein 3 and nod-like receptor protein 1 inflammasome activation in the hippocampal region of postmortem methamphetamine chronic user[J]. Bratislavske Lekarske Llisty,2019,120(10):769-776. [13] Gonçalves J,Leitão R A,Higuera-Matas A,et al. Extended-access methamphetamine self-administration elicits neuroinflammatory response along with blood-brain barrier breakdown[J]. Brain,Behavior,and Immunity,2017,62(4):306-317. [14] Andoh M,Ikegaya Y,Koyama R. Microglia modulate the structure and function of the hippocampus after early-life seizures[J]. Journal of Pharmacological Sciences,2020,144(4):212-217. doi: 10.1016/j.jphs.2020.09.003 [15] Mckendrick G,Graziane N M. Drug-Induced Conditioned Place Preference and Its Practical Use in Substance Use Disorder Research[J]. Frontiers in Behavioral Neuroscience,2020,14(1):582147. [16] Bardo M T,Bevins R A. Conditioned place preference: what does it add to our preclinical understanding of drug reward?[J]. Psychopharmacology,2000,153(1):31-43. doi: 10.1007/s002130000569 [17] Green T A,Bardo M T. Opposite regulation of conditioned place preference and intravenous drug self-administration in rodent models: Motivational and non-motivational examples[J]. Neuroscience and Biobehavioral Reviews,2020,116(9):89-98. [18] Qu H,Liu R,Chen J,et al. Aerobic Exercise Inhibits CUMS-Depressed Mice Hippocampal Inflammatory Response via Activating Hippocampal miR-223/TLR4/MyD88-NF-κB Pathway[J]. International Journal of Environmental Research and Public Health,2020,17(8):2676. doi: 10.3390/ijerph17082676 [19] Cui Y,Wang Y,Zhao D,et al. Loganin prevents BV-2 microglia cells from Aβ(1-42) -induced inflammation via regulating TLR4/TRAF6/NF-κB axis[J]. Cell Biology International,2018,42(12):1632-1642. doi: 10.1002/cbin.11060 [20] Garmabi B,Mohaddes R,Rezvani F,et al. Erythropoietin improve spatial memory impairment following methamphetamine neurotoxicity by inhibition of apoptosis,oxidative stress and neuroinflammation in CA1 area of hippocampus[J]. Journal of Chemical Neuroanatomy,2022,124(6):102137. [21] Re GF,Li H,Yang JQ,et al. Exercise modulates central and peripheral inflammatory responses and ameliorates methamphetamine-induced anxiety-like symptoms in mice[J]. Frontiers in Molecular Neuroscience,2022,15(8):955799. [22] Du SH,Qiao DF,Chen CX,et al. Toll-Like Receptor 4 Mediates Methamphetamine-Induced Neuroinflammation through Caspase-11 Signaling Pathway in Astrocytes[J]. Frontiers in Molecular Neuroscience,2017,10(12):409. [23] Wang X,Chen L,Xu Y,et al. Gastrodin alleviates perioperative neurocognitive dysfunction of aged mice by suppressing neuroinflammation[J]. European Journal of Pharmacology,2021,892(3):173734. [24] Li S,Bian L,Fu X,et al. Gastrodin pretreatment alleviates rat brain injury caused by cerebral ischemic-reperfusion[J]. Brain Research,2019,1712(11):207-216. [25] Ye T,Meng X,Wang R,et al. Gastrodin Alleviates Cognitive Dysfunction and Depressive-Like Behaviors by Inhibiting ER Stress and NLRP3 Inflammasome Activation in db/db Mice[J]. International Journal of Molecular Sciences,2018,19(12):3977. doi: 10.3390/ijms19123977 [26] 刘英杰,姜茜,张胜娜. 天麻素对毛果芸香碱诱发的癫痫大鼠TLR4/NF-κB信号通路影响的研究[J]. 新中医,2020,52(4):1-6. doi: 10.13457/j.cnki.jncm.2020.04.001 [27] Mei Z,Huang B,Qian X,et al. Gastrodin improves preeclampsia-induced cell apoptosis by regulation of TLR4/NF-κB in rats[J]. Food Science & Nutrition,2020,8(2):820-829. [28] 文欢,张大燕,王伟,等. 天麻素对糖氧剥夺再复供皮层神经细胞NF-κB炎症级联信号通路表达的影响[J]. 中国实验方剂学杂志,2017,23(21):104-111. doi: 10.13422/j.cnki.syfjx.2017210104 [29] Zheng X,Gong T,Tang C,et al. Gastrodin improves neuroinflammation-induced cognitive dysfunction in rats by regulating NLRP3 inflammasome[J]. BMC Anesthesiology,2022,22(1):1-13. doi: 10.1186/s12871-021-01532-1 [30] 薛凤麟,洪仕君,曾晓峰,等. 天麻素注射液通过调节背侧纹状体miR-30a表达改善大鼠甲基苯丙胺成瘾的实验研究[J]. 中药药理与临床,2020,36(1):85-89. doi: 10.13412/j.cnki.zyyl.2020.01.009 [31] 薛凤麟,洪仕君,曾晓峰,等. 基于nNOS途径的天麻素注射液改善甲基苯丙胺诱导大鼠神经毒性损伤的作用机制研究[J]. 中国药房,2020,31(10):1171-1178. doi: 10.6039/j.issn.1001-0408.2020.10.04 期刊类型引用(4)
1. 谭荣欣. 非生物型人工肝治疗肝功能衰竭的疗效观察. 现代诊断与治疗. 2024(17): 2636-2637+2640 .  百度学术
百度学术2. 杨军杰,钟炎平,毛静,刘鑫华,李姗,刘园园,雷旭,雷飞飞,雷雨,郭鹏,胡波,刘志新,谭华炳. 血浆置换联合双重血浆分子吸附治疗对乙型肝炎病毒相关慢加急性肝功能衰竭肝细胞再生的影响. 中国医学创新. 2023(05): 63-69 .  百度学术
百度学术3. 乔艳,刘传苗,李冬冬,赵文,巴志伟,汪小玲,张妹,郭普. 人工肝治疗肝衰竭患者医院感染危险因素分析及预测模型构建. 右江民族医学院学报. 2023(03): 458-462 .  百度学术
百度学术4. 乔艳,刘传苗,汪小玲,张妹,李冬冬,郭普. 人工肝治疗肝衰竭病人医院感染调查及危险因素分析. 蚌埠医学院学报. 2023(06): 758-761 .  百度学术
百度学术其他类型引用(1)
-







 下载:
下载:
 下载:
下载: