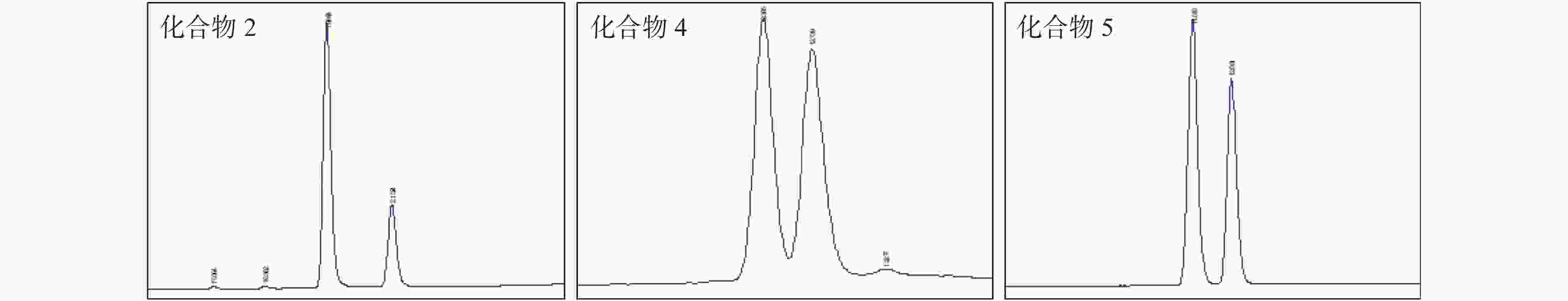
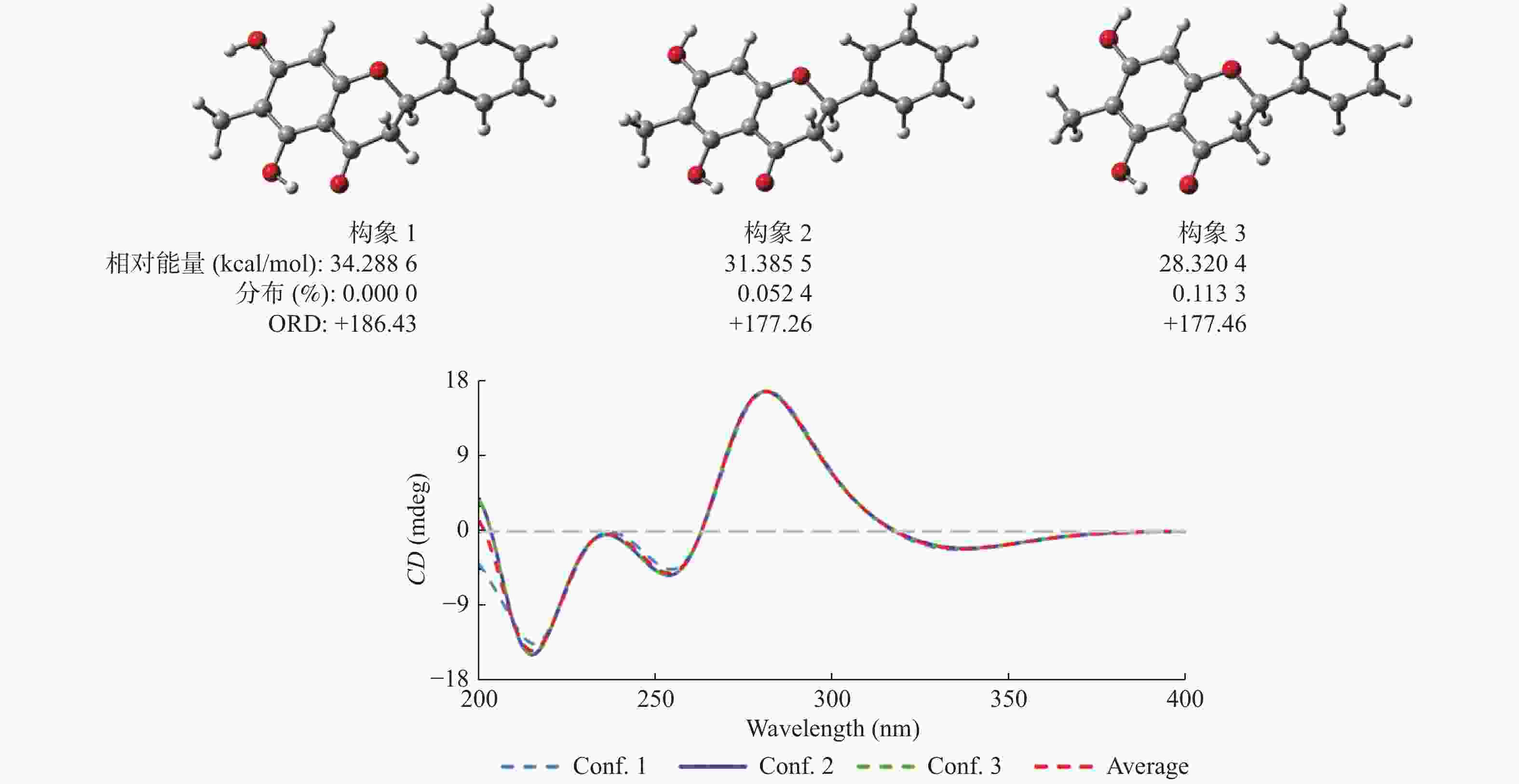
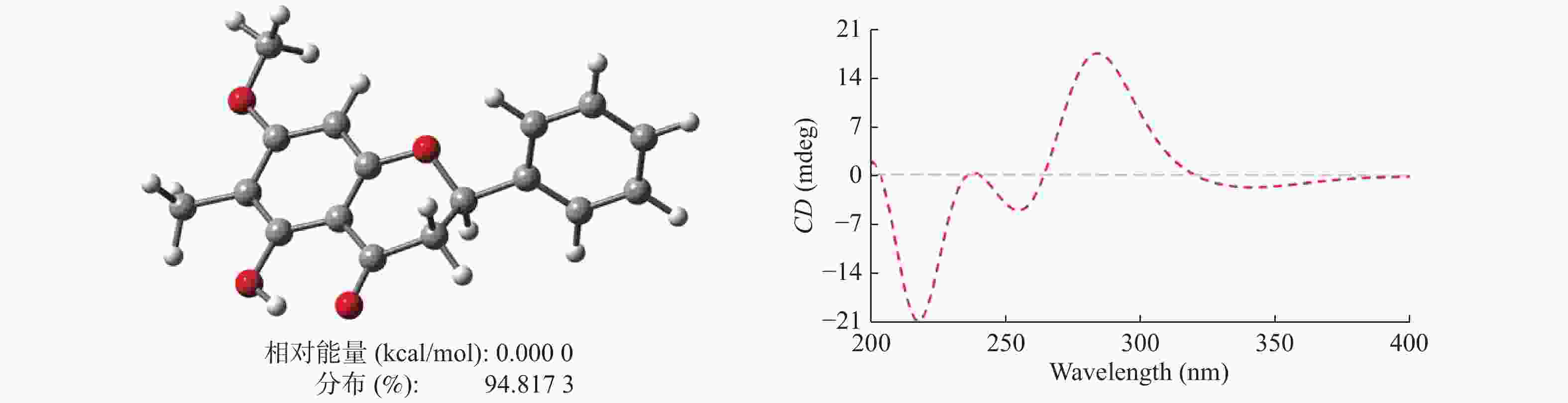
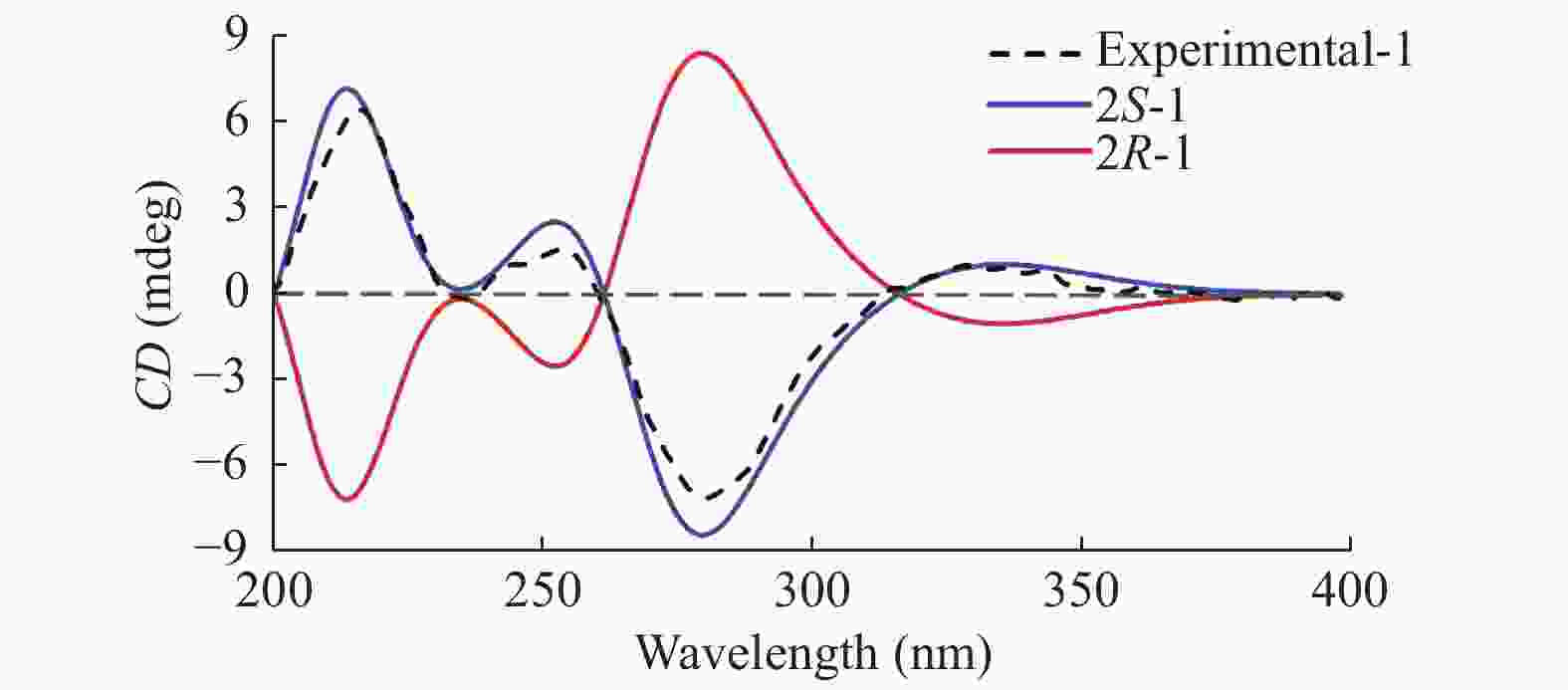
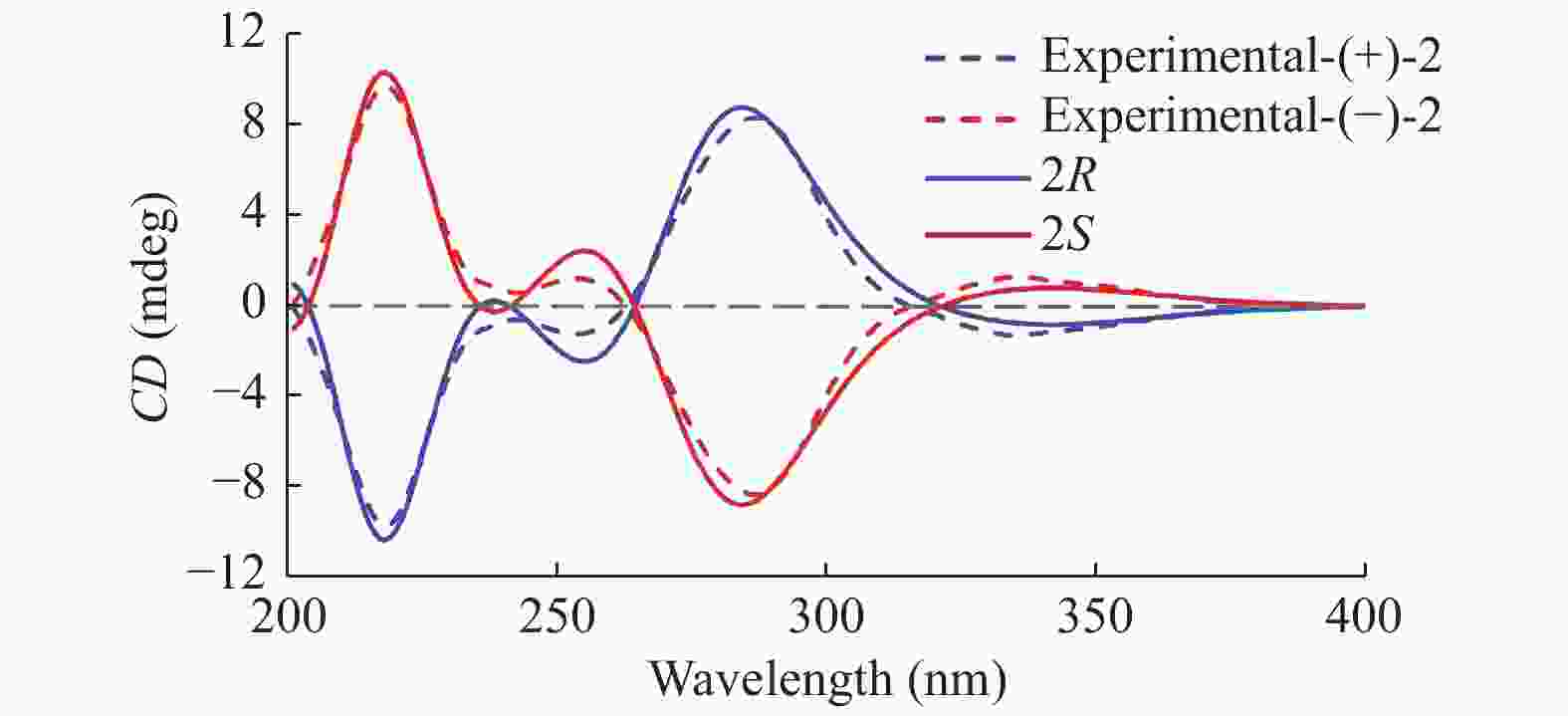
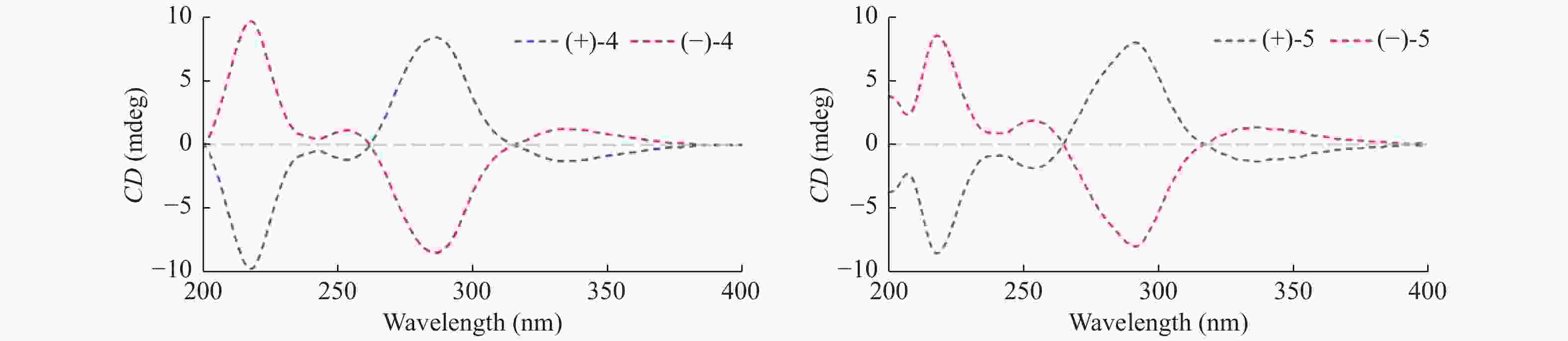
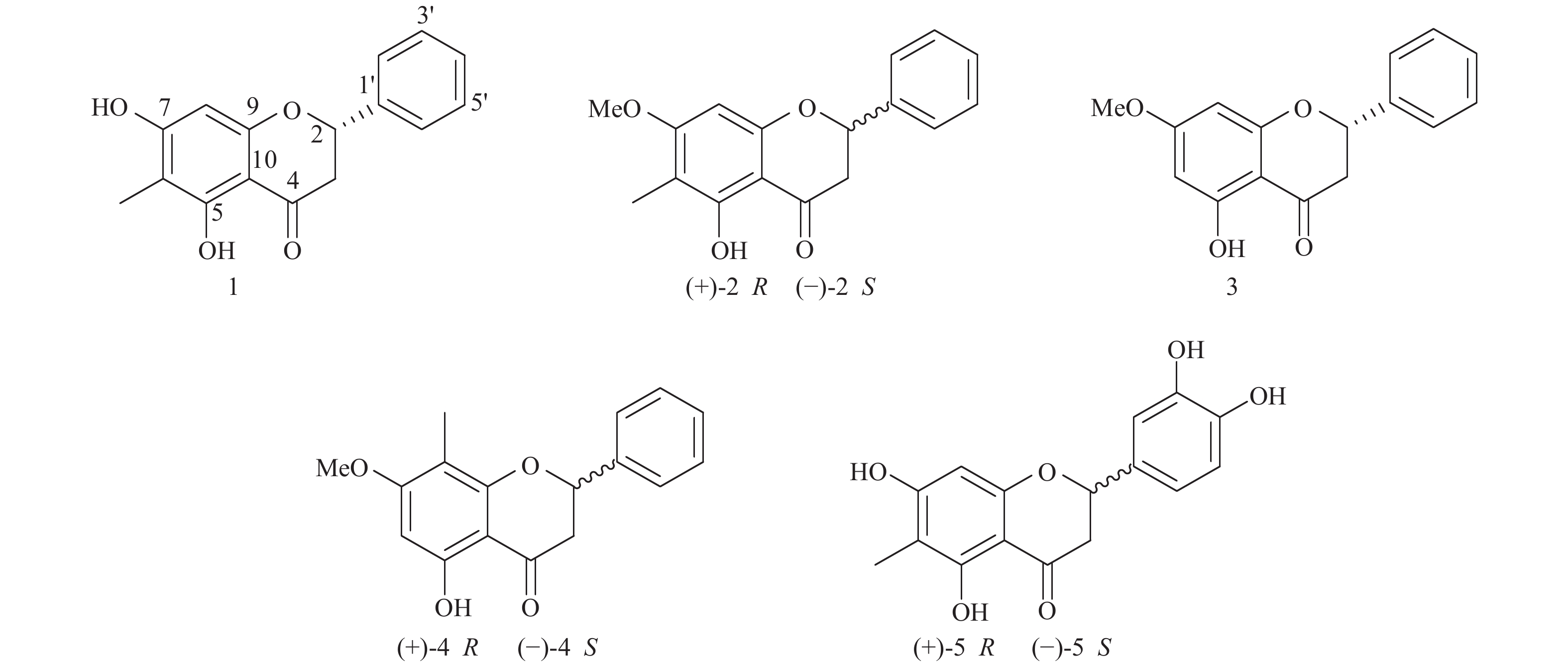
|
[1]
|
广西壮族自治区卫生厅. 广西中药材标准[M]. 南宁: 广西科技出版, 1996: 1.
|
|
[2]
|
Boozari M, Ebrahimi S N, Soltani S, et al. Absolute configuration and anti-cancer effect of prenylated flavonoids and flavonostilbenes from Sophorapachycarpa: Possible involvement of Wnt signaling pathway[J]. Bioorg Chem,2019,85:498‒504.
|
|
[3]
|
Yan H W, Zhu H, Yuan X, et al. Eight new biflavonoids with lavandulyl units from the roots of Sophoraflavescens and their inhibitory effect on PTP1B[J]. Bioorg Chem,2019,86:679‒685.
|
|
[4]
|
Zhu H, Yang Y N, Feng Z M, et al. Sophoflavanones A and B, two novel prenylated flavanones from the roots of Sophoraflavescens[J]. BioorgChem,2018,79:122‒125.
|
|
[5]
|
Navrátilová A, Schneiderová K, Veselá D, et al. Minor C-geranylated flavanones from Paulownia tomentosafruits with MRSA antibacterial activity[J]. Phytochemistry,2013,89:104‒113.
|
|
[6]
|
Ryu H W, Park M H, Kwon O K, et al. Anti-inflammatory flavonoids from root bark of Broussonetiapapyrifera in LPS-stimulated RAW264.7 cells[J]. BioorgChem,2019,92:103233.
|
|
[7]
|
Ma S G, Wang R B, Li W R, et al. New C-2 diastereomers of flavanone glycosides conjugated with 3-hydroxy-3-methylglutaric acid from the pericarp of Citrus grandis (L.) Osbeck[J]. BioorgChem,2018,80:519‒524.
|
|
[8]
|
Newman D J, Cragggm. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019[J]. J Nat Prod,2020,83(3):770‒803.
|
|
[9]
|
Wollenweber E, Dietz V H, Schilling G, et al. Flavonoids from chemotypes of the goldback fern, Pityrogrammatriangularis[J]. Phytochemistry,1985,24(5):965‒971.
|
|
[10]
|
Mayer R. Flavonoids from Leptospermum scoparium[J]. Phytochemistry,1990,29(4):1340‒1342.
|
|
[11]
|
Smolarz H D, Mendyk E, Bogucka-kocka A, et al. Pinostrobin--an anti-leukemic flavonoid from Polygonumlapathifolium L. ssp. nodosum (Pers.) Dans[J]. CJ Biosci,2006,61(1-2):64‒68.
|
|
[12]
|
Bertelli D, Papotti G, Bortolotti L, et al. 1H-NMR simultaneous identification of health-relevant compounds in propolis extracts[J]. Phytochem Anal,2012,23(3):260‒266.
|
|
[13]
|
Junior G M V, Sousa C M D, Cavalheiro A J, et al. Phenolic derivatives from fruits of dipteryxlacuniferaducke and evaluation of their antiradical activities[J]. HelvChimActa,2008,91(11):2159−2167.
|
|
[14]
|
Huang Y H, Zeng W M, Li G Y, et al. Characterization of a new sesquiterpene and antifungal activities of chemical constituents from Dryopterisfragrans (L.) Schott[J]. Molecules,2014,19(1):507‒513.
|
|
[15]
|
Barton G M. 7-O-β-D-Glucosyl-3', 4', 5-trihydroxy-6-methyl flavanone-a new C-methyl flavanone glycoside from Douglas-fir [Pseudotsugamenziesii (Mirb.) Franco] roots[J]. Can J Chem,1969,47(5):869‒871.
|
|
[16]
|
Wu Z B, Zhao Y Y, Yang X W, et al. Flavonoids from Bauhinia glauca subsp. pernervosa[J]. Chem Pharm Bull,2009,57(6):628‒631.
|
|
[17]
|
Finefield J M, Sherman D H, Kreitman M, et al. Enantiomeric natural products: occurrence and biogenesis[J]. AngewChemInt Ed,2012,51(20):4802‒4836.
|
|
[18]
|
Batista A N L, Santos F M, Batista J M, et al. Enantiomeric mixtures in natural product chemistry: separation and absolute configuration assignment[J]. Molecules,2018,23(2):492‒509.
|





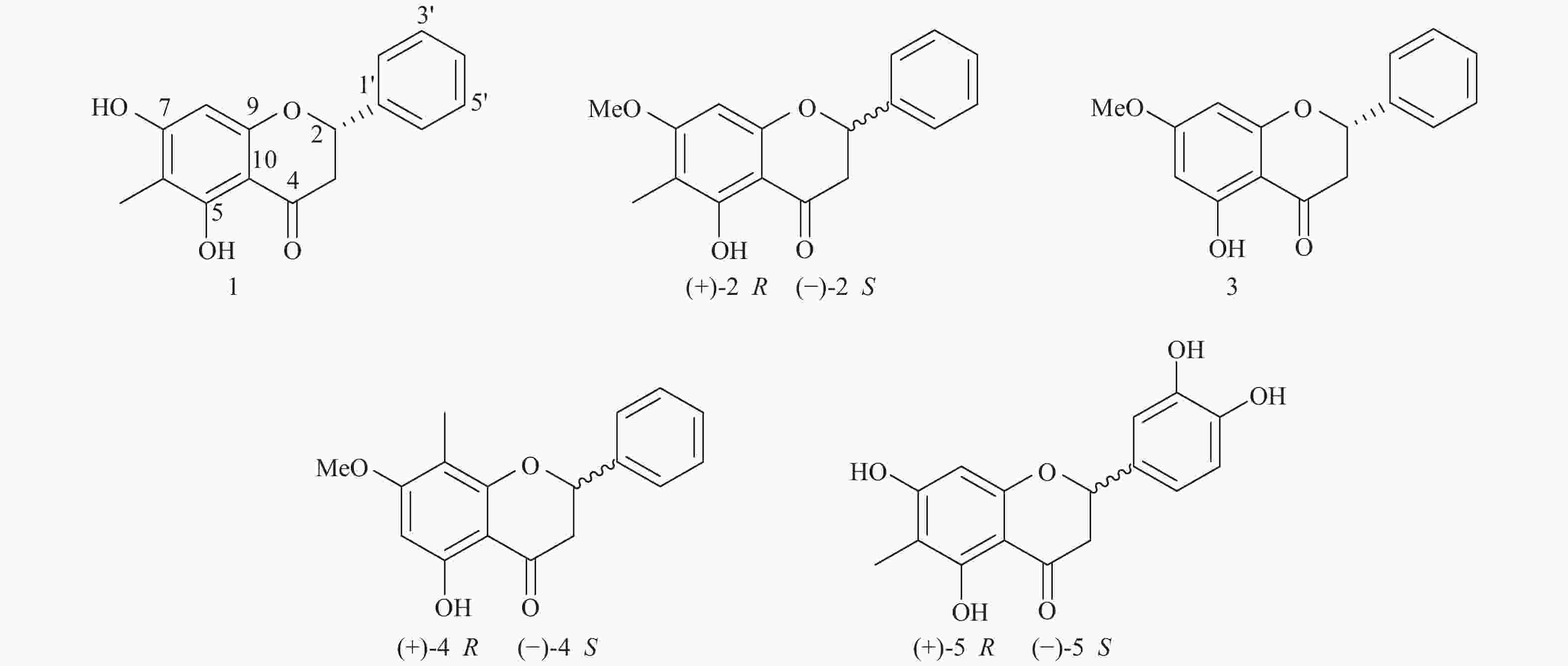
 下载:
下载: