Interventional Treatment of Muscular Ventricular Septal Defect in Children
-
摘要:
目的 探讨应用Cardi-O-Fix Plug封堵器治疗儿童肌部室间隔缺损(muscular ventricle septal defect,mVSD)的有效性和安全性。 方法 将昆明医科大学第一附属医院从2015年7月至2021年6月心内科收治的14例mVSD患儿作为研究对象。分为实验组(14例)和对照组(10例),实验组采用Cardi-O-Fix Plug封堵器进行封堵,对照组采用Cardi-O-Fix mVSD封堵器进行封堵。术后1d以及随访1个月、3个月、6个月采用经胸超声心动图和心电图评价封堵疗效及并发症的发生情况。 结果 24例患儿中22 例成功封堵,2例封堵失败(实验组和对照组各1例),实验组成功率92.8%(13/14),对照组成功率90.0%(9/10)。实验组的平均手术时长(71.93±14.85)min,对照组的平均手术时间时长(90.70±19.78)min,二者比较差异有统计学意义(P < 0.05)。实验组和对照组在术中及随访期间均未出现严重并发症。比较不同时间点2组的心脏超声指标(包括左室射血分数、左室舒张末期内径以及肺动脉压),差异均无统计学意义( P > 0.05)。 结论 采用Cardi-O-Fix Plug封堵器在经皮导管封堵心尖部及小梁部的儿童mVSD手术安全有效,短期及中长期发生心律失常的概率低。 Abstract:Objects To explore the effectiveness and safety of using the Cardio-O-Fix Plug occluder in the treatment of muscular ventricular septal defect(mVSD) in children. Methods 14 patients with mVSD were taken to the cardiology department of First Affiliated Hospital of Kunming Medical University from July 2015 to June 2021 as research subjects. They were divided into two groups: 14 children who received Cardi-O-Fix Plug occluder as the experimental group, and 10 children who received Cardi-O-O-Fix mVSD occluder as the control group. Electrocardiogram and transthoracic echocardiography were used to evaluate the occlusive efficacy and incidence of complications 1 day after surgery and 1 month, 3 months, and 6 months of follow-up. Results Among the 24 pediatric patients, 22 cases were successfully occluded, and 2 cases were unsuccessful(1 in the experimental group and 1 in the control group). The success rate of the experimental group was 92.8%(13/14), while the success rate of the control group was 90.0%(9/10). The average surgical duration of the experimental group was(71.93 ± 14.85) minutes, while the average surgical duration of the control group was(90.70 ± 19.78) minutes. There was a significant statistical difference between the two groups(P < 0.05). Both the experimental group and the control group did not experience serious complications during surgery and follow-up. There was no significant difference in cardiac ultrasound indicators(including left ventricular ejection fraction, left ventricular end-diastolic diameter, and pulmonary artery pressure) between the two groups at different time points( P > 0.05). Conclusion Transcatheter closure of mVSD using Cardi-O-Fix Plug occluder in children is both safe and effective. The incidence of arrhythmia is low in the short, medium and long term. -
Key words:
- Ventricular septal defect /
- Muscule /
- Occluder /
- Domestic /
- Percutaneous intervention /
- Congenital heart disease /
- Children
-
增生性瘢痕(hypertrophic scar,HS)是病理性瘢痕的一种[1]。它由人类组织创伤后局部组织成纤维细胞异常增殖及胶原蛋白合成、分泌紊乱以及引起细胞外基质(extracellular matrix,ECM)的过度沉积而形成,成纤维细胞的过度增殖及合成、分泌旺盛过度沉积,是HS的主要生物学基础[2]。现有研究表明,活化的PI3K/Akt信号通路表现出抗凋亡作用,参与调控多种细胞增殖、上皮间质转化、凋亡、迁移与分化等生理过程[3],但PI3K/Akt信号通路在HS发生发展进程中的调控机制尚不清楚。为此,本研究构建HS兔耳模型,评估阻断PI3K/Akt信号通路对兔耳瘢痕的生长抑制作用及Akt在Thr-308(p-Akt[T308])和Ser-473(p-Akt[S473])磷酸化对成纤维细胞凋亡的影响,以期初步探讨PI3K/Akt信号通路抑制剂对HS形成的影响。
1. 材料与方法
1.1 主要材料及试剂
新西兰大白兔购自昆明医科大学动物实验中心;PI3K抑制剂(LY294002)、DMSO、兔抗Akt[pS473]单克隆抗体、鼠抗Akt[pT308]单克隆抗体、GAPDH、HRP标记羊抗鼠IgG、HRP底物、驴抗兔Cy3荧光二抗、驴抗小鼠FITC荧光二抗均购自美国Merck Millipore公司;TUNEL试剂盒、POD、蛋白酶K、DNase I均购自Roche公司;蛋白Marker购自Fermentas;RIPA裂解液和PMSF均购自上海碧云天生物技术有限公司;羊抗兔IgG购自福州迈新生物技术开发技术有限公司。
1.2 实验方法
1.2.1 增生性瘢痕模型构建与分组
将20只新西兰大白兔用随机分为4组(每组5只):正常兔耳皮肤组(A)、增生瘢痕模型组(B)、DMSO处理增生瘢痕组(C)、LY294002处理增生瘢痕组(D)。B、C、D组构建兔耳软骨膜缺损创面,A组为假手术组。术后第2天,D组大白兔每个创面通过局部湿敷0.5 mL的LY294002(100 μmol/L),C组采用等体积的DMSO处理,连续外敷21 d,且药物实验方法同D组。于术后60 d取材,并于取材前记录和测量兔耳瘢痕厚度、颜色、硬度。本研究已获得云南省第二人民医院医学伦理委员会批准(审批号:20180331)。
1.2.2 组织病理学检查观察形态学变化
将收集的正常皮肤和瘢痕组织标本采用4%多聚甲醛固定组织标本8~12 h。随后,将组织脱水、浸蜡、包埋及切片。之后,烤片、脱蜡及水化。干片后,常规中性树胶封片,并于显微镜下观察兔耳表皮及真皮的变化并拍照(40倍)。增生块相对厚度 = (增生块厚度-软骨厚度)/耳腹面皮肤全层厚度。
1.2.3 免疫组化法检测p-Akt[S473]和p-Akt[T308]在组织中的表达量
常规石蜡切片及样品处理:3%H2O2孵育,PBS冲洗。抗原修复:0.01 mmol/L枸橼酸缓冲溶液(pH = 6.0)加热沸腾后断电,PBS冲洗。山羊血清封闭30 min。一抗孵育:兔抗p-Akt[S473]单克隆抗体和鼠抗p-Akt[T308]单克隆抗体,湿盒孵育,PBS冲洗。二抗孵育:羊抗兔IgG,方法同一抗。DAB显色:于室温条件下孵育,结束后采用PBS冲洗。复染:采用苏木素继续染色,并通过自来水洗刷样品。最后,将样本于200倍镜下观察。
1.2.4 Western blot检测总Akt、p-Akt[T308]和p-Akt[S473]在组织中的表达量
将收集的兔耳创面组织(100 mg),加入500 μL RIPA裂解液进行裂解。完成后,将裂解样本采用离心机(14 000 r/min)于低温(4 ℃)条件下离心10 min,取上清液备用。随后,样本蛋白与5×SDS样品缓冲液混匀,100 ℃水浴煮沸变性5 min。SDS-PAGE和免疫印迹杂交:按照每泳道35 μL总蛋白进行电泳、转膜、洗膜及封闭,按每平方厘米膜加0.1 mL兔抗p-Akt[S473]单克隆抗体(1∶1000)、鼠抗p-Akt[T308]单克隆抗体(1∶1000)及总Akt抗体(1∶1000),4 ℃过夜,洗膜,加入二抗HRP标记的羊抗兔IgG(1∶1000)室温下封闭2 h,洗膜后加入化学发光液,曝光和扫描后计算待测目的蛋白含量。
1.2.5 免疫荧光双染色法检测p-Akt[T308]和p-Akt[S473]在瘢痕组织中的表达
将包埋有样品的样品托置于恒温冰冻切片机中(-20 ℃)连续切片4 μm,载玻片贴附组织切片,置于FPA固定液中固定30 min,PBS冲洗,5%山羊血清湿盒室温封闭1 h,加一抗兔抗p-Akt[S473]单克隆抗体(1∶250)及鼠抗p-Akt[T308]单克隆抗体(1∶200),湿盒孵育,4 ℃过夜。0.3% Trition-X100溶液漂洗,于暗室内同时加荧光二抗驴抗小鼠FITC(1∶200)及驴抗兔Cy3(1∶200),37 ℃室温避光孵育2 h。0.3% Trition-X100溶液避光漂洗,封片后观察图片,并采集图像。
1.2.6 TUNEL法测定皮肤组织中成纤维细胞凋亡情况
常规制作石蜡切片及样本预处理:以蛋白酶K孵育切片,PBS冲洗。标记:将TUNEL混合液浸入样本,反应1 h后(室温)采用PBS冲洗。信号转化:过氧化酶POD溶液均匀分布样本,并于暗湿盒孵育样本半小时。显色:将处理后的样本采用DAB显色,结束后用PBS清洗。复染:采用苏木素对显色后的样本进行复染,结束后采用自来水清洗。最后,将样本于200倍镜下观察。
1.3 统计学处理
采用SPSS20.0软件进行相关数据的统计学分析,计量资料用(
$ \bar x \pm s $ )表示。2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两多重比较采用SNK-q检验。P < 0.05为差异有统计学意义。2. 结果
2.1 组织形态学变化
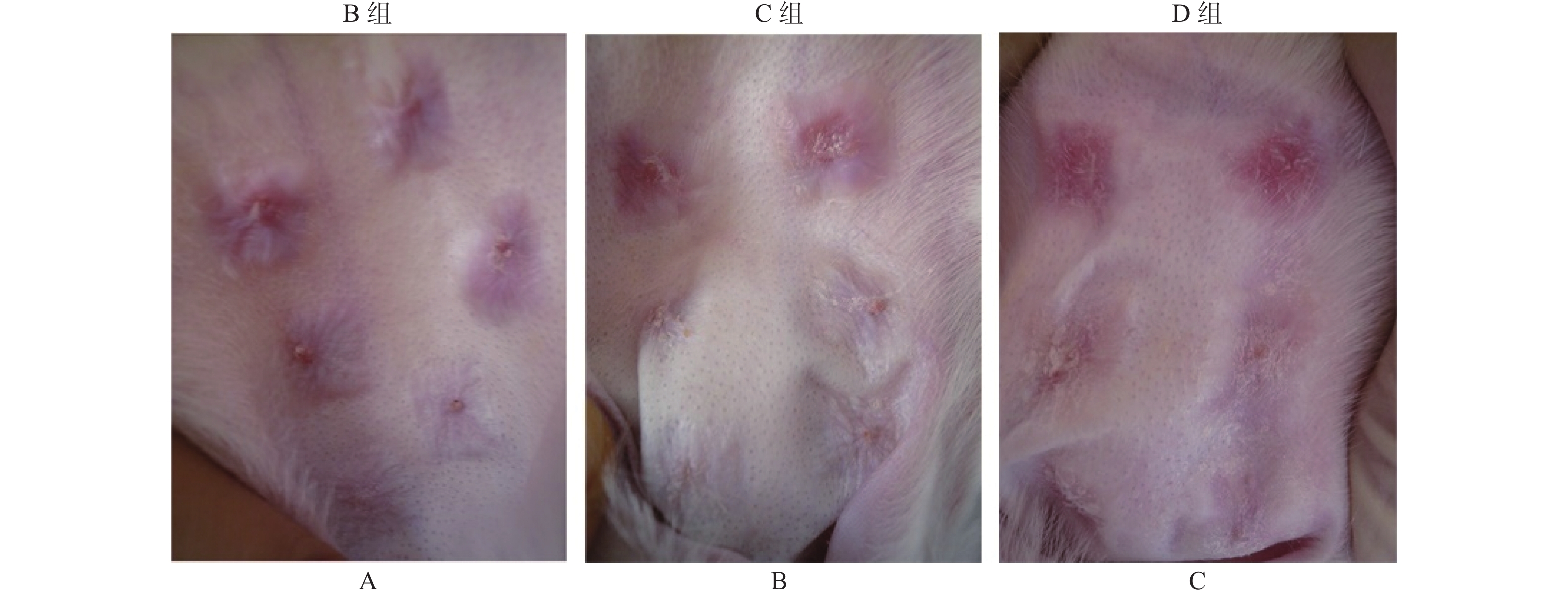
从图1中可以看出,B组大白兔软骨膜缺损创面瘢痕增生,突出皮面部充血肿胀,颜色为暗红色,质硬度。C组创面瘢痕淡红色,突出皮面,厚度及硬度较B组无见明显变化。D组创面瘢痕淡红色,颜色、突出皮面和硬度较B和C组有明显差异。
2.2 组织病理学变化
低倍镜下观察发现,B组和C组兔耳瘢痕组织皮层增厚,成纤维细胞增殖,炎性细胞浸润,胶原纤维排列紊乱,并血管分布。同时,瘢痕组织在D组明显变薄,血管较少。高倍镜下观察,B和C组瘢痕组织中有较多炎细胞浸润,成纤维细胞较多;D组中瘢痕厚度低于C组,炎细胞及成纤维细胞数量减少(P < 0.05),见表1,但B组与C组相比差异无统计学意义(P > 0.05)。
表 1 各组增生块相对增生厚度测量结果[n = 5,($ \bar x \pm s $ )]Table 1. The thickness of scar tissue in different groups [n = 5,($ \bar x \pm s $ )]组别 n 厚度(mm) F P B组 5 2.23 ± 0.38 1.177 0.37 C组 5 2.09 ± 0.10 D组 5 1.94 ± 0.08* 与C组相比,*P < 0.05。 2.3 免疫组化分析p-Akt[S473]和p-Akt[T308]在兔耳创面组织中的表达
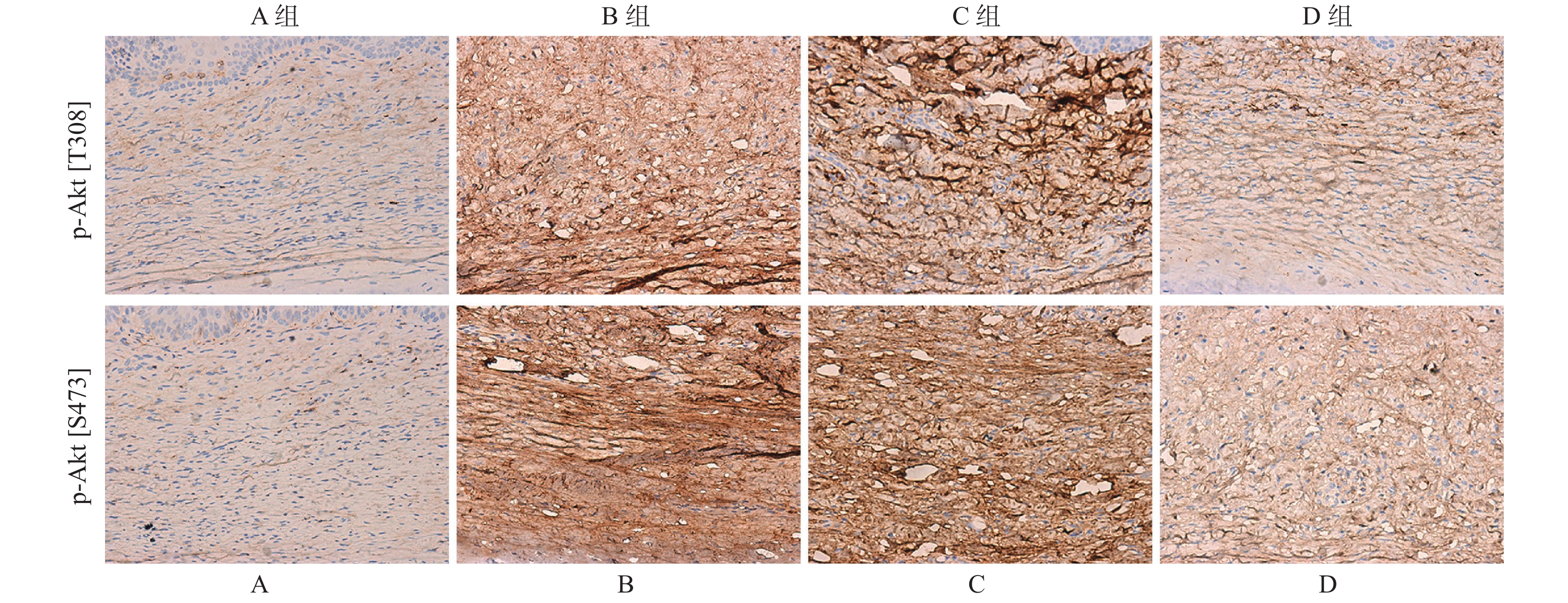
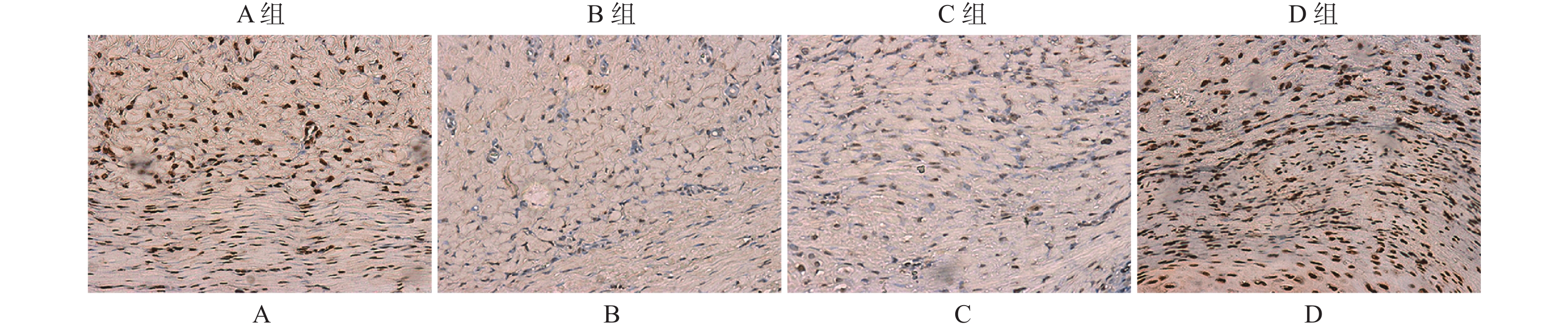
免疫组织化学分析结果显示,PI3K/Akt信号通路下游底物p-Akt[S473]和p-Akt[T308]在B组瘢痕组织中的染色阳性率要高于A组(图2)。D组中p-Akt[S473]和p-Akt[T308]染色阳性率显著低于C组(图2),但B组和C组中p-Akt[S473]和p-Akt[T308]染色阳性率无明显差异。
2.4 Western blot分析总Akt、p-Akt[T308]和p-Akt[S473]在兔耳创面中的表达水平
相比于A组,总Akt、p-Akt[T308]及p-Akt[S473]的表达量在B组显著升高,且差异具有统计学意义(图3,P < 0.05)。相比于B组,总Akt、p-Akt[T308]及p-Akt[S473]的表达量在D组中显著下调(图3,P < 0.05),但C组中表达基本一致,差异无统计学意义(P > 0.05)。
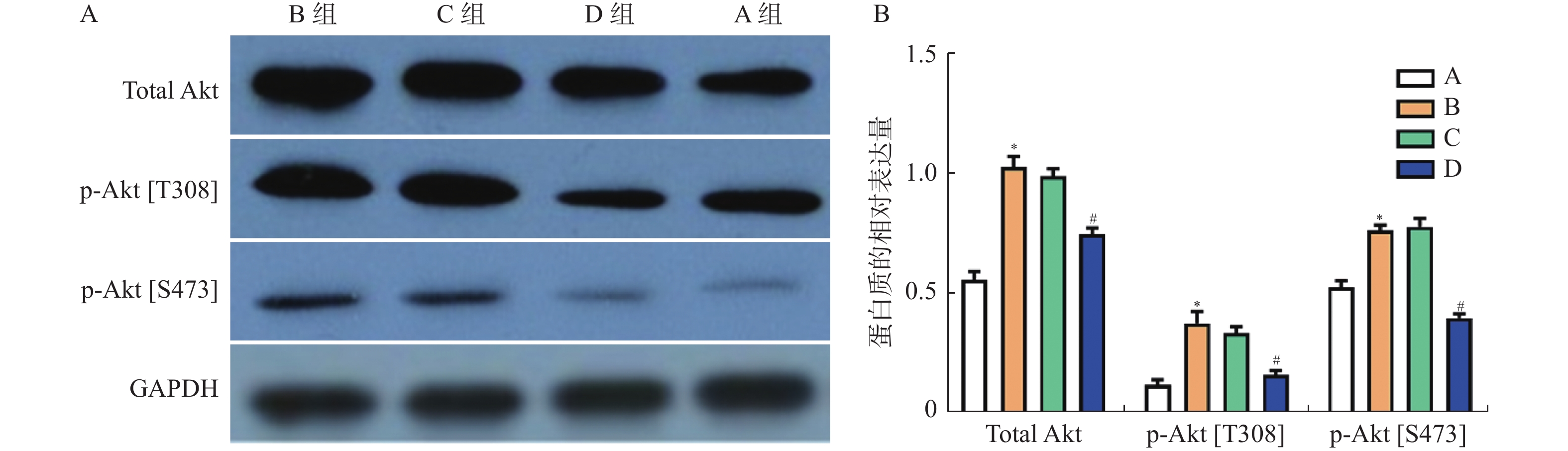 图 3 Western blot检测总Akt、p-Akt[T308]、p-Akt[S473]蛋白在兔耳创面中的表达水平A:Western blot检测总Akt、p-Akt[T308]、p-Akt[S473]蛋白;B:总Akt、p-Akt[T308]、p-Akt[S473]蛋白统计值; 与A组比较,*P < 0.05;与C组比较,#P < 0.05 。Figure 3. The protein expression of total Akt,p-Akt[T308],p-Akt[S473] in the tissues of rabbit ear trauma was examined by western blot
图 3 Western blot检测总Akt、p-Akt[T308]、p-Akt[S473]蛋白在兔耳创面中的表达水平A:Western blot检测总Akt、p-Akt[T308]、p-Akt[S473]蛋白;B:总Akt、p-Akt[T308]、p-Akt[S473]蛋白统计值; 与A组比较,*P < 0.05;与C组比较,#P < 0.05 。Figure 3. The protein expression of total Akt,p-Akt[T308],p-Akt[S473] in the tissues of rabbit ear trauma was examined by western blot2.5 免疫荧光分析p-Akt[T308]和p-Akt[S473]在瘢痕组织中的表达
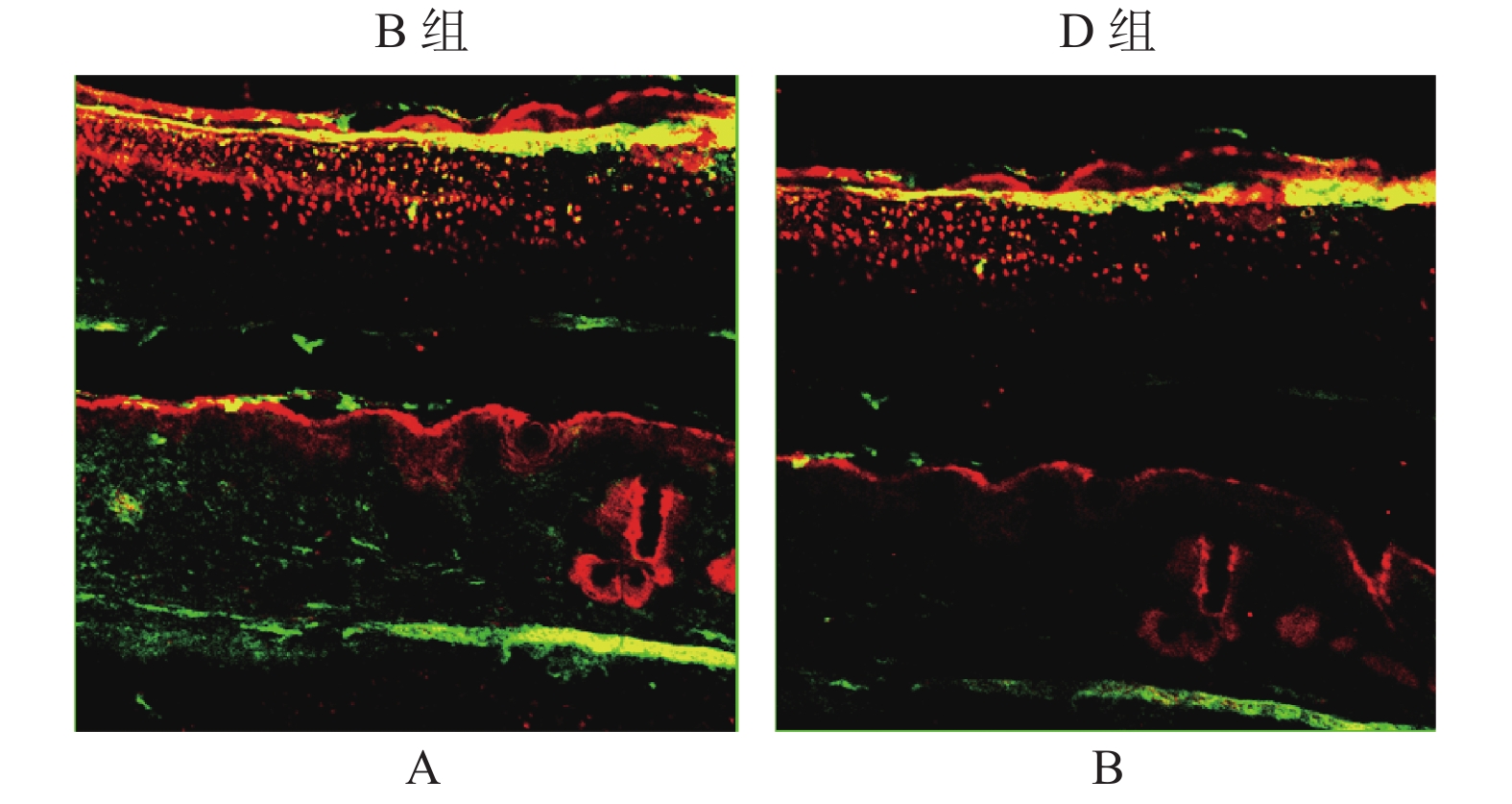
免疫荧光双染色结果显示(图4),p-Akt[T308]和p-Akt[S473]主要在瘢痕组织的胞浆内表达,但在B组中的阳性染色率高于D组。
2.6 兔耳创面组织中成纤维细胞凋亡的变化
TUNEL染色结果显示,与A组相比,B组中成纤维细胞凋亡水平明显下调(图5,表2,P < 0.05),但B组和C组相比差异无统计学意义(P > 0.05)。同时,与C组相比,D组视野下可见大量细胞凋亡,即成纤维细胞凋亡率显著上升,差异具有统计学意义(P < 0.01)。
表 2 各组凋亡指数的变化(n = 5,$ \bar x \pm s $ )Table 2. Changes of fibroblast apoptosis index (n = 5,$ \bar x \pm s $ )组别 n 凋亡率(%) F P A组 5 2.38 ± 0.41 16.357 < 0.001* B组 5 2.02 ± 0.16△ C组 5 2.05 ± 0.26 D组 5 3.66 ± 0.42##△△ *P < 0.05;与A组相比,△P < 0.05;与B组相比,##P < 0.01;与C组相比,△△P < 0.01。 3. 讨论
组织学研究表明,创伤修复后期,成纤维细胞异常增殖及胶原蛋白合成、分泌紊乱以及引起ECM的过度沉积而形成,是HS的主要生物学基础。临床治疗方法虽多,但无特效疗法,造成HS一直是整形外科与美容外科的重大难题之一。以往研究表明,活化的PI3K/Akt信号通路发挥抗凋亡作用[4-6],且其与增生性疾病的发生发展有关。因此,明确PI3K/Akt信号通路在HS中的调控作用具有重要临床意义。LY294002是PI3K的一种特异性抑制剂,其作用机制是与ATP竞争性结合PI3K,从而抑制其激酶活性和PI3K/Akt通路的活化[7-10]。
本研究结果表明,p-Akt[T308]和p-Akt[S473]主要位于细胞浆内,提示PI3K/Akt为胞浆内信号传递分子途径。同时,p-Akt[T308]和p-Akt[S473]在兔耳增生性瘢痕中的阳性表达率高于正常皮肤组的阳性表达率,但LY294002刺激过的兔耳增生性瘢痕中p-Akt[T308]和p-Akt[S473]的阳性表达率明显降低。免疫荧光双染法结果显示,p-Akt[T308]和p-Akt[S473]主要在胞浆内表达,并同时存在于瘢痕组织中,呈共活化状态,而LY294002组较瘢痕组呈现低表达。这提示PI3K/Akt信号通路的活化与Ser 473和Thr 308两个位点磷酸化的活化有关。同时,在正常组织中也有少量Akt蛋白的表达,这可能与机体自身维持基本的细胞增殖、分化等效应及ECM的更新功能有关。成纤维细胞为创伤修复过程中的重要功能细胞及瘢痕增生的最主要细胞,在HS的发生和发展过程中占重要地位。由此笔者推论,在皮肤创伤修复的整个纤维化的过程中,外界因素如物理因素、生长因子等首先启动了PI3K的高表达,Akt触发细胞膜的转位及Ser 473和Thr 308两个位点磷酸化的共活化,进而激活PI3K/Akt信号通路,从而促进成纤维细胞的增殖、活化以及ECM的沉积,增殖的成纤维细胞又可以合成分泌更多的生长因子,如此循环,最终形成纤维化,导致瘢痕形成。本研究结果也证实,使用LY294002刺激的兔耳HS组织中出现大量的成纤维细胞凋亡,凋亡指数较其余组明显升高。正常组织中可有一定量的细胞凋亡,而瘢痕的形成主要原因是成纤维细胞的大量聚集所导致。此外,以往研究证实,阻断PI3K/Akt信号通路可明显抑制HS的发展进程[11-15]。
综上所述,PI3K/Akt信号通路在HS形成中有一定相关性,该信号转导途径可能作为病理性瘢痕的治疗靶点。LY294002可能通过阻断PI3K/Akt信号通路的表达而抑制细胞增殖,产生抑制瘢痕增生的作用,但LY294002通过什么途径抑制细胞增生还需要进一步实验研究。因制作模型采用了全层皮肤及软骨膜全切除,创面难以进行药物注射,故采用溶液外敷,但LY294002的药物代谢,及透皮渗透的程度并未有报道。由于动物自身原因,或药物用量不足等可能导致不能完全抑制。如果可以在创面上皮化之前局部予足够药物干预,完全阻断PI3K/Akt信号通路的表达,可能出现瘢痕增生的有效控制。另外,PI3K/Akt信号通路抑制剂对病理性瘢痕增生的消退作用是否具有时效性、最佳治疗浓度以及皮肤毒性等,这些都将是后续研究重点,这也为PI3K/Akt信号通路作为HS治疗的靶途径提供有力的实验依据。
-
表 1 2组患儿的基本信息[( $\bar x\pm s$)/M(P25,P75)]
Table 1. General information of two groups of children [( $\bar x\pm s$)/M(P25,P75)]
项目 对照组(n = 10) 实验组(n = 14) t/z P 年龄(岁) 6.92 ± 5.17 6.21 ± 3.45 −0.380 0.709 体重(kg) 18.85[12.68,44.28] 17.75[15.98,21.08] −0.088 0.930 左室面大小(cm) 0.69 ± 0.13 0.57 ± 0.14 −2.057 0.052 右室面大小(cm) 0.47 ± 0.13 0.37 ± 0.12 −1.941 0.065 表 2 2组患儿手术时长及成功率的对比[( $\bar x\pm s $)/n(%)]
Table 2. Comparison of surgical duration and success rate between two groups of pediatric patients [( $\bar x\pm s $)/n(%)]
类别 对照组(n = 10) 实验组(n = 14) t P 手术成功率 9(90.0) 13(92.8) − 1.000 手术时长(min) 90.70 ± 19.78 71.93 ± 14.85 −2.661 0.014* *P < 0.05。 表 3 不同时间点2组患儿心脏超声指标的比较( $\bar x\pm s $)
Table 3. Comparison of cardiac ultrasound indicators between two groups of pediatric patients at different time points( $\bar x\pm s $)
时间 心超结果 对照组(n = 9) 实验组(n = 13) t P 术后1d 左室射血分数(%) 60.11 ± 5.67 59.00 ± 3.14 −0.592 0.561 左室舒张末期内径(mm) 35.22 ± 7.61 31.00 ± 3.65 −1.744 0.097 肺动脉压(mmHg) 28.78 ± 2.91 27.77 ± 2.71 −0.980 0.415 术后1月 左室射血分数(%) 58.89 ± 5.01 59.31 ± 3.17 0.241 0.812 左室舒张末期内径(mm) 34.00 ± 7.00 30.62 ± 3.62 −1.490 0.152 肺动脉压(mmHg) 27.67 ± 3.32 26.31 ± 2.56 −1.085 0.291 术后6月 左室射血分数(%) 58.78 ± 3.99 59.62 ± 2.90 0.571 0.574 左室舒张末期内径(mm) 32.33 ± 3.50 30.23 ± 2.83 −1.556 0.135 肺动脉压(mmHg) 28.11 ± 3.69 26.08 ± 2.69 −1.499 0.149 表 4 2组并发症的比较[n(%)]
Table 4. Comparison of complications between two groups [n(%)]
项目 实验组(n = 13) 对照组(n = 9) χ2 P 心律失常 1(7.69) 3(33.3) 2.350 0.264 残余分流 1(7.69) 2(22.2) 0.953 0.544 瓣膜返流 0 4(44.4) 7.062 0.017* *P < 0.05。 -
[1] Rao P S,Harris A D. Recent advances in managing septal defects: ventricular septal defects and atrioventricular septal defects[J]. F,1000,Res,2018,26(7):482-498. [2] Miyake T. A defect septal ventricular muscular review of isolated[J]. World J Pediatr,2020,16(2):120-128. doi: 10.1007/s12519-019-00289-5 [3] 李博宁,刘琮,欧振恒,等. 小儿肌部室间隔缺损介入治疗分析[J]. 中国介入心脏病学杂志,2021,29(10):589-591. doi: 10.3969/j.issn.1004-8812.2021.10.009 [4] 张力,张金盈. 儿童肌部室间隔缺损介入治疗效果分析[J]. 郑州大学学报(医学版),2017,52(4):504-507. [5] Thanopoulos B D. Catheter closure of congenital muscular ventricular septal defects[J]. Pediatr Cardiol,2005,26(3):220-223. doi: 10.1007/s00246-005-1004-6 [6] Chowdhury U K,Anderson R H,Spicer D E,et al. A review of the therapeutic managementof multiple ventricular septal defects[J]. J Card Surg,2022,37(5):1361-1376. doi: 10.1111/jocs.16289 [7] Maddali M M,Al-Maskari S N,Kandachar P S,et al. Transesophageal echocardiography-assisted transcatheter device closure of apical muscular ventricular septal defect[J]. Saudi J Anaesth,2019,13(2):148-150. doi: 10.4103/sja.SJA_625_18 [8] Lock J E,Block P C,McKay R G,et al. Transcatheter closure of ventricular septal defects[J]. Circulation,1988,78(2):361-368. [9] Pedra C A,Pedra S R,Chaccur P,et al. Perventricular device closure of congenital muscular ventricular septal defects[J]. Expert Rev Cardiovasc Ther,2010,8(5):663-674. doi: 10.1586/erc.10.31 [10] Patel H T,Hijazi Z M. Pediatric catheter interventions: a year in review 2004-2005[J]. Curr Opin Pediatr,2005,17(5):568-573. doi: 10.1097/01.mop.0000172813.56766.52 [11] 刘锦纷. 先天性心脏病镶嵌治疗的若干问题[J]. 中华外科杂志,2007,45(12):798-800. doi: 10.3760/j.issn:0529-5815.2007.12.002 [12] 陈捷,傅立军,杜军保. 《儿童常见先天性心脏病介入治疗专家共识》解读[J]. 中国医刊,2015,50(5):22-25. doi: 10.3969/j.issn.1008-1070.2015.05.007 [13] Song J. Percutaneous transcatheter closure of congenital ventricular septal defects[J]. Korean Circ J,2023,53(3):134-150. doi: 10.4070/kcj.2022.0336 [14] Chen Z,Yu Z,Su L,et al. Transcatheter closure of muscular ventricular septal defects using the Cardi-O-Fix plug[J]. Cardiol Young,2021,31(9):1472-1475. doi: 10.1017/S1047951121000482 [15] 韦丹妮,韩咏,雷先强,等. 经皮介入封堵治疗小儿心尖部肌部室间隔缺损2例[J]. 岭南心血管病杂志,2020,26(1):98-99. doi: 10.3969/j.issn.1007-9688.2020.01.23 -







 下载:
下载:

 下载:
下载: 
