Preparation of Graphene Oxide Nanosheets and Their Portable Colorimetric Determination of Biothiols
-
摘要:
目的 开发一种能够实时、快速、可视化检测生物硫醇(MEs)的方法,为疾病的早期诊断和评估提供有力手段。 方法 通过改良的Hummers方法制备具有优异的类过氧化物酶活性(POD-like)的片状氧化石墨烯(2D GO),并将比色法与智能手机集成构建快速可视化检测MEs的传感策略。 结果 2D GO能够催化过氧化氢(H2O2)分解产生具有强氧化性的羟基自由基(·OH),进而将无色3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)氧化为蓝色的ox-TMB,结合MEs的强还原作用对“2D GO+TMB+H2O2”比色传感体系显色效果的抑制作用实现了对MEs的快速可视化检测。 结论 基于2D GO所构建的比色平台具有较宽的线性检测范围(10~ 1000 μmol/L)以及良好的检测限(LOD < 7 μM),并成功用于测定胎牛血清样品中的MEs,回收率表现良好。Abstract:Objective To develop a method capable of real-time, rapid, and visual detection of MEs , providing a powerful tool for early diagnosis and assessment of diseases. Methods In this study, flake graphene oxide (2D GO) with excellent peroxidase-like activity (POD-like) was prepared by a modified Hummers' method, and a sensing strategy for the rapid visual detection of MEs was constructed by integrating colorimetry with a smartphone. Results 2D GO can catalyse the decomposition of hydrogen peroxide (H2O2) to produce highly oxidative hydroxyl radicals (·OH), which oxidize the colourless 3, 3', 5, 5'-tetramethylbenzidine (TMB) into blue ox-TMB. The strong reducing effect of MEs on the "2D GO + TMB + H2O2" colorimetric sensing system enables rapid visual detection of MEs. Conclusion The colorimetric platform constructed based on 2D GO has a wide linear detection range (10- 1000 μmol/L) and a good detection limit (LOD < 7 μM), and was successfully used for the determination of MEs in foetal bovine serum samples, with satisfactory recovery rates.-
Key words:
- Graphene oxide /
- Biothiols /
- Colorimetric sensing /
- Peroxide mimics enzymes
-
硫醇在生物体内扮演着至关重要的角色,其含量的异常与多种疾病的发生发展密切相关。其中最具代表性的是小分子生物硫醇(biological thiol,MEs):谷胱甘肽(glutathione,GSH)、半胱氨酸(cysteine,Cys)和高半胱氨酸(homocvsteine,Hcy),因其独有的巯基(-SH)官能团,参与了许多关键的生理过程和代谢途径。研究表明,GSH是细胞内含量最高的硫醇,被誉为细胞的氧化还原中心,其水平的失衡与衰老、过敏、肿瘤等多种疾病状态密切相关;Cys是蛋白质合成的重要组成部分,能够影响细胞的氧化应激反应,Cys的缺乏亦是过量均会对机体造成不同程度的伤害[1-4]。Hcy则是人体中一个重要的中间代谢产物,高浓度的Hcy会导致一系列心血管疾病的发生。因此,体内MEs的精确检测具有重要的应用价值,诸如多种疾病的早期诊断、病情监测以及治疗效果评估[5-7]。
迄今为止,已经提出了多种检测MEs的技术,如电化学发光[8]、酶联免疫法[9]、表面增强拉曼光谱[10]、毛细管电泳法[11]等。然而,这些技术大多价格昂贵、操作繁琐、耗时较长,因此无法实现即时监测MEs。相比之下,比色法因其简便易行、成本低廉、颜色直观等优势很好地弥补了传统检测方法的不足,更具实用性。酶催化是比色测定最常见的方法之一[12],可以将检测事件转化为颜色变化。然而天然酶价格昂贵且不稳定使其应用受到局限[13-14]。近年来,随着纳米技术的发展,一种显示着天然酶功能的纳米酶材料被发掘[15]。其中石墨烯(graphene oxide,GO)是目前自然界中发现“最薄、最强韧”的材料,在学术界引起了广泛关注,其高比表面积及大量的活性基团提供了更多的活性结合位点,使其具有优异的类过氧化物酶(POD-like)特性[16-18]。因此,基于GO构建一种能够快速实时比色检测MEs的平台,是非常必要且有意义的。
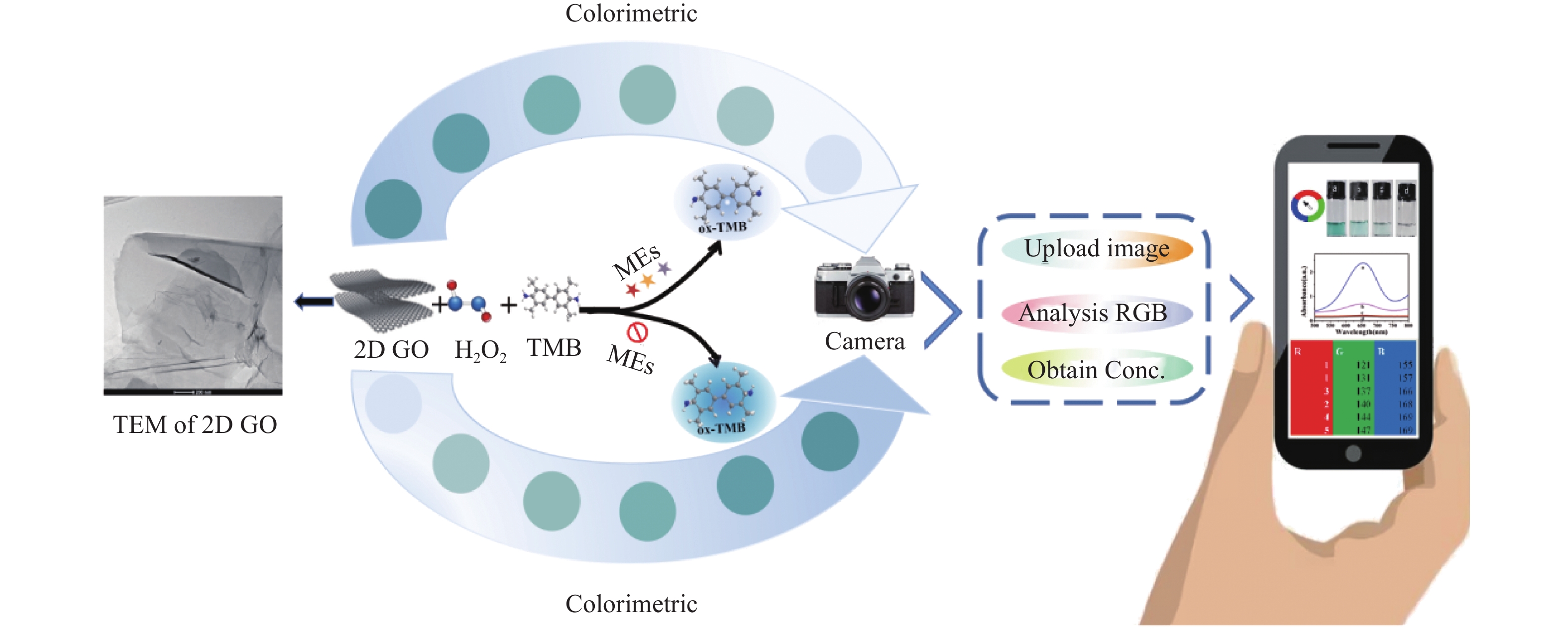
本文通过改良的Hummers方法制备了具有超薄形貌的片状氧化石墨烯(2D GO)[19]。鉴于2D GO优异的POD-like活性,提出了一种与智能手机集成可视化检测MEs的策略。机理见图1所示:2D GO凭借其高比表面积和大量含氧官能团,提供了更多的催化位点和反应界面,有效地催化过氧化氢(H2O2)产生更多的活性氧自由基并触发类芬顿反应。这些活性氧自由基可以催化无色的3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)在652 nm处产生具有特征吸收峰的蓝色氧化产物ox-TMB。由于MEs的强还原性,当MEs加入到显色体系中,“2D GO+TMB+H2O2”比色传感体系的显色会被抑制,并随着加入的MEs浓度的增加,蓝色褪色越明显。进一步利用智能手机拍照装置和APP取色器v3.1对溶液颜色的RGB值进行采集分析,实现了对MEs的实时智能可视化比色检测。总的来说,本研究构建的比色传感平台巧妙的通过分析图像相关颜色信息来实现对目标物的定量检测,具有快速、可靠、简便等特点。
1. 材料与方法
1.1 实验材料
谷胱甘肽(GSH)、L-半胱氨酸(Cys)、高半胱氨酸(Hcy)、3,3',5,5'-四甲基联苯胺(TMB)、乙醇(≥95%)、醋酸钠和醋酸均购置安徽泽升科技有限公司,石墨粉购置阿拉丁试剂(上海)有限公司,硝酸钠购于北京百灵威科技有限公司,此外实验所需危险试剂98%硫酸(H2SO4)、5%盐酸、高锰酸钾和30%过氧化氢(H2O2)均由学校提供;
分析天平(BSA124S)购于赛多利斯科学仪器(北京)有限公司、电热恒温水浴锅(DZKW-D-1)购于北京市光明医疗仪器有限公司、LCD数控加热型磁力搅拌器(MS-H-ProA)购于大龙兴创实验仪器(北京)股份公司、紫外-可见分光光度计(UV-4800)购于尤尼柯(上海)仪器有限公司。
1.2 研究方法
1.2.1 2D GO的制备
2D GO的制备参考Hummers进行了适当修改, 将含有25 mL 98% H2SO4的圆底烧瓶置于冰水浴中。搅拌下依次加入1 g石墨粉、0.5 g硝酸钠和3 g高锰酸钾。35 ℃反应30 min后,在0 ℃下少量多次地加入50 mL纯水,反应15 min。加入适量3%双氧水,热过滤,5%盐酸清洗滤饼,纯水离心洗涤产物GO至pH中性。超声剥离GO 5~6 h获得2D GO。
1.2.2 MEs的检测
在含有 TMB(10 mmol/L)和H2O2(10 mmol/L)的NaAc-HAc(0.2 M,pH =3.7)缓冲液中加入20 µL的2D GO分散液(10 µg/mL)和200 µL不同浓度的MEs,充分混合后于40℃恒温水浴锅中孵育5 min,通过紫外-可见分光光度计监测652 nm处氧化生成的ox-TMB的吸光度值。根据吸光度的变化ΔA建立MEs的校准曲线,ΔA=A0-A(A0为无MEs时体系的吸光度,A为有MEs时体系的吸光度)。
1.2.3 血清样品的检测
移取0.5 mL胎牛血清于离心管中,混合1 mL甲醇,
8000 r/min离心15 min以去除蛋白。将上清液通过0.22 μm微孔膜过滤,N2吹干后稀释100倍制得血清样品。通过标准加入法在处理过的血清样品中加入不同浓度的MEs,按1.2.2方法测定。2. 结果
2.1 方法的可行性
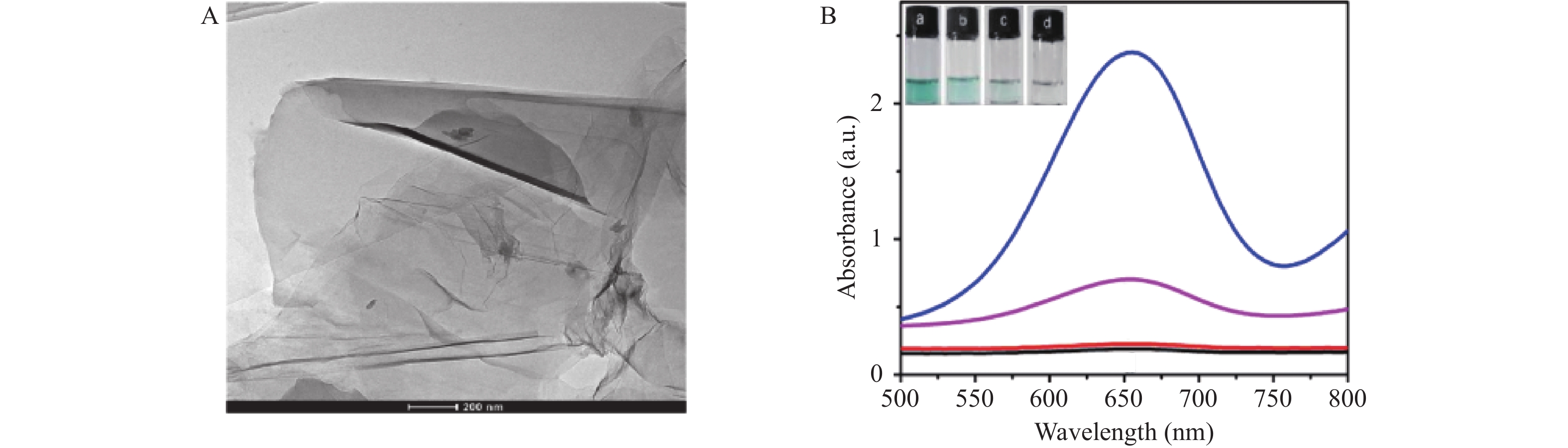
2D GO在透射电镜下为薄片状见图2A,极高的比表面积增强了其催化活性。进一步的预实验表明:当体系中同时存在TMB、H2O2和2D GO时,652 nm处的吸光度显著升高见图2B,表明氧化石墨烯具有POD-like。与单独的TMB-H2O2显色体系相比,2D GO的加入可以令显色更明显,具有放大效应。
2.2 显色反应条件的优化
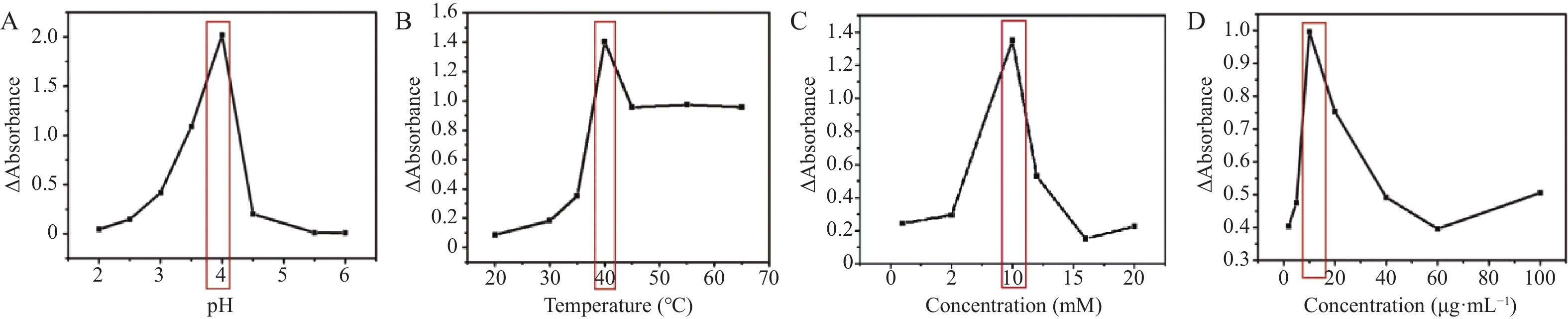
纳米酶的类酶催化活性受许多因素的影响。本实验研究了影响检测灵敏度的参数,包括缓冲溶液的pH值(2.0~6.0)、反应温度(30 ℃~70 ℃)、H2O2的浓度(0~20 mmol/L)以及2D GO的浓度(2~100 μg/mL)。结果见图3,当pH=4、温度为40℃时,以10 mM H2O2和10 μg/mL 2D GO触发的显色反应获得最大差值ΔA,作为最佳实验条件。
2.3 米氏动力学研究
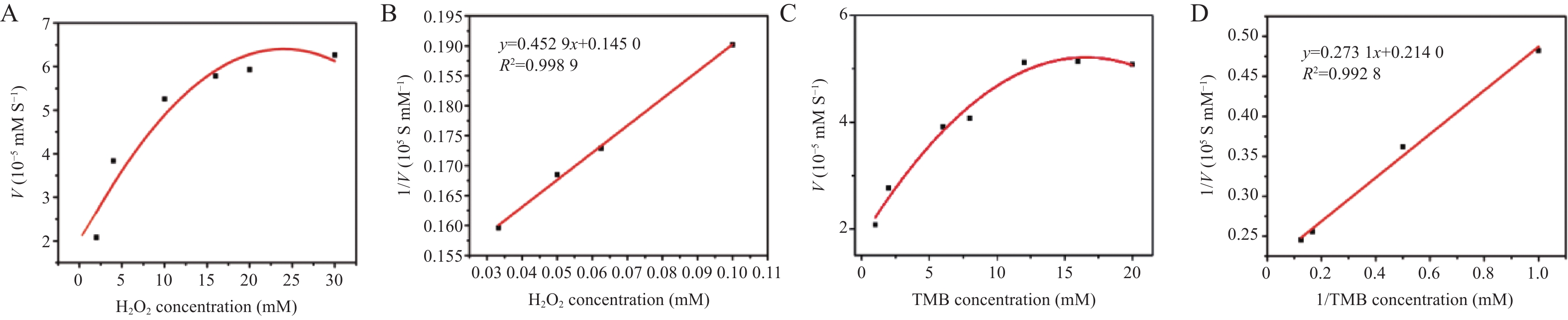
为了进一步评估2D GO的POD-like活性催化效率,通过底物固定原则来考察2D GO对另一个底物的稳态动力学行为。从图4A和4C可以看出,在一定底物浓度范围内,2D GO的催化反应符合典型的Michaelis-Menten动力学模型。进一步绘制其初速度与底物浓度相应的Lineweaver-Burk双倒数曲线见图4B和4D,通过1/V与1/[S]呈现出的线性曲线的斜率及截距可以计算得到催化反应的表观动力学常数Km和Vmax。从表1可看到2D GO对底物TMB和H2O2均具有较好的亲和力。这主要归功于2D GO的大比表面积及其表面带负电且具有大量含氧官能团。
表 1 米氏常数(Km)和最大反应速率(Vmax)的比较Table 1. Comparison of Michaelis constants ( Km ) and maximum reaction rates ( Vmax )2.4 分析性能评价
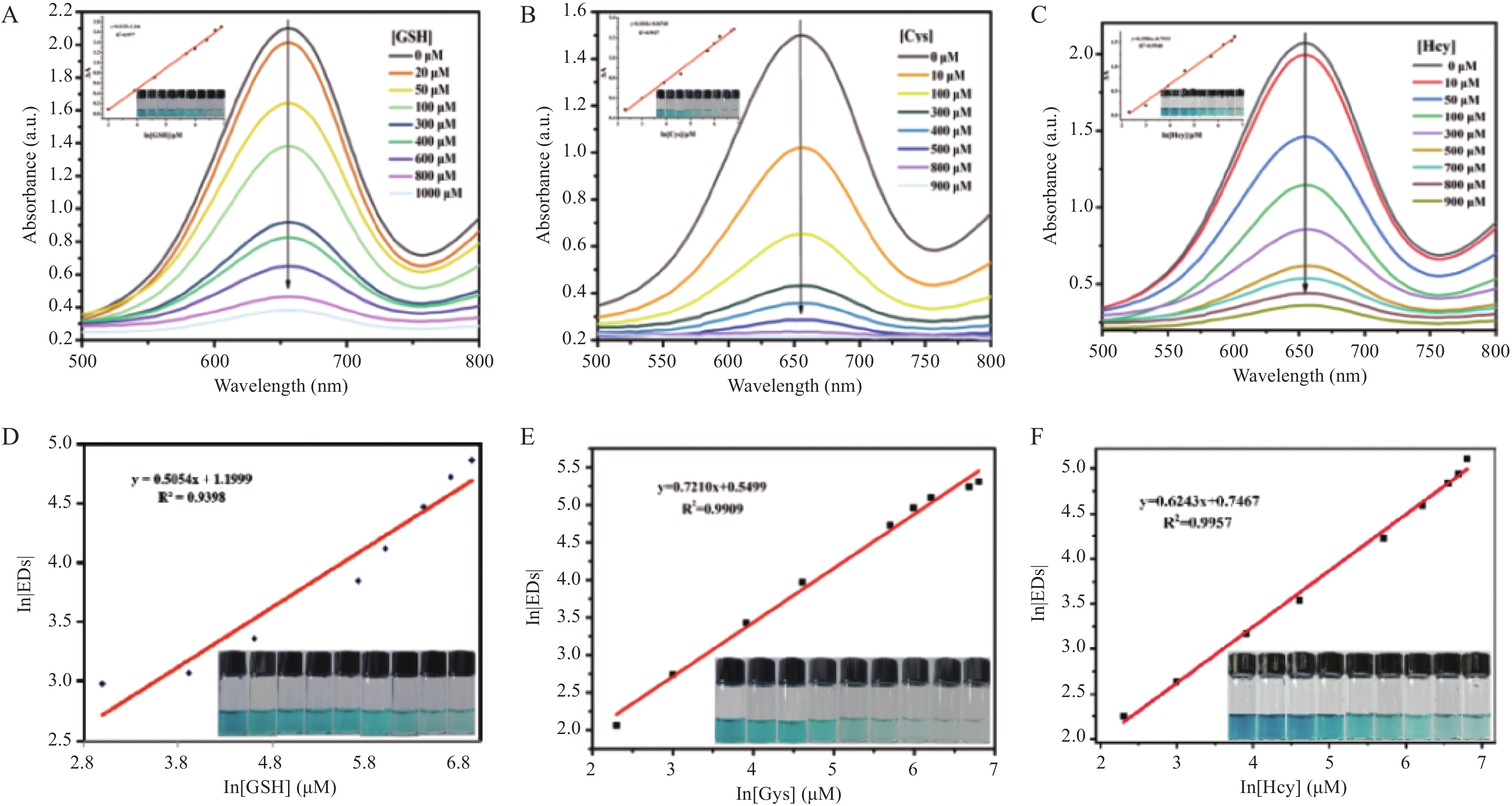
基于2D GO的POD-like活性,在最优条件下检测MEs。从图5A~5C可以看出,随着MEs浓度的增加,吸光度逐渐降低,峰型趋于平缓。且其插图表明不同种类一系列浓度MEs与ΔA均具有良好的线性关系;计算其检测限分别为LOD(GSH)=3.01 μM 、LOD(Cys)=6.79 μM、LOD(Hcy)=0.66 μM。
使用 APP取色器v3.1捕获每一份溶液的RGB值,为了提高检测的精密度,笔者通过计算RGB值的欧氏距离(euclidean distance, EDs),方程如下:EDs=(∆R2+∆G2+∆B2)1/2,以评估手机辅助定量检测MEs的灵敏度。如图5D~5F所示,不同类别MEs在10~
1000 μg/mL浓度范围内与In[EDs]值均呈良好的线性关系。本工作所构建的比色方法已成功用于三种MEs的检测,并与其他检测MEs方法进行比较。结果见表2,该方法检出限虽不突出,但其线性范围更宽,且检出限与毛细管电泳相比相差不大,虽不如高效液相色谱(HPLC)、质谱法等,但该比色法利用智能手机辅助可以实现生物硫醇的快速定量,更加快速便捷,同时为医学研究中MEs的现场分析提供了一种有发展潜力且高效的思路。表 2 不同方法检测MEs的比较Table 2. Comparison of different methods for detecting MEs催化剂 方法 物质 线性范围 检出限 参考文献 mBrB 毛细管电泳 GSH 7.5~100 µmol/L 1.41 μmol/L [24] TCNQ 和 GO协同 电化学分析法 GSH 0.25~124.3 μmol/L,
124.3 μmol/L~1.67 mmol/L0.15 μmol/L [25] MNPG 荧光法 GSH 0.2~20 μmol/L 0.05 μmol/L [26] 7 氟苯并-2-氧杂 -1,
3-二唑-4-磺酸铵高效液相色谱 Cys、Hcy、
CysGly、GSH0.5 ~15 μmol/L 0.10 μmol/L [27] BrDMC 质谱法 GSH 1.0~100.0 μmol/L 0.4 μmol/L [28] 2D GO 比色法 Hcy 10~ 1000 μmol/L0.66 μmol/L 本工作 2.5 比色传感平台在实际中的应用
为了评估所建立方法在实际应用中的可行性,笔者通过标准加入法对胎牛血清中的MEs进行了检测,并使用 APP 取色器v3.13对溶液颜色进行识别定量,计算其回收率。进一步将智能手机软件辅助检测MEs的实验结果与紫外-可见光谱法检测MEs的数据进行比较。结果见表3:与智能手机集成的比色传感平台对胎牛血清中MEs检测的相对回收率为88.4~107.9%,表明该方法在实际应用中具有潜在应用价值。
表 3 胎牛血清加标实验中MEs检测结果Table 3. Detection results of MEs in fetal bovine serum spiking assays样品 加标量 (μmol/L) 紫外-可见光谱法 手机可视化比色法 检测(μmol/L) 回收率(%) RSD(n=3,%) 检测(μmol/L) 回收率(%) RSD(n=3,%) GSH 0 55.20 − 4.3 7.80 − 4.9 50 101.90 96.90 7.0 60.99 105.5 2.6 400 458.74 100.8 3.3 411.82 101.0 0.5 800 851.42 99.6 6.5 871.99 107.9 1.0 Cys 0 13.55 − 4.3 11.15 − 4.9 50 60.20 94.20 7.9 65.90 107.8 4.3 400 411.47 99.50 7.7 403.83 98.20 1.4 800 817.99 100.5 6.3 716.78 88.40 0.5 Hcy 0 10.40 − 7.2 11.50 − 6.2 50 61.22 99.50 2.0 62.27 100.9 5.6 400 408.90 99.50 1.7 411 99.90 2.1 800 813.00 100.3 0.4 811.4 100.1 1.1 3. 讨论
本文通过改良的Hummers方法成功合成了具有优异POD-like活性的超薄纳米片2D GO。该材料在酸性条件下,能够催化H2O2产生·OH,使TMB氧化成蓝色的ox-TMB,利用MEs的强还原性,随着检测体系中MEs浓度的增加,产生的ox-TMB越少,溶液颜色肉眼可见的从有色到无色,这种感官上的认识结合智能手机的拍照技术获取RGB值进行分析[29],提出了一种快速可视化检测MEs的方案。这种将智能手机可视化与新兴纳米酶显色比色法相结合,用以建立具有快速便捷和即时检测等优点的新型MEs检测方法具有较大的应用潜能。正如预期那样,本工作在实际应用中通过加标回收法取得了良好的回收率,同时具有操作简单、检测时间短、仪器要求低等优点,弥补了其它方法成本高、需借助大型检测仪器等缺点,并且有望进一步开发应用于临床医学对疾病的早期诊断与评估。
-
表 1 米氏常数(Km)和最大反应速率(Vmax)的比较
Table 1. Comparison of Michaelis constants ( Km ) and maximum reaction rates ( Vmax )
表 2 不同方法检测MEs的比较
Table 2. Comparison of different methods for detecting MEs
催化剂 方法 物质 线性范围 检出限 参考文献 mBrB 毛细管电泳 GSH 7.5~100 µmol/L 1.41 μmol/L [24] TCNQ 和 GO协同 电化学分析法 GSH 0.25~124.3 μmol/L,
124.3 μmol/L~1.67 mmol/L0.15 μmol/L [25] MNPG 荧光法 GSH 0.2~20 μmol/L 0.05 μmol/L [26] 7 氟苯并-2-氧杂 -1,
3-二唑-4-磺酸铵高效液相色谱 Cys、Hcy、
CysGly、GSH0.5 ~15 μmol/L 0.10 μmol/L [27] BrDMC 质谱法 GSH 1.0~100.0 μmol/L 0.4 μmol/L [28] 2D GO 比色法 Hcy 10~ 1000 μmol/L0.66 μmol/L 本工作 表 3 胎牛血清加标实验中MEs检测结果
Table 3. Detection results of MEs in fetal bovine serum spiking assays
样品 加标量 (μmol/L) 紫外-可见光谱法 手机可视化比色法 检测(μmol/L) 回收率(%) RSD(n=3,%) 检测(μmol/L) 回收率(%) RSD(n=3,%) GSH 0 55.20 − 4.3 7.80 − 4.9 50 101.90 96.90 7.0 60.99 105.5 2.6 400 458.74 100.8 3.3 411.82 101.0 0.5 800 851.42 99.6 6.5 871.99 107.9 1.0 Cys 0 13.55 − 4.3 11.15 − 4.9 50 60.20 94.20 7.9 65.90 107.8 4.3 400 411.47 99.50 7.7 403.83 98.20 1.4 800 817.99 100.5 6.3 716.78 88.40 0.5 Hcy 0 10.40 − 7.2 11.50 − 6.2 50 61.22 99.50 2.0 62.27 100.9 5.6 400 408.90 99.50 1.7 411 99.90 2.1 800 813.00 100.3 0.4 811.4 100.1 1.1 -
[1] Dai J,Ma C G,Zhang P,et al. Recent progress in the development of fluorescent probes for detection of biothiols[J]. Dyes Pigm,2020,177(3):108321. [2] Yin C X,Xiong K M,Huo F J,et al. Fluorescent probes with multiple binding sites for the discrimination of Cys,Hcy,and GSH[J]. Angew Chem Int Ed Engl,2017,56(43):13188-13198. doi: 10.1002/anie.201704084 [3] Chen X,Zhou Y,Peng X,et al. Fluorescent and colorimetric probes for detection of thiols[J]. Chem Soc Rev,2010,39(6):2120-2135. doi: 10.1039/b925092a [4] Jung H S,Chen X,Kim J S,et al. Recent progress in luminescent and colorimetric chemosensors for detection of thiols[J]. Chem Soc Rev,2013,42(14):6019-6031. doi: 10.1039/c3cs60024f [5] Yue Y,Huo F,Ning P,et al. Dual-site fluorescent probe for visualizing the metabolism of Cys in living cells[J]. J Am Chem Soc,2017,139(8):3181-3185. doi: 10.1021/jacs.6b12845 [6] Xu T,Zhao S J,Wu X L,et al. β-Cyclodextrin-promoted colorimetric and fluorescence turn-on probe for discriminating highly toxic thiophenol from biothiols[J]. ACS Sustain Chem Eng,2020,8(16):6413-6421. doi: 10.1021/acssuschemeng.0c00766 [7] Chen H,Tang Y G,Lin W Y,et al. Recent progress in the fluorescent probes for the specific imaging of small molecular weight thiols in living cells[J]. Trends Analyt Chem,2016,76:166-181. doi: 10.1016/j.trac.2015.11.014 [8] Liu X R,Qian M P,Zhang C X,et al. Bis-cyclometalated Ir(III) complex-based electrogenerated chemiluminescence sensor array for discriminating three biothiols[J]. JOAT,2020,4(2):114-121. [9] Li Z H,Li Z H,Sun S G,et al. Design and characterization of methyl mercaptan biosensor using alcohol oxidase[J]. Sens Actuators B Chem,2014,192:680-684. doi: 10.1016/j.snb.2013.10.100 [10] Shen Y,Yue J,Shi W,et al. Target-triggered hot spot dispersion for cellular biothiol detection via background-free surface-enhanced Raman scattering tags[J]. Biosens Bioelectron,2020,151:111957. doi: 10.1016/j.bios.2019.111957 [11] Tu F Q,Zhang L Y,Guo X F,et al. Dual labeling for simultaneous determination of nitric oxide,glutathione and cysteine in macrophage RAW264.7 cells by microchip electrophoresis with fluorescence detection[J]. J Chromatogr A,2014,1359:309-316. doi: 10.1016/j.chroma.2014.07.026 [12] Duan W,Qiu Z,Cao S,et al. Pd-Fe3O4 Janus nanozyme with rational design for ultrasensitive colorimetric detection of biothiols[J]. Biosens Bioelectron,2022,196:113724. doi: 10.1016/j.bios.2021.113724 [13] Wang X Y,Hua Y H,Wei H,et al. Nanozymes in bionanotechnology: From sensing to therapeutics and beyond[J]. Inorg Chem Front,2016,3(1):41-60. doi: 10.1039/C5QI00240K [14] Lin S,Zhang Y,Cao W,et al. Nucleobase-mediated synthesis of nitrogen-doped carbon nanozymes as efficient peroxidase mimics[J]. Dalton Trans,2019,5,48(6):1993-1999. [15] Gao L Z,Zhuang J,Nie L,et al. Intrinsic peroxidase-like activity of ferromagnetic nanoparticles[J]. Nat Nanotechnol,2007,2(9):577-583. doi: 10.1038/nnano.2007.260 [16] Guo S J,Wang E K. Noble metal nanomaterials: Controllable synthesis and application in fuel cells and analytical sensors[J]. Nano Today,2011,6(3):240-264. doi: 10.1016/j.nantod.2011.04.007 [17] Vashist S K,Luong J H T. Recent advances in electrochemical biosensing schemes using graphene and graphene-based nanocomposites[J]. Carbon Lett,2015,84:519-550. doi: 10.1016/j.carbon.2014.12.052 [18] Reina G,González-Domínguez J M,Criado A,et al. Promises,facts and challenges for graphene in biomedical applications[J]. Chem Soc Rev,2017,46(15):4400-4416. doi: 10.1039/C7CS00363C [19] Saleh B D,Abdulwahhab G H,Ahmed S M R. Preparation and characterization of graphene oxide nanoparticles derived from wheat straw[J]. Mater Today,2023,80(2):860-869. [20] Wu S,Tian J,Xie N,et al. A sensitive,accurate,and high-throughput gluco-oligosaccharide oxidase-based HRP colorimetric method for assaying lytic polysaccharide monooxygenase activity[J]. Biofuel Bioprod Biorefin,2022,15(1):1-15. [21] Song Y J,Qu K G,Zhao C,et al. Graphene Oxide: Intrinsic peroxidase catalytic activity and its application to glucose detection[J]. Adv Mater,2010,22(19):2206-2210. doi: 10.1002/adma.200903783 [22] Liu Y,Jin H,Zou W,et al. Protein-mediated sponge-like copper sulfide as an ingenious and efficient peroxidase mimic for colorimetric glucose sensing[J]. RSC Adv,2020,10(48):28819-28826. doi: 10.1039/D0RA05496H [23] Guo Y J,Deng L,L J,et al. Hemin-graphene hybrid nanosheets with intrinsic peroxidase-like activity for label-free colorimetric detection of single-nucleotide polymorphism. ACS Nano,2011,5(2): 1282-1290. [24] Pérez-Rama M,Abalde J,Herrero C,et al. A capillary zone electrophoresis for determination of thiolic peptides in biological samples[J]. J Sep Sci,2009,32(12):2152-2158. doi: 10.1002/jssc.200900104 [25] Yuan B Q,Xu C Y,Zhang R C,et al. Glassy carbon electrode modified with 7,7,8,8-tetracyanoquinodimethane and graphene oxide triggered a synergistic effect: Low-potential amperometric detection of reduced glutathione[J]. Biosens Bioelectron,2017,96:1-7. doi: 10.1016/j.bios.2017.04.026 [26] Zhang H J,Chen J,Yang Y L,et al. Discriminative detection of glutathione in cell lysates based on oxidase-like activity of magnetic nanoporous graphene[J]. Anal Chem,2019,91(8):5004-5010. doi: 10.1021/acs.analchem.8b04779 [27] Ferin R,Pavão M L,Baptista J. Methodology for a rapid and simultaneous determination of total cysteine,homocysteine,cysteinylglycine and glutathione in plasma by isocratic RP-HPLC[J]. J Chromatogr B,2012,911:15-20. [28] Feng C H,Huang H Y,Lu C Y. Quantitation of the glutathione in human peripheral blood by matrix-assisted laser desorption ionization time-of-flight mass spectrometry coupled with micro-scale derivatization[J]. Anal Chim Acta,2011,690(2):209-214. doi: 10.1016/j.aca.2011.02.015 [29] Shi R,Yang J,Cheng S Q,et al. Colorimetric determination of biothiols with AuNPs@MoS2 NSs as peroxidase mimetic enzyme[J]. New J Chem,2022,46(39):18718-18723. doi: 10.1039/D2NJ03052G -






 下载:
下载:
 下载:
下载:

