Observation of Liraglutide's Effect on Function of Pancreatic Islets β-Cell in Type 2 Diabetes
-
摘要:
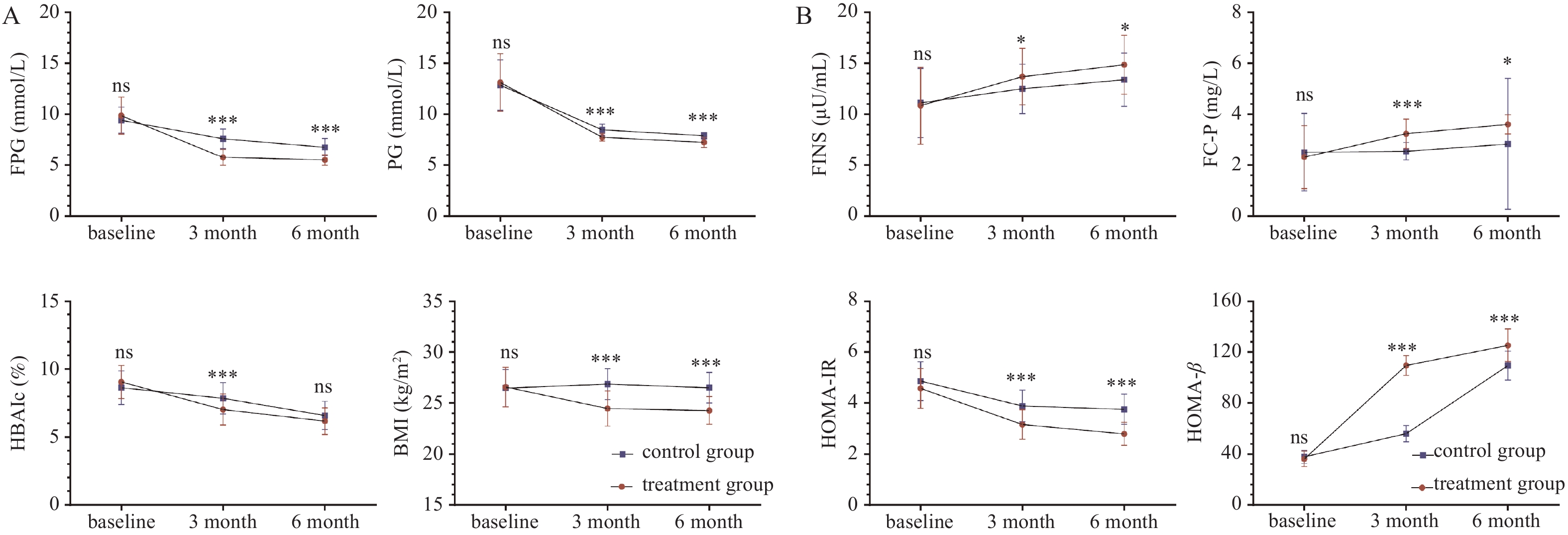
目的 观察GLP-1受体激动剂利拉鲁肽对初诊断2型糖尿病患者β细胞功能的影响。 方法 选择2020年3月至2021年3月在云南省第三人民医院内分泌科收治入院的新诊断2型糖尿病患者,随机分为试验组及对照组,试验组使用GLP-1受体激动剂利拉鲁肽治疗6月,对照组使用非GLP-1受体激动剂治疗6月(一联或二联方案)。观察和检测治疗前及治疗后3月、6月体重、BMI、FPG、2hPG、HbA1c、FINS、FC-P、HOMA-IR、HOMA-β的变化。 结果 92例患者纳入临床观察(试验组45例,对照组47例),与基线相比,治疗3月、6月后两组患者FPG、2hPG、HbA1c均显著下降 (P < 0.01),FINS、HOMA-IR、HOMA-β优于治疗前(P < 0.05),试验组BMI下降(P < 0.05),而对照组略有上升,但差异无统计学意义(P < 0.05)。与对照组相比,治疗6月后试验组较基线FPG、2hPG降幅更大,差异具有统计学意义(P < 0.05);HbA1c有一定下降,差异无统计学意义(P > 0.05)。治疗3月、6月试验组FC-P均优于治疗前(P < 0.05),而对照组直到治疗6月结束时FC-P才优于治疗前(P < 0.05)。 结论 初诊断2型糖尿病尽早使用GLP-1类似物治疗较非GLP-1类似物方案可以有更优的修复β细胞功能作用、减轻体重、有效改善胰岛素抵抗。 Abstract:Objective To observe the effect of the GLP-1 receptor agonist liraglutide on β-cell function in patients newly diagnosed with type 2 diabetes patients. Methods Type 2 diabetes patients diagnosed between March 2020 and March 2021 in the Endocrinology Department of Yunnan Provincial Third People's Hospital were recruited and randomly divided into an experimental group and a control group. The experimental group was treated with liraglutide, a GLP-1 receptor agonist, for 6 months, while the control group received treatment with non-GLP-1 receptor agonists for 6 months (monotherapy or dual therapy). Changes in Weight, BMI, FPG, PG, HbA1c, FINS, FC-P, HOMA-IR, and HOMA-β levels were observed and measured before treatment and at 3 and 6 months after treatment. Results A total of 92 patients were included in the clinical observation (45 in the experimental group and 47 in the control group). Compared to baseline, both groups showed significant reductions in FPG, 2hPG, and HbA1c at 3 and 6 months after treatment (P < 0.01). FINS, HOMA-IR, and HOMA-β improved compared to pre-treatment levels (P < 0.05). BMI decreased in the experimental group (P < 0.05), while it slightly increased in the control group, but the difference was not statistically significant (P > 0.05). Compared to the control group, the experimental group showed a greater reduction in FPG and 2hPG from baseline after 6 months of treatment, with statistically significant differences (P < 0.05). HbA1c showed a certain decrease, but the difference was not statistically significant (P > 0.05). FC-P in the experimental group was superior to pre-treatment levels at both 3 and 6 months (P < 0.05), while in the control group, FC-P was only improved at the end of 6 months of treatment (P < 0.05). Conclusion Early use of GLP-1 analogs in the treatment of newly diagnosed type 2 diabetes, as opposed to non-GLP-1 analog regimens, can lead to better restoration of β-cell function, weight reduction, and effective improvment of insulin resistance. -
Key words:
- Type 2 diabetes /
- Initial diagnosis /
- Liraglutide /
- β cellular function
-
表 1 试验组与对照组临床资料($\bar x \pm s $)
Table 1. Clinical characteristics of the experimental and control groups($\bar x \pm s $)
项目 试验组(n = 45) 对照组(n = 47) χ2/t P 性别(女/男) 14/31 21/26 1.80 0.18 年龄(岁) 45.85±2.81 46.43±2.08 1.17 0.24 体重(kg) 71.64±7.53 70.13±7.73 0.99 0.32 BMI(kg/m2) 26.57±1.94 26.47±1.83 0.27 0.79 FPG(mmol/L) 9.87±1.82 9.43±1.27 1.40 0.16 PG(mmol/L) 13.12±2.82 12.86±2.46 0.49 0.62 HbA1c(%) 9.05±1.22 8.63±1.24 1.71 0.09 FINS(μIU/mL) 10.85±3.78 11.12±3.39 0.38 0.71 FC-P(ng/mL) 2.32±1.24 2.51±1.53 0.68 0.50 HOMA-IR 4.58±0.78 4.86±0.76 1.81 0.07 HOMA-β 36.19±6.12 37.87±5.18 1.48 0.14 -
[1] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华糖尿病杂志,2021,13(4):315-409. [2] Cho N H,Shaw J E,Karuranga S,et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Research & Clinical Practice,2018,138(4):271‐281. [3] Li Y,Teng D,Shi X,et al. Prevalence of diabetes recorded in China's mainland using 2018 diagnostic criteria from the American Diabetes Association: national cross sectional study[J]. Bmj,2020,369(4):m997.Li Y,Teng D,Shi X,et al. Prevalence of diabetes recorded in China's mainland using 2018 diagnostic criteria from the American Diabetes Association: national cross sectional study[J]. Bmj,2020,369(4):m997. [4] U. K. prospective diabetes study 16. Overview of 6 years' therapy of type II diabetes: a progressive disease. U. K. Prospective Diabetes Study Group [J]. Diabetes,1995,44(11): 1249-1258. [5] Li Y,Xu W,Liao Z,et al. Induction of Long-term Glycemic Control in Newly Diagnosed Type 2 Diabetic Patients Is Associated With Improvement of β-Cell Function[J]. Diabetes Care,2004,27(11):2597-2602. doi: 10.2337/diacare.27.11.2597 [6] Liu J B,Liu J,Fang D H,et al. Fasting plasma glucose after intensive insulin therapy predicted long-term glycemic control in newly diagnosed type 2 diabetic patients[J]. Endocrine Journal,2013,60(6):725-732. [7] Weng J,Retnakaran R,Ariachery C A,et al. Short-term intensive insulin therapy at diagnosis in type 2 diabetes: plan for filling the gaps[J]. Diabetes Metab Res Rev,2015,31(6):537-544. doi: 10.1002/dmrr.2603 [8] Talchai C,Xuan S,Lin H V,et al. Pancreatic β cell dedifferentiation as a mechanism of diabetic β cell failure[J]. Cell,2012,150(6):1223-1234. doi: 10.1016/j.cell.2012.07.029 [9] Accili D. Insulin action research and the future of diabetes treatment: The 2017 banting medal for scientific achievement lecture[J]. Diabetes,2018,67(9):1701-1709. doi: 10.2337/dbi18-0025 [10] Kim-muller J Y,Fan J,Kim Y J R,et al. Aldehyde dehydrogenase 1a3 defines a subset of failing pancreatic β cells in diabetic mice[J]. Nature Communications,2016,7(8):12631-12634. [11] Kim S H,Liu A,Ariel D,et al. Pancreatic beta cell function following liraglutide-augmented weight loss in individuals with prediabetes: analysis of a randomised,placebo-controlled study[J]. Diabetologia,2014,57(3):455-462. doi: 10.1007/s00125-013-3134-3 [12] Rondinelli M,Rossi A,Gandolfi A,et al. Use of liraglutide in the real world and impact at 36 months on metabolic control,weight,lipid profile,blood pressure,heart rate,and renal function[J]. Clinical Therapeutics,2016,39(1):159-169. [13] Abdulreda M H,Rodriguez-Diaz R,Caicedo A,et al. Liraglutide compromises pancreatic β cell function in a humanized mouse model[J]. Cell Metabolism,2016,23(3):541-546. doi: 10.1016/j.cmet.2016.01.009 [14] Tasyurek H M,Altunbas H A,Balci M K,et al. Incretins: their physiology and application in the treatment of diabetes mellitus[J]. Diabetes Metab Res Rev,2014,30(5):354-371. doi: 10.1002/dmrr.2501 [15] 杨丽,胡淑芳,曾天舒. 利拉鲁肽对胰岛素抵抗小鼠肝脏组织自噬影响的研究[J]. 中国糖尿病杂志,2019,11(4):7. [16] 石春晖. 利拉鲁肽联合胰岛素强化治疗难治性2型糖尿病及对患者胰岛β细胞功能的影响分析[J]. 健康必读,2019,(5):234. [17] 高倩,章文俊,杨国军,等. FoxO1在高糖诱导小鼠胰岛β细胞去分化中的作用机制研究[J]. 浙江医学,2019,41(15):5. [18] 温滨红,赵璐,杨硕,等. 短期强化降糖序贯胰升血糖素样肽1对新诊断2型糖尿病患者胰岛β细胞功能第一时相分泌的影响[J]. 中国糖尿病杂志,2018,26(6):5. [19] 张红敏,吴锦林,张兴渝,等. 利拉鲁肽联合二甲双胍对2型糖尿病合并肥胖患者胰岛β细胞功能以及内脏脂肪水平的影响[J]. 中华细胞与干细胞杂志: 电子版,2019,9(3):5. [20] 荚杨洋,王佑民,赵晓彤,等. 应用不同序贯治疗方案对新诊断2型糖尿病患者短期胰岛素泵强化治疗后胰岛α细胞、β细胞功能的影响[J]. 中国糖尿病杂志,2018,26(2):5. [21] 李超杰,陈慧敏,濮先明. 利拉鲁肽联合胰岛素强化治疗难治性2型糖尿病的临床疗效观察[J]. 青岛医药卫生,2019,051(4):256-259. [22] 《缓解型糖尿病中国专家共识》编写专家委员会. 缓解2型糖尿病中国专家共识[J]. 中国全科医学,2021,24(32):4037-4048. [23] Guan Z,Du Y,Li R,et al. Association between glucagon-like peptide-1 receptor gene polymorphism and treatment response to GLP1R agonists in Chinese patients with type 2 diabetes: a prospective cohort study[J]. European Journal of Clinical Pharmacology,2022,78(5):793-799. doi: 10.1007/s00228-021-03249-z [24] El EID L,Reynolds C A,Tomas A,et al. Biased agonism and polymorphic variation at the GLP-1 receptor: Implications for the development of personalised therapeutics[J]. Pharmacological Research,2022,184(10):106411. [25] 金玲怡,张洁,邱佳萍. 胰高血糖素样肽-1类似物在治疗2型糖尿病中的意义[J]. 临床合理用药杂志,2020,13(28):3. -






 下载:
下载: