|
[1]
|
Lahiri A,Maji A,Potdar P D,et al. Lung cancer immunotherapy: Progress,pitfalls,and promises[J]. Mol Cancer,2023,22(1):1-37. doi: 10.1186/s12943-023-01740-y
|
|
[2]
|
Sung H,Ferlay J,Siegel R L,et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660
|
|
[3]
|
Nicholson A G,Tsao M S,Beasley M B,et al. The 2021 WHO classification of lung tumors: Impact of advances since 2015[J]. J Thorac Oncol,2022,17(3):362-387. doi: 10.1016/j.jtho.2021.11.003
|
|
[4]
|
Ren X,Luo X,Wang F,et al. Recent advances in copper homeostasis-involved tumor theranostics[J]. Asian J Pharm Sci,2024,19(5):1-34.
|
|
[5]
|
Lutsenko S,Roy S,Tsvetkov P. Mammalian copper homeostasis: Physiologic roles and molecular mechanisms[J]. Physiol Rev,2025,105(1):441-491. doi: 10.1152/physrev.00011.2024
|
|
[6]
|
Tsvetkov P,Coy S,Petrova B,et al. Copper induces cell death by targeting lipoylated TCA cycle proteins[J]. Science,2022,375(6586):1254-1261. doi: 10.1126/science.abf0529
|
|
[7]
|
Huang Q,Tian R,Yu J,et al. Identification of PSMD11 as a novel cuproptosis- and immune-related prognostic biomarker promoting lung adenocarcinoma progression[J]. Cancer Med,2024,13(11):2-15. doi: 10.1002/cam4.7379
|
|
[8]
|
Wu J,Fu G,Luo C,et al. Cuproptosis-related ceRNA axis triggers cell proliferation and cell cycle through CBX2 in lung adenocarcinoma[J]. BMC Pulm Med,2024,24(1):6-15. doi: 10.1186/s12890-024-02887-0
|
|
[9]
|
Ouyang G,Wu Z,Liu Z,et al. Identification and validation of potential diagnostic signature and immune cell infiltration for NAFLD based on cuproptosis-related genes by bioinformatics analysis and machine learning[J]. Front Immunol,2023,14(eCollection):1-16. doi: 10.3389/fimmu.2023.1251750
|
|
[10]
|
Love M I,Huber W,Anders S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2[J]. Genome Biol,2014,15(12):2-21. doi: 10.1186/s13059-014-0550-8
|
|
[11]
|
Ginestet C. ggplot2: Elegant graphics for data analysis[J]. Journal of the Royal Statistical Society Series A: Statistics in Society,2011,174(1):245-246. doi: 10.1111/j.1467-985X.2010.00676_9.x
|
|
[12]
|
Chen H,Boutros P C. VennDiagram: A package for the generation of highly-customizable Venn and Euler diagrams in R[J]. BMC Bioinformatics,2011,12(1):1-7. doi: 10.1186/1471-2105-12-35
|
|
[13]
|
Wu T,Hu E,Xu S,et al. ClusterProfiler 4.0:A universal enrichment tool for interpreting omics data[J]. Innovation (Camb),2021,2(3):1-10.
|
|
[14]
|
Therneau T M, Grambsch P M. Modeling survival data: Extending the Cox model[M]. New York: Springer, 2000:39-77.
|
|
[15]
|
Eng K H,Schiller E,Morrell K. On representing the prognostic value of continuous gene expression biomarkers with the restricted mean survival curve[J]. Oncotarget,2015,6(34):36308-36318. doi: 10.18632/oncotarget.6121
|
|
[16]
|
Newman A M,Liu C L,Green M R,et al. Robust enumeration of cell subsets from tissue expression profiles[J]. Nat Methods,2015,12(5):453-457. doi: 10.1038/nmeth.3337
|
|
[17]
|
Yoshihara K,Shahmoradgoli M,Martínez E,et al. Inferring tumour purity and stromal and immune cell admixture from expression data[J]. Nat Commun,2013,4(eCollection):1-11. doi: 10.1038/ncomms3612
|
|
[18]
|
Mirhadi S,Zhang W,Pham N A,et al. Mitochondrial aconitase ACO2 links iron homeostasis with tumorigenicity in non-small cell lung cancer[J]. Mol Cancer Res,2023,21(1):36-50. doi: 10.1158/1541-7786.MCR-22-0163
|
|
[19]
|
Chen Q,Wang Y,Yang L,et al. PM2.5 promotes NSCLC carcinogenesis through translationally and transcriptionally activating DLAT-mediated glycolysis reprograming[J]. J Exp Clin Cancer Res,2022,41(1):1-21. doi: 10.1186/s13046-022-02437-8
|
|
[20]
|
Cronan J E. Progress in the Enzymology of the mitochondrial diseases of lipoic acid requiring enzymes[J]. Front Genet,2020,11(eCollection):1-6.
|
|
[21]
|
Soreze Y,Boutron A,Habarou F,et al. Mutations in human lipoyltransferase gene LIPT1 cause a leigh disease with secondary deficiency for pyruvate and alpha-ketoglutarate dehydrogenase[J]. Orphanet J Rare Dis,2013,8(eCollection):2-9. doi: 10.1186/1750-1172-8-192
|
|
[22]
|
Tort F,Ferrer-Cortès X,Thió M,et al. Mutations in the lipoyltransferase LIPT1 gene cause a fatal disease associated with a specific lipoylation defect of the 2-ketoacid dehydrogenase complexes[J]. Hum Mol Genet,2014,23(7):1907-1915. doi: 10.1093/hmg/ddt585
|
|
[23]
|
Chen Y,Xu T,Xie F,et al. Evaluating the biological functions of the prognostic genes identified by the pathology atlas in bladder cancer[J]. Oncol Rep,2021,45(1):191-201.
|
|
[24]
|
Lv H,Liu X,Zeng X,et al. Comprehensive analysis of cuproptosis-related genes in immune infiltration and prognosis in melanoma[J]. Front Pharmacol,2022,13(eCollection):1-15. doi: 10.3389/fphar.2022.930041
|
|
[25]
|
Yan C,Niu Y,Ma L,et al. System analysis based on the cuproptosis-related genes identifies LIPT1 as a novel therapy target for liver hepatocellular carcinoma[J]. J Transl Med,2022,20(1):1-18. doi: 10.1186/s12967-022-03630-1
|





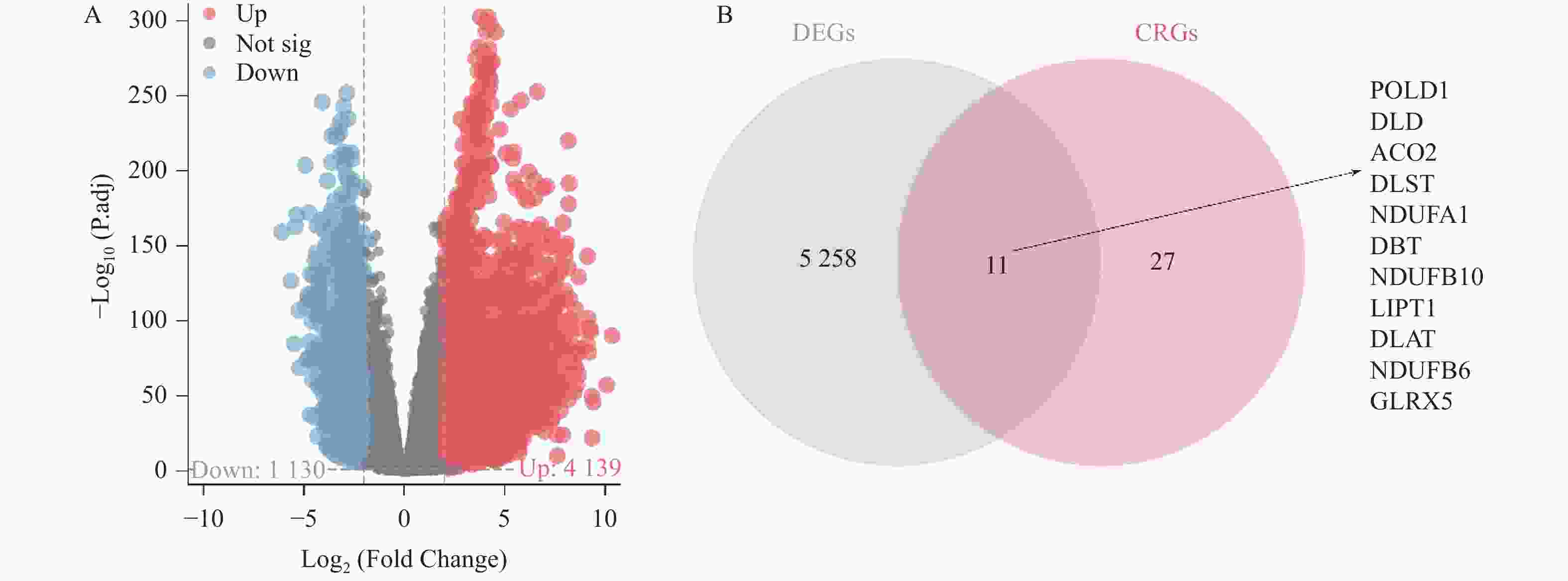
 下载:
下载: