Efficacy of Xinmailong Injection on Septic Cardiomyopathy
-
摘要:
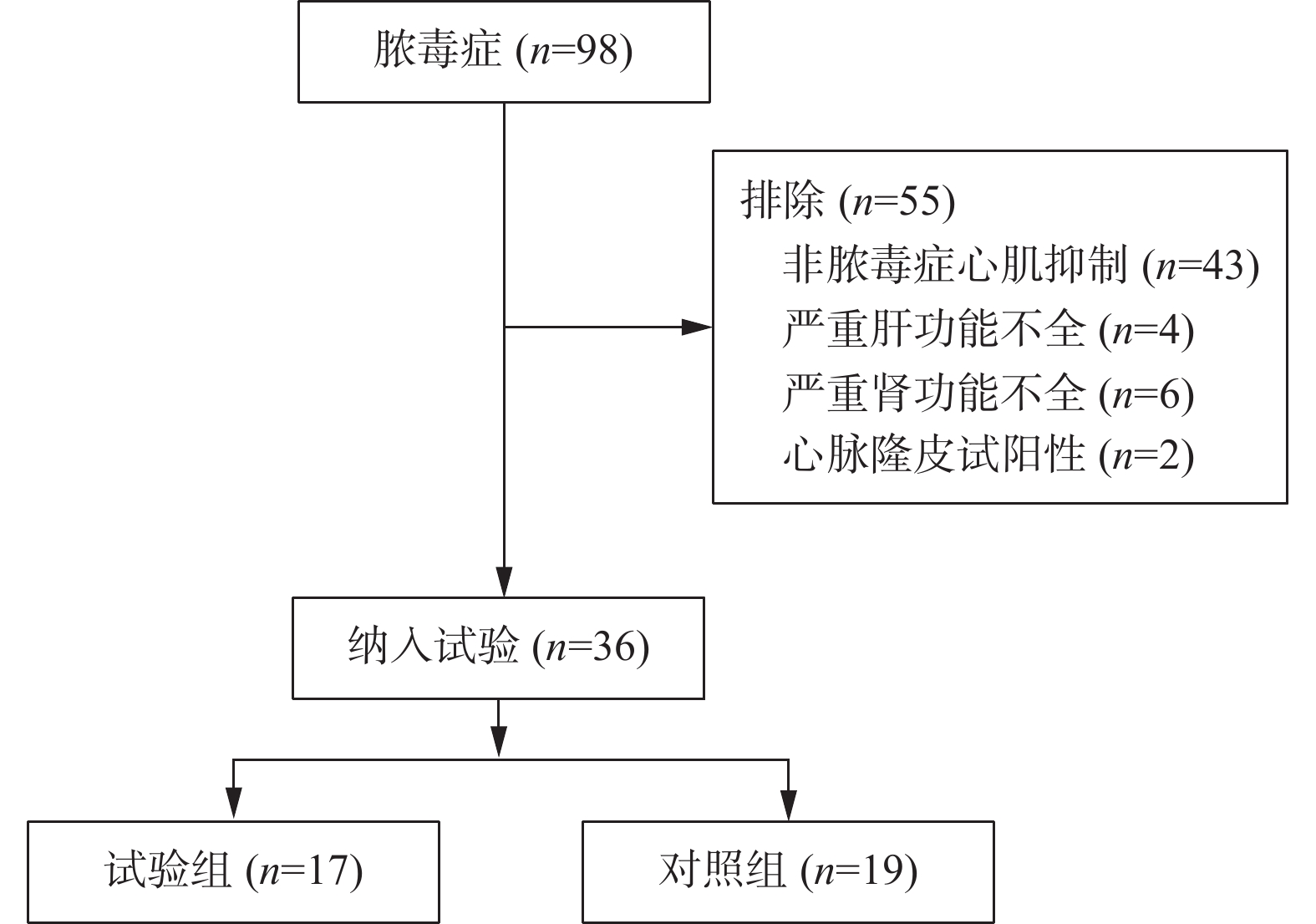
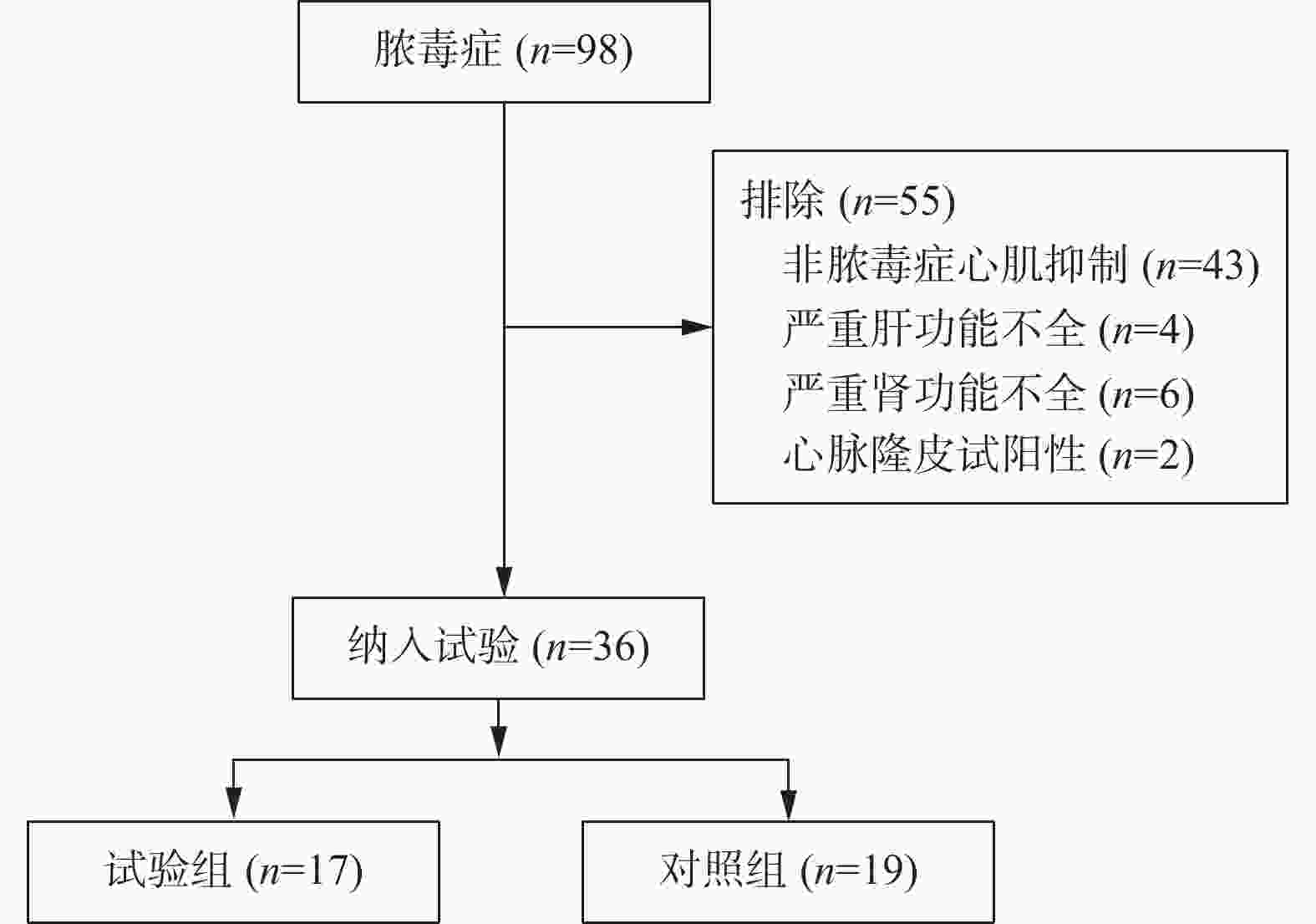
目的 探讨心脉隆注射液在脓毒症性心肌病治疗中的作用。 方法 采用随机对照、单盲法进行研究。36例诊断脓毒症性心肌病患者被随机分为对照组(n = 19)和心脉隆治疗组(n = 17)。2组患者均按照《2018脓毒症和脓毒性休克的管理国际指南》给予规范治疗,治疗期间利用PICCO 监测仪进行血流动力学监测。试验组在规范治疗基础上加用心脉隆注射液治疗,对照组同期进行0.9%氯化钠注射液进行输注。分别于治疗开始前、开始后24 h、72 h、120 h抽取患者外周静脉血,检测肌钙蛋白I、B型脑利钠尿肽,多普勒超声心动图评价心脏功能,比较PICCO显示血流动力学血相关指标。实验数据采用SPSS 19.0统计学软件包结合相关专业进行统计学分析。 结果 与对照组比较,试验组肌钙蛋白I、B型脑利钠尿肽水平明显下降;左室射血分数、三尖瓣环收缩期偏移幅度、E/A升高,E峰减速时间缩短;每搏量指数、心功能指数升高,差异具有统计学意义(P < 0.05)。 结论 心脉隆注射液对改善脓毒症性心肌病患者的心功能有一定作用。 Abstract:Objective To explore the efficacy of Xinmailong injection on septic cardiomyopathy. Methods A randomized controlled, single-blind study was conducted. 36 patients diagnosed with septic cardiomyopathy were randomly divided into control group (n = 19) and cardiomyopathy group (n = 17). All patients in the 2 groups were given standardized treatment according to the 2018 International Guidelines for the Management of Sepsis and Septic Shock, and hemodynamic monitoring was performed by PICCO monitor during treatment. The experimental group was treated with Xinmailong injection on the basis of standard treatment, and the control group was injected with 0.9% sodium chloride injection at the same time. Peripheral venous blood was extracted from patients before treatment, 24 h, 72 h and 120 h after treatment, respectively, to detect troponin I and B brain natriuretic peptide, Doppler echocardiography was used to evaluate cardiac function, and hemodynamic blood related indexes showed by PICCO were compared.The experimental data were statistically analyzed by SPSS 19.0 statistical software. Results Compared with the control group, the levels of Cardiac Troponin I and brain natriuretic peptide B in experimental groups were significantly decreased. Left ventricular ejection fraction (LVEF), tricuspid annular plane systolic excursion (TAPSE), E/A increased, E peak deceleration time decreased; Stroke volume index (SVI) and cardiac function index (CFI) increased, and the difference was statistically significant (P < 0.05). Conclusion Xinmailong injection can improve the cardiac function of patients with septic cardiomyopathy. -
Key words:
- Xinmailong injection /
- Sepsis /
- Myocardial suppression
-
表 1 2组患者基本情况比较( $ \bar x \pm s $)
Table 1. Baseline Participant Characteristics ( $ \bar x \pm s $)
指标 试验组 对照组 χ2/t P 性别(男/女) 10/7 11/8 0.003 0.955 年龄(岁) 54.65 ± 12.32 53.25 ± 11.87 0.297 0.803 身高(cm) 164.65 ± 12.31 166.87 ± 13.62 −0.212 0.832 APECHEII评分 19.12 ± 5.28 18.97 ± 5.59 1.766 0.079 血液净化(有/无) 15/2 16/3 0.122 0.726 表 2 2组患者不同时间点试验室指标比较( $ \bar x \pm s $)
Table 2. Comparison of laboratory parameters between two groups of patients at different time points ( $ \bar x \pm s $)
指标 试验前 试验24 h 试验72 h 试验120 h F P BNP(pg/mL) 试验组 885.76 ± 142.43 762.86 ± 143.54& 497.59 ± 132.37& 255.92 ± 46.43& 132.119 < 0.001 * 对照组 839.54 ± 231.43 759.63 ± 183.57 553.52 ± 142.65 480.76 ± 143.54 0.831 0.370 肌钙蛋白I(ng/mL) 试验组 4.37 ± 1.43 3.28 ± 1.09& 1.62 ± 0.78& 0.47 ± 0.16& 26.899 < 0.001 * 对照组 5.02 ± 2.82 4.88 ± 1.43 3.35 ± 1.02 1.77 ± 0.57 0.030 0.864 与实验前比较,&P < 0.05;不同时间点指标变化有趋势, *P < 0.05。 表 3 2组患者不同时间点心脏彩超相关指标比较( $ \bar x \pm s $)
Table 3. Comparison of Echocardiography at different time points between two groups of patients ( $ \bar x \pm s $)
指标 试验前 试验24 h 试验72 h 试验120 h F P 左室射血分数(%) 试验组 35.76 ± 4.54 42.54 ± 8.43& 49.56 ± 8.92&△ 51.32 ± 8.76&△# 4.836 0.081 对照组 36.32 ± 5.42 39.52 ± 4.32 45.72 ± 10.87 49.76 ± 10.42 0.681 0.417 左室舒张末内经 (mm) 试验组 68.32 ± 7.55 67.27 ± 7.12 65.28 ± 6.84 64.33 ± 7.62 8.095 0.009* 对照组 68.47 ± 8.21 65.54 ± 7.36 66.78 ± 7.52 66.13 ± 7.01 0.013 0.911 左室收缩末内经 (mm) 试验组 59.77 ± 10.46 57.92 ± 11.34 57.38 ± +9.27 56.79 ± 11.66 8.707 0.007* 对照组 59.67 ± 10.28 57.32 ± 10.39 56.48 ± 10.99 57.24 ± 10.31 0.287 0.594 二尖瓣血流频谱E/A峰 试验组 3.36 ± 0.52 0.92 ± 0.28& 0.72 ± 0.32&△ 1.49 ± 0.34&△# 10.397 0.003* 对照组 3.95 ± 0.58 1.32 ± 0.31 0.66 ± 0.23 1.01 ± 0.31 0.110 0.741 E峰减速时间(ms) 试验组 133.62 ± 25.32 169.47 ± 43.76& 256.87 ± 80.92&△ 205.53 ± 86.54&△# 26.899 < 0.001 * 对照组 129.53 ± 35.72 148.93 ± 69.42 289.06 ± 76.43 244.65 ± 73.52 0.555 0.458 三尖瓣环收缩期偏移幅度(mm) 试验组 11.33 ± 2.87 13.75 ± 5.42& 15.87 ± 4.72&△ 16.89 ± 3.72&△# 10.542 0.002* 对照组 12.17 ± 3.72 12.98 ± 3.92 13.37 ± 3.31 14.28 ± 3.09 1.173 0.283 与试验前比较,&P < 0.05;与试验后24 h比较, △P < 0.05; 与试验后72 h比较, #P < 0.05;不同时间点指标变化有趋势, *P < 0.05。 表 4 2组患者不同时间点血流动力学相关指标比较( $ \bar x \pm s $)
Table 4. Comparison of hemodynamic related parameters between two groups of patients at different time points ( $ \bar x \pm s $)
指标 试验前 试验24 h 试验72 h 试验120 h F P 每搏量指数(mL/m2) 试验组 34.20 ± 9.87 38.32 ± 11.77& 44.81 ± 10.62&△ 52.45 ± 9.42&△# 29.843 < 0.001 * 对照组 35.61 ± 13.33 36.67 ± 11.24 40.12 ± 10.74 45.32 ± 9.38 0.107 0.745 外周血管阻力指数(dyn*s*cm−5*m2) 试验组 2632.4 ± 314.3 2457.64 ± 367.3& 1989.4 ± 344.7&△ 1682.7 ± 276.5&△# 131.768 < 0.001 * 对照组 2790.6 ± 267.7 2637.2 ± 268.3 2293.2 ± 275.7 1983.2 ± 256.2 0.121 0.742 全心舒张末容积指数(mL/m2) 试验组 945.2 ± 203.6 908.9 ± 197.3& 809.3 ± 184.9&△ 779.6 ± 191.7&△# 78.608 < 0.001 * 对照组 949.3 ± 233.5 891.7 ± 186.3 822.2 ± 191.4 793.6 ± 205.2 4.937 0.071 心功能指数(L/min·m2) 试验组 3.21 ± 0.56 3.87 ± 0.71& 4.94 ± 0.85&△ 5.32 ± 0.78&△# 9.095 0.005* 对照组 3.17 ± 0.47 3 .54 ± 0.72 4.58 ± 0.88 4.91 ± 0.69 1.103 0.261 与试验前比较,&P < 0.05;与试验后24 h比较, △P < 0.05; 与试验后72 h比较, #P < 0.05;不同时间点指标变化有趋势, *P < 0.05 。 -
[1] 田慈,谢苗荣. 脓毒症心肌损伤机制的研究进展[J]. 临床和实验医学杂志,2013,12(2):148-150. [2] Lv X,Wang H. Pathophysiology of sepsis-induced myocardial dysfunction[J]. Military Medical Research,2016,3(4):202-211. [3] Wacharasint P,Nakada T A,Boyd J H. Normal-range blood lactate concentration in septic shock is prognostic and predictive[J]. Shock,2012,38(1):4-10. doi: 10.1097/SHK.0b013e318254d41a [4] 黄小春. 心脉隆注射液联合常规临床干预治疗冠心病并发心力衰竭患者的效果[J]. 中外医学研究,2022,20(28):134-137. [5] 周杨,彭芳. 心脉隆注射液与多种药物治疗心力衰竭的疗效和安全性分析[J]. 当代医药论丛,2020,18(13):60-63. [6] 李真玉,陈兵,李广平. 脓毒症心肌抑制的诊治进展[J]. 中国循环杂志,2015,30(07):705-707. [7] 肖军,唐发宽,王洪叶. 心脉隆注射液对急性心肌梗死患者脑钠肽的影响及其临床意义[J]. 医学综述,2010,16(17):2679-2681. [8] Rognoni A,Lupi A,Lazzero M. Levosimendan:From basic science to clinical trials[J]. Recent Pat Cardiovasc Drug Discov,2011,6(1):9-15. doi: 10.2174/157489011794578455 [9] Morgan P,Al-Subaie N,Rhodes A. Minimally invasive cardiac output monitoring[J]. Curr Opin Crit Care,2008,14(3):322-326. doi: 10.1097/MCC.0b013e3282fd6e4a [10] Lena M Napolitano. Sepsis 2018:Definitions and guideline changes[J]. Surg Infect (Larchmt),2018,19(2):117-125. doi: 10.1089/sur.2017.278 [11] 样雪婷, 张惠锋. 补产超广谱β-内酰胺酶肠杆菌科细菌感染患者使用抗菌药物的药物评价[J]昆明医科大学学报, 2022, 43 (6): 74-78. [12] Hochstadt A,Meroz Y,Landesberg G. Myocardial dysfunction in severe sepsis and septic shock:More questions than answers[J]. J Cardiothorac Vasc Anesth,2011,25(3):526-535. [13] 潘小进,孙华. 兔脓毒症早期心肌功能的变化[J]. 中国危重病急救医学,2004,16(6):355-357. [14] 江利冰,李瑞杰,张斌,等. 2016年脓毒症与脓毒性休克处理国际指南[J]. 中华急诊医学杂志,2017,26(3):263-266. [15] 刘峰宇,孙同文. 脓毒症心肌病的诊疗进展[J]. 中华急诊医学杂志,2022,31(7):858-861. [16] 耿丽娟,李素玮,张永利,等. 脓毒症心肌损伤发病机制的研究进展[J]. 中华内科杂志,2015,54(1):77-80. [17] 王维雯,李德霞,张杰,等. 射血分数降低的心力衰竭患者血清可溶性ST2与心脏重构的相关性[J]. 昆明医科大学学报,2021,42(08):71-77. [18] Kakihana Y,Ito T,Nakahara M,et al. Sepsis-induced myocardial dysfunction:Pathophysiology and management[J]. J Intensive Care,2016,4(1):22. doi: 10.1186/s40560-016-0148-1 [19] Esper A M,Martin G S. Extending international sepsis epidemiology:The impact of organ dysfunction[J]. Crit Care,2009,13(1):120. doi: 10.1186/cc7704 [20] Rhodes A,Evans L E,Alhazzani W,et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock:2016[J]. Intensive Care Med,2017,43(3):304-377. [21] 卢年芳,於江泉,邵俊,等. 超声心动图心室功能指标与脓毒症患者预后关系的研究[J]. 中华危重病急救医学,2022,34(7):740-745. -





 下载:
下载: