Effects of Periplaneta americana Extract on Autophagy and Invasive Metastasis of Subcutaneous Transplanted Hepatocellular Carcinoma in Nude Mice
-
摘要:
目的 研究美洲大蠊提取物CII-3和脱脂膏对肝癌耐药细胞BEL-7402/5-FU自噬和侵袭转移的影响以及初步的作用机制。 方法 对接种肝癌敏感细胞BEL-7402和肝癌耐药细胞BEL-7402/5-FU的移植瘤裸鼠,通过索拉菲尼、CII-3和脱脂膏药物处理后,观察给药后裸鼠血清生化指标,裸鼠瘤块变化和心、肝、肾、脾等脏器指数的变化,以及肝脏和瘤块病理学改变,同时观察肿瘤组织细胞中的自噬相关因子和侵袭转移相关因子的变化。 结果 CII-3和脱脂膏能使裸鼠体重呈下降趋势,并抑制肿瘤的生长,明显减轻瘤重(P < 0.01);CII-3能提高脾脏指数和心脏指数(P < 0.05);与耐药组相比,CII-3组裸鼠血清CR有升高趋势(P < 0.05);索拉菲尼和CII-3处理组能诱导肿瘤组织坏死,作用优于脱脂膏组;与耐药组相比,除AKT外(P > 0.05),CII-3和脱脂膏给药组均能明显抑制自噬和侵袭转移相关因子(P < 0.05)。 结论 美洲大蠊提取物CII-3和脱脂膏均能抑制肝癌耐药细胞的自噬和侵袭转移,同时具有较好的抑瘤作用。其对裸鼠肝癌移植瘤的肝肾损伤有待进一步观察。 Abstract:Objective To investigate the effects and preliminary mechanisms of the extract CII-3 and defatted ointment of Periplaneta americana on autophagy, invasion and metastasis of drug-resistant hepatocellular carcinoma cell line BEL-7402/5-FU. Methods The transplantation tumors of liver cancer-sensitive cells BEL-7402 and liver cancer-resistant cells BEL-7402/5-FU were treated with Sorafenib, CII-3, and defatted ointment drugs. Then, the serum biochemical indicators of the nude mice, changes in tumor size, and changes in organ indices such as heart, liver, kidney, and spleen were observed after drug administration. The histopathological changes in the liver and tumor were also observed, along with changes in autophagy-related factors and invasion and metastasis-related factors in tumor tissue cells. Results CII-3 and the deffated cream reduced the body weight of nude mice and inhibited tumor growth, significantly reducing tumor weight (P < 0.01). CII-3 increased the spleen index and heart index (P < 0.05); compared to the drug-resistant group, the CII-3 group showed an upward trend in serum CR (P < 0.05). Sorafenib and CII-3 treatment induced tumor tissue necrosis, with better effects than the deffatede ointment group; compared to the drug-resistant group, both the CII-3 and deffatede ointment groups significantly inhibited autophagy and invasion-related factors, except for AKT (P < 0.05). Conclusion Periplaneta americana extract CII-3 and deffatede ointment can inhibit the autophagy, invasion and metastasis of drug-resistant hepatocellular carcinoma cells, and also have a good anti-tumor effect. Further observation is needed for its liver and kidney damage on nude mice with hepatocellular carcinoma transplanted tumors. -
肝癌是一种常见的恶性肿瘤,在全球范围内发病率和死亡率均较高。据统计,我国肝癌死亡率居于亚洲国家首位[1]。目前,临床上治疗肝癌的手段通常有手术治疗、肝癌消融治疗、外放射治疗和药物治疗等[2],其中使用化疗药物治疗是一种较常规的治疗方式,但目前临床上使用的多数化疗药物易诱导肿瘤细胞产生耐药,甚至使肿瘤细胞具有多药耐药性(multi-drug resistance,MDR)[3]。因此探索药物对耐药肿瘤细胞的作用及机制成为治疗癌症的研究热点。
细胞自噬是一种依赖溶酶体的自我降解过程,有研究认为肿瘤细胞的自噬可促进癌症的生长和生存[4]。对于耐药肿瘤细胞,还可通过侵袭转移途径促进癌细胞的生存和扩散,这也是癌症难以治愈的一个原因。中药具有多靶点、多层次、低毒等优点,对肿瘤细胞及耐药肿瘤细胞疗效较佳。美洲大蠊作为一种动物中药,具有修复肝损伤、抗肿瘤等作用,尤其对肝癌具有较好的疗效,可逆转肝癌多药耐药。但美洲大蠊提取物对肝脏肿瘤细胞的自噬和侵袭转移的研究尚未见报道。故本文以裸鼠为实验对象,给予CII-3和脱脂膏进行干预,并以索拉菲尼为阳性对照,探讨美洲大蠊提取物CII-3与脱脂膏对肝癌细胞及肝癌耐药细胞自噬和侵袭转移力的影响。
1. 材料与方法
1.1 实验动物
雌雄各半的标准体重的SPF级Balb/c-nude裸鼠[动物合格证号:430727200101104518,许可证号:SCXK(湘)2019-0004],由湖南斯莱克景达实验动物有限公司提供。本实验已经大理大学实验动物伦理委员会批准。
1.2 主要试剂和设备
美洲大蠊提取物脱脂膏,系褐色粘稠糕状,得率约为75.18%,批号为P14805-20171023,由美洲大蠊干燥虫体的醇提物制备的浸膏制得。美洲大蠊脱脂膏进一步纯化的粗提物CII-3为黄褐色冻干粉末,得率约为0.2%,批号为17102125,以上2种均由大理大学昆虫生物医药研究院张成桂博士提供;5-氟尿嘧啶(5-Pentafluorouracil,5-FU)(批号WXBC0190V),购自美国 Sigma 公司;索拉非尼(批号819C021),购自北京索莱宝科技有限公司;谷草转氨酶测试盒(AST)(批号20201112),谷丙转氨酶测试盒(ALT)(批号20201113),肌酐测试盒(CRE)(批号20201109),尿素氮测试盒(BUN)(批号20201120),均购自南京建成生物科技有限公司;全波长酶标仪由Bio-Teck公司生产;激光共聚焦显微镜由徕卡公司生产;人肝细胞癌敏感细胞株BEL-7402,耐5-FU人肝细胞癌细胞株BEL-7402/5-FU,生产批号均为MXC050,均由上海美轩生物科技有限公司提供。
1.3 移植瘤模型的建立[5]
取密度为8×107的BEL-7402或BEL-7402/5-FU细胞悬液,用100 μL的 PBS和 Matrigel基质胶包裹好后,接种于裸鼠左前肢腋下。敏感组接种BEL-7402为肝癌敏感细胞模型,其他组均接种BEL-7402/5-FU为耐药肝癌细胞模型,接种第5天开始,每2 d 1次分别测量并记录裸鼠腋下肿瘤长短径。
1.4 动物分组、给药与取材[6]
取未接种肿瘤细胞的裸鼠作为空白组;接种BEL-7402并造模成功的裸鼠为敏感组;接种BEL-7402/5-FU并造模成功的裸鼠随机分为30 mg/kg索拉菲尼组、200 mg/kgCII-3组和200 mg/kg脱脂膏组,每组12只。在接种后的第8天分别按上述剂量给药(0.1 mL/10 g),连续给药14 d。末次给药24 h后,各组眼眶静脉丛取血用于生化指标监测;剥取瘤块以及心、肝、肾、脾等重要脏器,用于脏器指数、肿瘤体积和抑瘤率的计算、肝脏和肿瘤组织病理学检测以及肿瘤组织相关指标的检测。
1.5 裸鼠生化指标检测[7]
按照试剂盒要求测定各组血清中AST、ALT、CR、BUN等生化指标。
1.6 裸鼠的脏器指数和抑瘤率的检测[8]
脏器指数 = 脏器重量(mg)/动物体重(g)。
肿瘤体积 = 1/2(长径×短径×短径),肿瘤的相对体积=每次测量计算后的肿瘤体积/接种后第4天的体积[9]。
1.7 肝脏和肿瘤组织病理学检测[10]
将肝脏和肿瘤组织常规处理,分别进行石蜡包埋、切片、染色、封片,并于光学显微镜下观察病理组织变化。
1.8 肿瘤组织中自噬和侵袭转移相关mRNA的检测[11]
取肿瘤组织进行常规处理后,再按照相应试剂盒操作流程进行逆转录(RT-PCR)反应,确定自噬和侵袭转移相关因子引物,见表1,表2,观察RT-PCR反应并计算各基因的相对表达量。计算公式:
表 1 自噬相关因子引物序列表Table 1. Primers sequence of autophagy related factors名称 Forward Reverse 鼠ATG5 TGTGCTTCGAGATGTGTGGTT ACCAACGTCAAATAGCTGACTC ATG7 TGACCTTCGCGGACCTAAAGA CCCGGATTAGAGGGATGCTC 鼠BECLIN AGGCGAAACCAGGAGAGAC CCTCCCCGATCAGAGTGAA 鼠PIK3C3 AACAACCGTGTCGCTCTTTG GAACCATCTGCCTCCACGTTA 鼠LC3B GTCCTGGACAAGACCAAGTTCC CCATTCACCAGGAGGAAGAAGG 鼠P62 CCGGCTGATTGAGTCCCTC CCCCGATGTCGTAATTCTTGG GAPDH AGGTCGGTGTGAACGGATTTG TGTAGACCATGTAGTTGAGGTCA 表 2 侵袭转移相关因子引物序列表Table 2. Primer sequence of invasion and metastasis related factors名称 Forward Reverse 鼠MMP2 CAAGGATGGACTCCTGGCACAT TACTCGCCATCAGCGTTCCCAT 鼠MMP9 GCTGACTACGATAAGGACGGCA TAGTGGTGCAGGCAGAGTAGGA 鼠mTOR GGCACACATTTGAAGAAGCAG CTCGTTGAGGATCAGCAAGG 鼠AKT CCTTTATTGGCTACAAGGAACGG GAAGGTGCGCTCAATGACTG 鼠4EBP1 GGGGACTACAGCACCACTC GTTCCGACACTCCATCAGAAAT GAPDH TGGCCTTCGTGTTCCTAC GAGTTGTGTTGAAGTCGCA -△△Ct = -[△Ct(样本) - △Ct(相对比较组样本)]
△Ct = Ct(目的基因) - Ct(内参基因)
1.9 统计学处理
采用SPSS 17.0软件处理数据,正态分布的计量资料以均数±标准差(
$\bar x \pm s $ )表示,2组间比较采用t检验,多组间比较采用单因素方差分析,单因素方差分析有意义后各组两两比较采用q检验。P < 0.05表示差异具有统计学意义。2. 结果
2.1 CII-3和脱脂膏对移植瘤裸鼠体重及肿瘤抑制的影响
前期各组裸鼠体重变化不大,CⅡ-3组和脱脂膏组在后期有降低裸鼠体重的趋势,但差异无统计学意义(P > 0.05)。敏感组瘤体积增长速度较快,耐药组趋于稳定。索拉菲尼组、CII-3组和脱脂膏组在给药9 d后瘤体积明显减小。敏感组瘤重显著高于其余4组,耐药组明显高于索拉菲尼组、CII-3组和脱脂膏组(P < 0.01),索拉菲尼组、CII-3组、脱脂膏组之间瘤重,差异无统计学意义(P > 0.05),见图1。
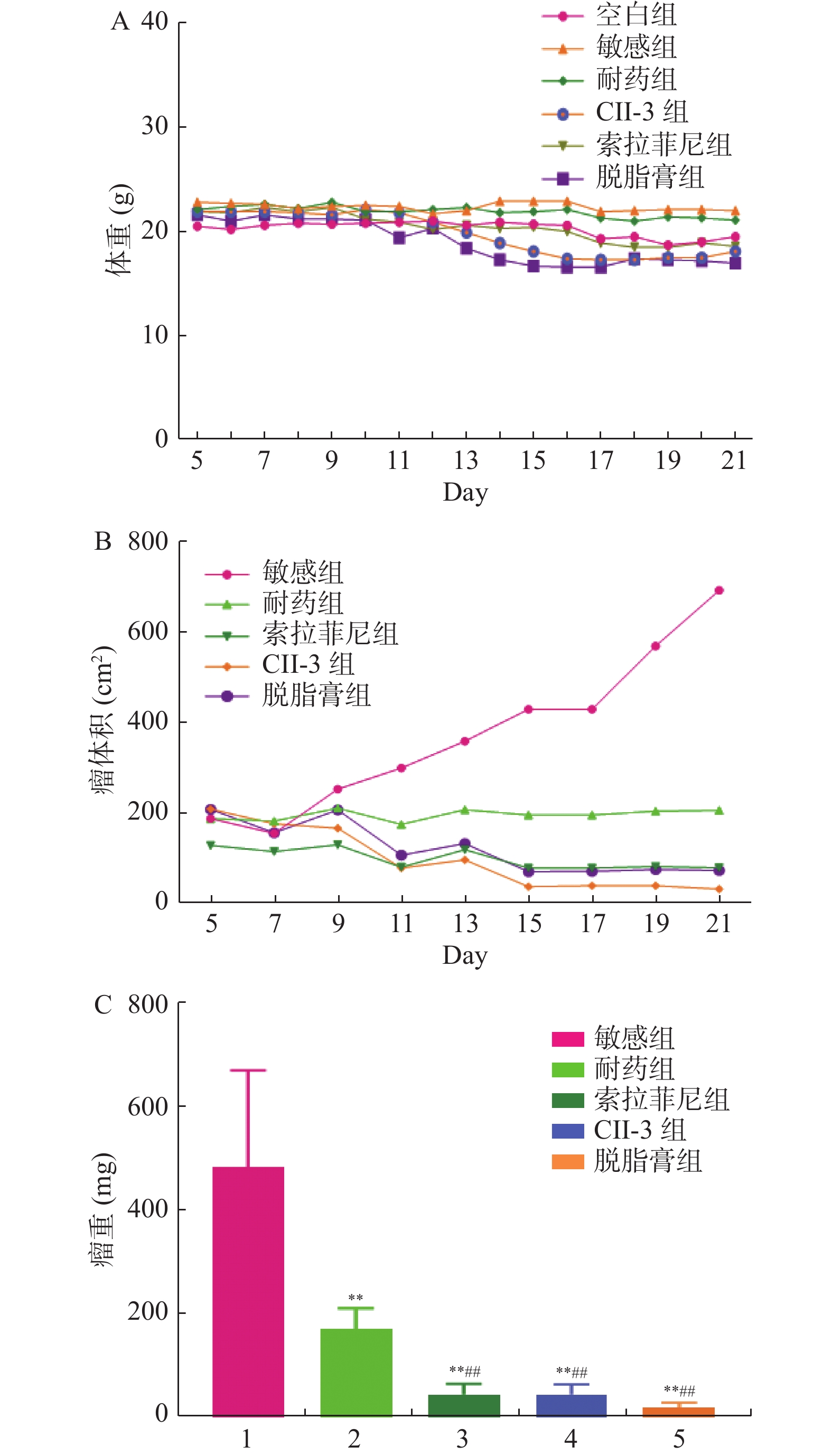 图 1 CII-3和脱脂膏对皮下移植瘤裸鼠体重、肿瘤体积及瘤重的影响A:CII-3和脱脂膏对皮下移植瘤裸鼠体重的影响;B:CII-3和脱脂膏对皮下移植瘤裸鼠瘤体积的影响;C:CII-3和脱脂膏对皮下移植瘤裸鼠瘤重的影响。与敏感组相比较,*P < 0.05, **P < 0.01;与耐药组比较,#P < 0.05, ##P < 0.01;与索拉非尼组相比较,△P < 0.05,△△P < 0.01。Figure 1. Effects of CII-3 and defatted ointment on body weight,tumor volume and tumor weight of nude mice with subcutaneously transplanted tumor
图 1 CII-3和脱脂膏对皮下移植瘤裸鼠体重、肿瘤体积及瘤重的影响A:CII-3和脱脂膏对皮下移植瘤裸鼠体重的影响;B:CII-3和脱脂膏对皮下移植瘤裸鼠瘤体积的影响;C:CII-3和脱脂膏对皮下移植瘤裸鼠瘤重的影响。与敏感组相比较,*P < 0.05, **P < 0.01;与耐药组比较,#P < 0.05, ##P < 0.01;与索拉非尼组相比较,△P < 0.05,△△P < 0.01。Figure 1. Effects of CII-3 and defatted ointment on body weight,tumor volume and tumor weight of nude mice with subcutaneously transplanted tumor2.2 CII-3和脱脂膏对移植瘤裸鼠脏器指数的影响
CII-3组心脏指数高于空白组、敏感组和耐药组(P < 0.05)。与空白组、敏感组、耐药组相比,索拉菲尼组提升肝脏指数,CII-3组和脱脂膏组则降低肝脏指数。各药物处理组均升高脾脏指数,尤其是CII-3组。脱脂膏组心脏指数较索拉菲尼组高(P < 0.05),其他组变化不明显。各组对肺脏指数影响,差异无统计学意义(P > 0.05),见表3。
表 3 CII-3和脱脂膏对皮下移植瘤裸鼠脏器指数的影响($\bar x \pm s $ ,n = 12)Table 3. Effects of CII-3 and defatted ointment on organ index in nude mice with subcutaneously transplanted tumor ($\bar x \pm s $ ,n = 12)组别 心脏指数(mg/g) 肝脏指数(mg/g) 脾脏指数(mg/g) 肺脏指数(mg/g) 肾脏指数(mg/g) 空白组 6.02 ± 0.80 56.73 ± 7.30 6.02 ± 0.80 9.03 ± 1.60 17.84 ± 2.10 敏感组 5.98 ± 0.90 60.50 ± 8.89 5.98 ± 0.90 9.12 ± 2.12 18.16 ± 1.17 耐药组 6.67 ± 1.55 63.74 ± 8.09 6.67 ± 1.55 9.68 ± 2.79 17.21 ± 3.17 索拉非尼组 6.67 ± 1.01 69.42 ± 8.81▲*# 6.67 ± 1.01 11.43 ± 3.52 17.45 ± 4.59 CII-3组 7.12 ± 1.55▲*# 58.14 ± 10.6△ 7.12 ± 1.55▲* 11.54 ± 2.97 18.06 ± 3.54 脱脂膏组 6.08 ± 0.71 52.67 ± 8.10#△ 6.08 ± 0.71 10.37 ± 3.14 20.85 ± 3.38△ F 3.45 9.31 3.45 3.31 3.53 P 0.021 < 0.01 0.021 0.025 0.019 与空白组比较,▲P < 0.05,▲▲P < 0.01;与敏感组比较,*P < 0.05,**P < 0.01;与耐药组比较,#P < 0.05,##P < 0.01;与索拉非尼组比较,△P < 0.05,△△P < 0.01。 2.3 CII-3和脱脂膏对移植瘤裸鼠血清生化指标的影响
与空白组相比,敏感组裸鼠的AST升高,索拉菲尼和脱脂膏组能降低AST,CII-3组则升高AST。对ALT的影响,也存在索拉菲尼和脱脂膏组降低其含量,CII-3组则升高其含量。各给药处理组均提升CR的含量,而各给药组对BUN含量影响则不明显,见表4。
表 4 CII-3和脱脂膏对皮下移植瘤裸鼠生化指标的影响($\bar x \pm s $ ,n = 12)Table 4. Effects of CII-3 and defatted ointment on biochemical indexes of nude mice with subcutaneously transplanted tumor ($\bar x \pm s $ ,n = 12)组别 AST(U/L) ALT(U/L) CR(μmol/L) BUN(mmol/L) 空白组 481.22 ± 62.98 13.99 ± 2.00 19.61 ± 2.75 5.34 ± 0.41 敏感组 660.91 ± 210.46▲ 12.27 ± 0.53 13.95 ± 4.25▲ 3.90 ± 0.51 耐药组 500.51 ± 83.87* 21.91 ± 5.26▲** 14.93 ± 2.35 4.88 ± 0.97 索拉非尼组 498.53 ± 140.13* 8.42 ± 2.34▲## 22.66 ± 4.13*# 4.83 ± 1.80 CII-3组 656.83 ± 106.84▲#△ 17.93 ± 1.88**△ 24.88 ± 4.59▲*# 3.33 ± 0.54▲#△ 脱脂膏组 491.06 ± 62.76# 12.81 ± 1.83# 19.92 ± 7.61* 4.64 ± 1.13 F 10.13 62.34 17.62 10.83 P < 0.01 <0.01 <0.01 <0.01 与空白组比较,▲P < 0.05,▲▲P < 0.01;与敏感组比较,*P < 0.05,**P < 0.01;与耐药组比较,#P< 0.05,##P < 0.01;与索拉非尼组比较,△P < 0.05,△△P < 0.01。 2.4 CII-3和脱脂膏对移植瘤裸鼠肝脏组织病理学的影响
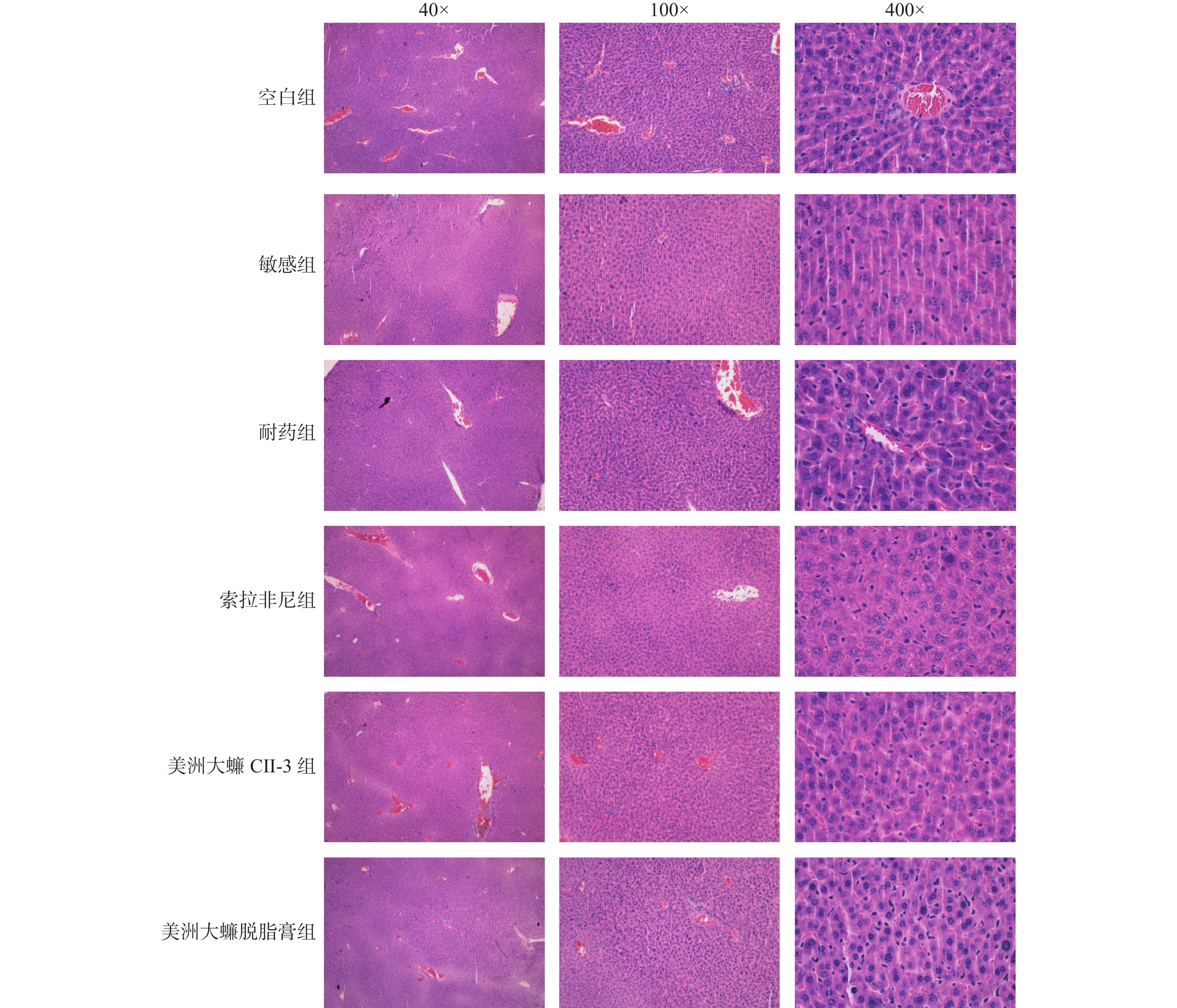
空白组肝组织细胞排列整齐、形状规则,而敏感组和耐药组肝组织的细胞核排列不整齐且出现皱缩现象,索拉菲尼组、CⅡ-3组和脱脂膏组对肝损伤的改善虽有一定作用,但效果不凸显,肝细胞排列部分仍存在不规则且多核现象,见图2。
2.5 CII-3和脱脂膏对移植瘤裸鼠肿瘤组织病理学的影响
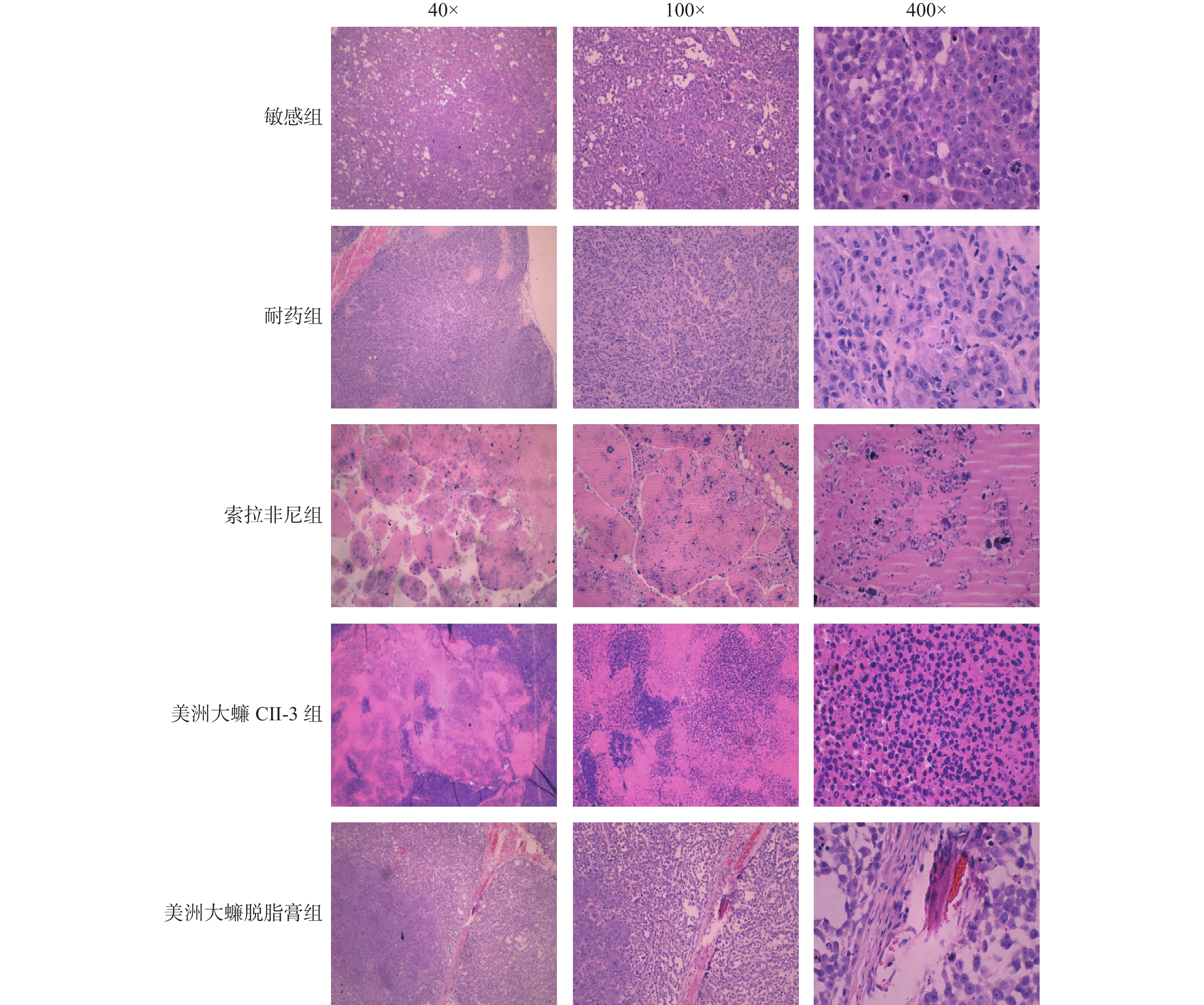
敏感组和耐药组肿瘤组织呈现鹅卵石或不规则形态,索拉菲尼组肿瘤组织细胞为片状坏死,细胞形态难以看清;CⅡ-3组大部分细胞呈不规则形态,成片状坏死,细胞核出现缩小甚至碎裂;脱脂膏组肿瘤细胞坏死不明显,见图3。
2.6 CII-3和脱脂膏对移植瘤裸鼠自噬相关因子mRNA的影响
与敏感组相比,耐药组6个自噬相关因子(ATG5、ATG7、BECLIN、LC3B、PIK3C3、P62)均呈现高表达。与耐药组相比,索拉菲尼组、CⅡ-3组和脱脂膏组均能抑制上述6个自噬相关因子的表达,见表5。
表 5 CII-3和脱脂膏对移植瘤裸鼠自噬相关因子mRNA的影响 ($\bar x \pm s $ ,n = 12)Table 5. Effects of CII-3 and defatted ointment on autophagy related factor mRNA in nude mice with transplanted tumor ($\bar x \pm s $ ,n = 12)组别 ATG5 ATG7 BECLIN LC3B PIK3C3 P62 敏感组 0.08 ± 0.01 0.04 ± 0.01 0.05 ± 0.03 0.03 ± 0.02 0.03 ± 0.00 0.04 ± 0.01 耐药组 1.00 ± 0.00** 1.00 ± 0.00** 1.00 ± 0.00** 1.00 ± 0.00** 1.00 ± 0.00** 1.00 ± 0.00** 索拉菲尼组 0.30 ± 0.14*# 0.03 ± 0.00## 0.02 ± 0.01## 0.16 ± 0.04**## 0.10 ± 0.02**## 0.1 ± 0.01**## CII-3组 0.16 ± 0.05## 0.05 ± 0.02## 0.12 ± 0.05*##△ 0.13 ± 0.06**## 0.04 ± 0.01##△ 0.08 ± 0.02*## 脱脂膏组 0.27 ± 0.12*## 0.07 ± 0.02## 0.12 ± 0.06*##△ 0.33 ± 0.01**##△△ 0.14 ± 0.03**##△ 0.24 ± 0.06**##△△ F 300.26 16442.05 1974.64 2171.41 10020.07 3148.02 P < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 与敏感组比较,*P < 0.05,**P < 0.01;与耐药组比较,#P < 0.05,##P < 0.01;与索拉非尼组比较,△P < 0.05,△△P < 0.01。 2.7 CII-3和脱脂膏对移植瘤裸鼠侵袭转移相关因子mRNA的影响
与敏感组相比,耐药组5个侵袭转移相关因子(MMP2、MMP9、mTOR、AKT、4EBP1)均呈现高表达。与耐药组相比,索拉菲尼组除提升4EBP1较为明显外,其余均降低;而CⅡ-3组和脱脂膏组均能抑制5个侵袭转移相关因子的表达,见表6。
表 6 CII-3和脱脂膏对移植瘤裸鼠侵袭转移相关因子mRNA的影响($\bar x \pm s $ ,n = 12)Table 6. Effects of CII-3 and defatted ointment on the mRNA of invasion and metastasis related factors in nude mice with transplanted tumor ($\bar x \pm s $ ,n = 12)组别 MMP2 MMP9 mTOR AKT 4EBP1 敏感组 0.01 ± 0.00 0.01 ± 0.02 0.04 ± 0.01 0.02 ± 0.01 0.23 ± 0.08 耐药组 1.00 ± 0.00** 1.00 ± 0.00* 1.00 ± 0.00** 1.00 ± 0.00 1.00 ± 0.00** 索拉非尼组 0.02 ± 0.01**## 0.18 ± 0.08# 0.04 ± 0.01## 0.11 ± 0.06 1.80 ± 0.30**## CII-3组 0.01 ± 0.01## 0.00 ± 0.00# 0.08 ± 0.02## 0.17 ± 0.10 0.15 ± 0.06# 脱脂膏组 0.04 ± 0.02## 0.03 ± 0.01# 0.15 ± 0.30**##△ 0.20 ± 0.32 0.33 ± 0.15# F 26096.68 2171.29 154.83 156.90 325.86 P < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 与敏感组比较,*P < 0.05,**P < 0.01;与耐药组比较,#P < 0.05,##P < 0.01;与索拉非尼组比较,△P < 0.05,△△P < 0.01。 3. 讨论
肝癌作为一种恶性肿瘤疾病,严重威胁着人民的身体健康和生命安全。化疗药由于毒性强,易产生MDR,疗效不显著等缺点限制了其在临床上的使用。多种中药因作用靶点多、不良反应小等优点被临床用于肿瘤的治疗[12]。美洲大蠊作为一种动物药,自开发为药物以来备受关注,已有大量研究表明美洲大蠊提取物可通过抑制肿瘤细胞生长、诱导细胞凋亡、逆转多药耐药等机制对多种癌症组织产生抑制作用[13]。细胞自噬和侵袭转移是肿瘤细胞的重要生命活动,许多中药发挥抗肿瘤作用就是通过调节肿瘤细胞的自噬、侵袭转移途径[14]。细胞自噬的调控对肝癌的作用至今仍是国内外的研究热点[15-16],例如有研究报道了RNA结合蛋白PNO1和类固醇原件结合蛋白2SREP2等就是通过调节肝癌细胞的自噬和侵袭转移从而抑制细胞凋亡成为肝细胞癌的治疗靶点[17-18]。此外,已有研究发现美洲大蠊提取物脱脂膏和CⅡ-3有一定的对抗肿瘤MDR的作用[19],但对于CⅡ-3和脱脂膏是否影响肿瘤的自噬和侵袭转移则没有深入研究。本研究通过动物实验检测美洲大蠊提取物对裸鼠瘤体积、脏器指数、生化指标,肿瘤细胞病理学及自噬和侵袭转移相关因子的表达来探讨脱脂膏和CⅡ-3对肝癌耐5-氟尿嘧啶细胞(BEL-7402/5-FU)自噬和侵袭转移能力的影响。
3.1 CⅡ-3和脱脂膏的抑癌作用
本研究观察到CII-3和脱脂膏有降低耐药肝癌裸鼠体重趋势,且可减少裸鼠皮下移植瘤体积和重量,表明美洲大蠊提取物CII-3和脱脂膏可抑制耐药性肝癌细胞的生长。此外,本研究还在镜下观察到敏感组和耐药组肿瘤细胞呈鹅卵石或不规则形态,而索拉菲尼组和CII-3组肿瘤细胞呈片状坏死,表明CII-3与抗肝癌药物索拉菲尼均对肿瘤细胞有杀伤作用,这进一步证明了CII-3具有抗肿瘤及抗肿瘤耐药效果。而脱脂膏组肿瘤细胞片状坏死情况不够明显,说明了美洲大蠊提取物CII-3的抗肿瘤及抗肿瘤耐药的效果比脱脂膏更佳。先前的研究也证明了脱脂膏和CⅡ-3可逆转人肝癌细胞HepG2/ADM细胞的多药耐药性,且CⅡ-3的效果优于脱脂膏[20]。
3.2 CⅡ-3和脱脂膏引起肝肾损伤
虽然先前大多研究认为美洲大蠊提取物可改善肝功能,减轻肝纤维化[21-22],但本研究发现裸鼠接种肝癌敏感细胞和耐药细胞后会对肝脏组织产生一定影响,诱发肝损伤,且索拉菲尼、美洲大蠊提取物CII-3均不能有效改善这种损伤。提示我们还应进一步加强对CII-3在抗肿瘤方面的作用机制和安全性研究。此外该研究也发现了CII-3和脱脂膏能提高脾脏指数,可升高血清CR值,一定程度也说明了CII-3和脱脂膏有一定的肝肾损伤,有必要进行进一步的分离纯化。
3.3 CII-3和脱脂膏影响肝癌细胞的自噬和侵袭转移
近年来研究发现细胞自噬和侵袭转移与肝细胞癌的发生、转移及耐药等方面有密切的关系[23-24]。细胞自噬和侵袭转移过程是由许多基因共同参与完成,其中参与细胞自噬的基因主要包括ATG5、ATG7、P62。其中ATG5主要参与自噬体形成,促进自噬前体膜延伸,ATG7参与调控自噬体的形成,P62主要依赖自噬进行降解。参与侵袭转移的主要有MMP家族(MMP2和MMP9表现最明显)、AKT、PI3K等[25-26]。在研究各组自噬和侵袭转移相关因子的表达时发现,耐药肿瘤组织中P62、ATG5、ATG7、MMP2、MMP9、AKT等均呈高表达,说明耐药肝癌细胞具有更强的自噬和侵袭转移能力,但P62作为自噬负相关因子却呈现出高表达,可能是由于P62作为自噬过程的最后阶段,受自噬影响较小。脱脂膏组和CII-3组中除P62外,其余自噬和侵袭转移相关因子的mRNA均明显降低。表明CII-3和脱脂膏可降低这种自噬和侵袭转移能力,且CII-3的作用效果优于脱脂膏,但二者对不同的自噬和侵袭转移相关因子可产生不同程度的影响,其中对自噬相关因子ATG5影响最为明显,而对ATG7和P62影响较小。证明美洲大蠊提取物可能只能作用于自噬的某些阶段。
综上所述,本研究从动物水平入手,在前期的实验基础上进一步研究了美洲大蠊提取物CII-3和脱脂膏对肝癌耐5-氟尿嘧啶细胞(BEL-7402/5-FU)自噬和侵袭转移能力的影响,为该药的物质基础研究和临床应用提供了实验依据。但由于动物样本有限等问题,未能进一步监测肿瘤组织中相关蛋白的表达,还需要进一步的研究。
-
图 1 CII-3和脱脂膏对皮下移植瘤裸鼠体重、肿瘤体积及瘤重的影响
A:CII-3和脱脂膏对皮下移植瘤裸鼠体重的影响;B:CII-3和脱脂膏对皮下移植瘤裸鼠瘤体积的影响;C:CII-3和脱脂膏对皮下移植瘤裸鼠瘤重的影响。与敏感组相比较,*P < 0.05, **P < 0.01;与耐药组比较,#P < 0.05, ##P < 0.01;与索拉非尼组相比较,△P < 0.05,△△P < 0.01。
Figure 1. Effects of CII-3 and defatted ointment on body weight,tumor volume and tumor weight of nude mice with subcutaneously transplanted tumor
表 1 自噬相关因子引物序列表
Table 1. Primers sequence of autophagy related factors
名称 Forward Reverse 鼠ATG5 TGTGCTTCGAGATGTGTGGTT ACCAACGTCAAATAGCTGACTC ATG7 TGACCTTCGCGGACCTAAAGA CCCGGATTAGAGGGATGCTC 鼠BECLIN AGGCGAAACCAGGAGAGAC CCTCCCCGATCAGAGTGAA 鼠PIK3C3 AACAACCGTGTCGCTCTTTG GAACCATCTGCCTCCACGTTA 鼠LC3B GTCCTGGACAAGACCAAGTTCC CCATTCACCAGGAGGAAGAAGG 鼠P62 CCGGCTGATTGAGTCCCTC CCCCGATGTCGTAATTCTTGG GAPDH AGGTCGGTGTGAACGGATTTG TGTAGACCATGTAGTTGAGGTCA 表 2 侵袭转移相关因子引物序列表
Table 2. Primer sequence of invasion and metastasis related factors
名称 Forward Reverse 鼠MMP2 CAAGGATGGACTCCTGGCACAT TACTCGCCATCAGCGTTCCCAT 鼠MMP9 GCTGACTACGATAAGGACGGCA TAGTGGTGCAGGCAGAGTAGGA 鼠mTOR GGCACACATTTGAAGAAGCAG CTCGTTGAGGATCAGCAAGG 鼠AKT CCTTTATTGGCTACAAGGAACGG GAAGGTGCGCTCAATGACTG 鼠4EBP1 GGGGACTACAGCACCACTC GTTCCGACACTCCATCAGAAAT GAPDH TGGCCTTCGTGTTCCTAC GAGTTGTGTTGAAGTCGCA 表 3 CII-3和脱脂膏对皮下移植瘤裸鼠脏器指数的影响(
$\bar x \pm s $ ,n = 12)Table 3. Effects of CII-3 and defatted ointment on organ index in nude mice with subcutaneously transplanted tumor (
$\bar x \pm s $ ,n = 12)组别 心脏指数(mg/g) 肝脏指数(mg/g) 脾脏指数(mg/g) 肺脏指数(mg/g) 肾脏指数(mg/g) 空白组 6.02 ± 0.80 56.73 ± 7.30 6.02 ± 0.80 9.03 ± 1.60 17.84 ± 2.10 敏感组 5.98 ± 0.90 60.50 ± 8.89 5.98 ± 0.90 9.12 ± 2.12 18.16 ± 1.17 耐药组 6.67 ± 1.55 63.74 ± 8.09 6.67 ± 1.55 9.68 ± 2.79 17.21 ± 3.17 索拉非尼组 6.67 ± 1.01 69.42 ± 8.81▲*# 6.67 ± 1.01 11.43 ± 3.52 17.45 ± 4.59 CII-3组 7.12 ± 1.55▲*# 58.14 ± 10.6△ 7.12 ± 1.55▲* 11.54 ± 2.97 18.06 ± 3.54 脱脂膏组 6.08 ± 0.71 52.67 ± 8.10#△ 6.08 ± 0.71 10.37 ± 3.14 20.85 ± 3.38△ F 3.45 9.31 3.45 3.31 3.53 P 0.021 < 0.01 0.021 0.025 0.019 与空白组比较,▲P < 0.05,▲▲P < 0.01;与敏感组比较,*P < 0.05,**P < 0.01;与耐药组比较,#P < 0.05,##P < 0.01;与索拉非尼组比较,△P < 0.05,△△P < 0.01。 表 4 CII-3和脱脂膏对皮下移植瘤裸鼠生化指标的影响(
$\bar x \pm s $ ,n = 12)Table 4. Effects of CII-3 and defatted ointment on biochemical indexes of nude mice with subcutaneously transplanted tumor (
$\bar x \pm s $ ,n = 12)组别 AST(U/L) ALT(U/L) CR(μmol/L) BUN(mmol/L) 空白组 481.22 ± 62.98 13.99 ± 2.00 19.61 ± 2.75 5.34 ± 0.41 敏感组 660.91 ± 210.46▲ 12.27 ± 0.53 13.95 ± 4.25▲ 3.90 ± 0.51 耐药组 500.51 ± 83.87* 21.91 ± 5.26▲** 14.93 ± 2.35 4.88 ± 0.97 索拉非尼组 498.53 ± 140.13* 8.42 ± 2.34▲## 22.66 ± 4.13*# 4.83 ± 1.80 CII-3组 656.83 ± 106.84▲#△ 17.93 ± 1.88**△ 24.88 ± 4.59▲*# 3.33 ± 0.54▲#△ 脱脂膏组 491.06 ± 62.76# 12.81 ± 1.83# 19.92 ± 7.61* 4.64 ± 1.13 F 10.13 62.34 17.62 10.83 P < 0.01 <0.01 <0.01 <0.01 与空白组比较,▲P < 0.05,▲▲P < 0.01;与敏感组比较,*P < 0.05,**P < 0.01;与耐药组比较,#P< 0.05,##P < 0.01;与索拉非尼组比较,△P < 0.05,△△P < 0.01。 表 5 CII-3和脱脂膏对移植瘤裸鼠自噬相关因子mRNA的影响 (
$\bar x \pm s $ ,n = 12)Table 5. Effects of CII-3 and defatted ointment on autophagy related factor mRNA in nude mice with transplanted tumor (
$\bar x \pm s $ ,n = 12)组别 ATG5 ATG7 BECLIN LC3B PIK3C3 P62 敏感组 0.08 ± 0.01 0.04 ± 0.01 0.05 ± 0.03 0.03 ± 0.02 0.03 ± 0.00 0.04 ± 0.01 耐药组 1.00 ± 0.00** 1.00 ± 0.00** 1.00 ± 0.00** 1.00 ± 0.00** 1.00 ± 0.00** 1.00 ± 0.00** 索拉菲尼组 0.30 ± 0.14*# 0.03 ± 0.00## 0.02 ± 0.01## 0.16 ± 0.04**## 0.10 ± 0.02**## 0.1 ± 0.01**## CII-3组 0.16 ± 0.05## 0.05 ± 0.02## 0.12 ± 0.05*##△ 0.13 ± 0.06**## 0.04 ± 0.01##△ 0.08 ± 0.02*## 脱脂膏组 0.27 ± 0.12*## 0.07 ± 0.02## 0.12 ± 0.06*##△ 0.33 ± 0.01**##△△ 0.14 ± 0.03**##△ 0.24 ± 0.06**##△△ F 300.26 16442.05 1974.64 2171.41 10020.07 3148.02 P < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 与敏感组比较,*P < 0.05,**P < 0.01;与耐药组比较,#P < 0.05,##P < 0.01;与索拉非尼组比较,△P < 0.05,△△P < 0.01。 表 6 CII-3和脱脂膏对移植瘤裸鼠侵袭转移相关因子mRNA的影响(
$\bar x \pm s $ ,n = 12)Table 6. Effects of CII-3 and defatted ointment on the mRNA of invasion and metastasis related factors in nude mice with transplanted tumor (
$\bar x \pm s $ ,n = 12)组别 MMP2 MMP9 mTOR AKT 4EBP1 敏感组 0.01 ± 0.00 0.01 ± 0.02 0.04 ± 0.01 0.02 ± 0.01 0.23 ± 0.08 耐药组 1.00 ± 0.00** 1.00 ± 0.00* 1.00 ± 0.00** 1.00 ± 0.00 1.00 ± 0.00** 索拉非尼组 0.02 ± 0.01**## 0.18 ± 0.08# 0.04 ± 0.01## 0.11 ± 0.06 1.80 ± 0.30**## CII-3组 0.01 ± 0.01## 0.00 ± 0.00# 0.08 ± 0.02## 0.17 ± 0.10 0.15 ± 0.06# 脱脂膏组 0.04 ± 0.02## 0.03 ± 0.01# 0.15 ± 0.30**##△ 0.20 ± 0.32 0.33 ± 0.15# F 26096.68 2171.29 154.83 156.90 325.86 P < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 与敏感组比较,*P < 0.05,**P < 0.01;与耐药组比较,#P < 0.05,##P < 0.01;与索拉非尼组比较,△P < 0.05,△△P < 0.01。 -
[1] 曹毛毛,李贺,孙殿钦,等. 全球肝癌2020年流行病学现状[J]. 中华肿瘤防治杂志,2022,29(5):322-328. [2] 中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗指南(2022年版)[J]. 中华肝脏病杂志,2022,30(4):367-388. doi: 10.3760/cma.j.cn501113-20220413-00193 [3] Yu Y,Wang Y,Xiao X,et al. MiR-204 inhibits hepatocellular cancer drug resistance and metastasis through targeting NUAK1[J]. Biochemistry and Cell Biology,2019,97(5):563-570. doi: 10.1139/bcb-2018-0354 [4] Zhang DY,Wang W,Sun XJ,et al. AMPK regulates autophagy by phosphorylating BECLIN at threonine 388[J]. Autophagy,2016,12(9):1447-1459. doi: 10.1080/15548627.2016.1185576 [5] 何晓晓,熊枝繁,邱梦君,等. 阿帕替尼对人肝癌裸鼠皮下移植瘤生长及生物钟基因表达的影响[J]. 山东医药,2018,58(8):31-33. doi: 10.3969/j.issn.1002-266X.2018.08.008 [6] 李银蕊,吕鸿,彭芳,等. 美洲大蠊多肽PAE2逆转肝癌多药耐药性[J]. 中国实验方剂学杂志,2021,27(5):52-61. [7] 尤金炜,张立波,方天,等. 绿色荧光裸鼠血液生理生化指标检测分析[J]. 中国比较医学杂志,2013,23(9):23-26. doi: 10.3969/j.issn.1671.7856.2013.009.005 [8] 吕鸿,王瑶,张蕊,等. 美洲大蠊多肽PAP-2对H22荷瘤小鼠的抑瘤作用研究[J]. 中国药房,2019,30(7):927-931. [9] 谭耀红. 肿瘤多药耐药机制及抗耐药肿瘤新药的研究[D]. 北京: 中国协和医科大学, 2003. [10] 田雨弘,高鸽,刘颖,等. 桔梗茎叶皂苷对H22荷瘤小鼠的抗肿瘤作用及机制研究[J]. 毒理学杂志,2016,30(1):45-48. [11] 王彦权,张鸿翰,吕鸿,等. 美洲大蠊多肽PAE2逆转耐药细胞株多药耐药性的研究[J]. 大理大学学报,2021,6(8):1-6. doi: 10.3969/j.issn.2096-2266.2021.08.001 [12] 詹东梅,刘延庆. 中药逆转胃癌多药耐药的研究进展[J]. 癌症进展,2020,18(13):1307-1311. [13] Zhao Y,Yang A,Tu P,et al. Anti-tumor effects of the American cockroach,Periplaneta americana[J]. Chin Med,2017,12:26. doi: 10.1186/s13020-017-0149-6 [14] Kim D G,Jung K H,Lee D G,et al. 20(S)-Ginsenoside Rg3 is a novel inhibitor of autophagy and sensitizes hepatocellular carcinoma to doxorubicin[J]. Oncotarget,2014,5(12):4438-4451. doi: 10.18632/oncotarget.2034 [15] Hashemi M,Nadafzadeh N,Imani M H,et al. Targeting and regulation of autophagy in hepatocellular carcinoma: Revisiting the molecular interactions and mechanisms for new therapy approaches[J]. Cell Commun Signal,2023,21(1):32. doi: 10.1186/s12964-023-01053-z [16] 陈怡璇,王琳,夏秀宏,等. 自噬在肝细胞癌中的作用机制研究进展[J]. 昆明医科大学学报,2023,44(4):159-164. doi: 10.12259/j.issn.2095-610X.S20230416 [17] Han Z,Liu D,Chen L,et al. PNO1 regulates autophagy and apoptosis of hepatocellular carcinoma via the MAPK signaling pathway[J]. Cell Death Dis,2021,12(6):552. doi: 10.1038/s41419-021-03837-y [18] Zhang F,Gao J,Liu X,et al. LATS-regulated nuclear-cytoplasmic translocation of SREBP2 inhibits hepatocellular carcinoma cell migration and invasion via epithelial-mesenchymal transition[J]. Mol Carcinog,2023,62(7):963-974. doi: 10.1002/mc.23538 [19] 于珊珊,张华,张婷婷,等. 美洲大蠊药理作用及临床应用研究[J]. 辽宁中医药大学学报,2016,18(4):228-231. doi: 10.13194/j.issn.1673-842x.2016.04.072 [20] 李彩琳,吴定宇,吕鸿,等. 美洲大蠊提取物逆转人肝癌细胞HepG2/ADM多药耐药的机制研究[J]. 中国药房,2020,31(15):1816-1823. doi: 10.6039/j.issn.1001-0408.2020.15.05 [21] Xiao Y, Gao C, Wu J, et al. Periplaneta americana extract alleviates steatohepatitis in a mouse model by modulating HMGB1-mediated inflammatory response[J]. Front Pharmacol, 2022, 13(期?): 995523.Xiao Y,Gao C,Wu J,et al. Periplaneta americana extract alleviates steatohepatitis in a mouse model by modulating HMGB1-mediated inflammatory response[J]. Front Pharmacol,2022,13:995523. [22] Shi W,An L,Zhang J,et al. Periplaneta americana extract ameliorates lipopolysaccharide-induced liver injury by improving mitochondrial dysfunction via the AMPK/PGC-1α signaling pathway[J]. Exp Ther Med,2021,22(4):1138. doi: 10.3892/etm.2021.10572 [23] Huang F,Wang B R,Wang Y G. Role of autophagy in tumorigenesis,metastasis,targeted therapy and drug resistance of hepatocellular carcinoma[J]. World J Gastroenterol,2018,24(41):4643-4651. doi: 10.3748/wjg.v24.i41.4643 [24] Wang J,Zhu Y,Ai X,et al. Long noncoding RNA 02027 inhibits proliferation,migration and invasion of hepatocellular carcinoma via miR-625-3p/PDLIM5 pathway[J]. J Gene Med,2023,25(6):e3485. doi: 10.1002/jgm.3485 [25] Zeng J,Liu W,Fan Y Z,et al. PrLZ increases prostate cancer docetaxel resistance by inhibiting LKB1/AMPK-mediated autophagy[J]. Theranostics,2018,8(1):109-123. doi: 10.7150/thno.20356 [26] Ong C W M,Elkington P T,Brilha S,et al. Neutrophil-derived MMP-8 drives AMPK-dependent matrix destruction in human puLmonary tuberculosis[J]. PloS Pathog,2015,11(5):e1004917. doi: 10.1371/journal.ppat.1004917 期刊类型引用(15)
1. 殷丽. 多形式集体宣教在白内障日间病房手术患者中的应用及对术后健康知识掌握情况的影响. 基层医学论坛. 2024(15): 102-104+144 .  百度学术
百度学术2. 谢驰,陈子盎,章尧,娄炜,金海鹰. 老年性白内障患者血糖与术后视力恢复的关联. 安徽理工大学学报(自然科学版). 2024(02): 94-100 .  百度学术
百度学术3. 付琴,祝青燕,邹霞,黄勇翔,刘悠. 结构化护理干预对老年白内障手术患者自我护理依从性的影响分析. 基层医学论坛. 2024(17): 70-73 .  百度学术
百度学术4. 刘媛,于莹,李景. 延续护理减少老年白内障手术患者术后并发症的效果评价. 中外医疗. 2024(19): 134-137 .  百度学术
百度学术5. 张杨,吕长芬. 延续性护理对2型糖尿病合并老年白内障患者术后的效果评价. 糖尿病新世界. 2024(12): 21-23 .  百度学术
百度学术6. 孙东洋. PDCA循环管理联合延续护理在老年白内障患者中的应用效果. 医药前沿. 2024(27): 95-97 .  百度学术
百度学术7. 徐燕,黄娟,马剑晴. 优质护理结合电话回访在老年白内障日间手术患者中的应用效果. 中西医结合护理(中英文). 2023(02): 21-24 .  百度学术
百度学术8. 朱文娟,赵久华,臧谋红,胡俊,杨丽. 医养结合视角下养老机构中延续护理对糖尿病患者的效果评价. 南通大学学报(医学版). 2023(02): 140-143 .  百度学术
百度学术9. 王瑞,张蓓,孙捷,和心依. 专科护士主导制定的围术期点药单对眼科日间手术患者用药依从性及眼科感染发生率的影响. 海南医学. 2023(12): 1793-1796 .  百度学术
百度学术10. 应莉,黄小建. 基于ADOPT问题解决模式的护理干预在老年性白内障超声乳化术患者中的应用效果. 当代护士(上旬刊). 2023(05): 128-132 .  百度学术
百度学术11. 袁雪,刘嫚. 流程化护理干预在眼科手术患者中的应用效果及对SAS、SDS评分的影响. 临床医学研究与实践. 2023(25): 162-165 .  百度学术
百度学术12. 龙皓,汤宁,应岚. 基于信息-动机-行为技巧模型构建健康教育在中青年慢性精神分裂症患者护理工作中的应用. 心理月刊. 2023(14): 71-74 .  百度学术
百度学术13. 刘民,陈玉春. 基于ADOPT问题解决模式护理干预对玻璃体切割术患者负性情绪、依从性及并发症的影响. 国际护理学杂志. 2023(21): 3903-3907 .  百度学术
百度学术14. 卢仪真. 健康教育联合CICARE沟通模式在眼科日间病房中的应用效果. 医学理论与实践. 2022(03): 505-506 .  百度学术
百度学术15. 张倩. 早期护理干预对缓解老年白内障手术患者术前焦虑的效果分析. 中国医药指南. 2021(30): 118-119 .  百度学术
百度学术其他类型引用(1)
-






 下载:
下载:
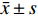
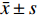
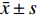
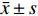
 下载:
下载:

