Significance of CXCL10 as a Biomarker of Liver Cirrhosis
-
摘要:
目的 探讨CXCL10作为一种肝硬化无创生物标志物的潜力及其在肝纤维化进展中的机制。 方法 收集2021年3~8月期间昆明医科大学第二附属医院肝硬化患者(n = 64)和健康体检者(n = 64)EDTA-K2抗凝管外周血标本,严格记录患者的基本信息和实验室检查结果。ELISA检测血浆中CXCL10浓度。分析CXCL10表达水平与生化检验结果的关系。用ROC曲线分析血浆CXCL10水平对肝硬化的预测价值。 结果 肝硬化患者血浆CXCL10浓度显著高于健康体检者,差异有统计学意义(P < 0.0001)。肝硬化患者血浆CXCL10水平与检验结果如ALT、AST、PT、APTT、DD成正相关关系(P < 0.05)。CXCL10的ROC曲线下面积为0.8264,具有较好的诊断效能。 结论 CXCL10可作为肝硬化的一种无创生物标志物,也是肝硬化潜在的治疗靶点。 Abstract:Objective To investigate the potential of CXCL10 as a noninvasive biomarker of liver cirrhosis and its mechanism in the progression of liver fibrosis. Methods Peripheral blood samples of EDTA-K2 anticoagulant tubes were collected from cirrhotic patients (n = 64) and healthy subjects (n = 64) in the Second Affiliated Hospital of Kunming Medical University from March to August 2021, and the basic information and laboratory examination results of the patients were strictly recorded. CXCL10 concentration in plasma was determined by ELISA. The relationship between CXCL10 expression level and biochemical test results was analyzed. ROC curve was used to analyze the predictive value of plasma CXCL10 levels for cirrhosis. Results The plasma CXCL10 concentration in patients with cirrhosis was significantly higher than that in healthy subjects, and the difference was statistically significant (P < 0.0001). Plasma CXCL10 levels were positively correlated with ALT, AST, PT, APTT and DD in patients with cirrhosis (P < 0.05). The area under ROC curve of CXCL10 is 0.8264, which has good diagnostic performance. Conclusion CXCL10 can be used as a non-invasive biomarker and a potential therapeutic target for liver cirrhosis. -
Key words:
- Liver fibrosis /
- CXCL10 /
- Liver cirrhosis
-
肝纤维化是各种慢性肝病(包括毒性损伤、病毒感染、自身免疫性疾病、代谢相关脂肪性肝病和遗传性疾病、酒精性肝病)进展过程中的动态病理过程,是肝脏对慢性损伤的病理性修复反应。肝纤维化的特征是细胞外基质(extracellular matrix,ECM即胶原、糖蛋白和蛋白多糖等)的过度积累,其被认为是一个中间阶段,可以逆转或进展为肝硬化和终末期肝病[1]。肝硬化是全球第11大最常见的死亡原因,每年导致超过116万人死亡[2]。肝纤维化不仅增加了终末
期肝病的发病率和死亡率,而且还增加了肝外疾病的风险,如非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是肝纤维化的病因之一,它增加了儿童和年轻人的心脏代谢死亡率[3]。新型冠状病毒肺炎(novel coronavirus pneumonia,COVID-19)流行目前是全球存在的一个重要健康问题,肝纤维化是新冠肺炎患者不利结局的独立危险因素[4]。然而,迄今为止,尚无有效的药物被批准用于临床预防肝纤维化的进展。因此,在肝纤维化的研究中,仍需进一步阐明肝纤维化的发病机制,探索新的有效治疗方法。
趋化因子(Chemotactic cytokines)是一种小的分泌蛋白,可以将免疫细胞和非免疫细胞招募到炎症或损伤部位。趋化因子在在肝脏中调节细胞伤口愈合反应起着重要作用,包括从循环和骨髓中招募炎症细胞,以及驻留的肝细胞向损伤部位迁移。在本文中,笔者将重点研究趋化因子C-X-C基序趋化因子10(CXCL10,也称为IP-10),CXCL10由免疫细胞(单核细胞、中性粒细胞和树突状细胞)和非免疫细胞(内皮细胞、成纤维细胞、间充质细胞、星形胶质细胞和肝细胞)分泌[5-6]。在肝脏内,CXCL10主要由肝纤维化的关键细胞如肝细胞、肝窦内皮细胞、肝星状细胞表达[7]。CXCL10的独特受体是CXCR3,它是一种跨膜G蛋白偶联受体,在效应T细胞上高度表达。CXCL10在感染性疾病、自身免疫性疾病和代谢性疾病中作为炎症介质发挥关键作用,CXCL10还能诱导细胞凋亡和细胞迁移,调节细胞增殖和血管生成[8]。目前它已被证明会加重由ConA引起的乙型肝炎、丙型肝炎、自身免疫性肝炎和T细胞性肝炎等肝病患者的肝脏炎症状况[9-10]。炎症由氧化应激和促炎趋化因子和细胞因子引起,从而导致肝损伤并促进纤维化[11]。有研究发现血清和肝脏CXCL10水平升高均与肝脏活组织检查中的高活动度和纤维化严重程度相关[11]。CXCL10在化学诱导的肝纤维化中发挥重要作用,CXCL10可能会吸引肝星状细胞到受损部位,参与肝细胞和免疫细胞之间的相互作用。CXCL10通过放大其他促炎细胞因子的作用来持续激活肝星状细胞,包括TNF-α、白介素6(IL-6)、白介素1β(IL-1β)、单核细胞趋化蛋白1(MCP-1)、干扰素(IFN-γ)和toll样受体9(TLR9)。这些数据表明,CXCL10在肝炎中作为一种促纤维化因子,而CXCL10的阻断可能是肝纤维化的治疗靶点。
肝纤维化早期诊断具有重要的临床意义,肝活检是诊断和分期的金标准。然而肝活检存在一些缺点,如盲穿刺或肝病变不均匀造成的误差。此外,肝穿刺是一种不能动态观察的有创检查。因此,它可能不被大多数患者所接受[12]。血清学诊断是应用最广泛的无创诊断方法,其样本采集方便,可动态观察,但其特异性相对较低[13],很少有参数可以被认为与纤维发生直接相关。目前,有几种无创或微创的方法,如瞬时弹性扫码(TE)和磁共振弹性成像用于肝纤维化分期[14],它们可以为纤维化患者提供高精度、无创的肝脏硬度测量方法,但受到肥胖等多种因素的限制,或受炎症活动的影响[15]。传统的CT图像和MRI可以对肝硬化和门脉高压进行定量评价,但对早期肝纤维化无法进行定量评价。本文研究了CXCL10可否作为一种无创标志物,以避免肝活检引起的并发症,可以动态监测肝功能变化,这可能有助于识别有进行性纤维化风险的患者,以便进行早期干预或保持更密切的监测,延缓肝硬化进展,降低肝癌发病率,通过血清学检测来协助临床诊断和治疗。或者需要结合其他多种肝纤维化生物标志物进行分析,以提高特异性。
本研究的目的是阐明CXCL10作为肝纤维化诊断和进展的无创生物标志物的潜力。在肝纤维化炎症的多个信号通路中阻断CXCL10信号通路,有助于开发新的抗纤维化策略为肝纤维化的治疗提供新思路。
1. 材料与方法
1.1 临床标本
收集2021年3月至8月期间昆明医科大学第二附属医院检验科肝硬化EDTA-K2抗凝管外周血标本64管为实验组,并收集同期体检中心的健康人群的外周血标本64管作为对照组。严格记录患者的基本信息和实验室检查结果,以便进行统计分析。肝硬化组排除标准:(1)失代偿期肝硬化;(2)原发性肝癌或其他恶性肿瘤;(3)合并其他重要脏器严重疾病、严重神经及精神疾病患者。该研究得到了昆明医科大学第二附属医院伦理委员会的认证。
1.2 ELISA检测血浆中CXCL10的浓度
血浆和上清中C-X-C基序趋化因子10 (CXCL10)的水平采用ELISA试剂盒(Sino Biological Inc.)根据试剂盒的方案检测。用酶标仪(BioTek,cytationl,美国)在450 nm处读取吸光强度。用标准物的浓度和OD值计算出标准曲线的直线回归方程式为y = 81.672X2 - 77.543X + 35.031,R2=0.9894。将样品的OD值代入方程式,即可计算出CXCL10浓度。将肝硬化患者血浆CXCL10水平分为低表达组(≤中位数水平)和高表达组(> 中位数水平),比较2组的肝功指标和凝血五项有无差异。
1.3 肝功实验结果
采用TBA-120FR 全自动生化分析仪检测,凝血实验结果用CS-5100全自动血凝分析仪检测。
1.4 统计学处理
应用SPSS 25.0软件和GraphPad Prism 8对相关数据进行处理和分析。计量资料首先进行正态性检验,数据为正态分布时用均数土标准差(
$\bar x \pm s $ )表示,组间比较采用独立样本t检验,相关性分析用Pearson 相关;数据呈非正态分布时,用中位数(四分位数)[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验,相关性分析用Spearman 秩相关。进一步采用受试者工作特征曲线(ROC曲线)分析CXCL10的诊断效能。以P < 0.05为差异有统计学意义。2. 结果
2.1 肝硬化患者一般临床资料
收集肝硬化患者的年龄、性别和检验结果等临床资料,经正态性检验分析,PT和APTT数据总体符合正态性分布,ALT、AST、LPS、GGT、TBA、TBIL、DBIL、IBIL、TT、FIB、DD数据总体不符合正态分布,见表1。
表 1 肝硬化患者的临床资料[$ \bar x \pm s $ /M(P25,P75)]Table 1. Clinical data of patients with cirrhosis [$ \bar x \pm s $ /M(P25,P75)]特征 数值 年龄(岁) 64 ± 11.52 性别(男/女) 46/18 ALT(U/L) 33(21,56.75) AST(U/L) 47(32,74.25) ALP(U/L) 98(80,159) GGT(U/L) 46(31.5,89.5) TBA(μmol/L) 43.55(19,97.43) TBIL(μmol/L) 30.55(17.03,70.9) DBIL(μmol/L) 14.10(6.9,38.4) IBIL(μmol/L) 15.55(7.8,25.93) PT (s) 16.94 ± 2.97 APTT(s) 44.23 ± 8.03 TT(s) 18.1(16.88,19.1) FIB(g/L) 1.86(1.53,2.56) DD(μg/mL) 2.68(1.73,4.79) 2.2 2组外周血中CXCL10浓度比较
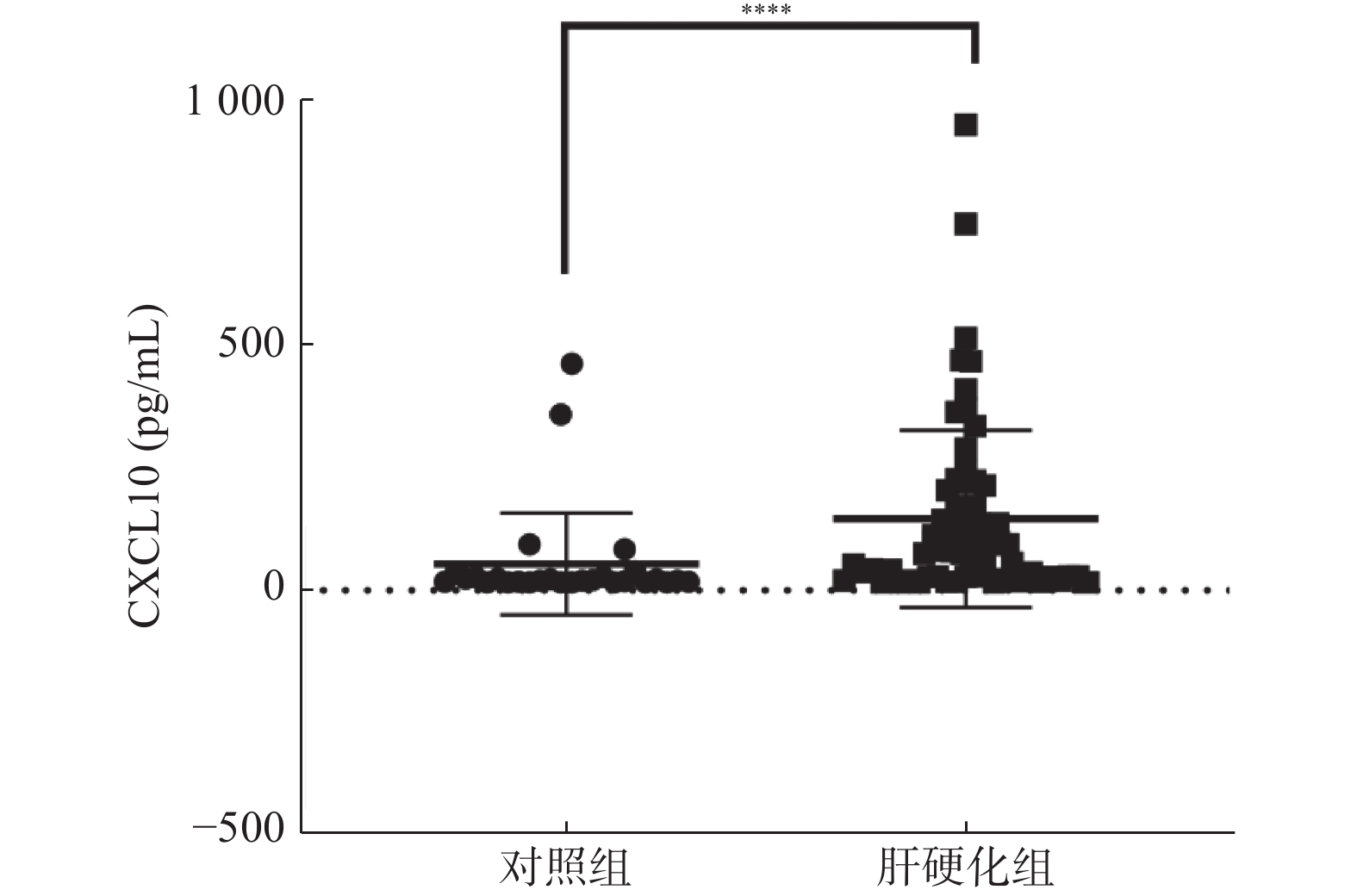
结果显示,健康对照组(n = 64)CXCL10的浓度是20.94 ng/mL(16.96,27.78),肝硬化组(n = 64)CXCL10的浓度是81.07 ng/mL(28.09,196.17),P < 0.0001,肝硬化患者血浆中CXCL10水平显著升高,2组差异有统计学意义,见图1。
2.3 肝硬化患者肝功检验结果与CXCL10浓度相关性分析
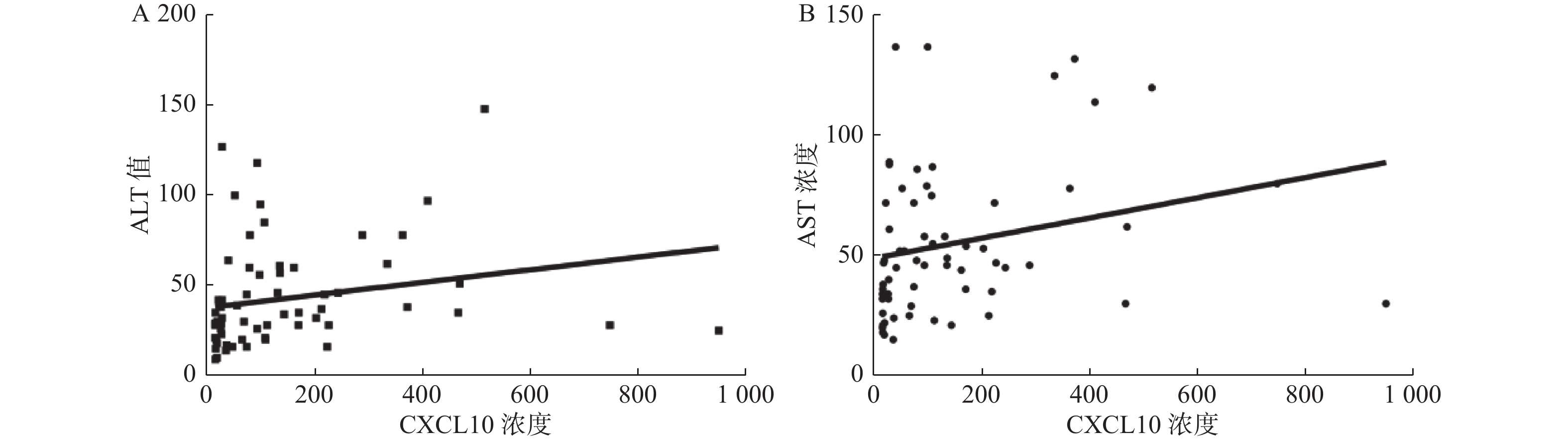
Spearman秩相关分析结果显示:肝硬化患者血浆中CXCL10浓度与ALT和AST成正相关关系,P < 0.05,与其余生化指标之间未见相关性,见表2,图2。
表 2 肝硬化患者血浆CXCL10浓度与肝功生化指标关系Table 2. Relationship between plasma CXCL10 concentration and liver function biochemical indexes in patients with cirrhosis项目 r P ALT(U/L) 0.4261 0.0004* AST(U/L) 0.36 0.0035* ALP(U/L) 0.01119 0.9354 GGT(U/L) 0.1621 0.2007 TBA(μmol/L) 0.2065 0.1074 TBIL(μmol/L) −0.03392 0.7902 DBIL(μmol/L) −0.00793 0.9512 IBIL(μmol/L) −0.1005 0.4372 *P < 0.05。 2.4 肝硬化患者凝血功能检验结果与CXCL10浓度相关性分析
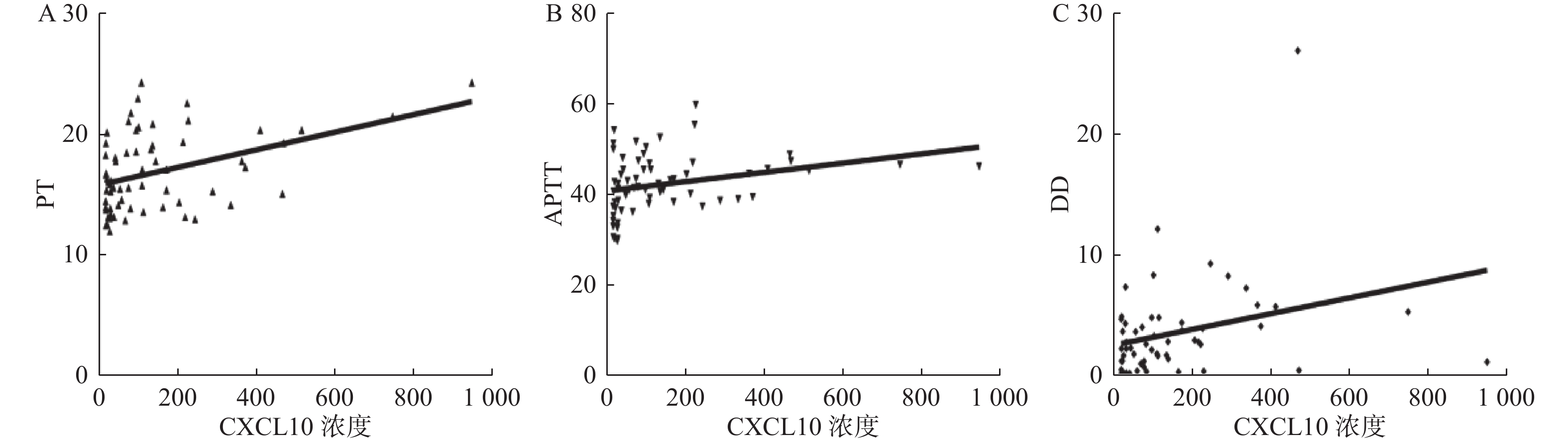
Pearson相关分析和Spearman秩相关分析结果显示:肝硬化患者血浆中CXCL10浓度与PT、APTT、DD成正相关关系(P < 0.05),与TT和FIB之间未见相关性(P > 0.05),见表3,图3。
表 3 肝硬化患者血浆CXCL10浓度与凝血指标关系Table 3. Relationship between plasma CXCL10 concentration and coagulation indexes in patients with cirrhosis项目 r P PT 0.4085 0.0008* APTT 0.2879 0.0211* TT 0.03217 0.8709 FIB −0.01198 0.9264 DD 0.3279 0.012* *P < 0.05。 2.5 CXCL10相关影响因素的线性回归分析
以ALT、AST、LPS、GGT、TBA、TBIL、DBIL、IBIL、PT、APTT、TT、FIB、DD为自变量,CXCL10为因变量,多重线性回归分析结果显示,DD的标准偏回归系数为1.922,P < 0.05,可认为DD对CXCL10的影响最大,见表4。
表 4 CXCL10相关影响因素的线性回归分析Table 4. Linear regression analysis of CXCL10 related influencing factors变量 β t P ALT −0.30 −0.148 0.883 AST 0.108 0.466 0.644 ALP −0.031 −0.112 0.912 GGT 0.033 0.129 0.898 TBA 0.235 1.201 0.238 TBIL −0.177 −0.527 0.601 DBIL −0.009 −0.054 0.957 IBIL −0.127 −0.466 0.644 PT 0.129 0.548 0.587 APTT 0.020 0.077 0.939 TT 0.312 1.383 0.176 FIB 0.164 0.810 0.423 DD 0.309 1.922 0.043* *P < 0.05。 2.6 高表达CXCL10组和低表达CXCL10组实验室指标差异分析
统计结果显示,2组ALT、AST、PT、APTT、DD指标差异均有统计学意义(P < 0.05),见表5。高表达CXCL10组中的ALT、AST、PT、APTT、DD值均大于低表达CXCL10组,见图4。
表 5 高表达CXCL10组和低表达CXCL10组实验室指标差异分析[$ \bar x \pm s $ /M(P25,P75)]Table 5. Difference analysis of laboratory indicators between high and low expression groups of CXCL10 [$ \bar x \pm s $ /M(P25,P75)]指标 低表达CXCL10(n = 31) 高表达CXCL10(n = 33) Z/t P ALT(U/L) 26(9,127) 46(20,148) −3.529 0.0003* AST(U/L) 37(17,137) 54(21,141) −2.486 0.0123* LPS(U/L) 98(54,441) 97(43,859) −0.800 0.9633 GGT(U/L) 39(21,264) 51(26,795) −1.559 0.1338 TBA(μ
mol/L)32.6(7.8,116.1) 50.8(8.1,408.3) −2.606 0.5693 TBIL(µmol/L) 31.7(9.8,404.5) 25.6(12.6,550) −0.013 0.9920 DBIL(µmol/L) 15(3.9,291.2) 12.7(6.4,440.9) −0.336 0.9137 IBIL(µmol/L) 16.7(4.3,113.31) 11.2(6.1,164.7) −0.262 0.5639 PT(s) 16.04 ± 0.44 17.58 ± 0.57 2.465 0.0165* APTT(s) 41.98 ± 1.28 46.19 ± 1.54 2.253 0.0278* TT(s) 18.22 ± 0.34 18.10 ± 0.43 0.1522 0.8795 FIB(g/L) 1.74(0.86,3.14) 1.89(0.85,3.51) −0.470 0.9582 DD(μg/mL) 1.73(0.33,7.43) 3.81(0.44,12.22) −2.767 0.0041* *P < 0.05。 2.7 血浆CXCL10水平对肝硬化的诊断价值
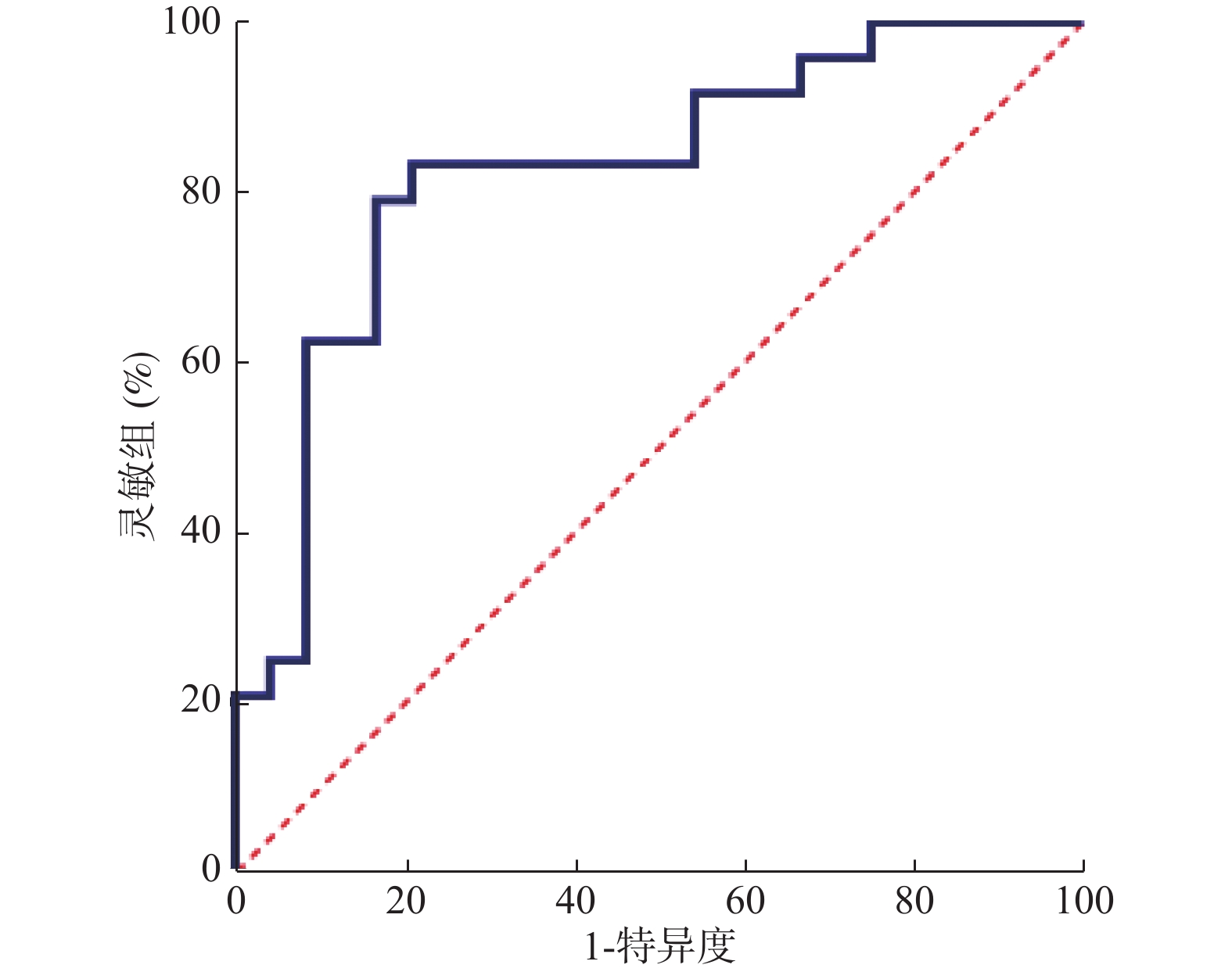
以AUC大于0.70作为判断该指标是否具有诊断价值的判断标准。CXCL10在预测肝硬化时,ROC曲线下面积为0.8264,大于0.7,约登指数为0.625,灵敏度值为0.8333,特异度值为0.7917,P < 0.0001,具有较好的诊断效能,见图5。
3. 讨论
我国约有3亿肝病患者,包括病毒性肝炎、非酒精性脂肪肝和酒精性肝病。每年有近40万人死于肝癌,占全球肝癌死亡总人数的51%[16]。由于肝病加重了我国的社会和医疗负担,因此动态监测肝功能变化,延缓肝硬化进展,降低肝癌发病率,并通过血清学检测协助临床诊断和治疗十分重要[17]。肝纤维化与肝细胞癌的发展密切相关,准确的纤维化评估对于肝细胞癌的筛查至关重要。区分晚期疾病患者,特别是肝硬化患者与轻度或无纤维化患者对于临床治疗决策很重要。目前,肝活检组织病理学检查仍是肝纤维化诊断的“金标准”。由于肝活检属于创伤性检查,少数病例可能会发生并发症,如疼痛、出血、感染甚至死亡,不易被患者接受和费用较高等缺点,限制了其普遍应用。尽管在东亚人群中已发现了一些与肝纤维化相关的重要生物标志物,如牛磺胆酸、紊乱的肠道微生物和粪便中的毛螺菌科[18-19],但还需要确定更多的标记物,以促进肝纤维化检测和预后预测的敏感性和特异性。除肝纤维化分期的病理检查外,白蛋白、IV型胶原蛋白、羟脯氨酸(Hyp)、天冬氨酸转氨酶(AST)、转氨酶(ALT)、血红蛋白、胆红素和腹水等生化指标均可间接反映肝纤维化的程度。在这种情况下,将CXCL10确定为肝纤维化进展的生物标志物可能是有用的,尽管尚未在肝纤维化中研究。
在本研究中,笔者评估了CXCL10作为一种无创性性生物标志物来预测患者肝纤维化阶段的能力。ALT是肝脏炎症最直接、最敏感、最经济的指标,其水平升高通常提示肝脏炎症的发生。笔者的数据显示,肝硬化患者血浆CXCL10水平与ALT、AST、PT、APTT、DD呈正相关关系,说明肝功生化指标不能代替CXCL10的检测,肝硬化患者血浆CXCL10水平是独立于生化指标之外的。提示CXCL10表达水平也可作为判断有无肝脏损伤和凝血功能异常的指标,与肝硬化患者的肝功能障碍相关。肝硬化患者的凝血酶原时间(PT)和部分凝血酶原时间(PTT)均会延长,说明在肝功能障碍的背景下,促凝因子的合成会减少,CXCL10表达水平可能也与凝血因子有关。高表达CXCL10和低表达CXCL10的肝硬化患者的检验结果如ALT、AST、PT、APTT、DD存在显著性差异,这表明肝脏损伤时肝细胞破坏释放ALT、AST的同时也促进CXCL10表达上调,但具体机制需要进一步的探索和研究。肝硬化患者血浆CXCL10水平较健康对照组明显上升,肝内CXCL10的表达随着肝纤维化的进展而增加,表明CXCL10也参与了肝脏炎症的发生和发展。CXCL10的ROC曲线下面积为0.8264,具有较好的诊断效能。因此CXCL10可作为一种无创标志物,以避免肝活检引起的并发症。它可以反映肝脏动态变化,这可能有助于识别有进行性纤维化风险的患者,以便进行早期干预或保持更密切的监测。目前,尚缺乏血清特异性肝纤维化诊断指标,依单一血液指标对肝纤维化评估作用有限,CXCL10可以联合其他指标检测和评估来提高诊断价值。然而,目前对CXCL10缺乏相关的长期纵向临床资料,难以在短期内应用于临床。总之,根据本研究获得的结果,CXCL10可以作为反映肝脏功能障碍的生物标志物,CXCL10与肝硬化有显著相关性,因此可作为肝硬化患者的敏感生物标志物。
-
表 1 肝硬化患者的临床资料[
$ \bar x \pm s $ /M(P25,P75)]Table 1. Clinical data of patients with cirrhosis [
$ \bar x \pm s $ /M(P25,P75)]特征 数值 年龄(岁) 64 ± 11.52 性别(男/女) 46/18 ALT(U/L) 33(21,56.75) AST(U/L) 47(32,74.25) ALP(U/L) 98(80,159) GGT(U/L) 46(31.5,89.5) TBA(μmol/L) 43.55(19,97.43) TBIL(μmol/L) 30.55(17.03,70.9) DBIL(μmol/L) 14.10(6.9,38.4) IBIL(μmol/L) 15.55(7.8,25.93) PT (s) 16.94 ± 2.97 APTT(s) 44.23 ± 8.03 TT(s) 18.1(16.88,19.1) FIB(g/L) 1.86(1.53,2.56) DD(μg/mL) 2.68(1.73,4.79) 表 2 肝硬化患者血浆CXCL10浓度与肝功生化指标关系
Table 2. Relationship between plasma CXCL10 concentration and liver function biochemical indexes in patients with cirrhosis
项目 r P ALT(U/L) 0.4261 0.0004* AST(U/L) 0.36 0.0035* ALP(U/L) 0.01119 0.9354 GGT(U/L) 0.1621 0.2007 TBA(μmol/L) 0.2065 0.1074 TBIL(μmol/L) −0.03392 0.7902 DBIL(μmol/L) −0.00793 0.9512 IBIL(μmol/L) −0.1005 0.4372 *P < 0.05。 表 3 肝硬化患者血浆CXCL10浓度与凝血指标关系
Table 3. Relationship between plasma CXCL10 concentration and coagulation indexes in patients with cirrhosis
项目 r P PT 0.4085 0.0008* APTT 0.2879 0.0211* TT 0.03217 0.8709 FIB −0.01198 0.9264 DD 0.3279 0.012* *P < 0.05。 表 4 CXCL10相关影响因素的线性回归分析
Table 4. Linear regression analysis of CXCL10 related influencing factors
变量 β t P ALT −0.30 −0.148 0.883 AST 0.108 0.466 0.644 ALP −0.031 −0.112 0.912 GGT 0.033 0.129 0.898 TBA 0.235 1.201 0.238 TBIL −0.177 −0.527 0.601 DBIL −0.009 −0.054 0.957 IBIL −0.127 −0.466 0.644 PT 0.129 0.548 0.587 APTT 0.020 0.077 0.939 TT 0.312 1.383 0.176 FIB 0.164 0.810 0.423 DD 0.309 1.922 0.043* *P < 0.05。 表 5 高表达CXCL10组和低表达CXCL10组实验室指标差异分析[
$ \bar x \pm s $ /M(P25,P75)]Table 5. Difference analysis of laboratory indicators between high and low expression groups of CXCL10 [
$ \bar x \pm s $ /M(P25,P75)]指标 低表达CXCL10(n = 31) 高表达CXCL10(n = 33) Z/t P ALT(U/L) 26(9,127) 46(20,148) −3.529 0.0003* AST(U/L) 37(17,137) 54(21,141) −2.486 0.0123* LPS(U/L) 98(54,441) 97(43,859) −0.800 0.9633 GGT(U/L) 39(21,264) 51(26,795) −1.559 0.1338 TBA(μ
mol/L)32.6(7.8,116.1) 50.8(8.1,408.3) −2.606 0.5693 TBIL(µmol/L) 31.7(9.8,404.5) 25.6(12.6,550) −0.013 0.9920 DBIL(µmol/L) 15(3.9,291.2) 12.7(6.4,440.9) −0.336 0.9137 IBIL(µmol/L) 16.7(4.3,113.31) 11.2(6.1,164.7) −0.262 0.5639 PT(s) 16.04 ± 0.44 17.58 ± 0.57 2.465 0.0165* APTT(s) 41.98 ± 1.28 46.19 ± 1.54 2.253 0.0278* TT(s) 18.22 ± 0.34 18.10 ± 0.43 0.1522 0.8795 FIB(g/L) 1.74(0.86,3.14) 1.89(0.85,3.51) −0.470 0.9582 DD(μg/mL) 1.73(0.33,7.43) 3.81(0.44,12.22) −2.767 0.0041* *P < 0.05。 -
[1] Zoubek M E,Trautwein C,Strnad P. Reversal of liver fibrosis:From fiction to reality[J]. Best Pract Res Clin Gastroenterol,2017,203(3):12-41. [2] Moon A M,Singal A G,Elliot B. Contemporary epidemiology of chronic liver disease and cirrhosis - science direct[J]. Clinical Gastroenterology and Hepatology,2020,18(12):50-66. [3] Simon T G,Roelstraete B,Hartjes K,et al. Non-alcoholic fatty liver disease in children and young adults is associated with increased long-term mortality[J]. Journal of Hepatology,2021,20(5):135-141. [4] Campos-Murgu í a A,Román-Calleja B,Toledo-Coronado I V,et al. Liver fibrosis in patients with metabolic associated fatty liver disease is a risk factor for adverse outcomes in COVID-19[J]. Digestive and Liver Disease,2021,48(21):48-56. [5] Caviglia J M,Yan J,Jang M K,et al. MicroRNA-21 and dicer are dispensable for hepatic stellate cell activation and the development of liver fibrosis[J]. Hepatology,2017,67(Suppl.1):65-72. [6] Lee Y S,Kim S Y,Ko E,et al. Exosomes derived from palmitic acid-treated hepatocytes induce fibrotic activation of hepatic stellate cells[J]. Scientific Reports,2017,7(1):30-45. [7] Holt A P,Haughton E L,Lalor P F,et al. Liver myofibroblasts regulate Infiltration and positioning of lymphocytes inhuman liver[J]. Gastroenterology,2009,136(2):5-14. doi: 10.1053/j.gastro.2008.09.006 [8] Barrow F,Khan S,Fredrickson G,et al. Microbiota‐Driven Activation of intrahepatic B Cells aggravates nonalcoholic steatohepatitis through innate and adaptive signaling[J]. Hepatology,2018,74(23):84-96. [9] Lafoz E,Ruart M,Anton A,et al. The endothelium as a driver of liver fibrosis and regeneration[J]. Cells,2020,9(4):29-35. [10] Barrow F,Khan S,Fredrickson G,et al. Exosomes from activated hepatic stellate cells contain GLUT1 and PKM2:a role for exosomes in metabolic switch of liver nonparenchymal cells[J]. The FASEB Journal,2019,33(7):41-56. [11] Motonobu,Watanabe,Soichiro,et al. Platelets contribute to the reduction of liver fibrosis in mice[J]. Journal of Gastroenterology & Hepatology,2009,21(17):23-32. [12] Ding B S,Ca O Z,Lis R,et al. Divergent angiocrine signals from vascular niche balance liver regeneration and fibrosis[J]. Nature,2014,505(7481):97-102. doi: 10.1038/nature12681 [13] Tannapfel A,Dienes H P,Lohse A W. The indications for liver biopsy[J]. Deutsches Ä rzteblatt International,2012,109(27-28):477-483. [14] Song Z Y,Ke-Bang W U,Li-Li W U,et al. Research progress on rapid serological assays for diagnosis of Japanese Encephalitis B[J]. China Animal Husbandry & Veterinary Medicine,2015,45(23):69-75. [15] Wang R,Ding Q,Yaqoob U,Assuncao T D,et al. Non-invasive assessment of hepatic steatosis:Prospective comparison of the accuracy of imaging examinations[J]. Journal of Hepatology,2010,52(4):79-85. [16] Kim S U,Seo Y S,Cheong J Y,et al. Factors that affect the diagnostic accuracy of liver fibrosis measurement by Fibroscan in patients with chronic hepatitis B[J]. Alimentary Pharmacology & Therapeutics,2010,32(3):498-505. [17] Wang W J, Xiao P, Xu H Q, et al. Growing burden of alcoholic liver disease in China: A review [J]. 世界胃肠病学杂志: 英文版, 2019, 25(12): 12.Wang W J,Xiao P,Xu H Q,et al. Growing burden of alcoholic liver disease in China:A review[J]. World Journal Gastroenterology,2019,25(12):12. [18] Ahmed Z,Ahmed U,Walayat S,et al. Liver function tests in identifying patients with liver disease[J]. Clinical and Experimental Gastroenterology,2018,11(6):1-7. [19] Liu Z,Zhang Z,Huang M,et al. Taurocholic acid is an active promoting factor,not just a biomarker of progression of liver cirrhosis:evidence from a human metabolomic study and in vitro experiments[J]. Bmc Gastroenterology,2018,18(1):112-116. doi: 10.1186/s12876-018-0842-7 期刊类型引用(1)
1. 张路芹,韩咏竹,程楠,董健健. 益气活血化浊法治疗Wilson病肝纤维化的疗效观察. 广州中医药大学学报. 2024(04): 822-828 .  百度学术
百度学术其他类型引用(2)
-






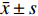
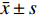
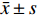
 下载:
下载:


 下载:
下载:

