Expression of CAV1 in Tumor Tissues and Its Effect on Survival Prognosis of Patients
-
摘要:
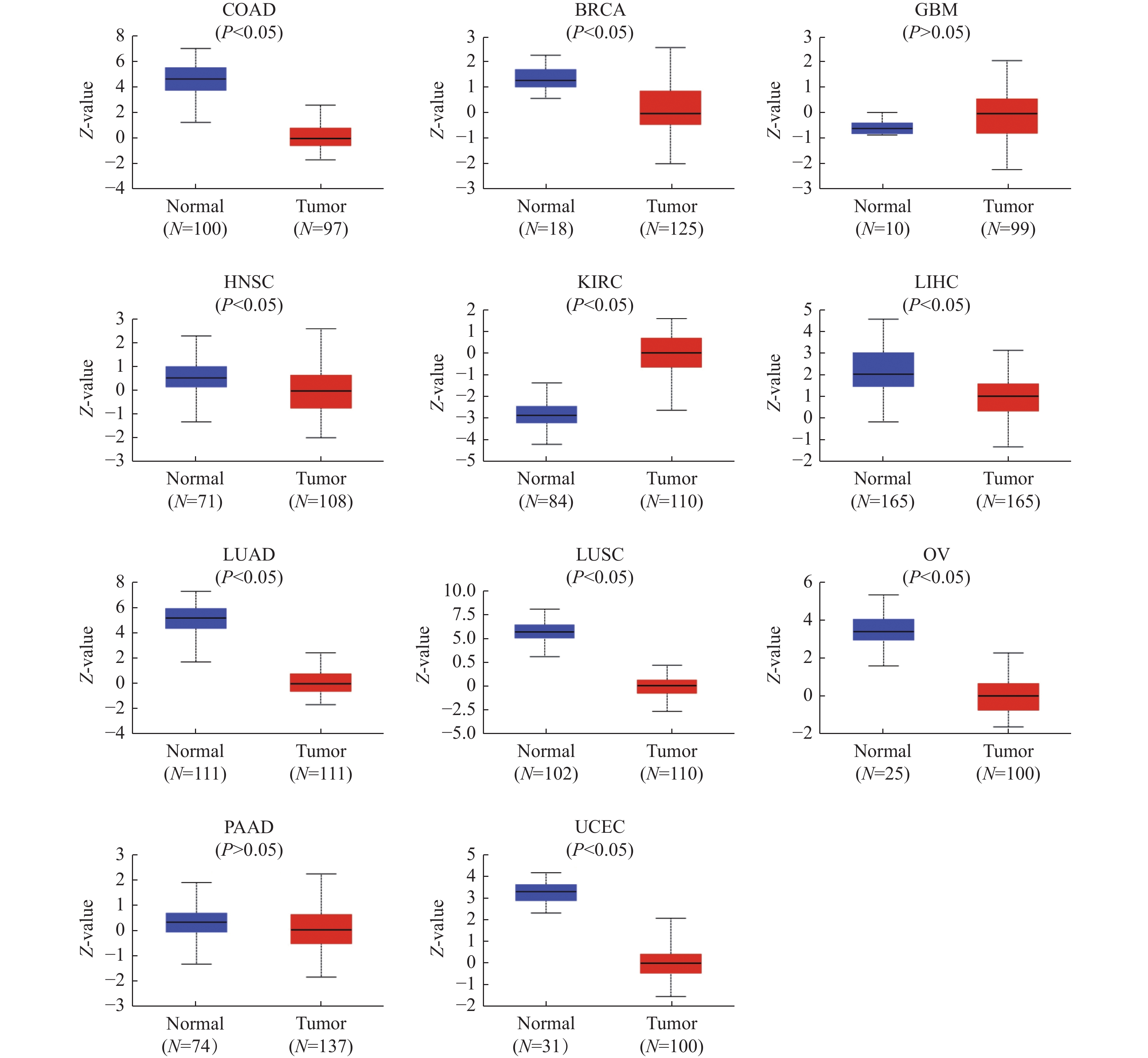
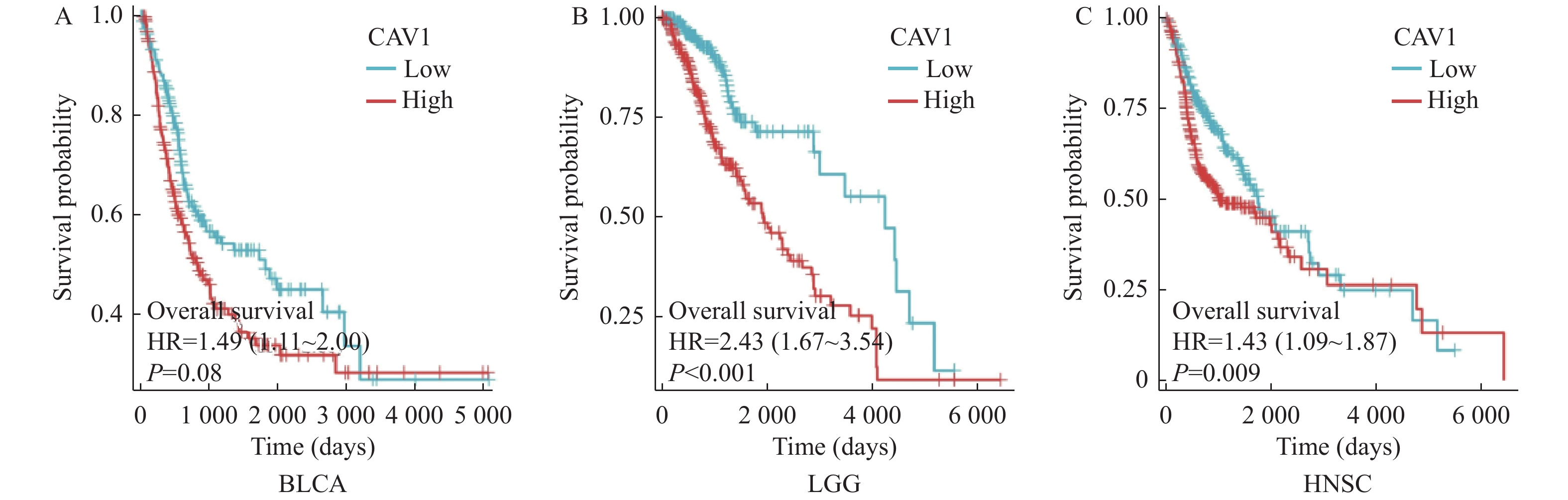
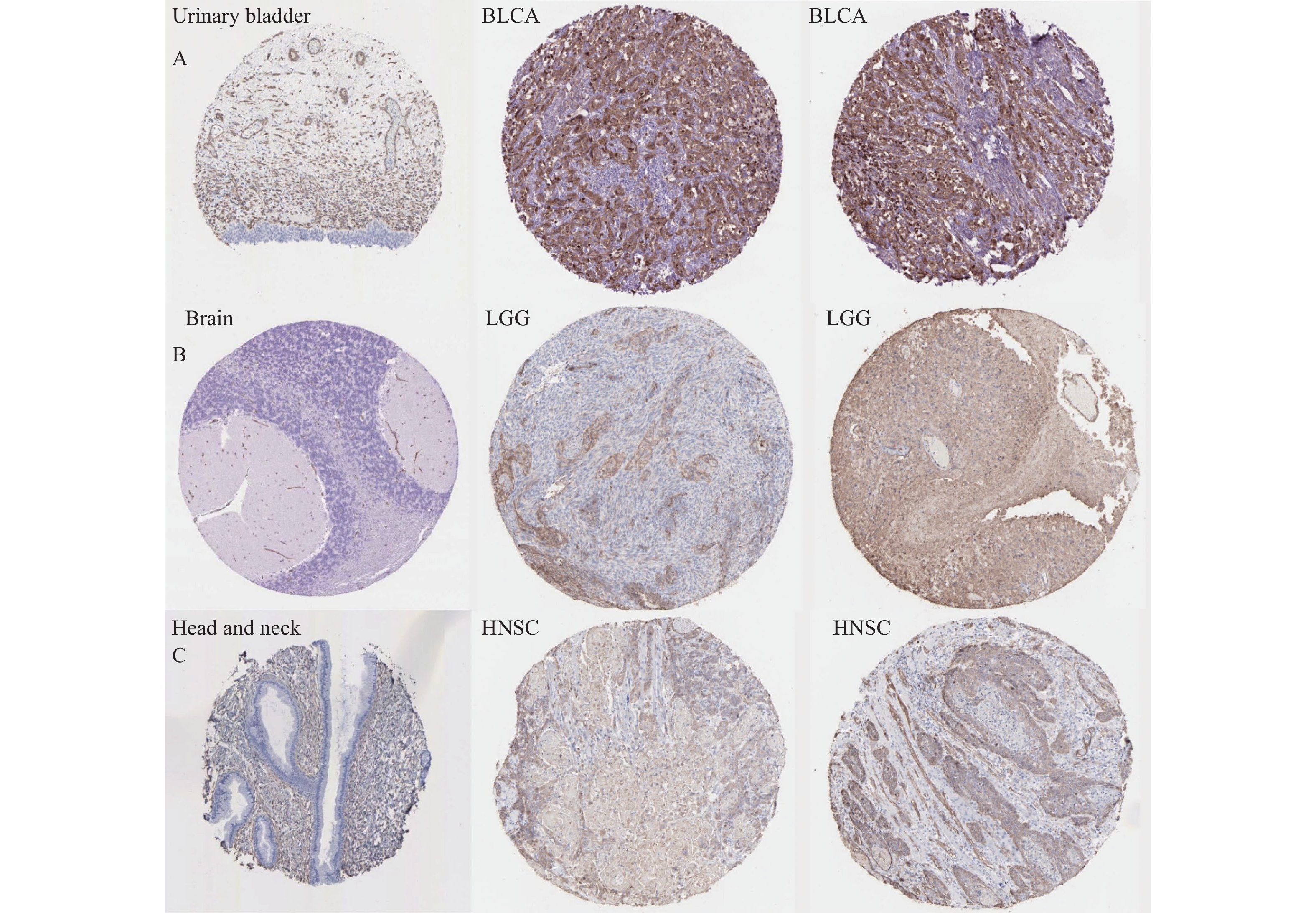
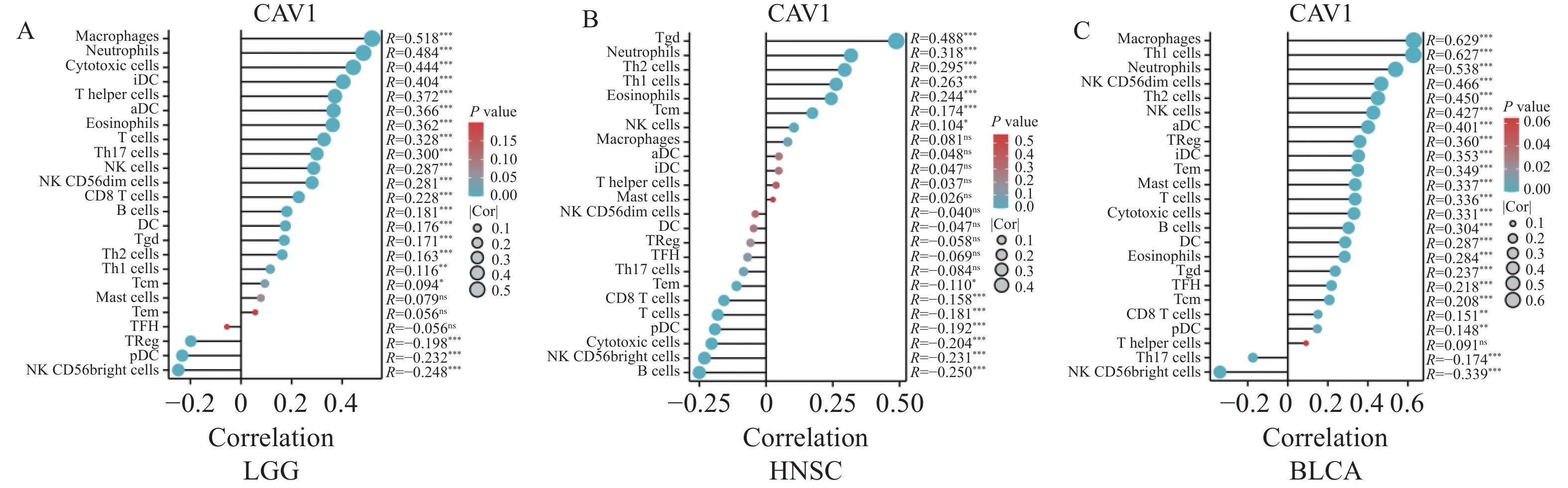
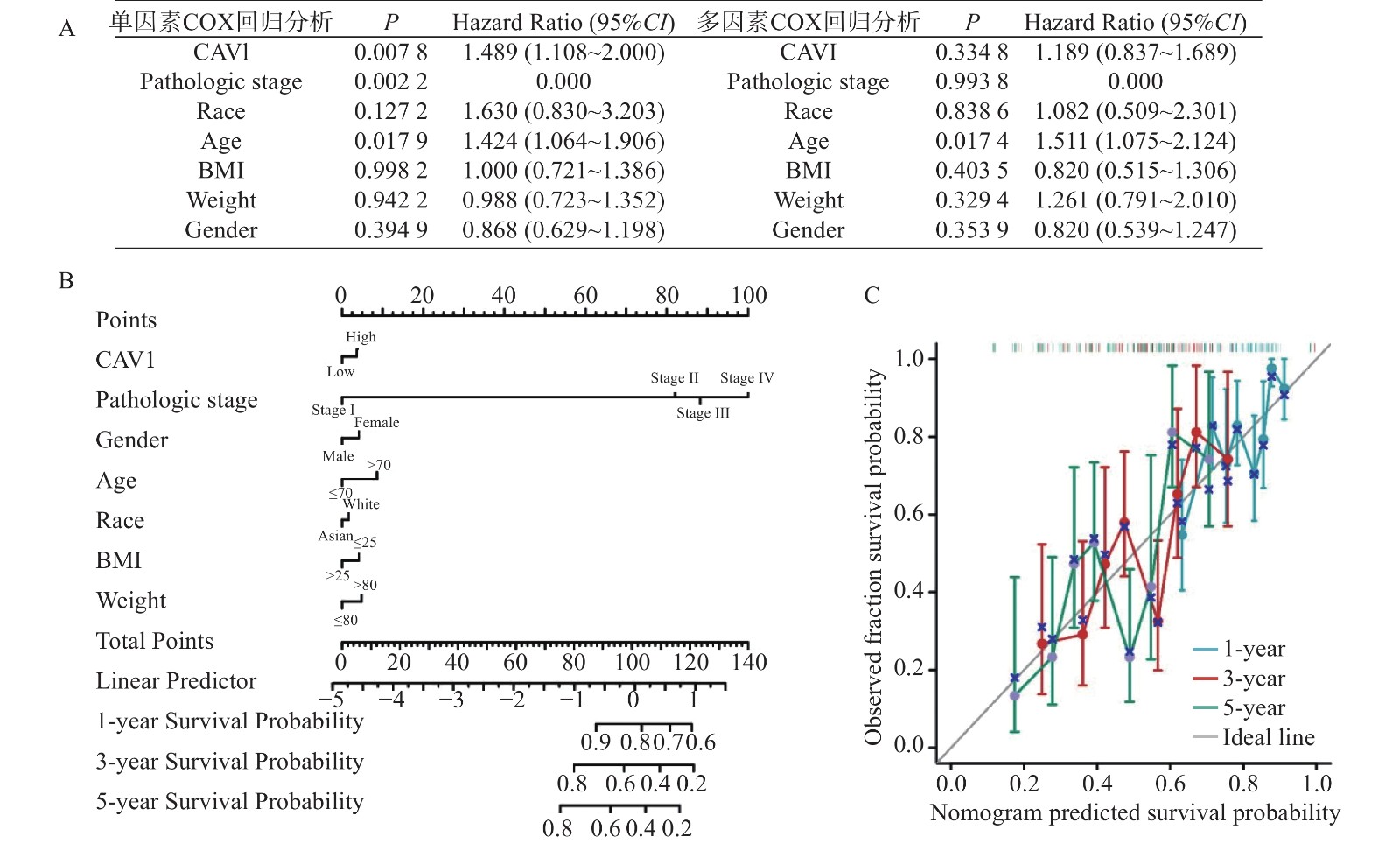
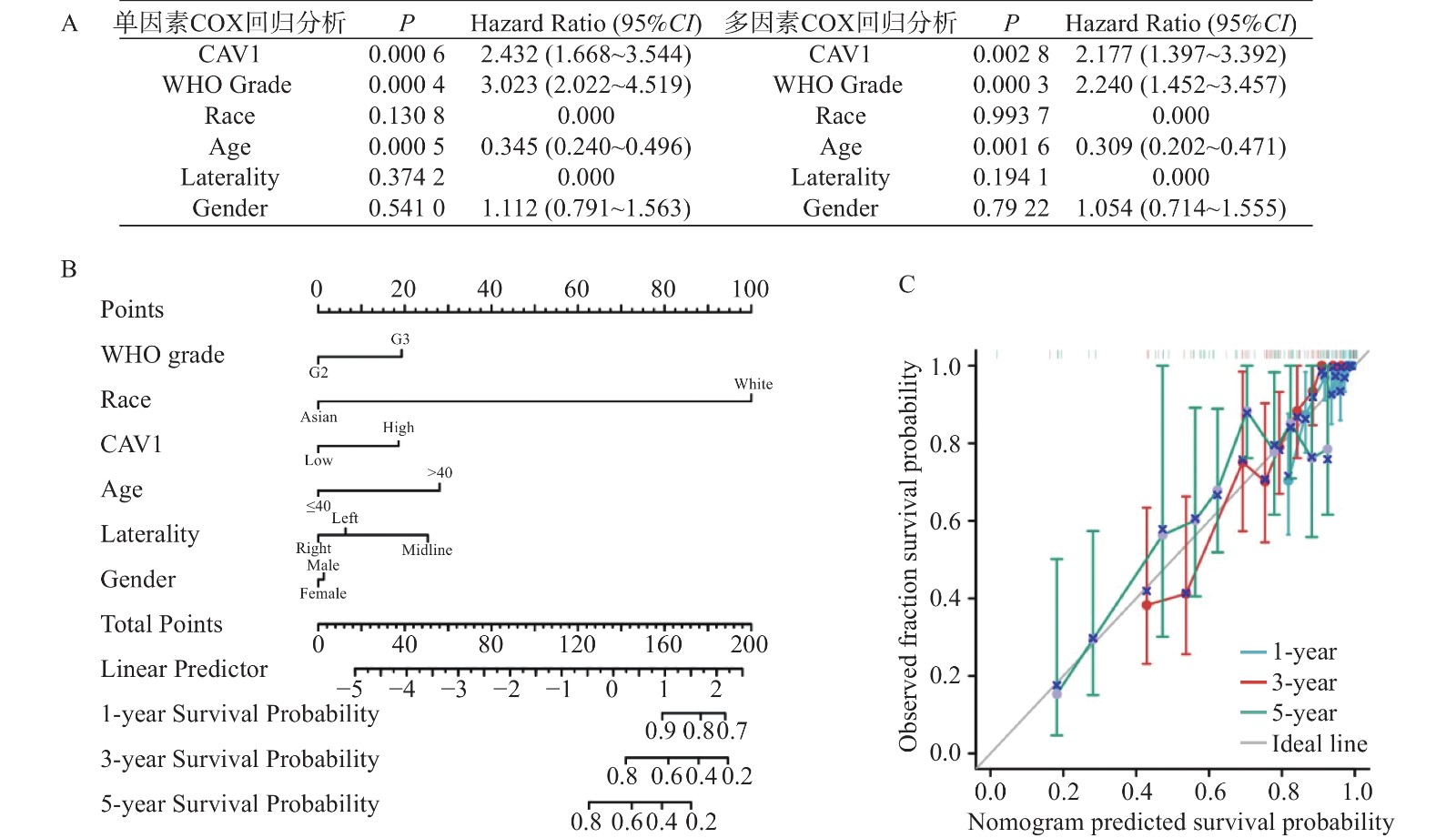
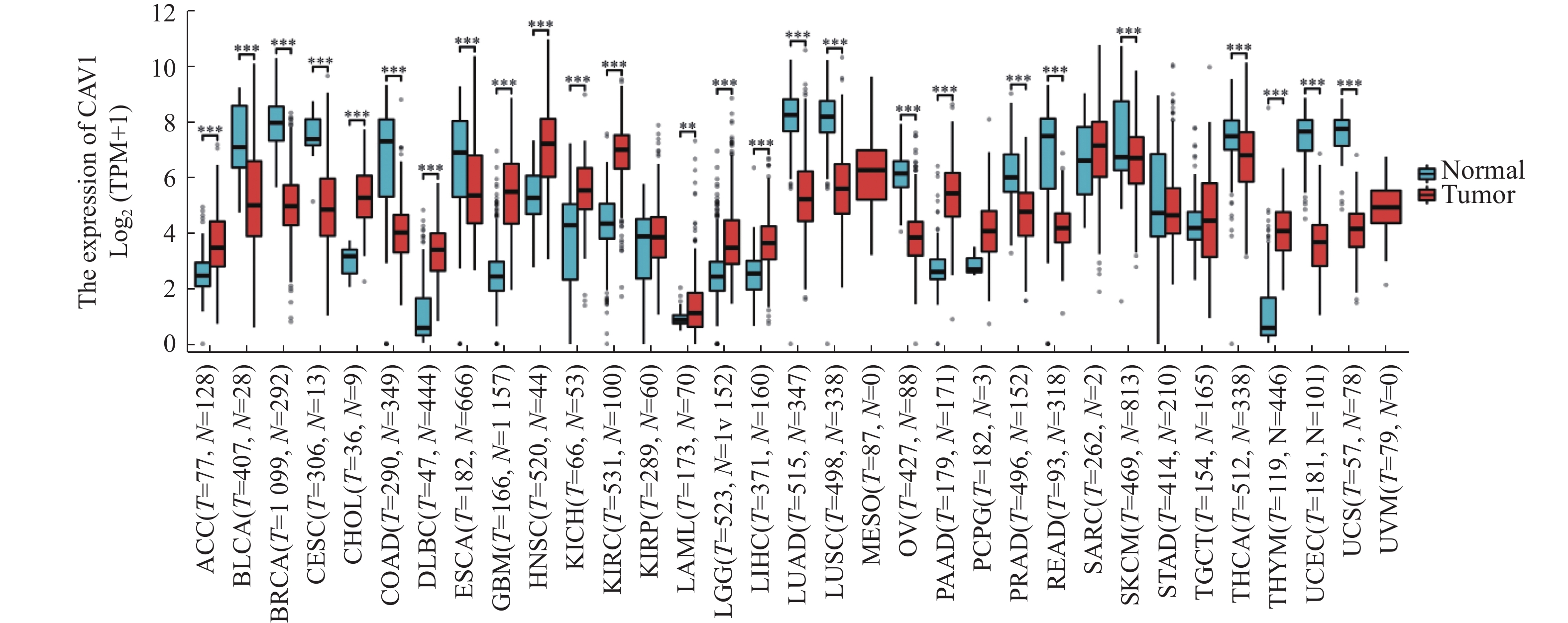
目的 通过生物信息学分析小凹蛋白-1(CAV1)在多种肿瘤中的表达与预后意义及其免疫浸润的相关性,阐明其对肿瘤预后的评估价值。 方法 基于TCGA和GTEx数据库分析CAV1基因在不同肿瘤组织中的mRNA表达水平,通过CPTAC数据库分析CAV1基因在不同肿瘤组织中的蛋白表达水平,单因素COX回归分析CAV1表达与肿瘤患者生存预后之间的相关性,HPA数据库分析CAV1表达的肿瘤免疫组化水平,Spearman相关性分析肿瘤与免疫浸润细胞的相关性。采用多因素COX回归和Nomogram列线图建立BLCA、LGG和HNSC预测评分模型。 结果 CAV1基因在26种肿瘤组织中mRNA异常表达(P < 0.05),CAV1的高表达对膀胱尿路上皮癌(BLCA)、脑低级别胶质癌(LGG)和头颈鳞状细胞癌(HNSC)3种肿瘤患者总生存期产生不良影响,并且在BLCA、LGG和HNSC中与多种肿瘤免疫浸润细胞密切相关。单因素COX回归分析显示CAV1(HR = 1.489,P = 0.0078)和年龄(HR = 1.424,P = 0.0022)是BLCA患者总生存期的危险因素,CAV1(HR = 2.432,P = 0.0006)与WHO grade(HR = 3.023,P = 0.0004)是LGG患者总生存期的危险因素,CAV1(HR = 1.432,P = 0.0085)与临床病理分型(HR = 1.806,P = 0.0006)是HNSC患者总生存期的危险因素。 结论 CAV1基因的表达及调节与BLCA、LGG和HNSC的发生发展、患者的预后、肿瘤免疫有一定的相关性,可能成为改善BLCA、LGG与HNSC患者预后的潜在标志。 Abstract:Objective Bioinformatics was used to analyze the correlation between CAV1 expression and its prognostic value and immune infiltration in various tumors and to clarify its value in evaluating tumor prognosis. Methods The mRNA expression level of CAV1 gene was analyzed based on TCGA and GTEx databases, the protein expression level of CAV1 gene was analyzed by CPTAC database, the correlation between CAV1 expression and survival and prognosis of tumor patients was analyzed by univariate COX regression, and the tumor immunohistochemistry level of CAV1 expression was analyzed by HPA database. Spearman correlation analysis of tumor and immune infiltrating cells. Results The mRNA expression of the CAV1 gene was different in 26 tumor tissues(P < 0.05), and the high expression of CAV1 had adverse effects on the overall survival of bladder urothelial carcinoma, low-grade glial carcinoma of the brain and head and neck squamous cell carcinoma. It is closely related to various tumor immune infiltrating cells in BLCA, LGG, and HNSC. Univariate COX regression analysis showed that CAV1(HR = 1.489, P = 0.0078) and age(HR = 1.424, P = 0.0022) were risk factors for overall survival in BLCA patients, while CAV1(HR = 2.432, P = 0.0006) and WHO grade(HR = 3.023, P = 0.0004) were risk factors for overall survival in LGG patients.CAV1(HR = 1.432, P = 0.0085) and clinicopathological classification(HR = 1.806, P = 0.0006) were risk factors for overall survival in HNSC patients. Conclusion The expression and regulation of CAV1 gene are correlated with the occurrence and development of BLCA, LGG and HNSC, patient prognosis and tumor immunity. They may be a prognostic factor of BLCA, LGG and HNSC patients. -
Key words:
- CAV1 /
- Human tumor /
- Survival Prognosis /
- Immunity
-
妊娠女性作为一个特殊的群体,其叶酸的充足补充对于胎儿的生长发及其自身的身体健康都非常重要。研究表明,亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)是体内叶酸代谢过程中涉及的重要酶,其基因多态性将影响妊娠女性体内叶酸及同型半胱氨酸(homocysteine,HCY)的水平,从而诱发神经管畸形[1]、复发性流产[2]、妊娠高血压疾病[3]等。其中妊娠期高血压疾病(hypertensive disorder complication pregnancy,HDCP)发病率高达12%,主要包括妊娠期高血压、子痫前期(轻度、重度)、子痫、妊娠合并慢性高血压、慢性高血压并发子痫前期等,且近几年呈上升趋势[4],严重影响了母婴的健康。但其发病原因至今尚未明确阐明,有研究表明HDCP的发生与妊娠女性MTHFR基因的个体化差异密切相关[5]。而MTHFR基因多态性的分布存在种族及地域差异。因此,了解本地区妊娠女性MTHFR基因多态性的群体遗传特征及遗传因素在妊娠期高血压疾病中的作用,指导孕期女性科学补服叶酸,防治妊娠高血压疾病具有必要性。
因此,本研究通过整理分析昆明市延安医院妊娠期女性的MTHFR 677 C > T基因多态性分布情况,并初步推测其与HDCP的关系,旨在阐明叶酸代谢关键酶基因多态性的分布特征及其与HDCP的相关性,为因地制宜的制定妊娠女性叶酸补充方案,并同时为预防妊娠女性妊娠期疾病的发生发展制定针对性的个体化干预措施提供科学依据,从而确保母婴健康安全。
1. 资料与方法
1.1 研究对象
资料来源于2016年10月至2017年9月到昆明市延安医院进行孕期检查的2 476例妊娠女性,其中妊娠期高血压疾病患者90例,且均在延安医院确诊。患者平均年龄(30.5±5.0)岁,平均收缩压(146.1±17.0)mmHg,平均舒张压(98.4±12.7)mmHg;而同时期在昆明市延安医院孕检的其余2386例患者,平均年龄(29.3±4.6)岁,平均收缩压(113.6±10.0)mmHg,平均舒张压(75.1±7.7)mmHg。全部纳入研究对象均未患有遗传性疾病、血液性疾病或生殖器畸形,且和年龄等一般资料无明显差异(P > 0.05),具有可比性。
1.2 主要试剂与仪器
本研究中检测目的基因分型的试剂包括核酸纯化试剂及测序反应通用试剂盒,分别为耀金保、耀金分(商品名)。离心机型号:湘仪TDZ5-WS。检测仪器:RT-CyclerTM 436 / TL998A荧光检测仪(博奥生物科技有限公司/西安天隆科技有限公司),检测结果的运行软件系统是 V2.0.713/V1.0.28。
1.3 检测方法
本研究检测MTHFR 677C > T基因型方法:数字荧光分子杂交(DFMH)检测。
主要操作方法如下:(1)裂解:1 mL 的NH4Cl预处理液稀释,用于裂解红细胞;(2)提取:静置5 min,期间需对血液样本反复上下颠倒,而后3 000 r/min,5 min离心可得到沉淀在离心管底的丰富的白细胞;(3)混匀:加入耀金保,吹打使其与白细胞混匀。室温静置20 ~ 30 min,期间需要颠倒混匀2次,放置待检测;(4)上样:据需检测的目的基因,取相对应的耀金分测试试剂,短暂离心后,向该测试试剂中加入1.5 μL处理后的白细胞样本,搅拌均匀,便可上机检测;(5)结果判读:按说明书操作荧光检测仪进行目的基因位点的检测,并利用个体化药学服务平台V2.0.713/V1.0.283进行检测结果分析与判读。
1.4 统计学处理
采用SPSS软件对所有数据进行统计差异学分析。对收集到的基因分型数据统计后进行Hardy-Weinberg遗传平衡检验,对基因多态性及等位基因频率进行χ2 检验,P < 0.05为差异有统计学意义。
2. 结果
2.1 Hardy-Weinberg遗传平衡分析
2 476例妊娠女性MTHFR 677C > T检测数据进行Hardy-Weinberg遗传平衡检验,所得结果差异无统计学意义(χ2 = 4.50,P > 0.05,表明MTHFR 677C > T基因型分布频率符合Hardy-Weinberg遗传平衡,样本具有本区域群体代表性,见表1。
表 1 妊娠女性基因分型的Hardy-Weinberg遗传平衡分析[n(%)]Table 1. Hardy-weinberg genetic balance analysis of the recruited pregnant women [n(%)]分析项 n 基因分型 等位基因频率 CC(a2) CT(2ab) TT(b2) C(a) T(b) 实际频数 2476 1005(40.59) 1106(44.67) 365(14.74) 3116/4952 1 836/4952 理论频数 2476 980.25(39.59) 1155.30(46.66) 340.45(13.75) 62.92 37.08 2.2 妊娠女性MTHFR 677C > T基因多态性及其与其他地区的相比较
本研究中MTHFR 677C > T基因型频率CC 40.59%,CT 44.67%,TT 14.74%,等位基因频率C62.92%,T37.08%;其与淄博、郑州、琼海等地区,差异有统计学意义(P < 0.05),与武汉、惠州、镇江、德阳等地区,差异无统计学意义(P > 0.05),见表2、表3。
表 2 不同地区MTHFR 677C > T基因型分布情况比较[n(%)]Table 2. Comparison of MTHFR 677C > T genotype distribution and frequencies by areas [n(%)]地区 MTHFR 677C > T χ2 P CC CT TT 昆明(本研究) 1005(40.59) 1106(44.67) 365(14.74) 淄博[6] 130(12.5) 457(43.9) 454(43.6) 28.784 < 0.05 郑州[7] 198(18.1) 493(45.1) 402(36.8) 18.269 < 0.05 武汉[8] 1069(36.9) 1367(47.2) 463(16.0) 0.276 > 0.05 惠州[9] 186(51.8) 134(37.3) 39(10.9) 2.692 > 0.05 琼海[10] 756(61.9) 390(31.9) 75(6.1) 10.329 < 0.05 镇江[11] 877(30.4) 1378(47.8) 630(21.8) 3.120 > 0.05 德阳[12] 1047(40.7) 1171(45.5) 355(13.8) 0.045 > 0.05 表 3 不同地区MTHFR 677C > T等位基因频率比较[n(%)]Table 3. Comparison of MTHFR 677C > T allele frequencies by areas [ n(%)]地区 MTHFR 677C > T χ2 P C T 昆明(本研究) 3116(62.92) 1836(37.08) 淄博[6] 717(34.4) 1365(65.6) 16.835 < 0.05 郑州[7] 889(40.7) 1297(59.3) 9.696 < 0.05 武汉[8] 3505(60.5) 2293(39.5) 0.144 > 0.05 惠州[9] 506(70.5) 212(29.5) 1.204 > 0.05 琼海[10] 1 902(77.9) 540(22.1) 5.409 < 0.05 镇江[11] 3132(54.3) 2638(45.7) 1.668 > 0.05 德阳[12] 3265(63.4) 1 881(36.6) 0.00 > 0.05 2.3 不同HDCP类型的妊娠女性MTHFR 677C > T 基因多态性分析
90例HDCP妊娠期女性,包括妊娠期高血压(63例)和子痫前期(27例),见表4、表5,妊娠期高血压和子痫前期妊娠女性MTHFR 677C > T基因型及等位基因频率,差异无统计学意义(P > 0.05)。
表 4 不同HDCP的妊娠女性MTHFR 677C > T 基因型分布情况比较[n(%)]Table 4. Comparison of MTHFR 677C > T genotype distribution and frequencies between gestational hypertension and preeclampsia [n(%)]妊娠期高血压疾病组别 MTHFR 677C > T n χ2 P CC CT TT 妊娠高血压组 24(38.09) 31(42.21) 8(12.69) 63 4.831 > 0.05 子痫前期组 9(33.33) 16(59.26) 2(7.41) 27 表 5 不同HDCP的妊娠女性MTHFR 677C > T 等位基因基因频率比较[n(%)]Table 5. Comparison of MTHFR 677C > T allele frequencies between gestational hypertension and preeclampsia [n(%)]妊娠期高血压疾病组别 等位基因频率 n χ2 P C T 妊娠高血压组 79(62.70) 47(37.30) 126 0.001 > 0.05 子痫前期组 34(63.00) 20(37.00) 54 2.4 妊娠高血压疾病(病例组)与非妊娠高血压疾病女性(对照组)MTHFR 677C > T基因多态性比较
如下图所示,妊娠高血压疾病组与同期非妊娠高血压疾病组比较,MTHFR 677C > T基因型频率,差异无统计学意义(P > 0.05);两组等位基因频率比较,差异无统计学意义(P > 0.05),见表6。
表 6 HDCP妊娠女性与非HDCP妊娠女性MTHFR 677C > T 基因分型及等位基因频率的比较[n(%)]Table 6. Comparison of MTHFR 677C > T genotype distribution and frequencies between HDCP(case)and control [n(%)]组别 n MTHFR 677C > T 等位基因频率 CC CT TT C T 病例组 90 33(36.67) 47(52.22) 10(11.11) 62.78 37.22 对照组 2386 972(40.74) 1059(44.38) 355(14.88) 62.93 37.07 P > 0.05 > 0.05 > 0.05 > 0.05 > 0.05 3. 讨论
亚甲基四氢叶酸还原酶主要作用是将体内的 5,10-亚甲基四氢叶酸还原为 5-甲基四氢叶酸,为血液中的Hcy再甲基化生成蛋氨酸提供甲基供体,从而参与DNA、RNA、蛋白质的甲基化,同时维持体内正常的同型半胱氨酸水平,是叶酸代谢的关键限速酶。其编码基因MTHFR基因位于染色体 1p36.3,整个编码区长1 970 bp,且包含了13个外显子。1995 年Front等[13]发现MTHFR 677C > T是该基因常见的多态性位点,其编码的蛋白质位于酶的活性区域内,而该位点的突变将导致MTHFR酶活性下降30%~70%,致使Hcy向蛋氨酸转化发生障碍,引发DNA等甲基化不足,同时Hcy在血液中堆积,增加血液中Hcy水平,从而产生一系列级联反应。已有研究证明在妊娠期高血压疾病发病过程中,患者体内往往伴随着Hcy水平不同程度的增高[14]。因此,可推测妊娠期高血压疾病的发病与MTHFR 677C > T基因多态性具有一定的关系。
本研究结果显示,云南昆明地区MTHFR 677C > T等位基因频率C62.92%,T37.08%,与莱芜、郑州、惠州、琼海等相比,等位基因频率,差异有统计学意义(P < 0.05)。表明昆明地区MTHFR 677C > T基因多态性频率分布不同于其他地区,且具有地域特异性,但云南省内该基因多态性地域性差异不明显[15]。病例组MTHFR 677C > T等位基因频率分别为C62.78%,T37.22%;对照组MTHFR 677C > T等位基因频率C62.93%,T37.07%,组间比较差异无统计学意义(P > 0.05)。本研究结果表明MTHFR 677C > T基因多态性与HDCP的发生之间并无显著性的相关性。但本研究作为回顾性研究,具有其局限性,可能产生数据偏差,从而影响研究结果。而且HDCP除了受遗传方面的影响,还受到多方面的影响,如免疫方面、氧化应激方面、胎盘或滋养细胞缺血,还有营养缺乏等[16]。因此,MTHFR 677C > T基因多态性与妊娠期高血压疾病的相关性仍需要系统的、全面的的研究。
MTHFR基因多态性与叶酸代谢吸收利用的个体化差异密切相关,而叶酸对于妊娠女性及胎儿的健康起着非常重要的作用。叶酸利用率降低将会增加胎儿畸形、先天性心脏病、妊娠高血压等多种疾病的发病风险[17-18]。理论上体内正常的叶酸水平能弥补因 MTHFR 基因多态性导致的酶活性降低引发的甲基化不足、Hcy水平过高等,从而降低出生缺陷、妊娠期高血压疾病等一系列疾病的发生率。因此,据MTHFR 677C > T多态性检测的结果,对风险较高基因型的女性进行早期干预。这样可提高体内叶酸水平,纠正Hcy代谢障碍,降低妊娠期孕妇及其胎儿相关疾病的发病风险,也可以为备孕女性提供个性化增补叶酸的临床指导[19]。
-
-
[1] Roy P S,Saikia B J. Cancer and cure: A critical analysis[J]. Indian J Cancer,2016,53(3):441-442. doi: 10.4103/0019-509X.200658 [2] Yahya E B,Alqadhi A M. Recent trends in cancer therapy: A review on the current state of gene delivery[J]. Life Sci,2021,15(269):119087. [3] 曹毛毛,陈万青. GLOBOCAN 2020全球癌症统计数据解读[J]. 中国医学前沿杂志,2021,13(3):63-69. [4] 马丽萍,丁春燕,田梅,等. 信号转导和转录激活因子3及小凹蛋白1在X射线诱导肺腺癌A549细胞早衰中的调控关系研究[J]. 中国医学装备,2021,18(3):1-5. [5] 黄青云. LncRNA HOTAIR通过MiR-203/Caveolin-1对乳腺癌细胞增殖、迁移和侵袭的影响[D]. 南昌: 南昌大学, 2021. [6] 李倩. Caveolin1通过OCTN2(SLC22A5)逆转结直肠癌耐药性[D]. 厦门: 厦门大学, 2021. [7] 高冬梅,张小芳,安杰,等. Cav-1对EGFR敏感基因突变非小细胞肺癌患者厄洛替尼治疗耐药的机制研究[J]. 解放军医药杂志,2022,34(3):1-5. [8] 邓心怡,高子煦,王璐,等. 环指蛋白157通过下调小凹蛋白-1表达参与ERK通路激活促进黑素瘤细胞增殖[J]. 中国临床医学,2023,30(2):257-264. [9] 崔玉洁,杜梦颖,李硕,等. Caveolin-1调控VEGFR-2对肺癌细胞增殖及侵袭的影响[J]. 现代中西医结合杂志,2022,31(20):2798-2802. [10] 韩蕴,李洪艳,张叶军,等. Caveolin-1和ER-α36相互作用促进胶质瘤细胞生长[J]. 癌症,2022,41(3):142-151. [11] Wang Y,Song Y,Che X,et al. Caveolin-1 enhances RANKL-induced gastric cancer cell migration[J]. Oncol Rep,2018,40(3):1287-1296. [12] 邵伟伟,王树人,刘水,等. 小窝蛋白1和表皮生长因子受体在肺腺癌的表达及临床意义[J]. 江苏医药,2023,49(2):158-163. [13] 谭超,邹黎黎. 小凹蛋白1与肿瘤的研究进展[J]. 中华肿瘤防治杂志,2015,22(6):483-488. [14] Sung H,Ferlay J,Siegel R L,et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660 [15] Vivian J,Rao A A,Nothaft F A,et al. Toil enables reproducible,open source,big biomedical data analyses[J]. Nature Biotechnology,2017,35(4):314-316. doi: 10.1038/nbt.3772 [16] Chen F,Chandrashekar D S,Varambally S,et al. Pan-cancer molecular subtypes revealed by mass-spectrometry-based proteomic characterization of more than 500 human cancers[J]. Nat Commun,2019,10(1):5679. doi: 10.1038/s41467-019-13528-0 [17] Bindea G,Mlecnik B,Tosolini M,et al. Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer[J]. Immunity,2013,39(4):782-795. doi: 10.1016/j.immuni.2013.10.003 [18] 王红磊,李昕宇,蒙椿海,等. Caveolin-1在肿瘤中的作用机制研究概况[J]. 广西中医药大学学报,2021,24(1):54-57. [19] 贾帅楠,李劲涛,赵丽娇,等. 环境致癌物与病毒协同致癌作用的研究进展[J]. 病毒学报,2018,34(4):601-609. [20] 余水红,李帆,金耀,等. 基于数据库探索GPX4基因在泛癌中的潜在价值[J]. 济宁医学院学报,2022,45(4):278-282. [21] 周威. TAF1L基因异常表达对口腔鳞状细胞癌病变作用的研究[D]. 深圳: 深圳大学, 2019. [22] 吴秀珍. 高通量基因测序在胃肠道恶性肿瘤中的临床意义[D]. 苏州: 苏州大学, 2017. [23] 彭贻龙,郑彩云. 骨肉瘤中FoxM1、Sox9基因异常表达与肿瘤病理特征的相关性研究[J]. 海南医学院学报,2018,24(7):797-799. [24] 谭金晶. DLK1基因异常表达及其促进肺癌细胞侵袭的分子机制[D]. 北京: 北京协和医学院, 2014. [25] Quest A F,Lobos-González L,Nuñez S,et al. The caveolin-1 connection to cell death and survival[J]. Curr Mol Med,2013,13(2):266-281. doi: 10.2174/156652413804810745 [26] Lin X,Chai G,Wu Y,et al. A methylation regulates the epithelial mesenchymal transition of cancer cells and translation of Snail[J]. Nat Commun,2019,10(1):2065. doi: 10.1038/s41467-019-09865-9 [27] 陈胜武,赵恒伍,高轶轩. Toll样受体2在泛癌中的表达、对预后的影响及其作用机制[J]. 中国医科大学学报,2022,51(9):810-816. -






 下载:
下载:
 下载:
下载: