Rare Cases of Hepatitis B Virus Infection Combined with Severe Cholinesterase Deficiency not Caused by Liver Dysfunction: Two Case Reports and Literature Review
-
摘要:
目的 分析乙肝病毒感染合并非肝脏合成功能障碍所致的胆碱酯酶(CHE)极度降低的罕见病例,探讨其临床意义。 方法 收集2021年7月和2022年2月在昆明市第三人民医院住院的2例罕见病例的临床资料,包括肝功能、凝血功能、乙肝标记物、乙肝病毒量、全外显子测序等进行分析,并作文献复习。 结果 2例乙肝病毒感染患者均长期CHE极度降低,肝脏合成功能良好,全外显子测序均显示存在血清胆碱酯酶(BCHE)基因突变。 结论 案例CHE极度低下并非是肝脏合成功能障碍所致。全外显子测序检出了2例患者的BCHE基因突变,非肝脏合成功能障碍所致的胆碱酯酶极度降低患者,进行BCHE基因突变筛查可能是必要的。 Abstract:Objective To analyze the hepatitis B virus infection with extreme reduction of cholinesterase(CHE) not caused by liver synthesis dysfunction, and to explore its clinical significance. Methods The clinical data of 2 rare cases hospitalized in the 3rd people’ s hospital of Kunming in July 2021 and February 2022, including liver function, coagulation function, hepatitis B markers, hepatitis B virus volume, and whole exon sequencing, were collected and analyzed, and literature was reviewed. Results CHE was extremely reduced in 2 patients with HBV infection, liver synthesis function was good, and whole exon sequencing showed the presence of butyrylcholinesterase(BCHE) gene mutation. Conclusion The extremely low CHE in this case is not due to liver function disorder. Exon sequencing detected mutations in the BCHE gene in two patients. Screening for BCHE mutations may be necessary in patients with extremely low cholinesterase levels not due to liver dysfunction. -
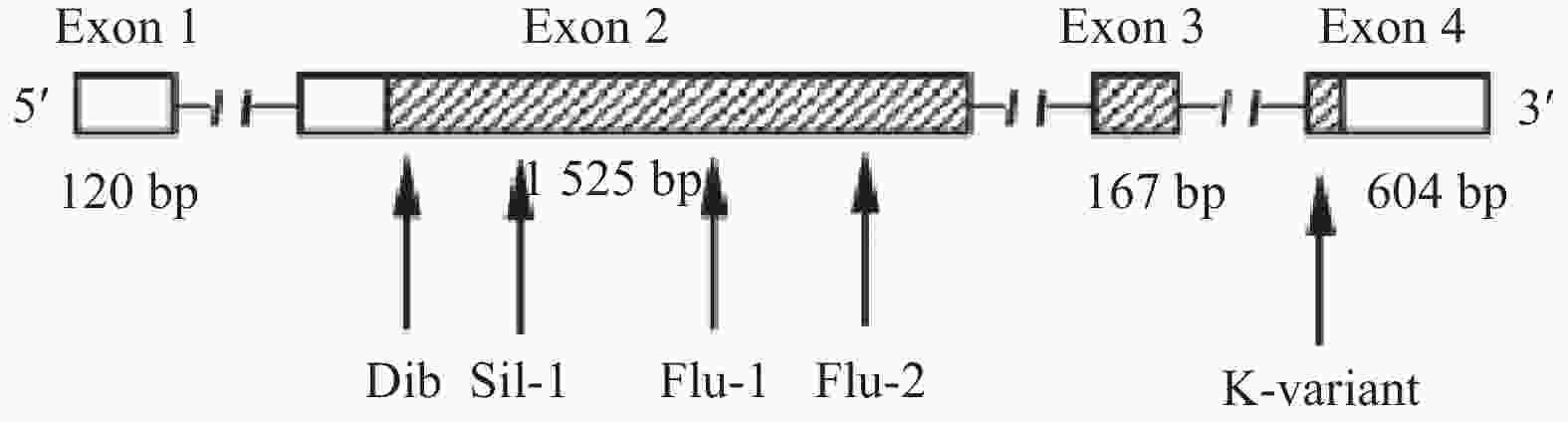
图 2 人类BCHE基因图谱及常见的物种突变情况[5]
Figure 2. Human BCHE gene map and common species mutations
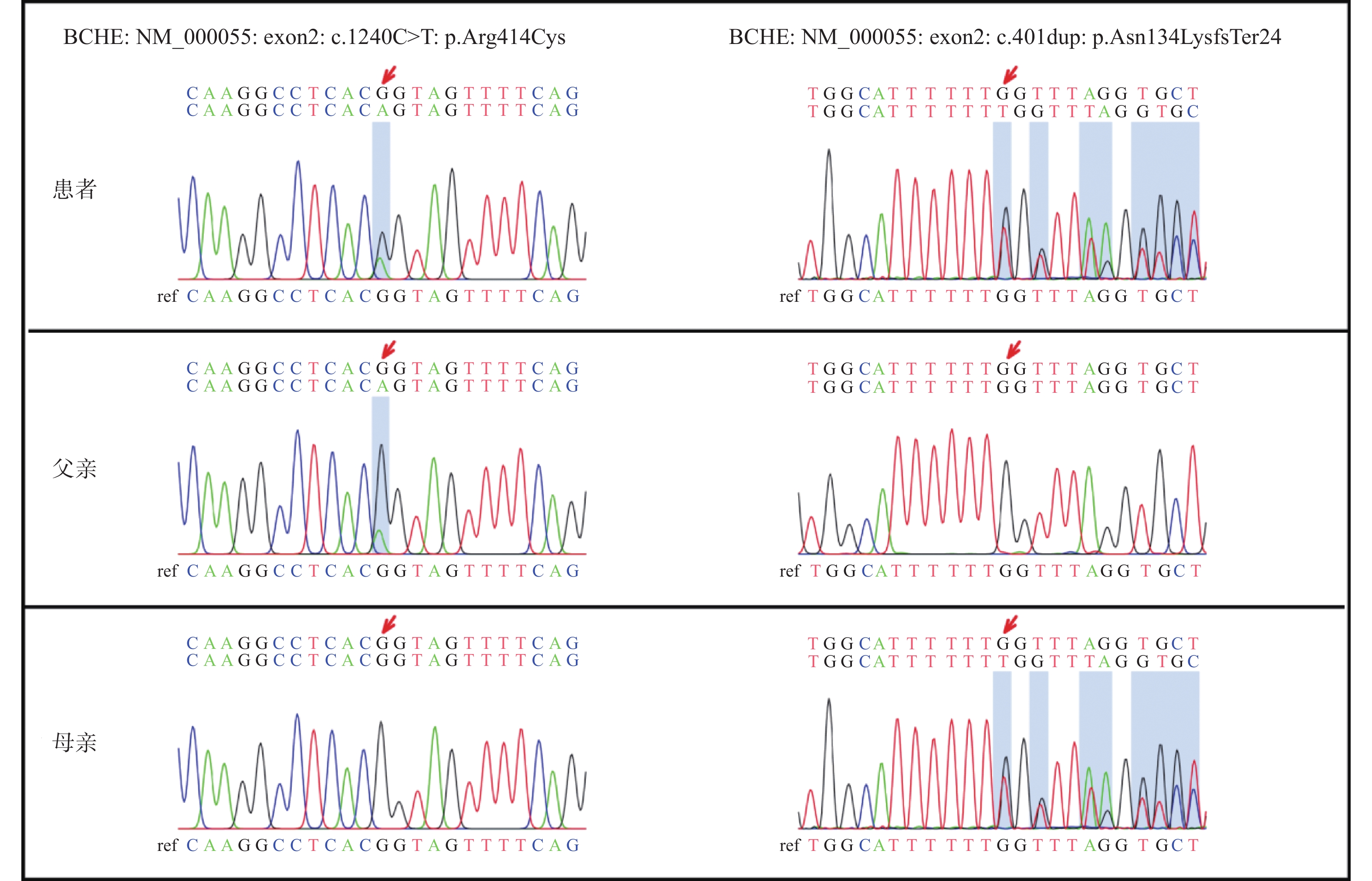
表 1 病例2全外显子测序检出的BCHE基因突变情况
Table 1. BCHE gene mutations detected by whole exon sequencing in case 2
基因(参考序列) 变异 染色体位置 变异频率 BCHE(NM_000055.2) c.1699G>A(p.A567T)纯合变异 Chr3: 165491280 0.1137 BCHE(NM_000055.2) c.1177G>C(p.G393R)杂合变异 Chr3: 165547645 0.0017 -
[1] 张明,李盾,陈仪本,等. 乙酰胆碱酯酶分子生物学研究进展[J]. 农药,2006,45(1):8-11. doi: 10.3969/j.issn.1006-0413.2006.01.003 [2] Andersson M L,M Ller A M,Wildgaard K. Butyrylcholinesterase deficiency and its clinical importance in anaesthesia: A systematic review[J]. Anaesthesia,2019,74(4):518-528. doi: 10.1111/anae.14545 [3] Trujillo R, West W P. Pseudocholinesterase deficiency [M]. StatPearls. Treasure Island (FL); StatPearls Publishing Copyright © 2023, StatPearls Publishing LLC. 2023: 5-8. [4] Arslan M,Novak M,Rosenthal D,et al. Cholinesterase deficiency syndrome-A pitfall in the use of butyrylcholinesterase as a biomarker for Wilson's disease[J]. Biomolecules,2022,12(10):1398. doi: 10.3390/biom12101398 [5] Yen T,Nightingale B N,Burns J C,et al. Butyrylcholinesterase (BCHE) genotyping for post-succinylcholine apnea in an Australian population[J]. Clin Chem,2003,49(8):1297-1308. doi: 10.1373/49.8.1297 [6] Stockhoff L,Muellner-Bucsics T,Markova A A,et al. Low serum cholinesterase identifies patients with worse outcome and increased mortality after TIPS[J]. Hepatology Communications,2022,6(3):621-632. doi: 10.1002/hep4.1829 [7] Zivkovic A R,Schmidt K,Sigl A,et al. Reduced serum butyrylcholinesterase activity indicates severe systemic inflammation in critically ill patients[J]. Mediators of Inflammation,2015,2015(5):274607. [8] Decker S O,Kr Ger A,Wilk H,et al. Concurrent change in serum cholinesterase activity and midregional-proadrennomedullin level could predict patient outcome following liver transplantation[J]. Biomolecules,2022,12(7):989. doi: 10.3390/biom12070989 [9] Geng H,Wang S,Jin Y,et al. Nutritional status and body composition in Wilson disease: A cross-sectional study from China[J]. Frontiers in nutrition,2021,8(6):790520. [10] Bhusal S,Bhandari R,Dahal S,et al. Organophosphorus poisoning among patients admitted to the intensive care unit of the department of internal medicine in a tertiary care centre: A descriptive cross-sectional study[J]. JNMA; Journal of the Nepal Medical Association,2022,60(253):766-769. doi: 10.31729/jnma.7823 [11] Garmavy H M S,Mohammed A A,Rashid H M,et al. A meta-analysis of normal human blood cholinesterase activities determined by a modified electrometric method[J]. Journal of Medicine and Life,2023,16(1):22-34. doi: 10.25122/jml-2022-0215 [12] Anglister N,Gonen-Shalom S,Shlanger P,et al. Plasma cholinesterase activity: A benchmark for rapid detection of pesticide poisoning in an avian scavenger[J]. The Science of the Total Environment,2023,877(6):162903. [13] 杜锴. 血浆凝血因子及胆碱酯酶在肝硬化患者的表达及临床意义[J]. 四川解剖学杂志,2020,28(4):62-63. doi: 10.3969/j.issn.1005-1457.2020.04.029 [14] 孙志君. 胆碱酯酶活性检测对进行性肝硬化诊断的临床意义[J]. 中外医疗,2020,39(22):1-3. doi: 10.16662/j.cnki.1674-0742.2020.22.001 [15] Cornelius B W,Jacobs T M. Pseudocholinesterase deficiency considerations: A case study[J]. Anesthesia Progress,2020,67(3):177-184. doi: 10.2344/anpr-67-03-16 [16] Soliday F K,Conley Y P,Henker R. Pseudocholinesterase deficiency: a comprehensive review of genetic,acquired,and drug influences[J]. AANA Journal,2010,78(4):313-320. [17] Acharya S,Bhattarai S,Shrimanker I,et al. A prolonged paralysis with succinylcholine in pseudocholinesterase deficiency: An undesired effect[J]. QJM:Monthly Journal of the Association of Physicians,2022,115(8):547-548. doi: 10.1093/qjmed/hcac103 [18] Maxwell J,Boothby A,Osborne R,et al. Prolonged paralysis after electroconvulsive therapy due to butyrylcholinesterase gene mutation[J]. Journal of Clinical Psychopharmacology,2021,41(5):610-611. doi: 10.1097/JCP.0000000000001423 [19] Pradhan B K,Van Helmond N,Mitrev L V,et al. Hereditary pseudocholinesterase deficiency discovery after electroconvulsive therapy[J]. BMJ Case Reports,2021,14(1):154-159. [20] Yu R,Guo Y,Dan Y,et al. A novel mutation in the BCHE gene and phenotype identified in a child with low butyrylcholinesterase activity: A case report[J]. BMC Medical Genetics,2018,19(1):58. doi: 10.1186/s12881-018-0561-5 [21] Yang X,Dang P,Liu W,et al. The role of butyrylcholinesterase in the regulation of cognitive dysfunction in minimal hepatic encephalopathy: A potential blood marker of disease evolution[J]. Frontiers in Neurology,2022,13(9):990997. [22] Douville N J,Kheterpal S,Engoren M,et al. Genetic mutations associated with susceptibility to perioperative complications in a longitudinal biorepository with integrated genomic and electronic health records[J]. British Journal of Anaesthesia,2020,125(6):986-994. doi: 10.1016/j.bja.2020.08.009 [23] Kurnutala L N,Rugnath N. Pseudocholinesterase deficiency - Is succinylcholine still needed to facilitate endotracheal intubation?[J]. Cureus,2020,12(9):10721. [24] Muntoni S,Rojkind M,Muntoni S. Colchicine reduces procollagen III and increases pseudocholinesterase in chronic liver disease[J]. World Journal of Gastroenterology,2010,16(23):2889-2894. doi: 10.3748/wjg.v16.i23.2889 -





 下载:
下载: