Cost-Effectiveness Analysis of Nilotinib Versus Dasatinib as Second-Line Treatment of Chronic Myeloid Leukemia
-
摘要:
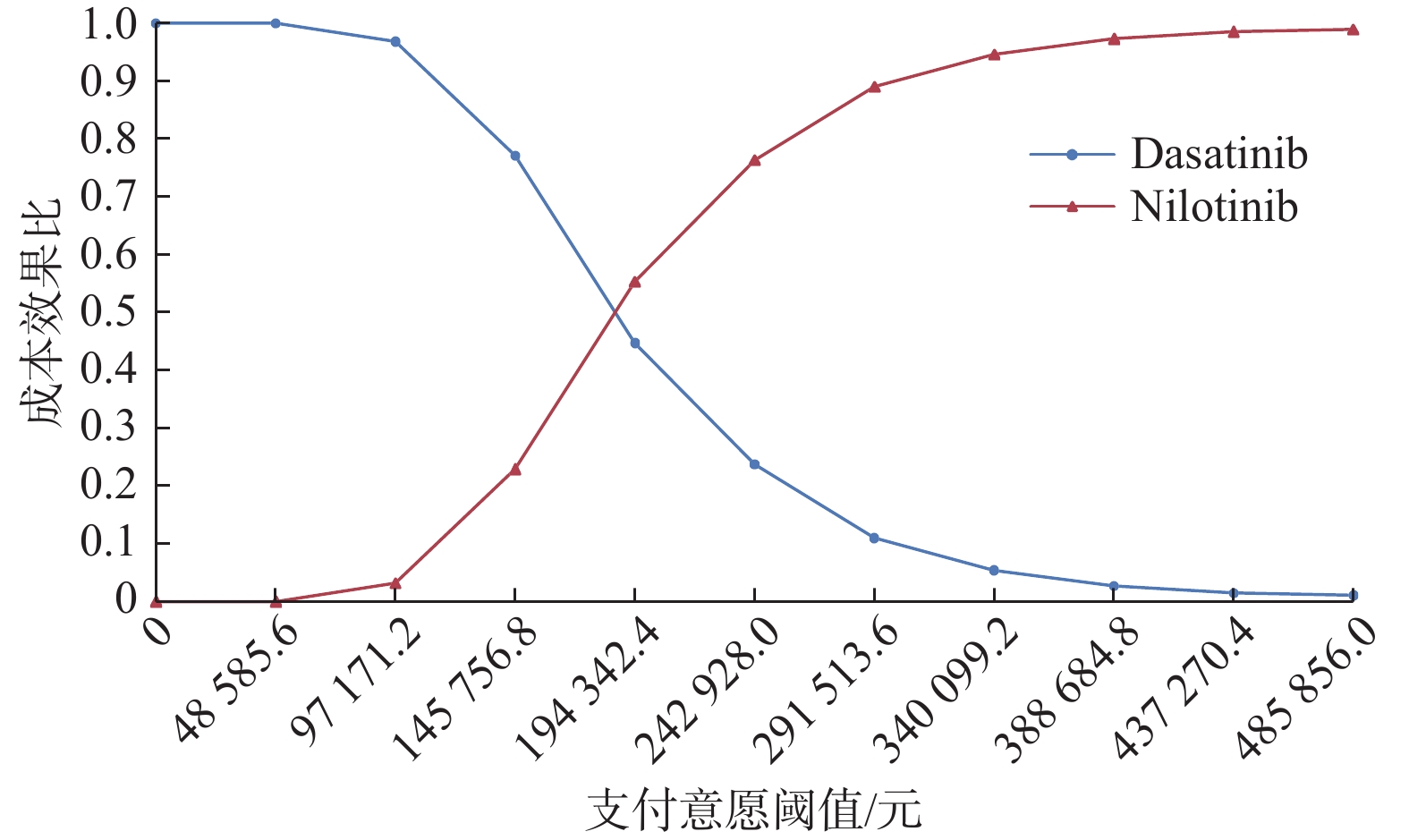
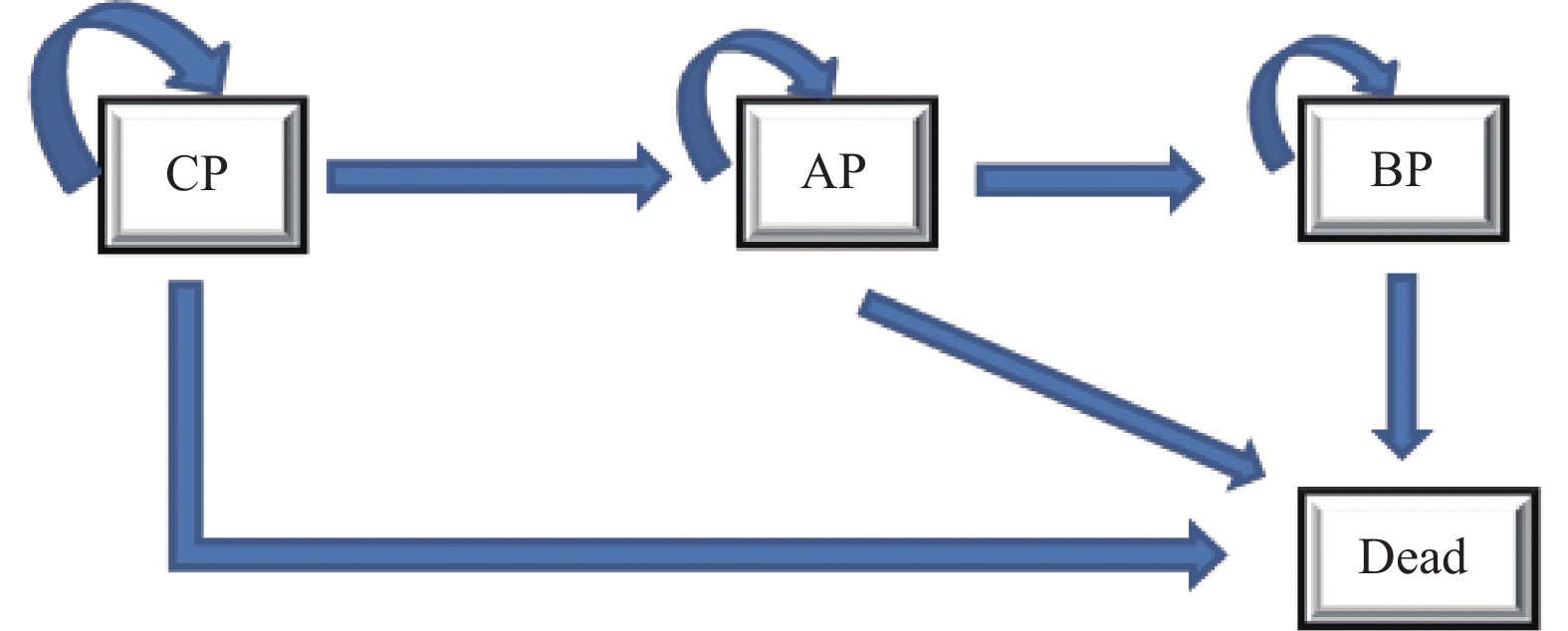
目的 评估费城染色体阳性慢性髓性白血病慢性期(Ph+CML-CP)患者中对伊马替尼耐药或不耐受的二线尼洛替尼与达沙替尼的成本效果。 方法 建立状态转移马尔可夫(Markov)模型进行成本效用分析,模型包括4种健康状态:慢性期(CP),加速期(AP),急变期(BP)和死亡。尼洛替尼与达沙替尼治疗的无进展生存率,疾病进展发生率,总生存率等有关临床参数来源于既往发表的研究和专家意见,健康状态效用值来源于文献。通过Treeage软件以增量成本效果比(ICER)作为评价指标,对尼洛替尼和达沙替尼2个方案的总产出和总成本进行评价,并通过单变量、概率敏感性分析评估模型稳定性。 结果 与选用达沙替尼治疗相比,选用尼洛替尼治疗的ICER 为182487.71元·QALY-1,低于3倍2021年全国人均GDP。敏感性分析显示主要的影响参数有贴现率,达沙替尼价格和尼洛替尼价格,模型结果稳定。 结论 选用尼洛替尼相对达沙替尼用于对伊马替尼耐药或不耐受的Ph+CML-CP患者治疗具有成本效用优势。 Abstract:Objective To evaluate the cost-effectiveness of nilotinib versus dasatinib in the second-line treatment of Philadelphia chromosome-positive chronic myeloid leukemia in chronic phase. Methods Establish a Markov model for cost-effectiveness analysis, including four health states: chronic phase (CP), accelerated phase (AP), blast phase (BP), and death. Clinical parameters related to progression-free survival rates, disease progression rates, overall survival rates, etc. for treatment with nilotinib and dasatinib are derived from previously published studies and expert opinions, while health state utility values are sourced from the literature. Using Treeage software, the incremental cost-effectiveness ratio (ICER) was used as an evaluation metric to assess the total output and total costs of the two schemes of nilotinib and dasatinib, and model stability is evaluated through univariate and probabilistic sensitivity analyses. Results Compared with using dasatinib for treatment, the ICER for using nilotinib treatment is 182487.71 yuan per QALY, which is less than 3 times the national per capita GDP in 2021. Sensitivity analysis showed that the main influencing parameters are the discount rate, dasatinib price, and nilotinib price, and the model results are stable. Conclusion Nilotinib has a cost-utility advantage over dasatinib in the treatment of Ph+CML-CP patients who are resistant or intolerent to imatinib. -
Key words:
- Nilotinib /
- Dasatinib /
- Chronic myeloid leukemia /
- Cost-effectiveness analysis /
- Second-line treatment
-
近年来,人口老龄化,再加之广谱抗生素、糖皮质激素、免疫抑制剂以及细胞毒药物的广泛应用,患者免疫功能受损,免疫力严重低下,使得侵袭性肺真菌感染(invasive pulmonary fungal infection,IPFI)的发病率及死亡率在全球范围内呈逐年升高趋势[1]。我国存在宿主因素的患者发病率为4.1%~41.2%,病死率为9.8%~60%[2]。国外研究证明慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者也是侵袭性真菌感染的易患宿主[3]。且有资料显示22.2%的COPD患者存在不同程度的肺部真菌感染[4]。COPD作为一种严重威胁人类健康的疾病,存在病情反复,急性加重的特点,极易出现二重感染,其中以IPFI多见,而IPFI症状及影像学表现无特异性,进展快,病死率高,因此对COPD并发IPFI早期诊断及治疗具有十分重要的意义[5]。近年来,具有无创、敏感、特异优点的血清1,3-β-D葡聚糖检测(G试验)和半乳甘露聚糖检测(GM试验)已被逐渐开始广泛应用,成为真菌感染的诊断标准之一[6-7]。本研究对2018年10月至2019年10月昆明医科大学第二附属医院急诊重症医学科收治的AECOPD存在肺真菌感染的26例患者的临床资料进行了统计分析,探讨肺泡灌洗液(BALF)G试验、GM试验对AECOPD患者并发IPFI的诊断价值。
1. 资料与方法
1.1 一般资料
随机选取2018年10月至2019年10月昆明医科大学第二附属医院急诊重症医学科收治的AECOPD合并肺真菌感染的患者26例,其中男性患者19例,女性患者7例,年龄56~82岁,平均(72.5±8.3)岁,将这些患者作为观察组。另选取同一时期昆明医科大学第二附属医院急诊重症医学科收治的AECOPD仅存在细菌感染的患者26例,作为对照组。其中男性患者21例,女性患者5例,年龄61~82岁,平均(71.4±8.5)岁。两组患者的一般资料比较,差异无统计学意义(P > 0.05)。本试验所选病例均有行纤维支气管镜检查的适应症且无禁忌症,由家属或本人签署知情同意书,并经过伦理委员会批准。
1.2 诊断标准
参照中华医学会2007年制定的《慢性阻塞性肺疾病诊治指南》[8]和中华医学会呼吸病学分会感染学组中华结核、呼吸杂志编辑委员会制定的“肺真菌病诊断和治疗专家共识”[9]。
1.3 排除标准
(1)家属或患者本人不同意行纤维支气管镜检查;(2)患者病情危重,不能耐受纤维支气管镜检查或存在纤维支气管镜的禁忌症;(3)行G、GM试验前已经验性使用抗真菌治疗;(4)在行G、GM试验前近期有应用可能干扰该试验结果的治疗(如使用可能导致假阳性的抗生素、白蛋白、免疫球蛋白及使用纤维素膜透析等)。
1.4 样本采集与处理
所有研究对象均在规范操作的纤维支气管镜下采集BALF,同时抽血采集血清标本,同时送检进行G和GM试验检测。
1.4.1 血清G/GM试验
血清标本均送昆明医科大学第二附属医院实验室检查,由实验人员统一规范操作,具体操作步骤严格按照试剂和仪器说明书进行。
1.4.2 BALF G/GM试验
BALF采集方法如下:纳入病例的患者在行纤维支气管镜检查前均行肺部CT检查,根据检查结果判定纤维支气管镜检查的目标段或亚段支气管。然后进行规范支气管镜操作,规范地采集标本,灌洗液回收量不少于5 mL。BALF经低温、离心处理后,采集上清液进行G/GM试验,原理和操作步骤同血清G/GM试验。
1.5 结果判定
G试验阳性的标准为测定值 > 100 pg/mL,GM试验阳性的标准为测定值 > 0.65 μg/mL。
1.6 观察指标
对比血清与BALF测定G/GM试验的水平,并统计G/GM试验的敏感度、特异性、阴性预测值、阳性预测值、假阳性率和假阴性率。
1.7 统计学处理
数据统计分析采用SPSS 20.0软件,以均数±标准差(
$\bar x $ ±s)表示计量资料,组间比较采用t检验;用n(%)表示计数资料,组间比较采用χ2检验;P < 0.05为差异有统计学意义。2. 结果
2.1 两组患者不同标本(BLAF和血清)G、GM试验结果
观察组中,BALF G试验阳性结果22例,GM试验阳性结果18例,血清G试验阳性结果20例,GM试验阳性结果16例,BALF GM联合G试验阳性23例;血清GM联合G试验阳性22例。无论是BLAF还是血清,观察组的G和GM试验阳性结果例数均明显高于对照组,且观察组中BALF测定G/GM试验的水平均高于血清测定值,差异有统计学意义(P < 0.05),见 表1、表2。
2.2 不同标本(BLAF和血清)G、GM试验诊断价值比较
BALF G试验联合GM试验检测特异性、灵敏度、阳性预测值、阴性预测值、假阳性率和假阴性率分别为92.3%、88.5%、93.5%、93.2%、7.7%和11.5%。BALFG试验联合GM试验检测诊断AECOPD并发侵袭性肺真菌感染的灵敏度、特异度、阳性预测值、阴性预测值、假阳性率和假阴性率均优于其他各项,见表3。
表 1 不同标本G、GM试验检测阳性率比较 [n (%)]Table 1. Comparison of G and GM test positive rate between different specimens[n (%)]组别 G试验 GM试验 BALF Blood BALF Blood 观察组(n = 26) 22(84.623) 20(76.871) 18(69.213) 16(61.521) 对照组(n = 26) 6(23.132) 7(26.872) 3(11.532) 4(15.412) χ2 21.672 15.061 19.742 13.587 P < 0.001 < 0.001 < 0.001 < 0.001 表 2 不同标本G、GM试验检测值比较($\bar x \pm s $ )Table 2. Comparison of G and GM test result between different specimens($\bar x \pm s $ )组别 G试验 GM试验 BALF Blood BALF Blood 观察组(n = 26) 37.512 ± 18.362 26.213 ± 12.579 1.862 ± 1.692 0.852 ± 0.687 对照组(n = 26) 14.803 ± 13.213 12.873 ± 7.731 0.221 ± 0.232 0.372 ± 0.253 t 4.253 5.423 4.314 4.262 P < 0.001 < 0.001 < 0.001 < 0.001 表 3 不同标本G、GM试验单项及联合检测结果(%)Table 3. G test,GM test or G combined with GM test result between different specimens(%)检测项目 G试验 GM试验 G+GM试验 BALF Blood BALF Blood BALF Blood 特异度 76.9 73.1 88.5 84.6 92.3 88.5 灵敏度 84.6 77.9 69.2 61.5 88.5 84.6 阳性预测值 74.8 74.1 84.2 79.1 93.5 89.6 阴性预测值 82.3 75.6 74.5 69.2 93.2 87.3 假阳性率 23.1 26.9 11.5 15.4 7.7 11.5 假阴性率 15.4 23.1 30.8 38.5 11.5 15.4 3. 讨论
慢性阻塞性肺疾病(COPD)是一种严重威胁人类健康的呼吸系统慢性疾病,具有病程长、病情反复、迁延难愈、进行性加重的特点,多数患者为老年人,病情加重时,甚至需要使用呼吸机治疗,且在治疗过程中需长期应用抗菌药物和糖皮质激素来治疗及控制病情,对免疫系统产生了抑制作用,故而发生侵袭性肺真菌感染的风险较高。有报道表示,慢性阻塞性肺疾病急性加重期(AECOPD)并发真菌感染占因AECOPD住院总人数的4.91%[10],真菌感染中又多以侵袭性肺部真菌感染(IPFI)为常见[11-12]。AECOPD患者并发IPFI的症状、体征,甚至影像学常常缺乏特异性,往往容易忽略或漏诊,从而导致严重后果。
近年来,血清1,3-β-D葡聚糖检测(G试验)和半乳甘露聚糖检测(GM试验),具有无创、敏感、迅速等特点,被广大临床医师所接受和认可,但仍然存在一定的误差。G试验检测的是1,3-β-D葡聚糖,该物质广泛存在于真菌细胞壁内且为真菌所特有。当真菌侵入机体后,机体的吞噬细胞吞噬真菌,持续释放1,3-β-D葡聚糖,使血液及体液中1,3-β-D葡聚糖含量增高[13]。但是在IPFI早期,真菌尚未进入血液中,因此早期血清G试验阳性率并不高[14]。且血清G试验常因病人输注白蛋白、球蛋白、抗肿瘤药物、磺胺类药物、哌拉西林/他唑巴坦等半合成青霉素等情况时呈现假阳性。GM试验检测的是半乳甘露聚糖,而曲霉菌细胞壁含有该成分,当曲霉菌侵入机体后,半乳甘露聚糖即被释放出来,从而被检测到,且该物质是最早释放的抗原,在临床或放射学征象出现之前就能被检测到[15]。但也有研究证实,其与其他真菌(双歧杆菌、新型隐球菌、镰刀菌、青霉菌)及内酰胺类抗生素有交叉反应[16]。另外,非粒缺曲霉菌患者,白细胞会吞噬GM抗原,亦可造成GM试验假阴性。因此,无论是血清G试验还是GM试验均存在一定的假阳性率和假阴性率[17-18],为临床判断带来一定的难度。
本研究结果提示无论是BLAF还是血清,观察组的G/GM试验阳性结果例数均高于对照组;观察组中BALF测定G/GM试验的水平均高于血清测定,差异有统计学意义(P < 0.05);BALF G试验联合GM试验检测诊断AECOPD并发IPFI的灵敏度、特异度、阳性预测值、阴性预测值均高于其他各项,假阳性率和假阴性率低于其他各项,提示BALF G/GM试验对AECOPD患者并发IPFI有较高的灵敏性及特异性,具有更高的临床诊断价值,且BALF G试验联合GM试验检测能有效提高诊断AECOPD并发IPFI的灵敏度、特异度、阳性预测值、阴性预测值,降低假阳性率和假阴性率,减少了误诊、漏诊情况的发生,优于单项G试验或GM试验检测及血清G试验联合GM试验检测。
综上所述,无论是血清还是肺泡灌洗液G和GM试验对早期诊断AECOPD患者并发侵袭性肺真菌感染的诊断均具有一定的临床价值,但是肺泡灌洗液G和GM试验优于血清G和GM试验,且肺泡灌洗液G和GM试验联合检测可以提高试验结果的灵敏性和特异性,降低假阳性和假阴性的发生率,对于早期诊断AECOPD患者并发IPFI提供有效的实验室数据,有临床价值。但肺泡灌洗液G和GM试验需要患者行支气管镜检查,操作有一定侵入性,若能取得患者或家属的同意,在临床诊断上更有价值,值得推广。
-
表 1 状态转移概率
Table 1. Transition probability
表 2 药品成本
Table 2. Drug cost
药品名称 规格 生产产家 价格(元/盒) 达沙替尼 50 mg/片,60片/盒 AstraZeneca Pharmaceuticals LP 7274.16 20 mg/片,60片/盒 3607.00 50 mg/片,7片/盒 正大天晴药业集团股份有限公司 377.11 20 mg/片,7片/盒 186.99 50 mg/片,7片/盒 石药集团欧意药业股份有限公司 373.25 20 mg/片,7片/盒 185.08 尼洛替尼 200 mg/粒,120粒/盒 Novartis PharmaSte 11030.40 150 mg/粒,120粒/盒 8850.00 药品价格来源于药智网(https://www.yaozh.com/)。 表 3 成本与效用参数
Table 3. Cost and utility parameters
参数模型 均值 下限 上限 概率分布 文献来源 药品成本(元/d) 尼洛替尼CP期#
尼洛替尼AP期#
尼洛替尼BP期#367.68(295)
367.68(295)
367.68(295)275.76(221.25)
275.76(221.25)
275.76(221.25)404.45(324.5)
404.45(324.5)
404.45(324.5)Gamma
Gamma
Gamma药智网
药智网
药智网达沙替尼CP期
达沙替尼AP期
达沙替尼BP期242.47
362.71
362.71106.64
159.52
159.52266.72
398.98
398.98Gamma
Gamma
Gamma药智网
药智网
药智网其他成本 (元) 门诊挂号费 15.00 10.50 19.50 Gamma * 全血细胞计数和外周血分类 24.00 16.80 31.20 Gamma * 骨髓细胞遗传学分析、荧光原位杂交 642.00 449.40 834.60 Gamma * 定量聚合酶链反应检测BCR-ABL 350.00 245.00 455.00 Gamma * 聚合酶链反应扩增BCR-ABL转录本后测序 1292.00 904.40 1679.60 Gamma * 效用值 CP期使用尼洛替尼效用值 0.810 0.648 0.972 Beta [16] CP期使用达沙替尼效用值 0.780 0.624 0.936 Beta [17] AP期效用值 0.650 0.520 0.780 Beta [18] BP期效用值 0.53 0.424 0.636 Beta [12] 死亡 0 Beta 不良反应 1563.32 1094.32 2023.32 Gamma [17] 贴现率(%) 5 0 8 Beta [19] #括号内为数值尼洛替尼用量为300 mg q12 h ;* 2022年云南省三级甲等医院收费标准。 表 4 成本效果分析
Table 4. Cost-effectiveness results
治疗方案 尼洛替尼用法用量 QALYs 总成本/元 ICER/元·QALY−1 达沙替尼 8.77 257929.14 尼洛替尼 400 mg q12 h(100%) 9.11 319830.67 182487.71 300 mg q12 h(45.9%) 9.11 292090.70 100709.42 -
[1] 中华医学会血液学分会. 慢性髓性白血病中国诊断与治疗指南(2020年版)[J]. 中华血液学杂志,2020,(5):353-364. doi: 10.3760/cma.j.issn.0253-2727.2020.05.001 [2] Morel F,Ka C,Le Bris MJ,et al. Deletion of the 5' abl region in Philadelphia chromosome-positive chronic myeloid leukemia[J]. Leukemia,2003,17(2):473-474. doi: 10.1038/sj.leu.2402816 [3] Melo J V. The diversity of BCR-ABL fusion proteins and their relationship to leukemia phenotype[J]. Blood,1996,88(7):2375-2384. doi: 10.1182/blood.V88.7.2375.bloodjournal8872375 [4] Baccarani M,Cortes J,Pane F,et al. Chronic myeloid leukemia: An update of concepts and management recommendations of European Leukemia Net[J]. J Clin Oncol,2009,27(35):6041-6051. doi: 10.1200/JCO.2009.25.0779 [5] Mace M L,Dahl J,Jabbour E J. Which tyrosine-kinase inhibitor to use first in chronic phase chronic myelogenous leukemia?[J]. Expert Opin Pharmacother,2015,16(7):999-1007. [6] Radich J P, Deininger M, Abboud C N, et al. NCCN clinical practice guidelines in oncology: Chronic myelogenous leukemia (2023, Version 1) [M/OL]. [2023-1-23]. https://www.nccn.org//login?ReturnURL=https://www.nccn.org/professionals/physician_gls/pdf/cml.pdf [7] 陈琳,杨敏,程国华. 尼洛替尼与达沙替尼二线治疗慢性髓系白血病的药物经济学评价[J]. 肿瘤,2016,36(6):698-704,710. [8] 徐伟,高楠,马丽,等. 大剂量伊马替尼、达沙替尼和尼洛替尼治疗慢性髓性白血病的成本效用分析[J]. 中国医院药学杂志,2017,37(19):1974-1978. [9] Bonifacio M,Maheshwari V,Tran D,et al. Economic model to evaluate the cost-effectiveness of second-line nilotinib versus dasatinib for the treatment of Philadelphia chromosome-positive chronic myeloid leukemia (CML-CP) in Italy[J]. Pharmacoecon Open,2022,6(1):95-104. doi: 10.1007/s41669-021-00286-3 [10] Li N,Yang X,Fan L,et al. Nilotinib versus dasatinib as second-line therapy in patients with Philadelphia chromosome-positive chronic myeloid leukemia in chronic phase who are resistant or intolerant to imatinib: A cost-effectiveness analysis based on real-world data[J]. J Med Econ,2017,20(4):328-336. doi: 10.1080/13696998.2016.1261032 [11] Yue X,Hincapie A L,Li Y,et al. Safety and cost-effectiveness of ponatinib versus other tyrosine kinase inhibitors as second-line therapy in patients with chronic myeloid leukemia in the United States[J]. Leuk Lymphoma,2022,63(4):946-954. doi: 10.1080/10428194.2021.2002320 [12] Giles F J,Coutre P D L,Pinilla-Ibarz J,et al. Nilotinib in imatinib-resistant or imatinib-intolerant patients with chronic myeloid leukemia in chronic phase: 48-month follow-up results of a phase II study[J]. Leukemia,2013,27(1):107-112. doi: 10.1038/leu.2012.181 [13] Shah N P,Kim D W,Kantarjian H M,et al. Potent transient inhibition of BCR-ABL with dasatinib 100 mg daily achieves rapid and durable cytogenetic responses and high transformation-free survival rates in chronic phase chronic myeloid leukemia patients with resistance,suboptimal response or into[J]. Heamatologica,2010,95(2):232-240. doi: 10.3324/haematol.2009.011452 [14] Griffin J D,Guerin A,Chen L,et al. Comparing nilotinib with dasatinib as second-line therapies in patients with chronic myelogenous leukemia resistant or intolerant to imatinib - a retrospective chart review analysis[J]. Curr Med Res Opin,2013,29(6):623-631. doi: 10.1185/03007995.2013.789012 [15] Shah N P,Guilhot F,Cortes J E,et al. Long-term outcome with dasatinib after imatinib failure in chronic-phase chronic myeloid leukemia: Follow-up of a phase 3 study[J]. Blood,2014,123(15):2317-2324. doi: 10.1182/blood-2013-10-532341 [16] Kulpeng W,Sompitak S,Jootar S,et al. Cost-utility analysis of dasatinib and nilotinib in patients with chronic myeloid leukemia refractory to first-line treatment with imatinib in Thailand[J]. Clin Ther,2014,36(4):534-543. [17] Huang X,Jiang Q,Hu J,et al. Four-year follow-up of patients with imatinib-resistant or intolerant chronic myeloid leukemia receiving dasatinib: Efficacy and safety[J]. Front Med,2018,13(3):344-353. [18] Padula W V,Larson R A,Dusetzina S B,et al. Cost-effectiveness of tyrosine kinase inhibitor treatment strategies for chronic myeloid leukemia in chronic phase after generic entry of imatinib in the United States[J]. J Natl Cancer Inst,2016,108(7):djw003. doi: 10.1093/jnci/djw003 [19] 刘国恩. 中国药物经济学评价指南(2020中英双语版)[M]. 北京: 中国市场出版社, 2020: 27-47. [20] Nguyen J T,Cole A L,Leech A A,et al. Cost-effectiveness of first-line tyrosine kinase inhibitor therapy initiation strategies for chronic myeloid leukemia[J]. Value Health,2020,23(10):1292-1299. doi: 10.1016/j.jval.2020.05.019 [21] Li N,Zheng B,Cai H F. et al. Cost effectiveness of imatinib,dasatinib,and nilotinib as first-line treatment for chronic-phase chronic myeloid leukemia in china[J]. Clin Drug Investig,2018,38(1):79-86. doi: 10.1007/s40261-017-0587-z [22] Cai D,Shi S,Jiang S,et al. Estimation of the cost-effective threshold of a quality-adjusted life year in China based on the value of statistical life[J]. Eur J Health Econ,2022,23(4):607-615. doi: 10.1007/s10198-021-01384-z -







 下载:
下载:


 下载:
下载: