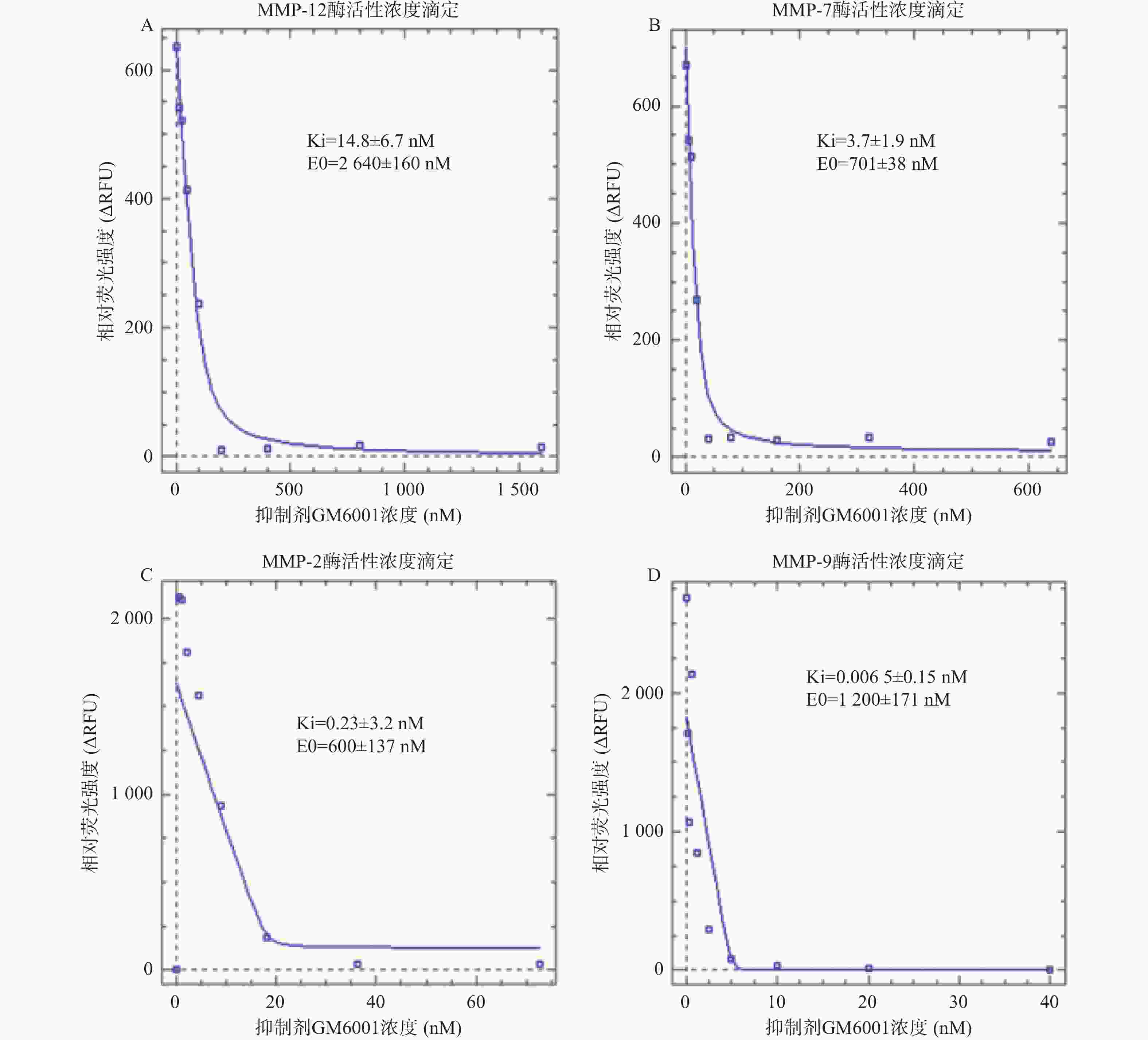
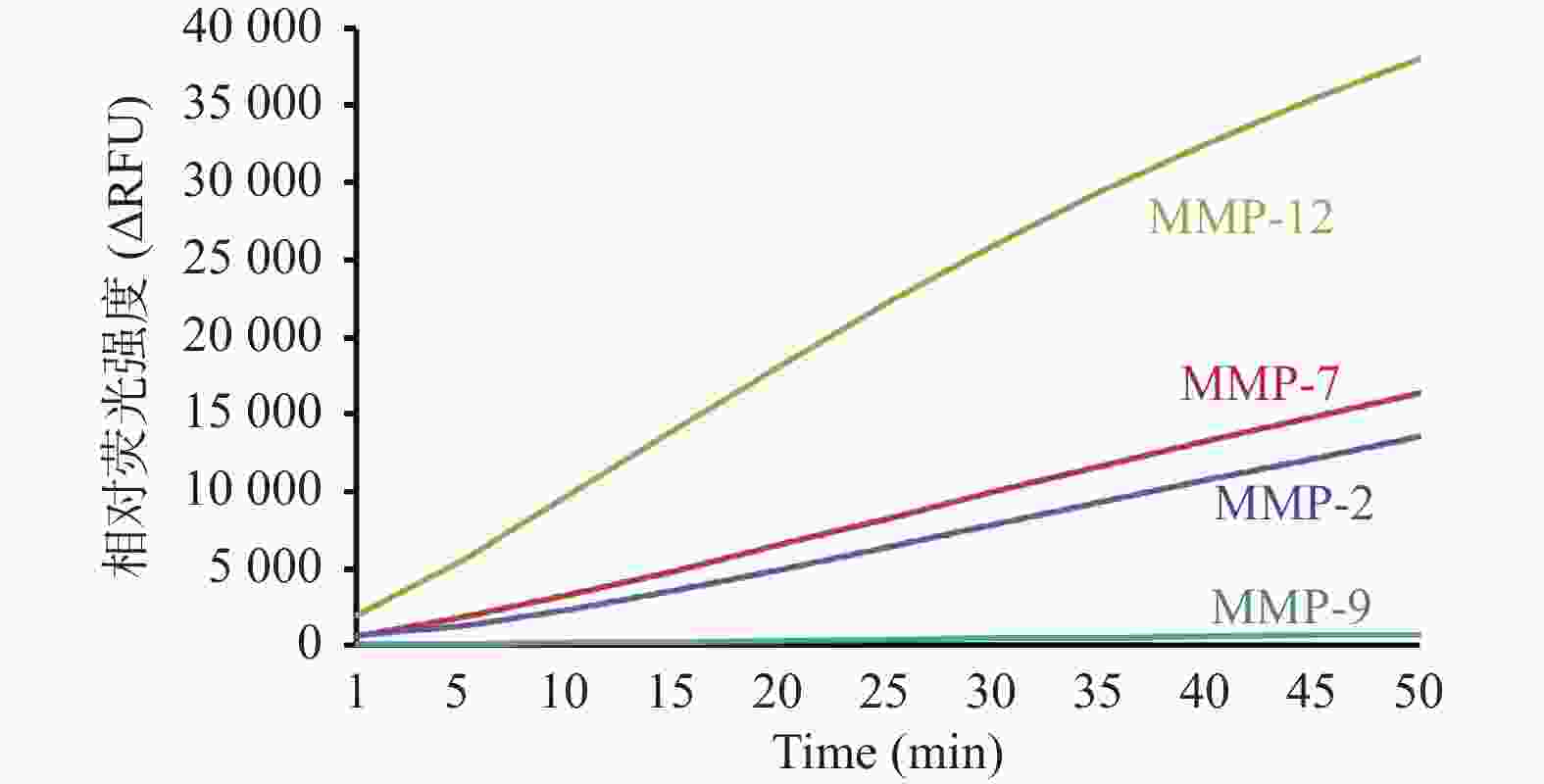
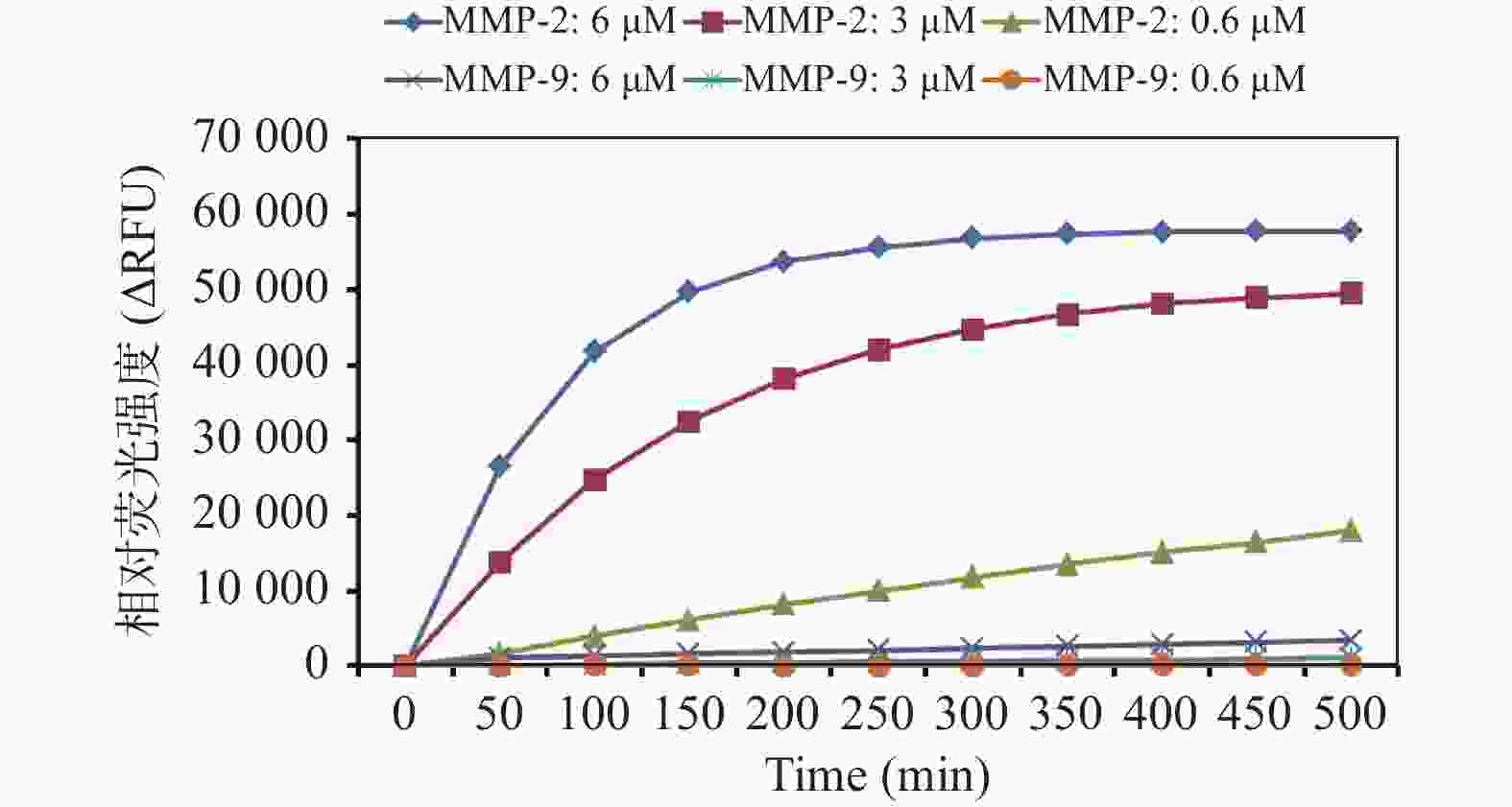
|
[1]
|
Wang X,Khalil R A. Matrix metalloproteinases,vascular remodeling,and vascular disease[J]. Advances in Pharmacology, 2018,81:241-330.
|
|
[2]
|
Kampoli A M,Tousoulis D,Papageorgiou N,et al. Matrix metalloproteinases in acute coronary syndromes: Current perspectives[J]. Current Topics in Medicinal Chemistry,2012,12(10):1192-1205. doi: 10.2174/1568026611208011192
|
|
[3]
|
Wang J,Tan G J,Han L N,et al. Novel biomarkers for cardiovascular risk prediction[J]. Journal of Geriatric Cardiology: JGC,2017,14(2):135-150.
|
|
[4]
|
Dabek J,Kulach A,Gasior Z. The role of matrix metalloproteinases in acute coronary syndromes[J]. European Journal of Internal Medicine, 2007,18(6):463-466. doi: 10.1016/j.ejim.2007.01.007
|
|
[5]
|
Ye Y,Wan W,Wang J,et al. The CEACAM1-derived peptide QLSN impairs collagen-induced human platelet activation through glycoprotein VI[J]. Bioscience,Biotechnology,and Biochemistry, 2020,84(1):85-94.
|
|
[6]
|
Wang J,Ye Y,Wei G,et al. Matrix metalloproteinase12 facilitated platelet activation by shedding carcinoembryonic antigen related cell adhesion molecule1[J]. Biochemical and Biophysical Research Communications, 2017,486(4):1103-1109. doi: 10.1016/j.bbrc.2017.04.001
|
|
[7]
|
Stryer L. Fluorescence energy transfer as a spectroscopic ruler[J]. Annual Review of Biochemistry, 1978,47:819-846. doi: 10.1146/annurev.bi.47.070178.004131
|
|
[8]
|
孟照辉,叶雨佳,谢月辉,等. 一种检测人基质金属蛋白酶-12活性的荧光多肽底物[P]. 云南省: CN201410450501.X, 2017-02-01.
|
|
[9]
|
Kuzmič P. DynaFit--a software package for enzymology[J]. Methods in Enzymology, 2009,467: 247-280.
|
|
[10]
|
Santos-Martínez M J,Medina C,Jurasz P,et al. Role of metalloproteinases in platelet function[J]. Thrombosis Research, 2008,121(4):535-542. doi: 10.1016/j.thromres.2007.06.002
|
|
[11]
|
Gresele P,Falcinelli E,Sebastiano M,et al. Matrix metalloproteinases and platelet function[J]. Progress in Molecular Biology and Translational Science, 2017,147:133-165.
|
|
[12]
|
Seizer P,May A E. Platelets and matrix metalloproteinases[J]. Thrombosis and Haemostasis, 2013,110(5):903-909.
|
|
[13]
|
Visse R,Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure,function,and biochemistry[J]. Circulation Research, 2003,92(8):827-839. doi: 10.1161/01.RES.0000070112.80711.3D
|
|
[14]
|
Creemers E E,Cleutjens J P,Smits J F,et al. Matrix metalloproteinase inhibition after myocardial infarction: a new approach to prevent heart failure?[J]. Circulation Research, 2001,89(3):201-210. doi: 10.1161/hh1501.094396
|
|
[15]
|
Lindsey M L,Escobar G P,Mukherjee R,et al. Matrix metalloproteinase-7 affects connexin-43 levels,electrical conduction,and survival after myocardial infarction[J]. Circulation, 2006, 113 (25):2919-2928.
|
|
[16]
|
Johnson J L,George S J,Newby A C,et al. Divergent effects of matrix metalloproteinases 3,7,9,and 12 on atherosclerotic plaque stability in mouse brachiocephalic arteries[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005,102(43):15575-15580.
|
|
[17]
|
L. N,L. J,J. N,et al. Increased plasma concentration of matrix metalloproteinase-7 in patients with coronary artery disease[J]. Clinical Chemistry, 2006(8): 1522-1527.
|
|
[18]
|
Morgan A R,Rerkasem K,Gallagher P J,et al. Differences in matrix metalloproteinase-1 and matrix metalloproteinase-12 transcript levels among carotid atherosclerotic plaques with different histopathological characteristics[J]. Stroke, 2004,35(6):1310-1315. doi: 10.1161/01.STR.0000126822.01756.99
|
|
[19]
|
Y. -B. Z,W. L,L Q. Y,et al. Expression changes and roles of matrix metalloproteinases in a rat model of traumatic deep vein thrombosis[J]. Chinese Journal of Traumatology - English Edition, 2010(3): 188-192.
|
|
[20]
|
Bergers G,Brekken R,McMahon G,et al. Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis[J]. Nature Cell Biology, 2000,2(10):737-744. doi: 10.1038/35036374
|
|
[21]
|
O'Reilly M S,Wiederschain D,Stetler-Stevenson W G,et al. Regulation of angiostatin production by matrix metalloproteinase-2 in a model of concomitant resistance[J]. The Journal of Biological Chemistry, 1999,274(41):29568-29571. doi: 10.1074/jbc.274.41.29568
|
|
[22]
|
Hannocks M J,Zhang X,Gerwien H,et al. The gelatinases,MMP-2 and MMP-9,as fine tuners of neuroinflammatory processes[J]. Matrix Biology: Journal of the International Society for Matrix Biology, 2019,75:102-113. doi: 10.1016/j.matbio.2017.11.007
|
|
[23]
|
Kurzepa J,Kurzepa J,Golab P,et al. The significance of matrix metalloproteinase (MMP)-2 and MMP-9 in the ischemic stroke[J]. The International Journal of Neuroscience, 2014,124(10):707-716. doi: 10.3109/00207454.2013.872102
|
|
[24]
|
Shevchenko A V,Golovanova O V,Konenkov V I,et al. Analysis of the gene polymorphism of matrix metalloproteinase-2 and -9 in patients with coronary heart disease[J]. Terapevticheskii Arkhiv, 2010,82(1):31-34.
|
|
[25]
|
Trivedi V,Boire A,Tchernychev B,et al. Platelet matrix metalloprotease-1 mediates thrombogenesis by activating PAR1 at a cryptic ligand site[J]. Cell, 2009,137(2):332-343. doi: 10.1016/j.cell.2009.02.018
|
|
[26]
|
Sebastiano M,Momi S,Falcinelli E,et al. A novel mechanism regulating human platelet activation by MMP-2-mediated PAR1 biased signaling[J]. Blood, 2017,129(7):883-895. doi: 10.1182/blood-2016-06-724245
|
|
[27]
|
Gresele P,Falcinelli E,Loffredo F,et al. Platelets release matrix metalloproteinase-2 in the coronary circulation of patients with acute coronary syndromes: possible role in sustained platelet activation[J]. European Heart Journal, 2011(3):316-325.
|
|
[28]
|
Martinez A,Salas E,Radomski A,et al. Matrix metalloproteinase-2 in platelet adhesion to fibrinogen: interactions with nitric oxide[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical research, 2001(4):646-651.
|
|
[29]
|
Sanchis L,Andrea R,Falces C,et al. Prognosis of new-onset heart failure outpatients and collagen biomarkers[J]. European Journal of Clinical Investigation, 2015,45(8):842-849. doi: 10.1111/eci.12479
|
|
[30]
|
Sheu J R,Fong T H,Liu C M,et al. Expression of matrix metalloproteinase-9 in human platelets: regulation of platelet activation in in vitro and in vivo studies[J]. British Journal of Pharmacology, 2004,143(1):193-201. doi: 10.1038/sj.bjp.0705917
|
|
[31]
|
Fernandez-Patron C,Martinez-Cuesta MA,Salas E,et al. Differential regulation of platelet aggregation by matrix metalloproteinases-9 and -2[J]. Thrombosis and Haemostasis, 1999,82(6):1730-1735.
|
|
[32]
|
Dini F L,Buralli S,Bajraktari G,et al. Plasma matrix metalloproteinase-9 better predicts outcome than N-terminal protype-B natriuretic peptide in patients with systolic heart failure and a high prevalence of coronary artery disease[J]. Biomedicine & Pharmacotherapy, 2010,64(5):339-342.
|
|
[33]
|
Wagner D R,Delagardelle C,Ernens I,et al. Matrix metalloproteinase-9 is a marker of heart failure after acute myocardial infarction[J]. Journal of Cardiac Failure, 2006,12(1):66-72. doi: 10.1016/j.cardfail.2005.08.002
|
|
[34]
|
Kelly D,Khan S Q,Thompson M,et al. Plasma tissue inhibitor of metalloproteinase-1 and matrix metalloproteinase-9: novel indicators of left ventricular remodeling and prognosis after acute myocardial infarction[J]. Eur Heart J, 2008,29(17):2116-2124. doi: 10.1093/eurheartj/ehn315
|






 下载:
下载: