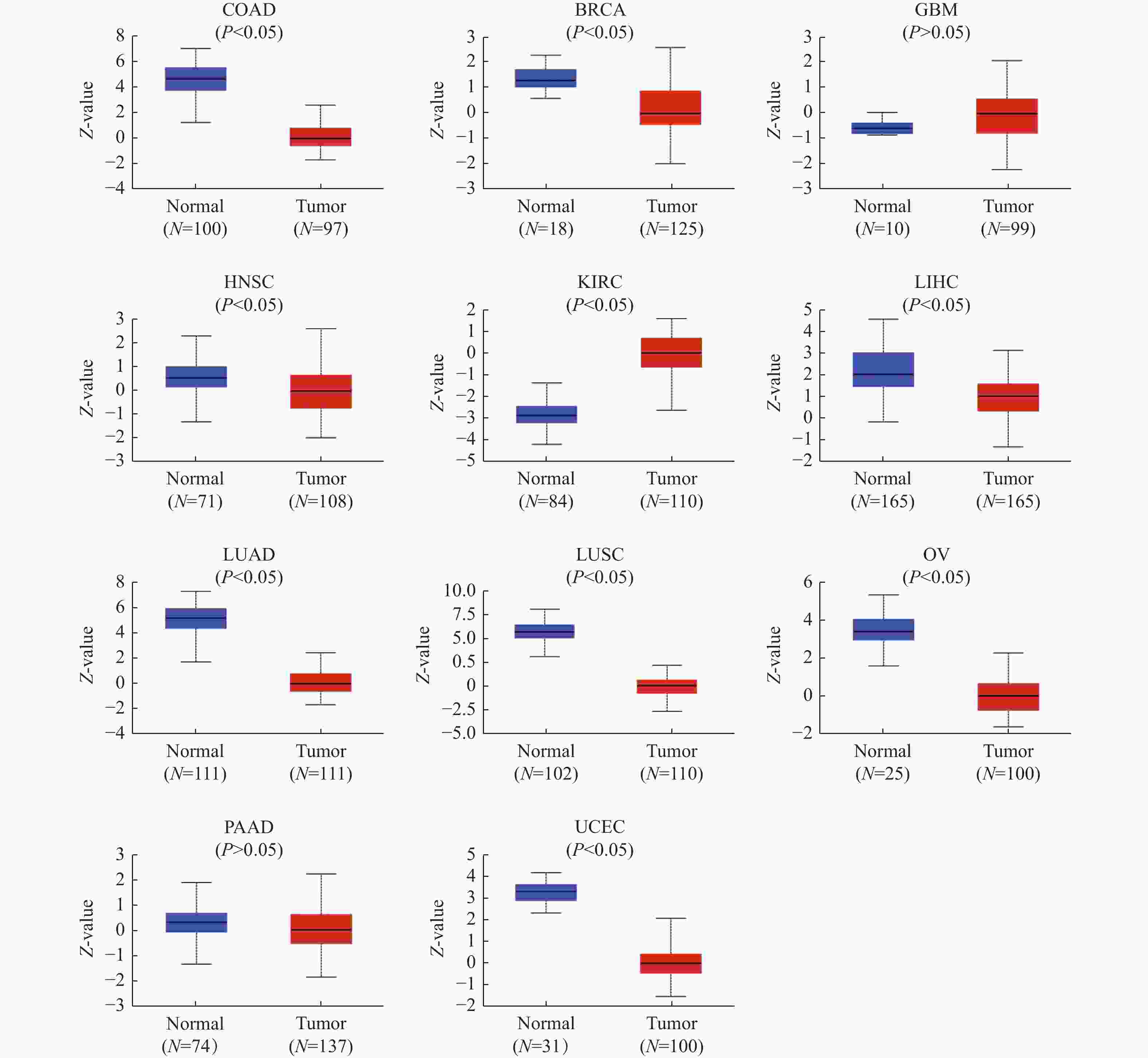
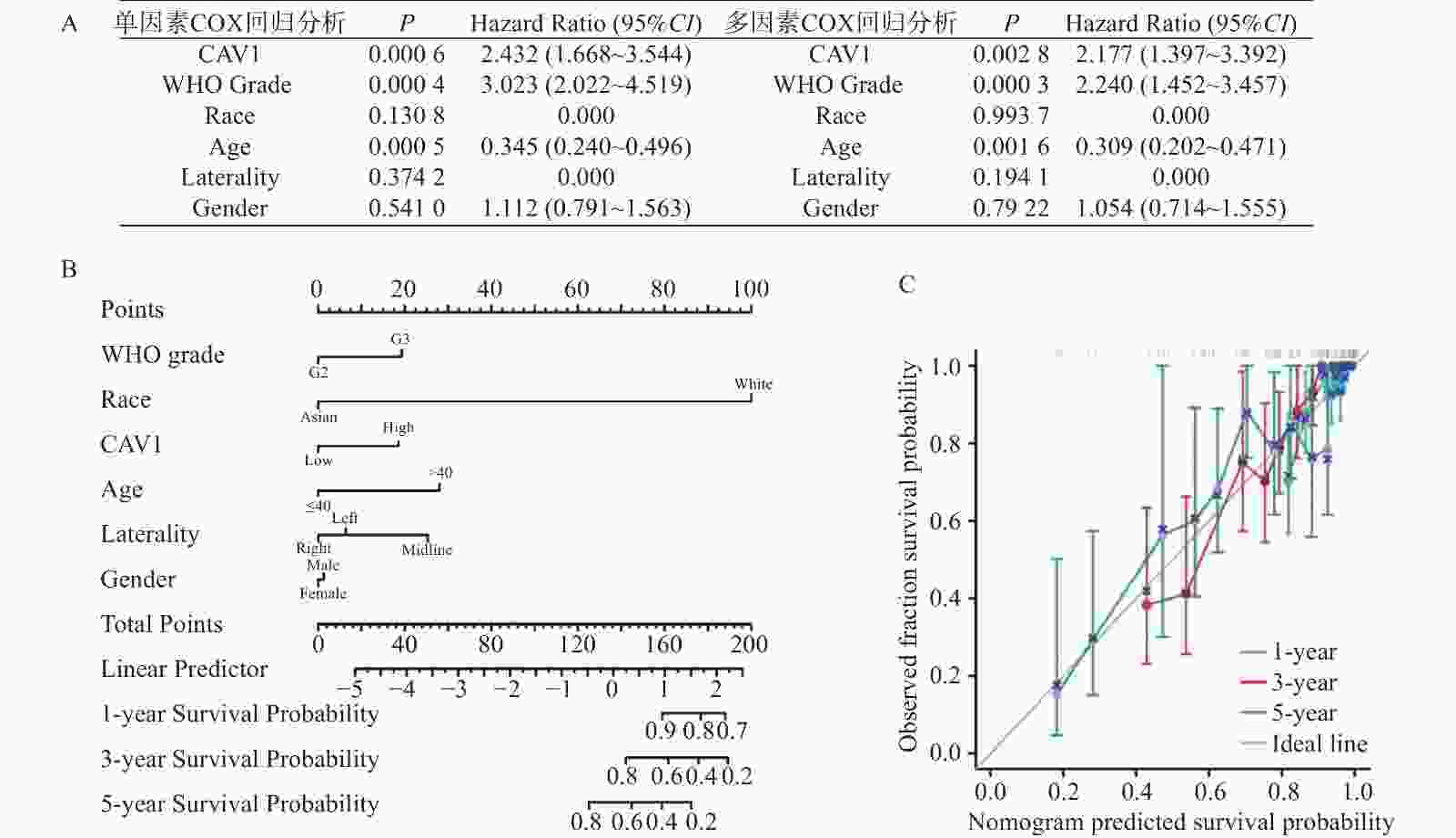
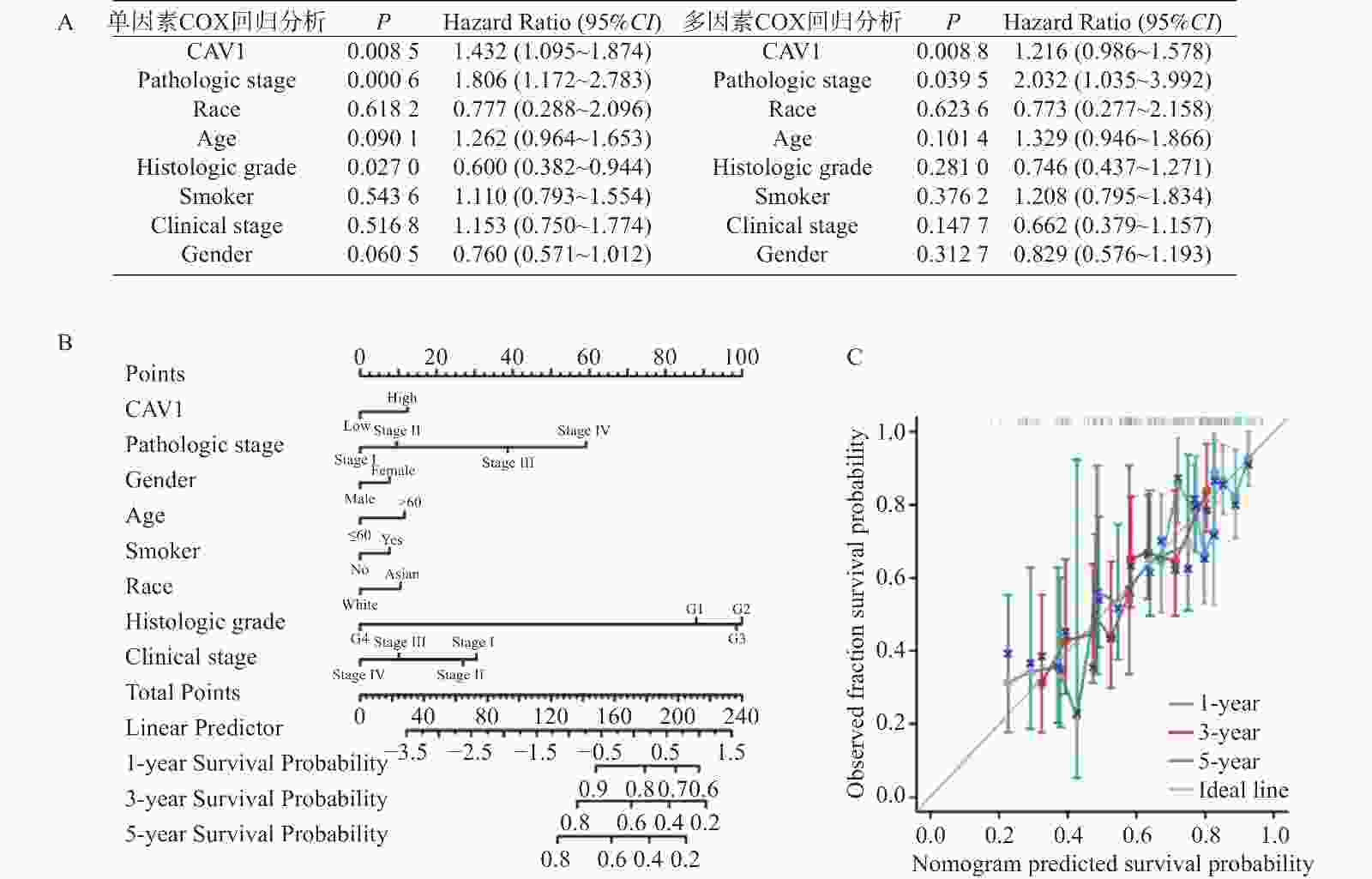
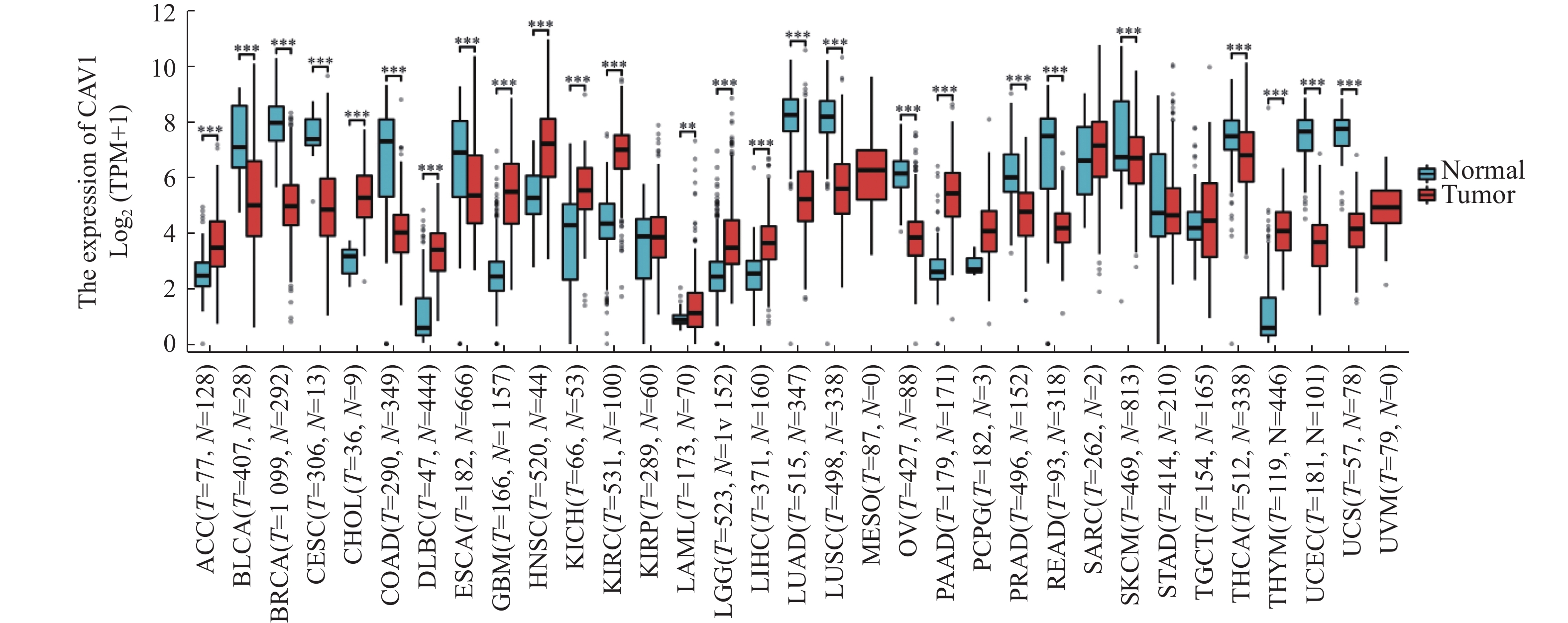
|
[1]
|
Roy P S,Saikia B J. Cancer and cure: A critical analysis[J]. Indian J Cancer,2016,53(3):441-442. doi: 10.4103/0019-509X.200658
|
|
[2]
|
Yahya E B,Alqadhi A M. Recent trends in cancer therapy: A review on the current state of gene delivery[J]. Life Sci,2021,15(269):119087.
|
|
[3]
|
曹毛毛,陈万青. GLOBOCAN 2020全球癌症统计数据解读[J]. 中国医学前沿杂志,2021,13(3):63-69.
|
|
[4]
|
马丽萍,丁春燕,田梅,等. 信号转导和转录激活因子3及小凹蛋白1在X射线诱导肺腺癌A549细胞早衰中的调控关系研究[J]. 中国医学装备,2021,18(3):1-5.
|
|
[5]
|
黄青云. LncRNA HOTAIR通过MiR-203/Caveolin-1对乳腺癌细胞增殖、迁移和侵袭的影响[D]. 南昌: 南昌大学, 2021.
|
|
[6]
|
李倩. Caveolin1通过OCTN2(SLC22A5)逆转结直肠癌耐药性[D]. 厦门: 厦门大学, 2021.
|
|
[7]
|
高冬梅,张小芳,安杰,等. Cav-1对EGFR敏感基因突变非小细胞肺癌患者厄洛替尼治疗耐药的机制研究[J]. 解放军医药杂志,2022,34(3):1-5.
|
|
[8]
|
邓心怡,高子煦,王璐,等. 环指蛋白157通过下调小凹蛋白-1表达参与ERK通路激活促进黑素瘤细胞增殖[J]. 中国临床医学,2023,30(2):257-264.
|
|
[9]
|
崔玉洁,杜梦颖,李硕,等. Caveolin-1调控VEGFR-2对肺癌细胞增殖及侵袭的影响[J]. 现代中西医结合杂志,2022,31(20):2798-2802.
|
|
[10]
|
韩蕴,李洪艳,张叶军,等. Caveolin-1和ER-α36相互作用促进胶质瘤细胞生长[J]. 癌症,2022,41(3):142-151.
|
|
[11]
|
Wang Y,Song Y,Che X,et al. Caveolin-1 enhances RANKL-induced gastric cancer cell migration[J]. Oncol Rep,2018,40(3):1287-1296.
|
|
[12]
|
邵伟伟,王树人,刘水,等. 小窝蛋白1和表皮生长因子受体在肺腺癌的表达及临床意义[J]. 江苏医药,2023,49(2):158-163.
|
|
[13]
|
谭超,邹黎黎. 小凹蛋白1与肿瘤的研究进展[J]. 中华肿瘤防治杂志,2015,22(6):483-488.
|
|
[14]
|
Sung H,Ferlay J,Siegel R L,et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660
|
|
[15]
|
Vivian J,Rao A A,Nothaft F A,et al. Toil enables reproducible,open source,big biomedical data analyses[J]. Nature Biotechnology,2017,35(4):314-316. doi: 10.1038/nbt.3772
|
|
[16]
|
Chen F,Chandrashekar D S,Varambally S,et al. Pan-cancer molecular subtypes revealed by mass-spectrometry-based proteomic characterization of more than 500 human cancers[J]. Nat Commun,2019,10(1):5679. doi: 10.1038/s41467-019-13528-0
|
|
[17]
|
Bindea G,Mlecnik B,Tosolini M,et al. Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer[J]. Immunity,2013,39(4):782-795. doi: 10.1016/j.immuni.2013.10.003
|
|
[18]
|
王红磊,李昕宇,蒙椿海,等. Caveolin-1在肿瘤中的作用机制研究概况[J]. 广西中医药大学学报,2021,24(1):54-57.
|
|
[19]
|
贾帅楠,李劲涛,赵丽娇,等. 环境致癌物与病毒协同致癌作用的研究进展[J]. 病毒学报,2018,34(4):601-609.
|
|
[20]
|
余水红,李帆,金耀,等. 基于数据库探索GPX4基因在泛癌中的潜在价值[J]. 济宁医学院学报,2022,45(4):278-282.
|
|
[21]
|
周威. TAF1L基因异常表达对口腔鳞状细胞癌病变作用的研究[D]. 深圳: 深圳大学, 2019.
|
|
[22]
|
吴秀珍. 高通量基因测序在胃肠道恶性肿瘤中的临床意义[D]. 苏州: 苏州大学, 2017.
|
|
[23]
|
彭贻龙,郑彩云. 骨肉瘤中FoxM1、Sox9基因异常表达与肿瘤病理特征的相关性研究[J]. 海南医学院学报,2018,24(7):797-799.
|
|
[24]
|
谭金晶. DLK1基因异常表达及其促进肺癌细胞侵袭的分子机制[D]. 北京: 北京协和医学院, 2014.
|
|
[25]
|
Quest A F,Lobos-González L,Nuñez S,et al. The caveolin-1 connection to cell death and survival[J]. Curr Mol Med,2013,13(2):266-281. doi: 10.2174/156652413804810745
|
|
[26]
|
Lin X,Chai G,Wu Y,et al. A methylation regulates the epithelial mesenchymal transition of cancer cells and translation of Snail[J]. Nat Commun,2019,10(1):2065. doi: 10.1038/s41467-019-09865-9
|
|
[27]
|
陈胜武,赵恒伍,高轶轩. Toll样受体2在泛癌中的表达、对预后的影响及其作用机制[J]. 中国医科大学学报,2022,51(9):810-816.
|





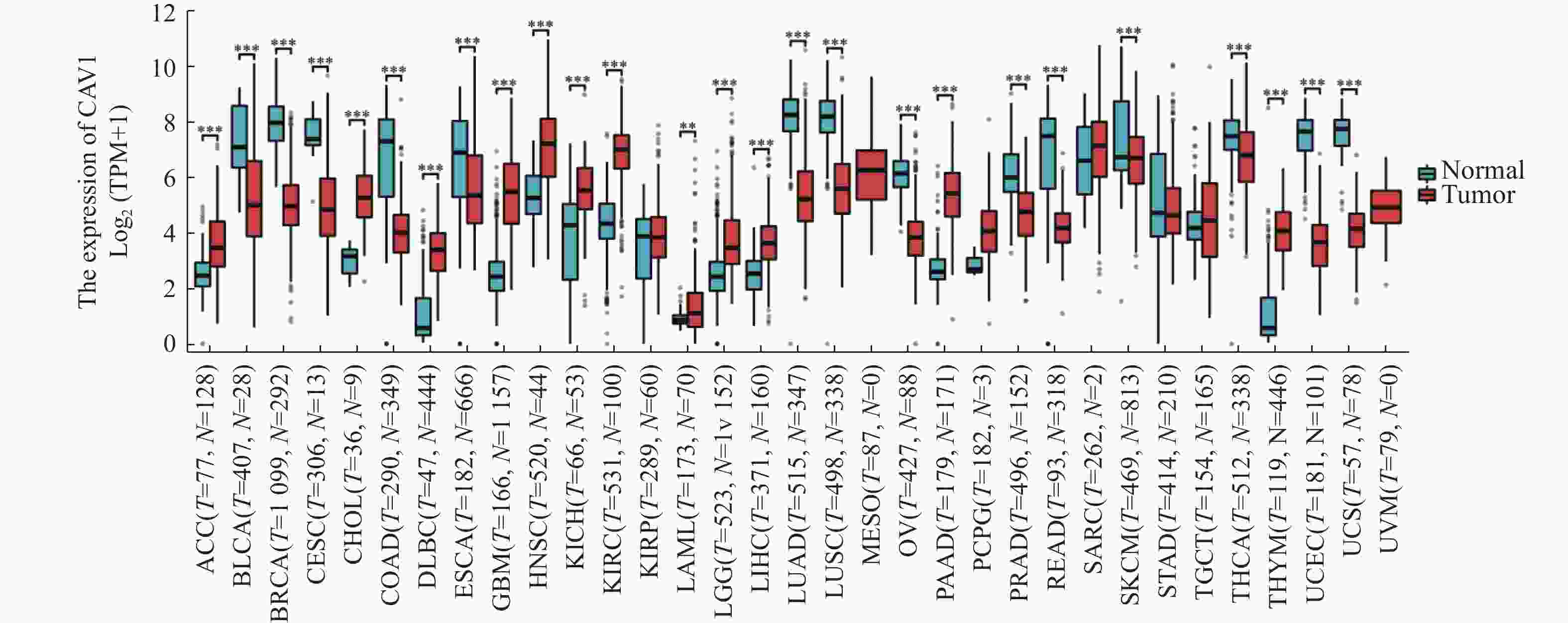
 下载:
下载: