Effect of Plasma Exchange with Double Plasma Molecular Adsorption on Cytokines in Autoimmune Hepatitis with Liver Failure
-
摘要:
目的 观察血浆置换(plasma exchange,PE)联合双重血浆分子吸附(double plasma molecular absorb system,DPMAS)对自身免疫性肝炎合并肝衰竭患者细胞因子的影响,探讨血浆置换联合双重血浆分子吸附对此类患者的免疫治疗意义,以及对预后的影响。 方法 选取22例在昆明市第三人民医院于2017年10月至2020年8月期间住院诊断为自身免疫性肝炎合并肝衰竭患者,应用血浆置换联合双重血浆分子吸附治疗,观察结合内科综合治疗前后细胞因子(IL-2、IL-4、IL-6、IL-10、TNF-α)、肝功能、血氨、凝血功能、血常规等指标的变化。 结果 治疗前后对比,患者的细胞因子(IL-2、IL-6、TNF-α)、肝功能(TBIL、AST、ALT、ALB)、血氨、凝血酶原活动度、血红蛋白、血小板等指标经治疗后显著下降,差异有统计学意义(P < 0.05);治疗前后对比,患者的细胞因子(IL-4、IL-10)、总胆汁酸等指标,差异无统计学意义(P > 0.05)。 结论 应用选择性血浆置换联合双重血浆分子吸附治疗自身免疫性肝炎合并肝衰竭患者,能稳定内环境,为肝细胞的再生能力创造条件,恢复肝功能,改善黄疸等临床症状,能提高患者的生存率,以及肝衰竭的救治成功率,值得推广。 Abstract:Objective To study the effect of Plasma Exchange (PE) combined with Double Plasma Molecular Absorption System (DPMAS) on cytokines in patients with autoimmune hepatitis complicated with liver failure, and to explore the significance of Plasma Exchange combined with Double Plasma Molecular absorption in immunotherapy and the impact on the prognosis of such patients. Methods In this study, 22 patients with autoimmune hepatitis complicated with liver failure who were hospitalized in the Third People’ s Hospital of Kunming City from October 2017 to August 2020 were selected. These patients received plasma exchange combined with double plasma molecular adsorption therapy, and the changes of cytokines (IL-2, IL-4, IL-6, IL-10, TNF-α), liver function, blood ammonia, coagulation function, blood routine and other indicators before and after the combined medical treatment were analyzed. Results After treatment, the levels of cytokines IL-2, IL-6, and TNF-α, liver function (TBil, AST, ALT, ALB), blood ammonia, prothrombin activity, hemoglobin, platelet decreased significantly, (P < 0.05); while the differences in cytokines IL-4 and IL-10), total bile acid and other indicators were statistically insignificant (P > 0.05). Conclusion Selective plasma exchage combined with double plasma molecular adsorption in the treatment of patients with autoimmune hepatitis complicated with liver failure helps to maintain homeostasis and supports the regeneration of liver cells, so as to restore liver function and improve clinical symptoms such as jaundice. This method can improve the survival rate of patients, improve the success rate of liver failure treatment, and is worthy of clinical promotion. -
Key words:
- Plasmapheresis /
- Double plasma molecular adsorption /
- Autoimmune hepatitis /
- Liver failure /
- Cytokines
-
自身免疫性的肝炎(autoimmune hepatitis,AIH)是自身抗体检测阳性、γ-球蛋白血症和(或)高免疫球蛋白G、肝脏组织学的界面性肝炎为特点的肝细胞的一种自身免疫反应炎症性疾病。如果治疗耽误会导致肝硬化、肝功能的衰竭,若为急性发作,可致急性肝功能衰竭,严重的导致死亡[1-2]。由于自身免疫性肝衰竭的发生率为2%~8%[3],出现肝衰竭的患者,临床上更是少见,其影响因素在于免疫损伤,缺血缺氧性的损伤,内毒素血症,其关键因素是细胞因子的水平[4]。针对自身免疫性肝炎合并肝衰竭最有效的治疗为肝移植,但是肝源少、费用昂贵、高技术水平要求、术后的长期免疫抑制的治疗,限制临床的应用[5]。目前多种疾病合并肝衰竭的患者的首选非生物型人工肝技术及内科综合治疗为主[6],其中一种治疗模式:血浆置换(plasma exchange,PE)联合双重血浆分子吸附( double plasma molecular absorb system,DPMAS)术可以高效清除总胆红素、内毒素、多种细胞因子、血氨等,减轻患者的炎症反应,补充凝血因子、白蛋白等生物活性因子,恢复肝功能,为肝细胞的再生创造时间,稳定机体内环境,改善患者的相关临床症状,提高肝衰竭患者的救治的成功率,改善患者的预后[7]。
本研究观察应用血浆置换联合双重血浆分子吸附术治疗自身免疫性肝衰竭患者的临床价值。
1. 资料与方法
1.1 病例资料
选取22例在昆明市第三人民医院于2017年10月至2020年8月期间住院确诊的自身免疫性肝炎合并肝衰竭患者作为研究对象。
诊断标准及临床分型:参照2015年自身免疫性肝炎的诊断和治疗共识及肝衰竭诊治指南[8-9]。
纳入病例共22例,其中男 1例,女 21例。年龄在46~75岁,平均(55.04±8.23)岁。平均的住院天数(38.50±16.29) d。人工肝的治疗共58例次。治疗次数及例数:3次 6例,2次 6例,1次 7例,10次 1例,4次 1例,7次 1例。平均治疗次数为2~3次,频率在2~3次/周。
临床分型:肝衰竭(慢性)5例;肝衰竭(急性) 3例,肝衰竭慢加急性(亚急性) 14例;肝衰竭(亚急性) 0例;其中分期:前期 12例,早期 6例,中期 3例,晚期 1例。
本研究通过昆明市第三人民医院医学伦理委员会审核批准。
1.2 设备、耗材及药品
1.2.1 设备:
日本可乐丽公司的人工肝治疗仪。
1.2.2 耗材:
单针的双腔导管、体外循环的血管通路、日本可乐丽公司生产的血液回路(KPE-89PE)、膜型血浆分离(EC-4A20)、珠海丽珠健帆公司生产的胆红素吸附器(BS330)及血液灌流器(HA330-Ⅱ)。
1.2.3 药品
用于置换的20%的人血白蛋白+复方氯化钠及同种异体同型血浆,预冲用的肝素钠,抗凝用的低分子肝素钙、抗过敏的地塞米松及盐酸异丙嗪,冲管用的葡萄糖及生理氯化钠等。
1.3 治疗方法
1.3.1 内科综合治疗
给予免疫抑制剂,保肝降酶的还原性谷胱甘肽及甘草酸制剂,促肝细胞生长因子,调节免疫药物胸腺肽,纠正低蛋白血症,补充凝血因子,保持大便通畅,抗感染,补充能量及维生素,维持水电解质平衡,预防消化道出血及并发症等综合内科治疗。
1.3.2 人工肝治疗方法
血浆置换(PE)联合双重血浆分子吸附( DPMAS)治疗:治疗前用肝素钠充分预冲血路管及血浆分离器,穿刺深静脉留置导管,术后连接可乐丽(日本)人工肝治疗仪。根据患者凝血功能给予低分子肝素钙抗凝,地塞米松预防过敏,置换液为同种异体血浆及白蛋白3 000 mL,治疗3~4 h;按照使用说明对健帆胆红素吸附器(BS330)以及血液灌流器(HA330-Ⅱ)进行提前预冲,使其充分肝素化,待选择性血浆置换术治疗结束时后,依次串联胆红素吸附柱及血液灌流器,根据患者的凝血功能、血小板,调整低分子肝素钙的剂量,总的置换量在7 000~8 000 mL,总治疗5~6 h。
1.4 观察指标
观察人工肝治疗前及治疗后细胞因子(IL-2、IL-4、IL-6、IL-10、TNF-α),肝功能及凝血功能:总胆红素(TBIL)、门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、凝血酶原活动度(PTA),总胆汁酸(TBA),血氨,血常规(HGB、PLT)等。
1.5 临床疗效判定[8-9]
显效:病情好转,各指标基本恢复正常;有效:病情缓解,各指标明显改善;无效:病情未改善或者加重,各指标无改善。
1.6 统计学处理
运用SPSS 21.0统计学软件进行数据分析处理,计量资料符合正态分布则采用均数±标准差(
$\bar x\pm s$ )表示,符合偏态分布的采用中位数±四分位数间距(M ± Q)表示;治疗前后相关指标的比较,正态分布数据采用配对t检验,偏态分布数据采用非参数检验(秩和检验);P < 0.05为差异有统计学意义。2. 结果
2.1 疗效
治疗后患者的皮肤及巩膜黄染、皮肤瘙痒、纳差、乏力、恶心、欲呕吐、腹胀、小便黄等症状有改善。其中,总有效率 = (显效 + 有效)/总例数×100%。显效 14例,占63.64%,有效 4例,占18.18%,无效 4例,总有效率81.82%,无死亡病例。
2.2 治疗前后细胞因子指标的比较
治疗后患者的细胞因子IL-2、IL-6、TNF-a水平下降,差异有统计学意义(P < 0.05);患者的IL-4、IL-10指标,差异无统计学意义(P > 0.05);(PE + DPMAS)治疗后见自身免疫性肝炎合并肝衰竭患者的IL-2、IL-6、TNF-a等细胞因子水平降低,见表1。
表 1 治疗前后细胞因子的比较[(M ± Q),pg/mL]Table 1. Comparison of cytokines before and after treatment [(M ± Q),pg/mL]组别 IL-2 IL-4 IL-6 IL-10 TNF-a 治疗前 3.44 ± 3.44 1.06 ± 1.60 31.61 ± 58.56 19.09 ± 24.21 7.05 ± 9.31 治疗后 1.73 ± 2.48 * 0.54 ± 0.90 15.27 ± 31.70* 19.36 ± 22.55 3.47 ± 6.16* 与治疗前比较,*P < 0.05。 2.3 治疗前后患者的肝功能、血氨、凝血功能、血常规、指标的比较
治疗前后观察患者在TBIL、AST、ALT、ALB、血氨、凝血酶原活动度(PTA)、血红蛋白(HGB)、血小板(PLT)等以上指标的比较,差异有统计学意义(P < 0.05);前后对比总胆汁酸(TBA),差异无统计学意义(P > 0.05),见表2、表3。
表 2 治疗前后肝功能的比较[($\bar x \pm s$ )/(M ± Q)]Table 2. Comparison of the liver function before and after treatment [($\bar x \pm s$ )/(M ± Q)]组别 TBIL(μmol/L) AST(U/L) ALT(U/L) TBA(μmol/L) ALB(g/L) 治疗前 388.58 ± 145.90 348.86 ± 299.80 253.86 ± 229.76 298.47 ± 118.77 28.73 ± 3.78 治疗后 180.28 ± 63.84* 125.82 ± 101.2* 111.18 ± 88.43* 278.04 ± 105.91 31.05 ± 2.33* 与治疗前比较,*P < 0.05。 表 3 治疗前后血氨、凝血酶原活动度、血常规的比较[($\bar x \pm s$ )/(M ± Q)]Table 3. Comparison of the blood routine,blood ammonia and prothrombin activity before and after treatment[($\bar x \pm s$ )/(M ± Q)]组别 血氨(μmol/L) PTA(%) HGB(g/L) PLT(×109/L) 治疗前 58.80 ± 34.24 37.14 ± 12.57 114.91 ± 24.99 153.45 ± 53.75 治疗后 30.85 ± 32.00* 56.77 ± 14.65* 103.23 ± 20.44* 137.00 ± 43.86* 与治疗前比较,*P < 0.05。 3. 讨论
自身免疫性肝炎(autoimmune hepatitis,AIH)在药物治疗的选择上常选用免疫抑制剂,如果失治或者延误可能进一步发展为肝衰竭。自身免疫性肝衰竭的发生率为2%~8%[3]。肝衰竭是肝细胞变性坏死,肝脏的功能下降,其解毒的功能降低,致使体内的内毒素产物产生,从而抑制了肝细胞的再生能力,并发症多,病死率高,是常见的危急重症[10]。目前内科对症治疗的基础上联合非生物性人工肝系统治疗[9]是多种疾病合并肝衰竭的首选治疗,选择性血浆置换术联合双重血浆分子吸附术(PE + DPMAS)为近年来新发展的组合治疗模式之一。血浆置换术(PE)是将患者全血中的血浆用模型血浆分离的方法丢弃,补充20%的人血白蛋白和同种异体血浆进行等量置换,以降低血清胆红素及转氨酶水平,改善凝血功能,补充蛋白,血氨的清除水平有限[11-13];双重血浆分子吸附(DPMAS)采用离子交换树脂(BS330)和中性大孔吸附树脂(HA330-Ⅱ)两种吸附剂,能高效吸附总胆红素的水平,清除胆汁酸、血氨、内毒素、炎症介质及多种细胞因子,缺点是不可以改善凝血功能,不能补充白蛋白等生物活性因子[14-15]。选择性血浆置换术联合双重血浆分子吸附(PE+DPMAS):高效的清除患者的总胆红素、血氨及内毒素的水平,降低多种细胞因子,减轻炎性反应综合征,稳定患者的内环境,补充患者的凝血因子和白蛋白,肝功能恢复,为肝细胞再生创造机会,改善皮肤虹膜黄染、小便黄的黄疸症状,进一步提高肝衰竭患者救治的成功率。
关于发病机制,研究指出“内毒素-巨噬细胞-细胞因子风暴”[16-17]是肝衰竭核心机制。肝衰竭时内毒素刺激机体,促使成纤维细胞、单核-巨噬性细胞及肝细胞合成大量的TNF-α,当疾病恶化时体内的TNF-α水平升高,肝细胞发生凋亡、坏死,诱导IL-6、IL-2、IL-8等多种细胞因子产生[18-19]。IL-6对机体有免疫调节、代谢的作用,由单核-巨噬细胞、淋巴细胞等产生[18],反映患者肝衰竭时病情进展的严重性、肝细胞的坏死程度[19]。IL-10在急慢性肝炎中,拮抗促炎症因子,有负向的免疫调节的作用,它与总胆红素有着负相关性,IL-10的升高对肝脏的损伤起着一定的保护作用[20]。研究发现TNF-α、IFN-γ、IL-1、IL-6等与肝衰竭关系密切[21]。综上所述,多种细胞因子是肝细胞变性坏死的关键性因素,肝脏细胞的再生创造能力在肝衰竭时可被产生的细胞因子所抑制,而研究也指出免疫性的、缺血缺氧性的损伤及内毒素血症等是肝衰竭的主要因素[3]。肝脏细胞的坏死及凋亡时TNF-α水平升高,此时IL-6、IL-2、IL-8等多种细胞因子便产生,参与机体的免疫调节、炎症、代谢等作用。故在肝衰竭病变中TNF-α、IFN-γ、IL-1、IL-2、IL-6、IL-8等细胞因子升高,反映了疾病的进展的严重程度,肝细胞坏死的程度,IL-10水平升高对肝损伤起保护作用。
本研究通过观察22例采用非生物型人工肝结合内科综合对症治疗自身免疫性肝炎合并肝衰竭患者的临床研究,观察发现多数治疗的次数在2~3次,频率在2~3次/周,总有效率为81.82%,无效率18.18%,2例肝移植,无死亡病例。观察治疗前后患者的细胞因子(TNF-a、IL-2、IL-4、IL-6、IL-10)、肝功能、凝血功能、血氨、血小板、血红蛋白等指标的变化。研究结果显示:经治疗后此类患者的细胞因子IL-2、IL-6、TNF-a等指标显著下降,总胆红素、转氨酶及血氨水平下降,凝血功能改善,白蛋白升高,差异有统计学意义(P < 0.05),与相关报道一致[22]。患者的总胆汁酸在短期内下降不明显,有待研究;患者血小板与血红蛋白治疗后有所下降,考虑与治疗过程中人工肝治疗仪的机械损伤及吸附材料对血小板的吸附等因素有关。IL-4、IL-10前后,差异无统计学意义(P > 0.05),有待进一步收集样本资料观察研究。
综上所述,应用选择性血浆置换联合双重血浆分子吸附治疗自身免疫性肝炎合并肝衰竭患者,能稳定内环境,为肝细胞的再生能力创造条件,恢复肝功能,改善黄疸等临床症状,提高患者的生存率,肝衰竭的救治成功率也得到了提高,值得推广。本研究对细胞因子的观察,对自身免疫性肝炎合并肝衰竭患者免疫的损伤、肝脏损伤的程度、疾病的预后判断等有重要意义。
-
表 1 治疗前后细胞因子的比较[(M ± Q),pg/mL]
Table 1. Comparison of cytokines before and after treatment [(M ± Q),pg/mL]
组别 IL-2 IL-4 IL-6 IL-10 TNF-a 治疗前 3.44 ± 3.44 1.06 ± 1.60 31.61 ± 58.56 19.09 ± 24.21 7.05 ± 9.31 治疗后 1.73 ± 2.48 * 0.54 ± 0.90 15.27 ± 31.70* 19.36 ± 22.55 3.47 ± 6.16* 与治疗前比较,*P < 0.05。 表 2 治疗前后肝功能的比较[(
$\bar x \pm s$ )/(M ± Q)]Table 2. Comparison of the liver function before and after treatment [(
$\bar x \pm s$ )/(M ± Q)]组别 TBIL(μmol/L) AST(U/L) ALT(U/L) TBA(μmol/L) ALB(g/L) 治疗前 388.58 ± 145.90 348.86 ± 299.80 253.86 ± 229.76 298.47 ± 118.77 28.73 ± 3.78 治疗后 180.28 ± 63.84* 125.82 ± 101.2* 111.18 ± 88.43* 278.04 ± 105.91 31.05 ± 2.33* 与治疗前比较,*P < 0.05。 表 3 治疗前后血氨、凝血酶原活动度、血常规的比较[(
$\bar x \pm s$ )/(M ± Q)]Table 3. Comparison of the blood routine,blood ammonia and prothrombin activity before and after treatment[(
$\bar x \pm s$ )/(M ± Q)]组别 血氨(μmol/L) PTA(%) HGB(g/L) PLT(×109/L) 治疗前 58.80 ± 34.24 37.14 ± 12.57 114.91 ± 24.99 153.45 ± 53.75 治疗后 30.85 ± 32.00* 56.77 ± 14.65* 103.23 ± 20.44* 137.00 ± 43.86* 与治疗前比较,*P < 0.05。 -
[1] 王绮夏,蒋翔,连敏,等. 2015年欧洲肝病学会临床实践指南:自身免疫性肝炎[J]. 临床肝胆病杂志,2015,31(12):2000-2019. doi: 10.3969/j.issn.1001-5256.2015.12.006 [2] 沈含章,张乐. 自身免疫性肝炎及其中西医结合治疗的研究进展[J]. 上海医药,2019,40(5):6-9,70. doi: 10.3969/j.issn.1006-1533.2019.05.003 [3] Latif N,Mehmood K. Risk factor for fulminant hepatic failure and their relation with outcome in children[J]. J Pak Med Assoc,2010,60(3):175-178. [4] Yokokawa J,Saito H,Kanno Y,et al. Overlap of primary biliary cirrhosis and autoimmune hepatitis:Characteristics,therapy,and long term outcomes[J]. J Gastroenterol Hepatol,2010,25(2):376-382. doi: 10.1111/j.1440-1746.2009.06018.x [5] 邹龙,刘洪,马霖杰. 非生物型人工肝的治疗新进展[J]. 中国普外基础与临床杂志,2017,24(5):634-637. [6] 中华医学会感染病学分会肝衰竭与人工肝学组. 非生物型人工肝支持系统治疗肝衰竭指南(2016年版)[J]. 中华临床感染病杂志,2016,9(2):97-101. doi: 10.3760/cma.j.issn.1674-2397.2016.02.001 [7] Goral V,Atayan,Kaplan A. The relation between pathogenesis of liver cirrhosis,hepatic encephalopathy and serum cytokine levels:What is the role of tumor necrosis factor α[J]. Hepatogastroenterology,2011,58(107-108):943-948. [8] 自身免疫性肝炎诊断和治疗共识(2015),中华医学会肝病学分会,中华医学会消化病学分会,中华医学会感染病学分会. 自身免疫性肝炎诊断和治疗共识(2015年版)[J]. 临床肝胆病杂志,2016,32(1):9-21. doi: 10.3969/j.issn.1001-5256.2016.01.002 [9] 中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊疗指南(2012年版)[J]. 中华肝脏病杂志,2013,21(3):177-183. doi: 10.3760/cma.j.issn.1007-3418.2013.03.006 [10] KR Awitt. Autoimmune hepatitis[J]. N Engl J Med,2006,354(1):54-66. doi: 10.1056/NEJMra050408 [11] 张乐,岳云璇,夏加伟,等. 非生物型人工肝治疗肝衰竭的疗效评价[J]. 昆明医科大学学报,2017,38(1):82-87. doi: 10.3969/j.issn.1003-4706.2017.01.017 [12] 李守娟,王丽,胡朝霞,等. 人工肝联合凉血解毒化瘀方治疗重型乙肝疗效观察[J]. 湖南中医药大学学报,2016,36(6):20-23. doi: 10.3969/j.issn.1674-070X.2016.06.006 [13] 王云,戚应杰,岳莉,等. 人工肝血浆置换与胆红素吸附联合治疗重症肝炎后患者肝功能及HBV-DNA水平变化[J]. 检验医学与临床,2017,14(5):643-645. doi: 10.3969/j.issn.1672-9455.2017.05.016 [14] Bjursten LM,Rasmusson L,Oh S,et al. Titanium dioxide nanotubes enhance bone bonding in vivo[J]. J Biomed Mater Res A,2010,92(3):1218-1224. [15] 雷鹏,段军民,李淑森,等. 血浆置换联合胆红素吸附治疗重型肝炎的疗效观察[J]. 中国现代药物应用,2016,10(20):52-53. [16] Chastre A,Bélanger M,Beauchesne E,et al. Inflammatory cascades driven by tumor necrosis factor-alpha play a major role in the progression of acute liver failure and its neurological complications[J]. PloS One,2012,7(11):e49670. doi: 10.1371/journal.pone.0049670 [17] 陈智. 肝衰竭发生与发展过程中的免疫机制研究进展[J]. 中华肝脏病杂志,2012,20(10):733-736. doi: 10.3760/cma.j.issn.1007-3418.2012.010.005 [18] 李昌明,肖青,韩建魁. 白细胞介素6临床应用进展[J]. 中国误诊学杂志,2007,7(1):30-32. doi: 10.3969/j.issn.1009-6647.2007.01.012 [19] Lai H S,Lin W H,Lai S L,et al. Interleukin-6 mediates angiotensinogen gene expression during liver regeneration[J]. Plo S One,2013,8(7):e67868. doi: 10.1371/journal.pone.0067868 [20] Naveau S,Balian A,Capron F,et a1. Balance between pro and anti-inflammatory cytokines in patients with acute alcoholic hepatitis[J]. Gastroentero1 Clin Biol,2005,29(3):269-274. doi: 10.1016/S0399-8320(05)80760-2 [21] Henning W,Zimmermann,Christian Trautwein,et al. Functional role of monocytes and macrophages for the inflammatory response in acute liver injury[J]. Gastrointestinal Sciences,2012,3(56):103389. [22] 张泽敏,黄仕艺,于兰芳,等. 人工肝血浆置换联合胆红素吸附治疗对重症肝炎患者炎症因子的影响[J]. 中华医院感染学杂志,2014,24(8):1830-1832. -






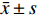
 下载:
下载:
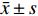
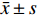
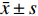

 下载:
下载: 
