Effects of Different Doses of Gastrodin on Conditioned Place Preference and Microglia Activation in Hippocampus of Methamphetamine Dependent Rats
-
摘要:
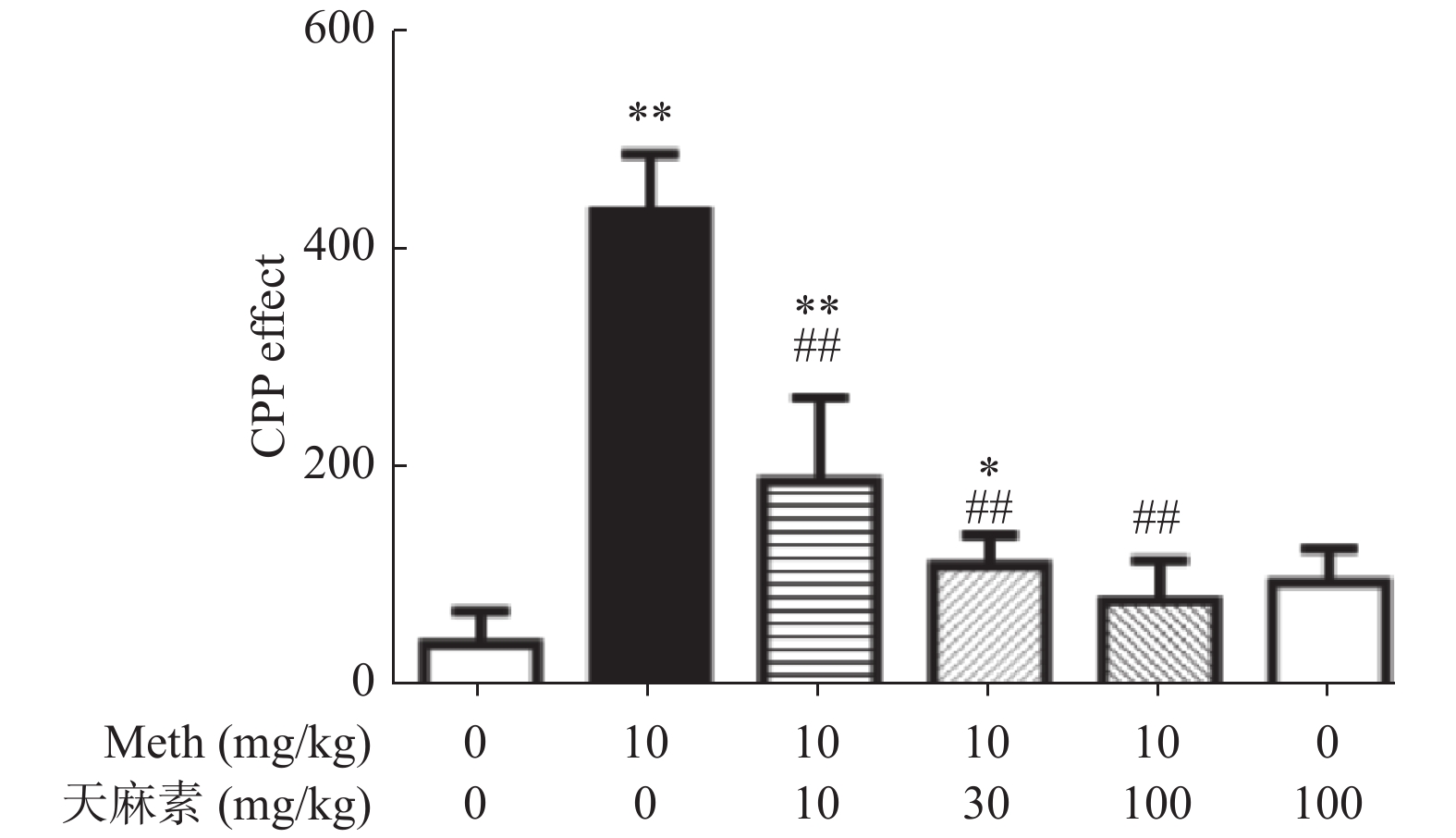
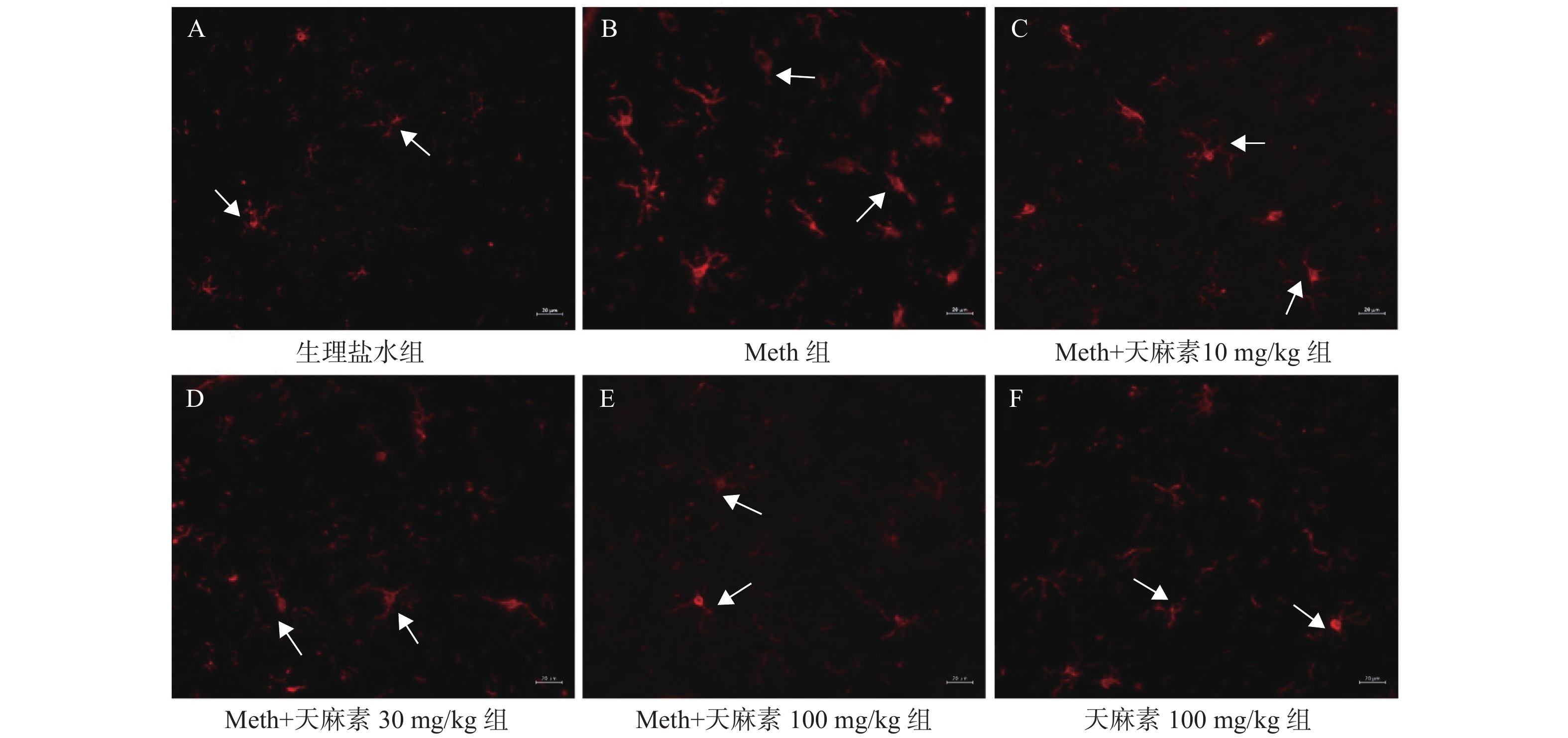
目的 研究不同剂量天麻素(gastrodin,Gas)对甲基苯丙胺(methamphetamine,Meth)依赖大鼠条件性位置偏爱(conditioned place preference,CPP)的影响及海马小胶质细胞激活状态的改变。 方法 腹腔注射Meth(10 mg/kg,qd,14 d)建立Meth依赖大鼠CPP模型,然后采用10 mg/kg、30 mg/kg、100 mg/kg不同剂量的天麻素治疗14 d,测定不同剂量天麻素对Meth依赖大鼠CPP效应的影响;用免疫荧光技术检测不同剂量天麻素对海马小胶质细胞激活的影响。 结果 Meth依赖大鼠CPP模型建立成功。与生理盐水组相比,Meth组的CPP效应明显增强,差异有统计学意义(P < 0.05);天麻素治疗可使大鼠在伴药箱停留时间明显缩短;与Meth组相比,10 mg/kg、30 mg/kg、100 mg/kg的天麻素治疗后,可呈剂量依赖性地降低Meth诱导的CPP效应,且100 mg/kg的天麻素可基本消除Meth诱导的CPP效应。免疫荧光检测结果显示,与生理盐水组相比,Meth组大鼠海马小胶质细胞明显被激活;经10 mg/kg、30 mg/kg、100 mg/kg的天麻素治疗后,小胶质细胞激活被明显抑制,且30 mg/kg、100 mg/kg两组剂量的天麻素治疗后抑制效果更明显。 结论 天麻素可呈剂量依赖性降低Meth依赖大鼠的CPP效应,天麻素对Meth成瘾具有改善作用。不同剂量的天麻素可抑制Meth依赖CPP大鼠海马组织小胶质细胞的激活状态。 Abstract:Objective To study the effects of different dosages of gastrodin on conditioned place preference and hippocampal microglia activation in methamphetamine (Meth)-dependent rats. Methods Meth dependent CPP model was established by intraperitoneal injection of meth (10 mg/kg, QD, 14 d) and then gastrodin (10 mg/kg, 30 mg/kg, 100 mg/kg) was used for 14 d to determine the effect of gastrodin on CPP in meth dependent rats. After that, the immunofluorescence technique was used to detect the effect of different doses of gastrodin on the activation of microglia in hippocampus. Results The Meth-dependent rat CPP model was successfully established. Gastrodin treatment could shorten the time of the rats stayed in the drug-paired chamber. Compared with the saline group, the CPP effect of the Meth group was significantly enhanced, and the difference was statistically significant (P < 0.05). Compared with Meth group, 10 mg/kg, 30 mg/kg, and 100 mg/kg gastrodin treated groups showed a dose-dependent reduction of Meth-induced CPP effect, and 100 mg/kg of gastrodin could basically eliminate the CPP effect induced by Meth. The results of immunofluorescence showed that, compared with the normal saline group, the hippocampal microglia of the Meth group was significantly activated. After the treatment with 10 mg/kg, 30 mg/kg, or 100 mg/kg gastrodin, the microglia cell activation was inhibited by gastrodin, and the performance was more obvious after the treatment with 30 mg/kg and 100 mg/kg gastrodin. Conclusion Gastrodin can reduce the CPP effect of Meth-dependent rat in a dose-dependent manner; gastrodin has a potential effect on methamphetamine dependence. Gastrodin can inhibit the activation of hippocampal microglia in hippocampus region of Meth-dependent rat. -
Key words:
- Methamphetamine (Meth) /
- Gastrodin /
- Conditional position preference (CPP) /
- Hippocampus /
- Microglia
-
呼吸道感染好发于小儿人群中,80.0%患者由于病毒感染引起,亦可由细菌、非典型病原体及真菌引起[1-2]。相关研究表明[3-4]:呼吸道感染多发生在冬春季节,多为散发,能在气候突变时引起小规模流行。主要是由于患儿免疫力及抵抗力相对较差引起,且学龄前儿童每年呼吸道感染次数为4~8次,严重影响我国患儿健康与成长[5]。司序研究表明[6]:每年由于呼吸道感染致死的儿童占死亡儿童的20.0%左右,且常见的呼吸道感染病毒包括:鼻病毒、呼吸道合胞病毒、腺病毒、副流感病毒(parainfluenza virus,PIV)、甲型流感、乙型流感等,且不同地区、年龄及季节存在明显的差异性。李雅清等[7]研究表明:非典型病原体是呼吸道感染病原谱中重要组成部分,且最新研究显示,肺炎支原体(mycoplasma pneumoniae,MP)在呼吸道感染患儿中阳性检出率呈增高趋势,部分患儿伴有细菌感染,是呼吸道感染病情加重、病程迁延的独立危险因素。由于不同病原呼吸道感染患儿临床表现缺乏特异性,根据医院病原学数据,了解不同病原体的流行特点,能为临床制定相应的防治措施提供参考依据[8-9]。本研究以安宁地区住院患儿为研究对象,探讨安宁地区住院患儿呼吸道感染病毒病毒病原体阳性检测结果分析,报道如下。
1. 资料与方法
1.1 临床资料
选择2019年9月至2022年2月安宁地区住院患儿1766例为对象,根据年龄分为 < 6月龄组、6月龄~4岁组、4~14岁组;根据新冠疫情防控,2019年9月至2020年2月前为公众防护前,2020年2月后公众防护后;诊断标准[10-11]:(1)急性感染症状之一,发热或体温降低,白细胞计数升高或降低;(2)呼吸道感染症状之一,咽痛、咳嗽、喘息、气短。纳入标准:(1)符合呼吸道感染疾病诊断标准[12-13];(2)均积极配合完成呼吸道病毒病原学检测;(3)患儿以发热、咳嗽、喘息、咽痛等呼吸道感染症状入院。排除标准:(1)既往有器质性基础性疾病;(2)因其他原因住院或未能完成治疗、检测者。根据年龄分为 < 6月龄组、6月龄~4岁组、4~14岁组;2019年9年至2020年2月患儿370例,其中,男189例,女181例,年龄(0~14)岁,平均(2.98±1.31)岁;病程(2~6)d,平均(3.15±0.73)d;2020年9月至2021年2月患儿389例,其中,男231例,女158例,年龄(0~13.6)岁,平均(3.05±1.35)岁;病程(2~7)d,平均(3.21±0.76)d;2021年9月至2022年2月患儿1007例,其中,男508例,女499例,年龄(0~14)岁,平均(3.09±1.41)岁;病程(2~8)d,平均(3.25±0.79)d。不同时间段患儿临床资料比较差异无统计意义(P > 0.05),具有可比性。本实验经安宁市第一人民医院伦理委员会批准下执行。
1.2 研究方法
1.2.1 标本采集及处理
所有患儿均采用鼻咽拭子采集鼻咽部脱落细胞,并将采集标本的棉签放置试管中,灌入2~3 mL生理盐水,立即送检备用,如不能立即送检,放入4°冰箱冷藏并在24 h内检测[14-15]。
1.2.2 检测方法
采用直接免疫荧光法,将荧光素标记在7种呼吸道病毒抗体上,直接与相应的病毒抗原进行特异性反应,在荧光显微镜下观察[16-17]。统计分析患儿的一般情况。
1.3 统计学处理
采用SPSS24.0软件处理,计数资料行χ2检验,采用n(%)表示,计量资料行t检验,采用(
$\bar x \pm s $ )表示,P < 0.05为差异有统计学意义。2. 结果
2.1 安宁地区住院患儿不同时间段呼吸道病原体检出阳性率比较
安宁地区住院患儿1 766例,均完成鼻咽拭子标本采集,并完成呼吸道病毒病原学检测,结果表明:入组患儿阳性584例,检出阳性率为33.07%。呼吸道病毒病原体中检出主要以呼吸道合胞病毒、腺病毒、副流感病毒Ⅲ型为主,分别为316例、90例、82例,检出阳性率分别为17.89%、5.10%、4.64%,见表1。
表 1 安宁地区住院患儿不同时间段呼吸道病原体检出阳性率比较[n(%)]Table 1. Comparison of positive rate of respiratory pathogens detected in hospitalized children at different time periods in Anning Area [n(%)]时间 样本数
(n)阳性数 甲型流感
病毒抗原乙型流感
病毒抗原呼吸道合胞
病毒抗原腺病毒
抗原副流感病毒
Ⅰ型抗原副流感病毒
Ⅱ型抗原副流感病毒
Ⅲ型抗原2019.9~2020.2 370 95(25.68) 22(5.95) 5(1.35) 52(14.05) 9(2.43) 2(0.54) 0(0.00) 5(1.35) 2020.9~2021.2 389 112(28.79) 0(0.00) 0(0.00) 84(21.59) 4(1.03) 4(1.03) 2(0.51) 18(4.63) 2021.9~2022.2 1007 377(37.44) 4(0.40) 48(4.77) 180(17.87) 77(7.65) 8(0.79) 1(0.10) 59(5.86) 2.2 防护前不同年龄段患儿呼吸道病原体七联检阳性率比较
安宁地区住院患儿呼吸道病毒病原体阳性率主要集中在 < 6月龄组,6月龄~4岁组,分别占总阳性率111(34.69%)和327(34.31%),不同年龄段呼吸道病毒病原体检出阳性率具有统计意义(χ2 = 8.392,P = 0.031),见表2。
表 2 防护前不同年龄段患儿呼吸道病原体检出阳性率比较[n(%)]Table 2. Comparison of positive rates of respiratory pathogens detected in children of different ages before protection [n(%)]年龄段 样本数
(n)阳性数 甲型流感
病毒抗原乙型流感
病毒抗原呼吸道合胞
病毒抗原腺病毒
抗原副流感病毒
Ⅰ型抗原副流感病毒
Ⅱ型抗原副流感病毒
Ⅲ型抗原< 6月龄组 320 111(34.69) 4(3.60) 4(3.60) 86(77..48) 4(1.25) 4(3.60) 1(0.90) 8(7.21) 6月龄~4岁组 953 327(34.31) 9(2.75) 12(3.67) 194(59.32) 46(14.07) 7(2.14) 1(0.31) 58(17.74) 4~14岁组 493 146(29.61) 13(8.90) 37(25.34) 37(7.51) 40(27.40) 3(2.05) 1(0.68) 15(10.27) χ2 − 8.392 4.291 3.868 7.513 5.325 1.092 0.000 1.015 P − 0.031* 0.046* 0.049* 0.031* 0.036* 0.743 1.000 0.193 *P < 0.05。 2.3 公众防护前与公众防护后原体七联检阳性率比较
公众防护前甲型流感病毒阳性率为5.95%;呼吸道合胞病毒阳性率为14.05%;而公众防护后甲型流感病毒阳性率为0.29%;呼吸道合胞病毒阳性率为18.91%;公众防护前后乙型流感病毒抗原、腺病毒抗原、副流感病毒Ⅰ型、副流感病毒Ⅱ型、副流感病毒Ⅱ型检出率差异无统计意义(P > 0.05),见表3。
表 3 公众防护前与公众防护后呼吸道病原体检出阳性率比较[n(%)]Table 3. Comparison of positive rate of respiratory pathogens detected before and after public protection [n(%)]时间段 样本数
(n)阳性数 甲型流感
病毒抗原乙型流感
病毒抗原呼吸道合胞
病毒抗原腺病毒
抗原副流感病毒
Ⅰ型抗原副流感病毒
Ⅱ型抗原副流感病毒
Ⅲ型抗原公众防护前 370 95(25.67) 22(5.95) 5(1.35) 52(14.05) 9(2.43) 2(0.54) 0(0.00) 5(1.35) 公众防护后 1396 489(35.02) 4(0.29) 48(3.44) 264(18.91) 81(5.80) 12(0.86) 3(0.21) 77(5.52) χ2 − 27.149 74.143 1.494 16.103 16.919 0.927 1.124 20.835 P − 0.001* 0.001* 0.222 0.001* 0.181 0.336 0.289 0.231 *P < 0.05。 3. 讨论
呼吸道感染属于是一种全球性、持续性的公共卫生问题,好发于儿童人群中,主要由于患儿年龄相对较小,身体器官尚未完全发育,导致病毒抵抗力相对较差[18-20]。武迪研究表明[21]:病毒是引起呼吸道感染的重要病原体,且全球每年约有儿童57万死于呼吸道感染,由于多数儿童感染病毒后,缺乏特异性临床表现,单一的症状难以实现病原学的鉴别,再加上病毒传播速度相对较快并不断演化,均会增加临床甄别难度。本研究中,入组患儿呼吸道感染病毒检测阳性584例,阳性率为33.07%。呼吸道病毒病原体检出主要以呼吸道合胞病毒、腺病毒、副流感病毒III型为主,分别为316例、90例、82例;从本研究结果看出,安宁地区住院患儿呼吸道病毒病原体检出阳性率较高,且以呼吸道合胞病毒、腺病毒、副流感病毒III型为主。因此,加强儿童呼吸道感染病毒病原学检测,明确呼吸道感染病原对早期诊断、合理治疗及降低静脉输液及抗生素使用具有重要意义[22-23]。
目前,临床上对于呼吸道病毒的测定方法包括:病毒的分离培养、间接、直接免疫荧光法等[24-25]。病毒分离培养属于传统的测定方法,并将其视为“金标准”,临床使用时常需要结合流行病学季节、临床特征等推测。但是该方法检查所需时间较长,难以实现大样本的鉴别与测定[26-27]。而间接免疫荧光法能同时实现多种类型病毒的测定及筛查,但是该方法敏感度较低,测定过程中受到的干扰相对较多。因此,本研究中以直接免疫荧光法完成呼吸道病毒的测定,并完成患儿年龄与季节的分组,结果表明:安宁地区住院患儿呼吸道感染病毒病原体阳性主要集中在 < 6月龄组、6月龄~4岁组,检出阳性率分别为34.69%、34.31%,不同年龄段呼吸道病毒病原体检出阳性率具有统计意义(χ2 = 8.392,P = 0.031);从本研究结果看出,安宁地区住院患儿呼吸道病毒病原体阳性与年龄存在紧密的联系。主要是由于患儿年龄小,部分患儿断奶后丧失母体的保护性抗体保护作用,再加上儿童免疫系统发育不完全、免疫功能较低有关,接触的人群与生活环境相对复杂,再加上户外活动增多等,均会增加呼吸道病原体检出率[28-29]。本研究中,公众防护前甲型流感病毒阳性率、呼吸道合胞病毒阳性率分别为5.95%、14.05%,公众防护后分别为0.29%、18.91% ,公众防控后甲型流感病毒阳性率得到明显降低,可能与新冠肺炎防控期间大众戴口罩、洗手、减少集聚等有关,甲型流感为丙类传染病,对患儿危害较大,有传播流行趋势,因此,坚持公众戴口罩、洗手、减少集聚等公众防护措施对甲型流感预防有重要意义。临床上应根据安宁地区呼吸道病毒感染的年龄、发病季节等,采取相应的措施预防、干预,对于不适患儿应尽早就医,做好相应的防护措施,避免流行性爆发,促进患儿早期恢复[30]。
综上所述,坚持公众戴口罩、洗手、减少集聚等公众防护对甲型流感预防有重要意义,安宁地区住院患儿呼吸道病毒病原体阳性率较高,加强儿童呼吸道感染病毒病原学检测,明确呼吸道感染病原对早期诊断、合理治疗具有重要意义。
-
表 1 各组大鼠在伴药箱的停留时间[n = 6,(
$ \bar x \pm s$ )]Table 1. The time of each group of rats in the drug-paired chamber [n = 6,(
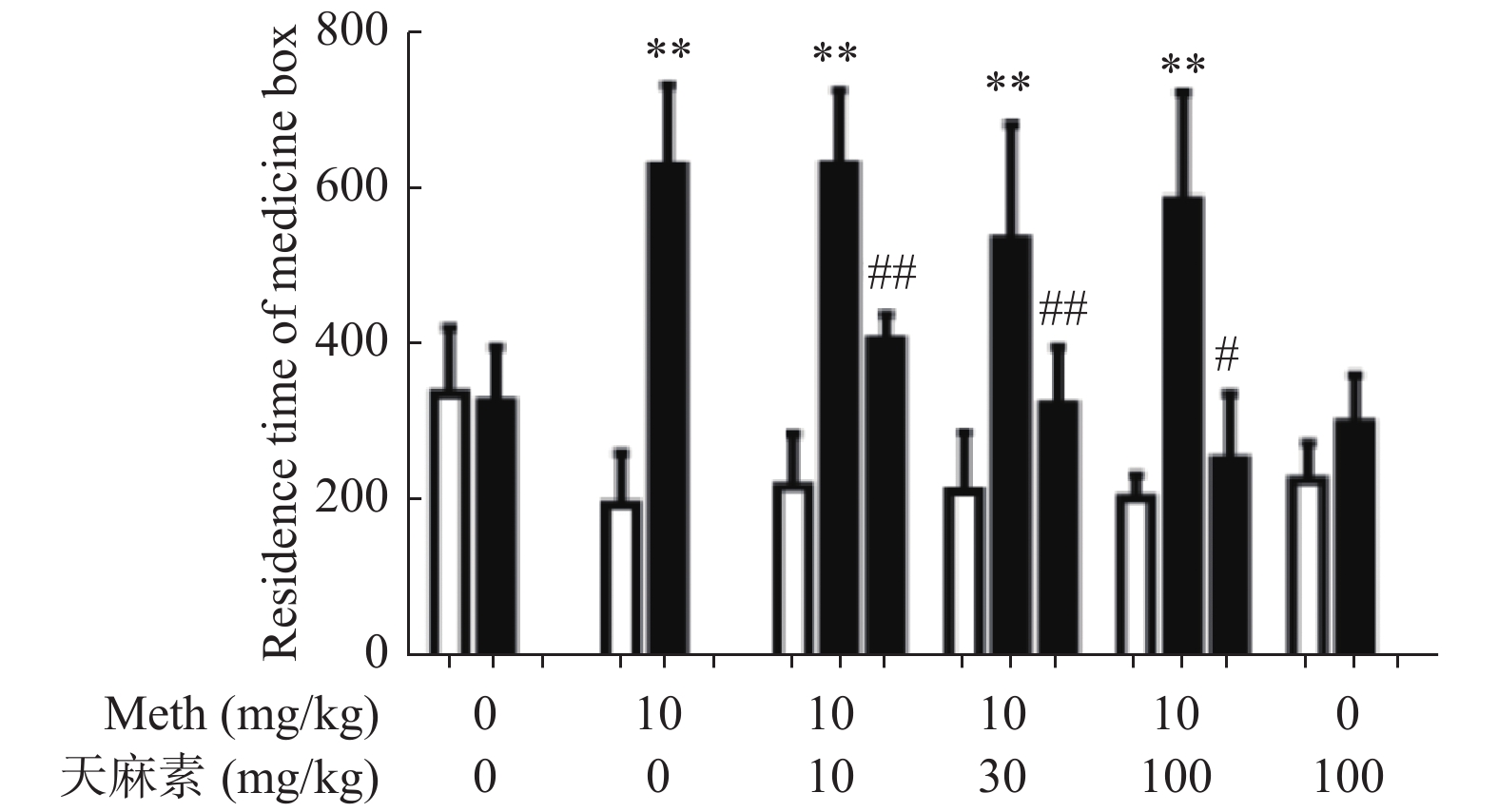
$ \bar x \pm s$ )]组别 适应期(s) 训练期(s) 治疗期(s) t/F P 生理盐水组 336.9 ± 85.2 327.9 ± 69.5 − 1.5 0.7 Meth组 194.7 ± 66.9 629.8 ± 103.2** − 20.3 < 0.01 天麻素100 mg/kg组 226.1± 48.2 299.9 ± 61.1 − 2.5 0.06 Meth+天麻素10 mg/kg组 218.2 ± 67.8 630.9 ± 95.7** 406.1 ± 33.7## 51.5 < 0.01 Meth+天麻素30 mg/kg组 212.2 ± 76.3 535.2 ± 148.3** 322.9 ± 74.5## 14.5 < 0.01 Meth+天麻素100 mg/kg组 203.3 ± 29.5 585.6 ± 138.6*** 253.3 ± 84.2# 28.6 < 0.01 与适应期比较,*P < 0.05、**P < 0.01、***P < 0.001;与训练期比较,#P < 0.05、##P < 0.01。 表 2 各组大鼠给药前后在伴药箱停留时间的差值[n = 6,(
$ \bar x \pm s$ )]Table 2. Comparison of the difference of times that the rat stayed in the drug-paired chamber before and after Meth administration [n = 6,(
$\bar x \pm s$ )]分组 伴药箱停留时间的差值(s) 生理盐水组 38.9 ± 29.5 Meth组 435.1 ± 52.6** 天麻素100 mg/kg组 94.6 ± 31.2 Meth + 天麻素10 mg/kg组 187.9 ± 76.5**## Meth + 天麻素30 mg/kg组 110.7 ± 27.3*## Meth + 天麻素100 mg/kg组 78.1 ± 36.4## F 59.9 P < 0.01 与生理盐水组比较,*P < 0.05、**P < 0.01;与Meth组比较,#P < 0.05、##P < 0.01。 -
[1] Mizoguchi H,Yamada K. Methamphetamine use causes cognitive impairment and altered decision-making[J]. Neurochemistry International,2019,12(4):106-113. [2] Papageorgiou M,Raza A,Fraser S,et al. Methamphetamine and its immune modulating effects[J]. Maturitas,2018,8(3):45-52. [3] Xue Y,Yong W,Li Q Y,et al. The main molecular mechanisms underlying methamphetamine-induced neurotoxicity and implications for pharmacological treatment[J]. Frontiers in Molecular Neuroscience,2018,11(6):186-192. [4] Shaerzadeh F,Streit W J,Heysieattalab S,et al. Methamphetamine neurotoxicity,microglia,and neuroinflammation[J]. Journal of Neuroinflammation,2018,15(1):34-39. doi: 10.1186/s12974-018-1072-1 [5] Wang Z Y,Guo L,Han X,et al. Naltrexone attenuates methamphetamine induced behavioral sensitization and conditioned place preference in mice[J]. Behavioral Brain Research,2020,6(1):45-51. [6] Zhao Z L,Kim Y W,Yang Y P,et al. Glycyrrhizae radix methanol extract attenuates methamphetamine-induced locomotor sensitization and conditioned place preference[J]. Evidence-based Complementary & Alternative Medicine(eCAM),2014,11(3):152-157. [7] Yang G M,Li L,Xue F L,et al. The potential role of PKA/CREB signaling pathwaycon-cerned with gastrodin administration on methamphetamine-induced conditioned place preference rats and SH-SY5Y Cell line[J]. Neurotoxicity Research,2020,7(12):1-10. [8] Ma C L,Li L,Yang G M,et al. Neuroprotective effect of gastrodin in methamphetamine induced apoptosis through regulating cAMP/PKA/CREB pathway in cortical neuron[J]. Human & Experimental Toxicology,2020,39(8):1118-1129. [9] 黄兆奎,石振金,吴亚梅,等. 甲基苯丙胺不同给药时程及天麻素的干预对建立大鼠条件性位置偏爱模型的影响[J]. 昆明医科大学学报,2019,40(3):1-5. doi: 10.3969/j.issn.1003-4706.2019.03.001 [10] Andoh M,Ikegaya Y,Koyama R,et al. Microglia modulate the structure and function of the hippocampus after early-life seizures[J]. Journal of Pharmacolo -gical Sciences,2020,144(4):212-217. doi: 10.1016/j.jphs.2020.09.003 [11] Wolf S A,Boddeke H W,Kettenmann H,et al. Microglia in physiology and disease[J]. Annual Review of Physiology,2017,7(9):619-643. [12] Chao J,Zhang Y,Du L,et al. Molecular mechanisms underlying the involvement of the sigma-1 receptor in methamphetamine-mediated microglial polarization[J]. Sci Rep,2017,7(1):115-121. doi: 10.1038/s41598-017-00091-1 [13] Yang T,Zang S,Wang Y,et al. Methamphetamine induced neuroinflammation in mouse brain and microglial cell line BV2:Roles of the TLR4/TRIF/Peli1 signaling axis[J]. Toxicology Letters,2020,9(3):150-158. [14] Sekine Y,Ouchi Y,Sugihara G,et al. Methamphetamine causes microglial activation in the brains of human abusers[J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience,2008,28(22):5756-5761. doi: 10.1523/JNEUROSCI.1179-08.2008 -







 下载:
下载:


 下载:
下载: