Changes of c-Fos Protein and Structural Plasticity in Nucleus Accumbens of Mice after Ultrasound Stimulation
-
摘要:
目的 通过对超声刺激小鼠伏隔核(NAc)后c-Fos蛋白及结构可塑性的检测,观察超声刺激脑区后神经元激活和结构改变情况,初步探讨超声进行神经调控的机制。 方法 将C57 BL/6小鼠随机分为超声刺激组12只,假刺激组6只。超声刺激组使用低强度聚焦超声以固定参数刺激小鼠NAc区,连续刺激7 d后行NAc区免疫组化测定c-Fos蛋白表达、电镜下观察神经元结构可塑性改变情况;假刺激组同样以超声刺激探头照射,不开机无输出功率。 结果 超声刺激后NAc区神经元c-Fos的表达比例显著提高,差异有统计学意义(P < 0.001)。电镜下发现超声刺激组树突棘分布稀疏,数量显著减少,形态呈蘑菇型或矮树桩样,与假刺激组相比,超声刺激后树突棘密度显著降低,差异有统计学意义(P < 0.0001),树突长度显著缩短,差异有统计学意义(P < 0.0001)。 结论 低强度聚焦超声可显著激活NAc脑区神经元,同时可抑制性调节神经元的结构可塑性,这证明了超声刺激具备干预与治疗脑疾病的潜能。 Abstract:Objective To observe the neuronal activation and structural changes after the stimulation of the nucleus accumbens (NAc) in mice by detecting c-Fos protein and structural plasticity, and to preliminally explore the mechanism of neural regulation by ultrasound. Methods C57 BL/6 mice were randomly divided into ultrasonic stimulation group (n = 12) and sham stimulation group (n = 6). In the ultrasound stimulation group, low intensity focused ultrasound was used to stimulate the NAc region of mice with fixed parameters. After 7 days of continuous stimulation, the expression of c-Fos protein in the NAC region was determined by immunohistochemistry, and the changes of neuronal plasticity were observed by electron microscopy. The sham stimulation group was also irradiated with ultrasonic stimulation probe, and no output power was obtained without turning on the machine. Results All mice successfully completed the whole process of ultrasonic stimulation. The expression ratio of c-fos in NAC neurons was significantly increased after ultrasound stimulation (P < 0.001). Under electron microscope, it was found that the distribution of dendritic spines in the ultrasonic stimulation group was sparse, the number of dendritic spines was significantly reduced, and the morphology was mushroom-like or dwarf stump-like. Compared with the sham stimulation group, the density of dendritic spines was significantly reduced (P < 0.0001), and the length of dendrites was significantly shortened (P < 0.0001). Conclusion Low intensity focused ultrasound can significantly activate neurons in NAc brain region, and inhibit and regulate the structural plasticity of neurons, which proves that ultrasound stimulation has the potential to intervene and treat brain diseases. -
Key words:
- Ultrasonic stimulation /
- Neuromodulation /
- c-Fos /
- Structural plasticity.
-
脑科学是近年来我国科学研究的重要方向,探讨脑神经回路的机制和寻找神经疾病的诊疗方案已成为全球神经科学研究领域的共同目标。在神经调控技术中,低强度聚焦超声(low-intensity focused ultrasound,LIFU)是一种新兴无创的治疗方法。LIFU可通过超声波透过颅骨,将声物理效应集中在特定的脑区,从而达到调节大脑活动的目的。LIFU进行神经调控的机制尚不明确,国内外学者的研究发现,不同参数的超声刺激能够兴奋或抑制神经元的活动[1-2],改变受体下游分子活性,导致电压敏感性离子通道的开放或失活[3-4]。LIFU可调控奖励回路,调节蛋白表达水平,这些为相关疾病发病机制的研究提供了理论支撑。
伏隔核(nucleus accumben,NAc)是奖赏环路的核心环节,与动机行为和奖赏行为密切联系,主要涉及药物成瘾、镇痛以及行为活动等,是研究成瘾的关键大脑核团。因此,研究LIFU对NAc的调控作用,可为药物成瘾及脑科学其他疾病提供一种新的治疗思路。c-Fos是一种即刻早期应答基因,可被多种刺激诱导激活,是一种常用的神经元兴奋性标记物[5]。结构可塑性的改变可反应神经元适应和学习记忆的变化[6]。综上,本研究通过LIFU刺激小鼠NAc脑区后,进行c-Fos蛋白测定及超微结构观察结构可塑性的改变,观察超声刺激脑区后神经元激活和结构改变情况,初步探讨超声进行神经调控的机制,为后续超声神经调控治疗脑疾病的研究提供实验依据。
1. 材料与方法
1.1 材料
1.1.1 实验动物及分组
选用SPF级的体重18~22 g(6~7周龄),雄性C57 BL/6小鼠18只(湖南斯莱克景达实验动物有限公司)。在SPF级环境下适应性饲养1周,自由进食和饮水。实验已通过昆明医科大学伦理委员会审批(审批号kmmu 2021265)。随机分成超声刺激组12只、假刺激组6只。
1.1.2 主要仪器与试剂
超声神经刺激仪(中国科学院深圳先进技术研究院),小动物麻醉机SA420(江苏塞昂斯生物科技有限公司,中国),倒置激光共聚焦显微镜N-SIM/C2 si(尼康株式会社,日本),数显脑立体定位仪SA301(江苏塞昂斯生物科技有限公司,中国),兔抗c-Fos 多克隆抗体(Abbkine公司,美国,ABP0071),IFKine驴抗兔IgG二抗(Abbkine公司,美国,A24221),FD Rapid GolgiStainTM Kit试剂盒(上海玉博生物科技有限公司,中国)。
1.2 方法
1.2.1 超声刺激
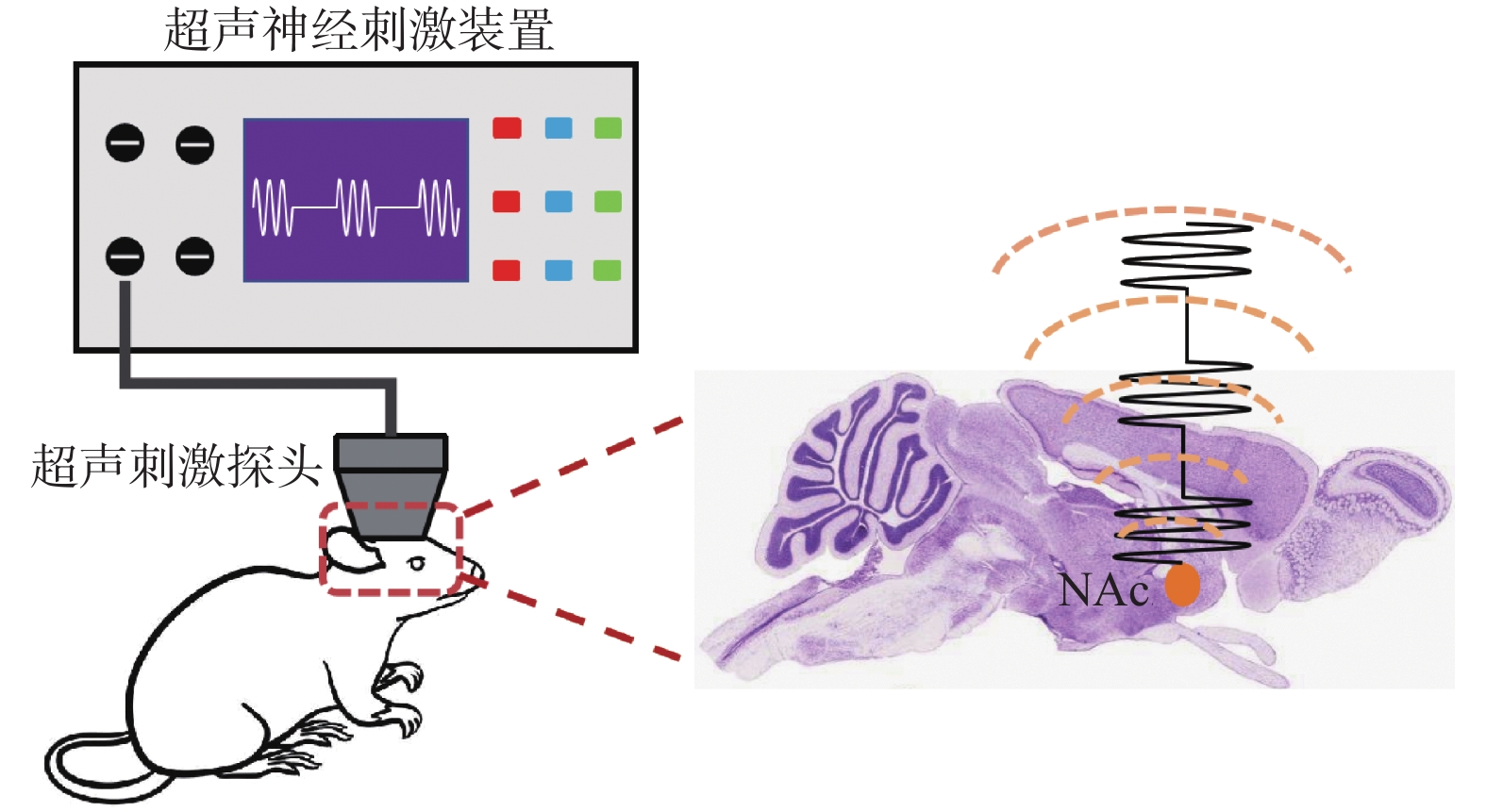
18只小鼠由呼吸面罩异氟烷麻醉后,将头部固定于脑立体定位仪上,暴露前囟,把超声刺激探头对准NAc坐标(以Bregma为坐标原点M/X:+0.5 mm,A/P:+1.18 mm,D/V:-4.50 mm)进行超声调控,见图1,超声刺激组超声调控参数为:探头频率0.5 MHz,脉冲重复频率(pulse repetition frequency,PRF)1 000 Hz,脉冲声压590 kPa,占空比为50%,刺激时间为每天10 min,持续7 d。假刺激组将超声刺激探头置于相同位置,不开电源无输出功率。18只小鼠均顺利完成整个超声刺激过程,刺激过程中无死亡或其他异常情况。
1.2.2 免疫组化测定c-Fos蛋白
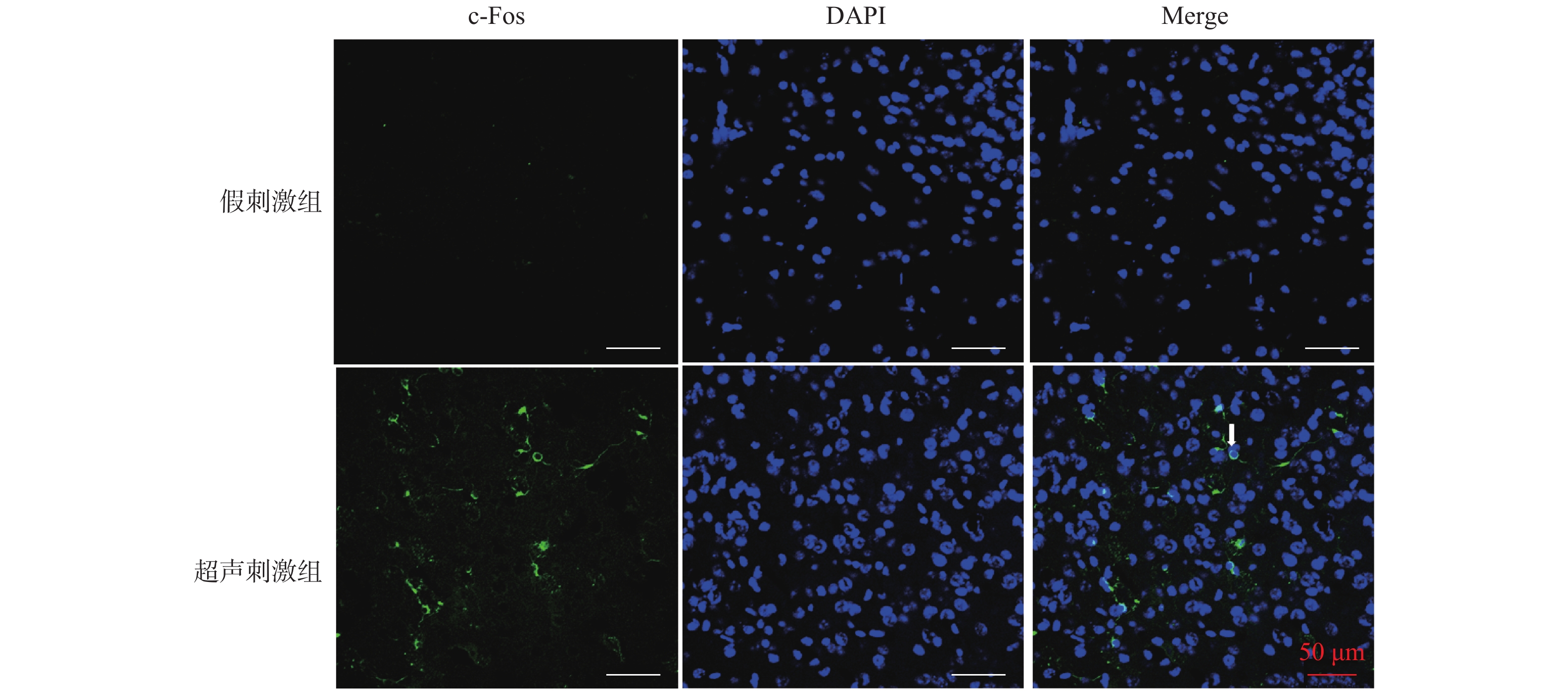
最后一次刺激结束后,8%水合氯醛(0.35 mL/100 g)腹腔注射麻醉后灌注取脑,使用4%多聚甲醛4 ℃固定24 h,经15%蔗糖溶液脱水、30%蔗糖溶液梯度脱水沉底后,取出脑组织,用吸水纸吸干表面蔗糖溶液,使用OCT包埋,-22 ℃冰冻切片,片厚20 µm。0.3% Triton溶液常温孵育10 min,PBS清洗后羊血清封闭1.5 h。c-Fos兔抗多克隆抗体(1∶200)-抗,4 ℃孵育,过夜。驴抗兔IgG二抗(1∶500),常温避光孵育1.5 h。轻轻甩干后,滴入抗荧光衰减封片剂(含DAPI),封片固定。将免疫荧光染色样本置于激光共聚焦显微镜下观察,低倍镜下(蓝色荧光场)找到NAc并观察,每个标本随机取2~4个高倍视野(10×40)曝光。利用Image J软件对图片进行c-Fos阳性神经元统计,计算阳性神经元比例做归一化处理。
1.2.3 切片、高尔基染色及病理观察
最后一次刺激结束后,腹腔注射水合氯醛麻醉后灌注取脑,将脑组织浸泡在FD Rapid GolgiStainTM Kit试剂盒等体积的Solutions A 与 Solutions B 混合溶液,24 h后,换液1次,室温避光保存14 d,然后取出脑组织转至Solutions C,24 h后,换液1次,室温,避光保存2 d;使用OCT包埋,-22 ℃冰冻切片,片厚100 µm,切片放置湿盒中,避光常温15~30 min;按1∶1∶2的比例配置Solutions D,Solutions E与双蒸水混合液,然后混合液滴在脑切片上显色10 min。
将高尔基染色后的样本置于倒置激光共聚焦显微镜系统中扫描拍摄,先在低倍镜下寻找NAc,然后切换到高倍镜(40×倍镜)采集NAc神经树突、树突棘图像。利用Image J软件对图片NAc神经元树突长度进行测量,计算平均树突长度(µm/50个神经元);对固定单位内树突棘数量进行计数,计算树突棘密度(个/µm)。
1.3 统计学处理
实验数据使用 SPSS 25.0软件进行统计分析。正态分布的计量资料采用t检验,以
$\bar x \pm s $ 表示,非正态分布的计量资料采用秩和检验,以[M(P25,P75)]表示。P < 0.05为差异有统计学意义。2. 结果
2.1 超声刺激后c-Fos改变
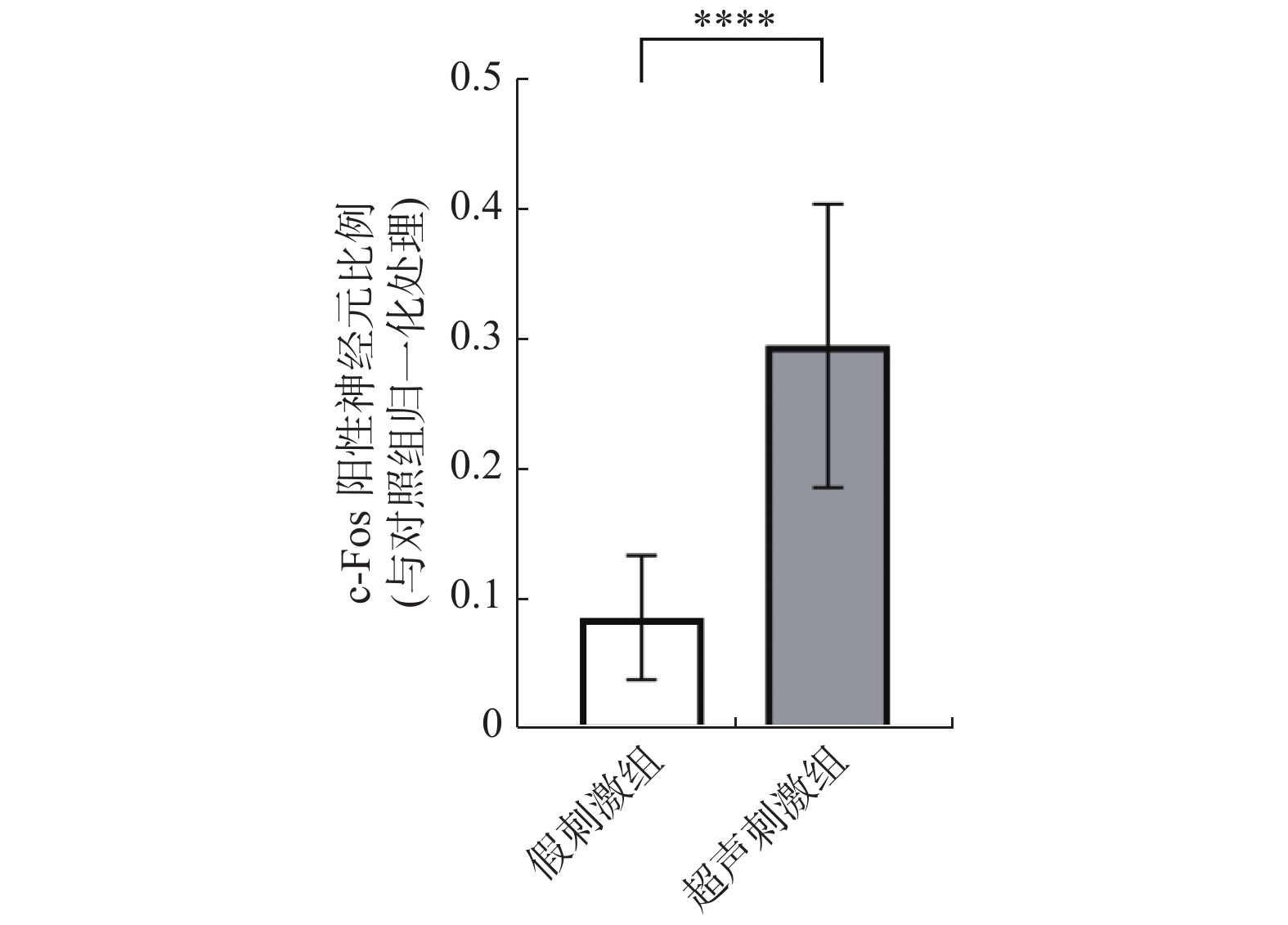
DAPI条件下所显示的为细胞核(蓝色),FITC条件下所显示的为神经元表达c-Fos蛋白(绿光),Merge为前两者组合,见图2白色箭头所示。超声刺激组表达c-Fos的神经元比例为(29.9±12.9)%,假刺激组比例为(6.3±5.8)%,2组相比,超声刺激组明显高于对照组,差异有统计学意义(P < 0.001),见表1、图2、图3。说明LIFU刺激后NAc区神经元c-Fos的表达比例显著提高。
表 1 小鼠NAc区 c-Fos阳性神经元比例统计分析($\bar x \pm s $ )Table 1. Statistical analysis of the proportion about c-Fos positive neurons in the NAc ($\bar x \pm s $ )组别 n c-Fos阳性神经元比例(%) 假刺激组 30 8.58 ± 4.78 超声刺激组 30 29.50 ± 10.91**** 与假刺激组比较,****P < 0.0001。 2.2 超声刺激后超微结构改变
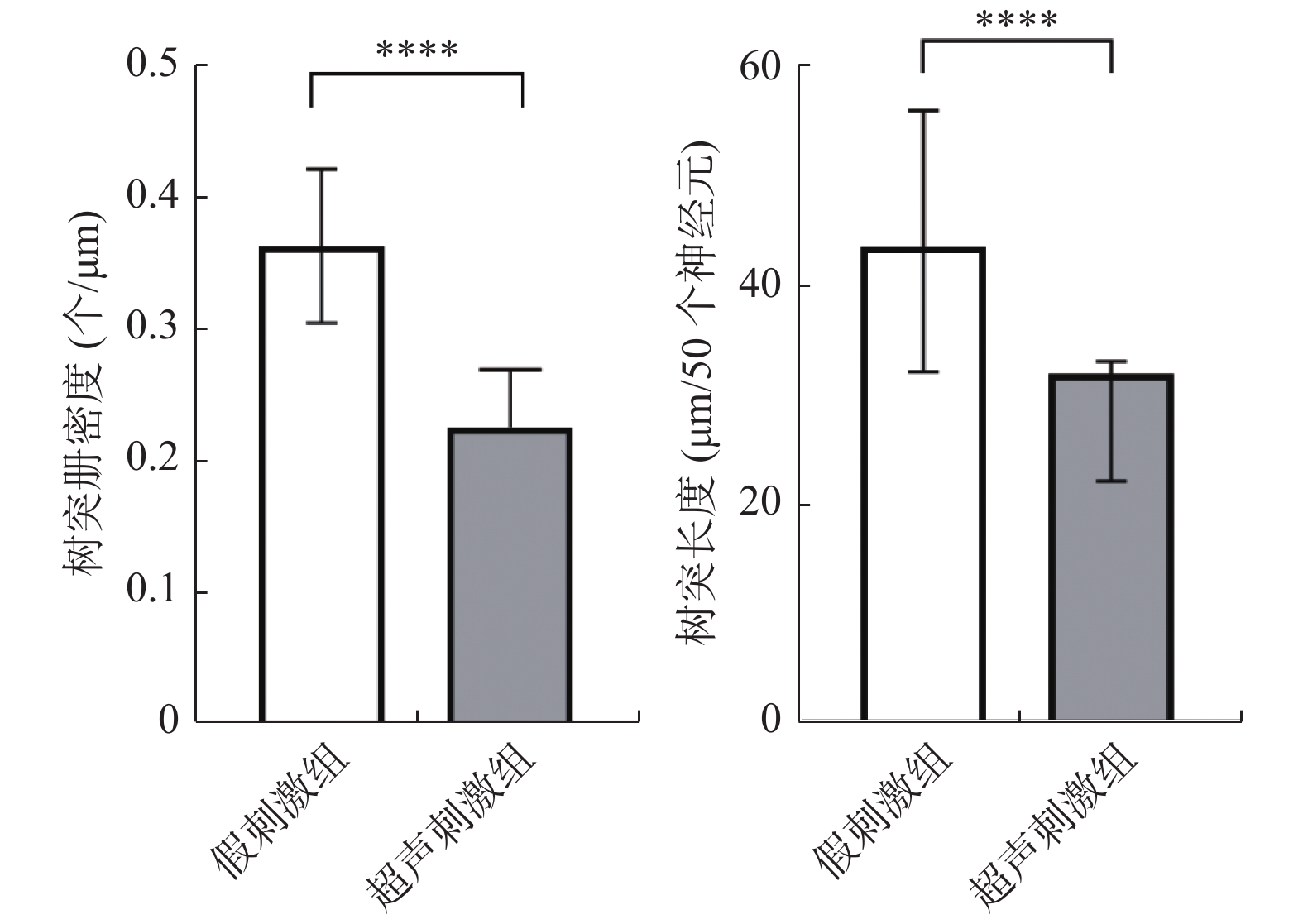
通过高尔基染色后,在倒置激光共聚焦显微镜下观察NAc区神经元,发现假刺激组的树突棘呈伪足样,有较大的棘头,而超声刺激组的树突棘呈蘑菇型或矮树桩样,且树突棘分布稀疏,数量显著减少,见图4,蓝色箭头所示为树突棘,神经元之间连接减少,甚至出现神经元连接中断。NAc区神经元树突棘密度和树突长度统计数据显示,与假刺激组相比,超声刺激后树突棘密度显著降低(P < 0.0001),树突长度显著缩短(P < 0.0001),见表2,表3、图5。
表 2 LIFU对小鼠NAc区树突棘密度的影响($\bar x \pm s $ )Table 2. Effect of LIFU on dendritic spine density in the NAc ($\bar x \pm s $ )组别 n 树突棘密度(个/µm) 假刺激组 30 0.36 ± 0.06 超声刺激组 30 0.23 ± 0.04**** 与假刺激组比较,****P < 0.0001。 表 3 LIFU对正常小鼠NAc区树突长度的影响[M(P25,P75)]Table 3. Effect of LIFU on dendritic length in the NAc [M(P25,P75)]组别 n 树突长度(µm/50个神经元) Z值 P值 假刺激组 30 43.65(32.19,56.05) −4.28 < 0.0001 超声刺激组 30 31.95(22.20,33.13) 与假刺激组比较,****P < 0.0001。 3. 讨论
调控神经核团和神经环路是脑功能及机制研究的重要方法,也是探索相关脑疾病诊疗方法的重要手段。常见的神经调控手段有电极深部脑刺激(deep brain stimulation,DBS)、经颅磁刺激(transcranial magnetic stimulation,TMS)、经颅直流电刺激(transcranial direct current stimulation,tDCS)以及光遗传学技术(Optogenetics)等,与其他神经调控方法相比,超声刺激是目前唯一一种同时具备无创、高时空分辨力等优点的神经调控方法,还可以联合CT、MRI及肌电诱发电位仪等监测设备实时调控特定脑区。
c-Fos是一种常用的神经元兴奋性标记物,对于编码和唤起记忆具有重要作用,当神经元被激活时,c-Fos表达会上调[7]。蛋白表达的检测已作为药物成瘾、脑部损伤等许多神经疾病的重要参照指标[8]。在本研究中,LIFU刺激后发现c-Fos表达显著增加,说明超声刺激能显著激活相应脑区神经元,证明了超声刺激的有效性。这与QIU等[9]的研究结果相一致。
神经元的结构可塑性与脑疾病中大脑功能的持久变化密切相关[10],目前结构可塑性的研究都集中在树突和树突棘的形态学改变上。大部分成瘾类物质如海洛因、可卡因、尼古丁等可以都可引起NAc区或内侧前额叶皮质区(medial prefrontal cortex,mPFC)的神经元树突棘密度增高和树突分支增多[11-12],但吗啡则导致NAc和mPFC树突棘密度显著降低和树突分支的减少[13]。在本研究中,笔者使用LIFU刺激正常小鼠的NAc区后,电镜观察首次发现树突棘密度降低、树突长度变短,这充分证明了超声刺激可以改变神经元的结构可塑性,且在本组超声刺激参数下(探头频率0.5 MHz,PRF 1 000 Hz,声压590 kPa,占空比50%,刺激时间10 min,连续7 d)出现了抑制性的改变。不同于Huang的研究,他发现在探头频率0.5 MHz,PRF 500 Hz,声压0.42 MPa的超声参数下对大鼠海马区域刺激后树突棘密度显著增加[14]。这表明,不同的超声刺激参数对于神经细胞结构可塑性的改变可能有着双向调控的能力。结合神经细胞结构可塑性改变基础,笔者可以设想,未来可以通过超声参数多能级的分组摸索,进一步证实超声神经调控的双向性,寻找到超声刺激在神经调控中正向和负向调控的临界点,同时也可使用LIFU在脑疾病的治疗中进行尝试。
综上所述,在本研究中,笔者发现LIFU能有效激活神经元,也能抑制性地调控NAc区神经元的结构可塑性。这充分证明了超声刺激具备干预与治疗脑疾病的潜能,尤其在药物依赖方面,将为毒品的戒治提供一种新思路。
-
表 1 小鼠NAc区 c-Fos阳性神经元比例统计分析(
$\bar x \pm s $ )Table 1. Statistical analysis of the proportion about c-Fos positive neurons in the NAc (
$\bar x \pm s $ )组别 n c-Fos阳性神经元比例(%) 假刺激组 30 8.58 ± 4.78 超声刺激组 30 29.50 ± 10.91**** 与假刺激组比较,****P < 0.0001。 表 2 LIFU对小鼠NAc区树突棘密度的影响(
$\bar x \pm s $ )Table 2. Effect of LIFU on dendritic spine density in the NAc (
$\bar x \pm s $ )组别 n 树突棘密度(个/µm) 假刺激组 30 0.36 ± 0.06 超声刺激组 30 0.23 ± 0.04**** 与假刺激组比较,****P < 0.0001。 表 3 LIFU对正常小鼠NAc区树突长度的影响[M(P25,P75)]
Table 3. Effect of LIFU on dendritic length in the NAc [M(P25,P75)]
组别 n 树突长度(µm/50个神经元) Z值 P值 假刺激组 30 43.65(32.19,56.05) −4.28 < 0.0001 超声刺激组 30 31.95(22.20,33.13) 与假刺激组比较,****P < 0.0001。 -
[1] Gibson B C,Sanguinetti J L,Badran B W,et al. Increased excitability induced in the primary motor cortex by transcranial ultrasound stimulation[J]. Front Neurol,2018,(9):1007. [2] Hyungmin K. Suppression of EEG visual-evoked potentials in rats through neuromodulatory focused ultrasound[J]. Neuroreport,2015,26(4):211-215. doi: 10.1097/WNR.0000000000000330 [3] Tyler W J,Lani S W,Hwang G M. Ultrasonic modulation of neural circuit activity[J]. Curr Opin Neurobiol,2018,50(2):22-31. [4] Kubanek J,Shukla P,Das A,et al. Ultrasound elicits behavioral responses through mechanical effects on neurons and ion channels in a simple nervous system[J]. J Neurosci,2018,38(12):3081-3091. doi: 10.1523/JNEUROSCI.1458-17.2018 [5] Greenberg M E,Ziff E B. Stimulation of 3T3 cells induces transcription of the c-fos proto-oncogene[J]. Nature,1984,311(5985):433-438. doi: 10.1038/311433a0 [6] Wang K,Lu J M,Xing Z H,et al. Effect of 1.8 GHz radiofrequency electromagnetic radiation on novel object associative recognition me mory in mice[J]. Sci Rep,2017,(7):44521. [7] Grossman N,Bono D,Dedic N,et al. Noninvasive deep brain stimulation via temporally interfering electric fields[J]. Cell,2017,169(6):1029-1041. doi: 10.1016/j.cell.2017.05.024 [8] Yap E L,Pettit N L,Davis C P,et al. Bidirectional perisomatic inhibitory plasticity of a Fos neuronal network[J]. Nature,2021,590(7844):115-121. doi: 10.1038/s41586-020-3031-0 [9] Qiu Z,Kala S,Guo J,et al. Targeted neurostimulation in mouse brains with non-invasive ultrasound[J]. Cell Rep,2020,32(7):108033. doi: 10.1016/j.celrep.2020.108033 [10] Robinson T E,Berridge K C. Addiction[J]. Annu Rev Psychol,2003,54:25-53. doi: 10.1146/annurev.psych.54.101601.145237 [11] Ren Z,Sun W L,Jiao H,et al. Dopamine D1 and N-methyl-D-aspartate receptors and extracellular signal-regulated kinase mediate neuronal morphological changes induced by repeated cocaine administration[J]. Neuroscience,2010,168(1):48-60. doi: 10.1016/j.neuroscience.2010.03.034 [12] Kruyer A,Scofield M D,Wood D,et al. Heroin cue-evoked astrocytic structural plasticity at nucleus accumbens synapses inhibits heroin seeking[J]. Biol Psychiatry,2019,86(11):811-819. doi: 10.1016/j.biopsych.2019.06.026 [13] Robinson T E,Gorny G,Savage V R,et al. Widespread but regionally specific effects of experimenter- versus self-administered morphine on dendritic spines in the nucleus accumbens,hippocampus,and neocortex of adult rats[J]. Synapse,2002,46(4):271-279. doi: 10.1002/syn.10146 [14] Huang X,Lin Z,Wang K,et al. Transcranial low-intensity pulsed ultrasound modulates structural and functional synaptic plasticity in rat hippocampus[J]. IEEE Trans Ultrason Ferroelectr Freq Control,2019,66(5):930-938. doi: 10.1109/TUFFC.2019.2903896 期刊类型引用(1)
1. 段敏丹,陈雪,王悦,苏雷,史茜,贾友超,霍燃. 微小RNA多态性和非小细胞肺癌遗传易感性关系研究. 陕西医学杂志. 2017(07): 833-835+839 .  百度学术
百度学术其他类型引用(0)
-






 下载:
下载:






 下载:
下载:

