Mechanism of miR-373 on Behaviors of Depression-mice via P2X7R
-
摘要:
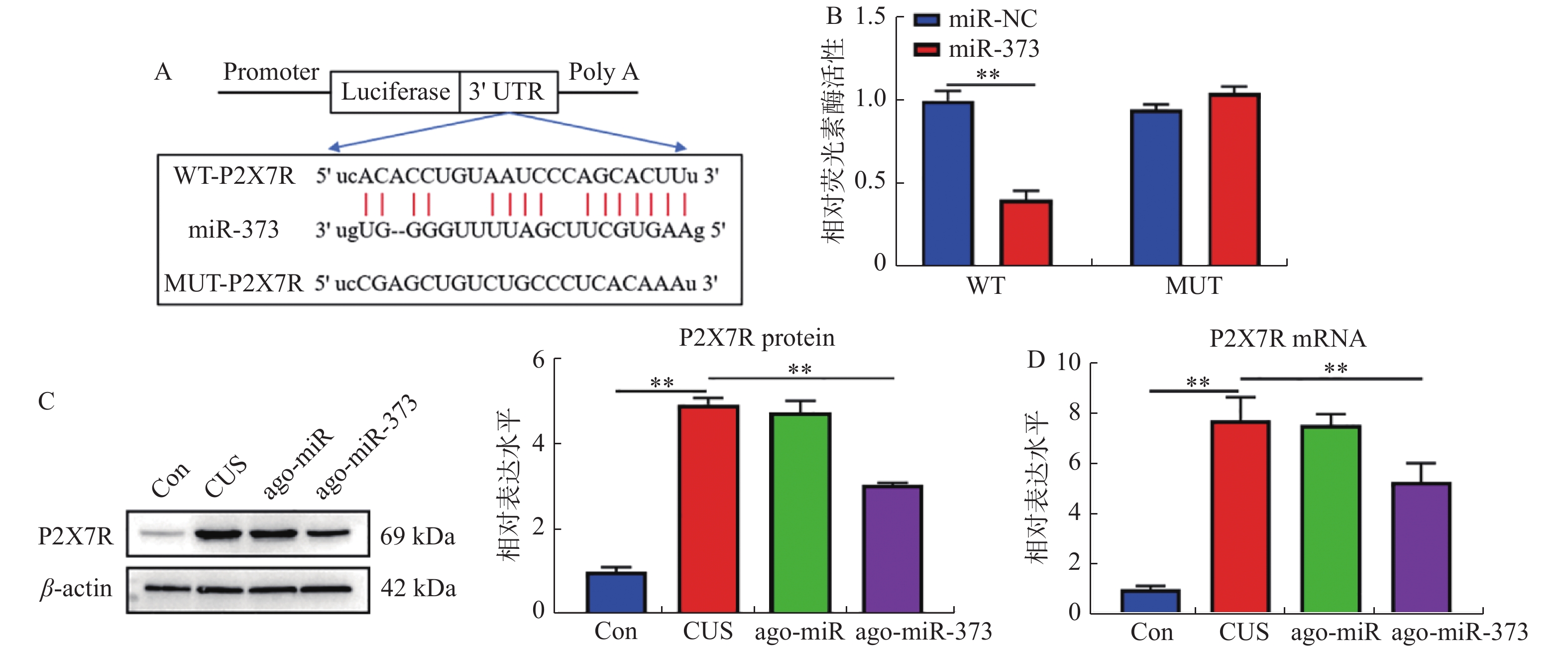
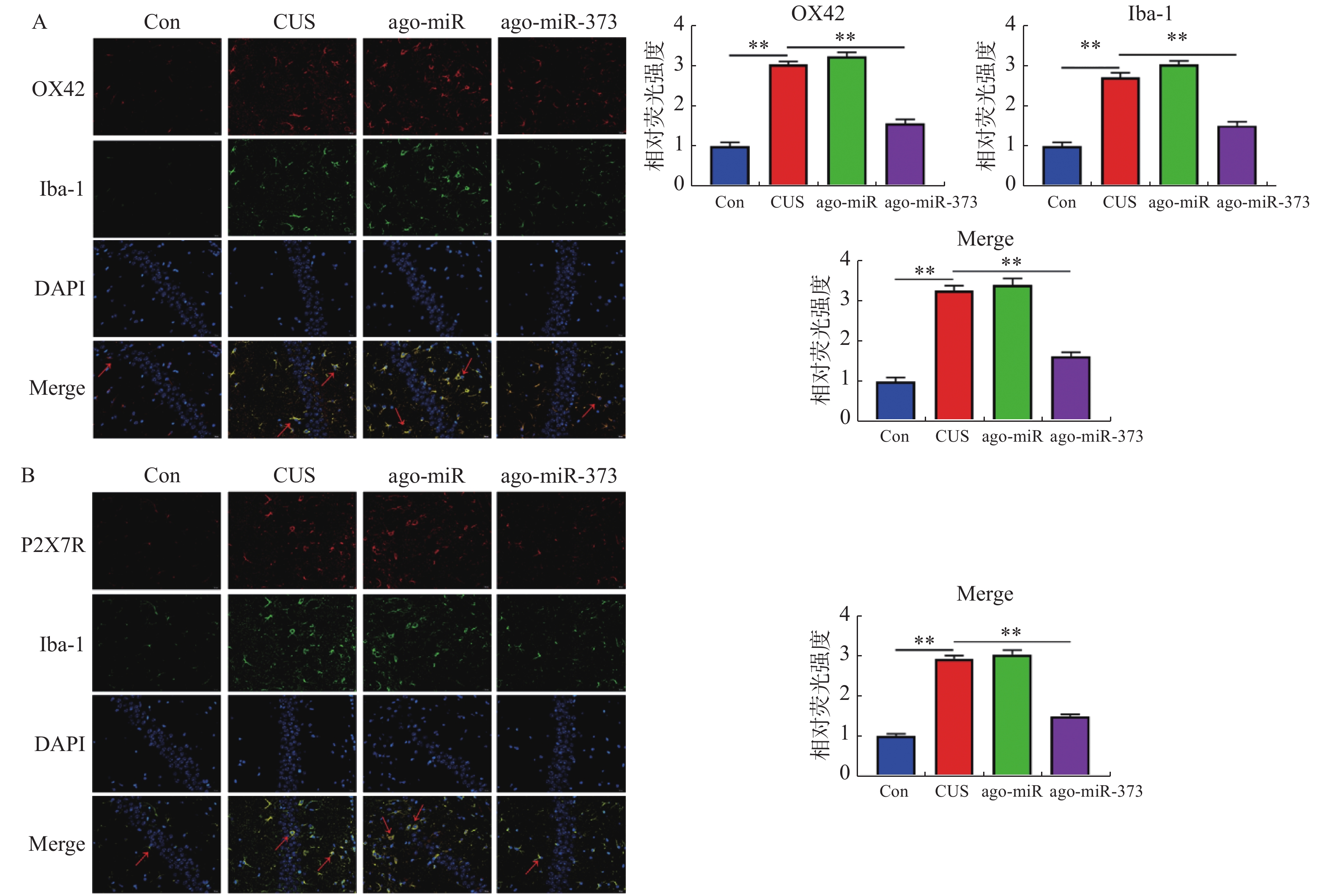
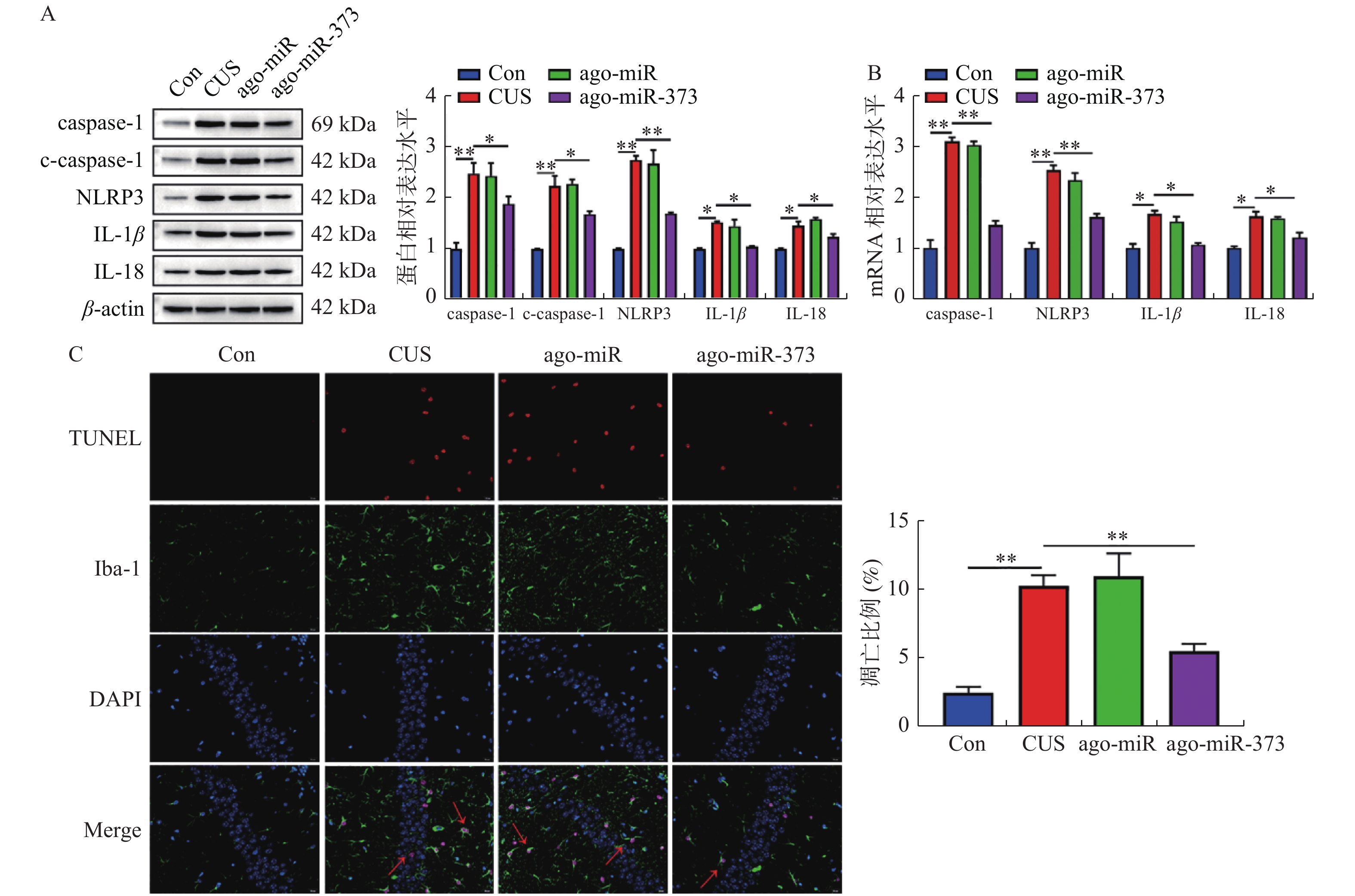
目的 探讨miR-373对抑郁症小鼠模型抑郁样行为,小胶质细胞激活和焦亡的影响。 方法 采用慢性不可预知应激构建抑郁症小鼠模型。蔗糖偏好,强迫游泳,尾部悬挂和社会实验评估小鼠的抑郁样行为。免疫荧光双染小胶质细胞标志物Iba-1和小胶质细胞活化标志物OX-42以评估小鼠海马层中小胶质细胞增殖和活化状态。TUNEL试剂盒检测小胶质细胞的凋亡。荧光定量PCR检测miR-373的表达水平。蛋白质印记检测P2X7R和细胞焦亡相关蛋白的表达水平。双荧光素酶报告基因实验验证miR-373和P2X7R的靶向关系。 结果 慢性不可预知应激处理的小鼠,蔗糖偏好度和社交时间显著下调,并且强迫游泳和尾部悬挂不动时间显著增加(P < 0.05)。miR-373在抑郁症模型小鼠中异常高表达,且能够缓解小鼠的抑郁样行为(P < 0.05)。miR-373靶向负调控小鼠海马层小胶质细胞中P2X7R的表达水平(P < 0.01)。miR-373抑制小鼠海马层中小胶质细胞增殖和激活(P < 0.01)。miR-373抑制小胶质细胞中Caspase-1,C-caspase-1,NLRP3,IL-1β和IL-18表达,并抑制小胶质细胞凋亡(P < 0.05)。 结论 miR-373通过靶向抑制P2X7R的表达,从而缓解抑郁症小鼠模型的抑郁样行为,并抑制其海马层中小胶质细胞活化和焦亡。 Abstract:Objective To explore the effect of miR-373 on depression-like behavior, microglia activation and pyrolysis in depression mice. Methods We Used chronic unpredictable stress to establish depression mice model. Sucrose preference, forced swimming, tail suspension, and Social interaction test were evaluate depression-like behaviors. Immunofluorescence double-stained microglia marker Iba-1 and microglia activation marker OX-42 were used to evaluate the proliferation and activation of microglia in the hippocampus of mice. TUNEL kit was used to detect microglia apoptosis. RT-qPCR was used to detect miR-373 expression. Western blotting was used to detect the expression of P2X7R and pyrolysis-related proteins. The targeting relationship between miR-373 and P2X7R was verified by dual-luciferase reporter gene assay. Results In mice treated with chronic unpredictable stress, sucrose preference and social time were significantly reduced, and immobility time of forced swimming and tail suspension was significantly increased (P < 0.05). miR-373 washighly expressed, and alleviated depression-like behavior in depression model mice (P < 0.05). miR-373 targeted and negatively regulated P2X7R expression in microglia ofmice hippocampus (P < 0.01). miR-373 inhibited the proliferation and activation of microglia (P < 0.01). miR-373 inhibited caspase-1, c-caspase-1, NLRP3, IL-1β and IL-18 expression, and the apoptosis of microglia (P < 0.05). Conclusion ImiR-373 inhibits P2X7R expression to alleviate depression-like behavior, and inhibit the activation and pyroptosis of microglia in the hippocampus of depression mice. -
Key words:
- Depression /
- Depression-like behavior /
- Microglia /
- Pyroptosis /
- miR-373 /
- P2X7R
-
根治性膀胱切除术(radical cystectomy,RC)联合尿流改道术(urinary diversion,UD)是肌层浸润性膀胱癌的主要治疗手段[1]。近年来,随着机器人手术技术的推广、微创手术技巧的完善和加速康复方案的广泛应用,根治性膀胱切除术的手术操作技术与围术期护理水平得到显著提升,但术后仍存在28%~64%的并发症发生率[2],尤其是肾功能损害,其发生率为20%~70%不等[3−5]。长期的肾功能损害可导致肾功能衰竭、心血管疾病甚至死亡[6],严重影响患者术后健康生活质量。目前国内外关于根治性膀胱切除术后肾功能损害的发生率及影响因素的研究日渐增多,但对于该并发症的流行病学调查较为分散,各项研究间的发生率差异较大,且受到诸如样本量、地区等影响导致研究的结论尚有差异。鉴于此,本研究通过Meta分析,以估计肾小球滤过率(estimated glomerular filtration rate,eGFR)为观察指标,系统分析根治性膀胱切除术后肾功能损害的发生率及影响因素,以期为根治性膀胱切除术后肾功能损害的早期防范与干预提供参考。
1. 资料与方法
1.1 文献检索
采用主题词与自由词相结合的检索方法,计算机检索知网、万方、维普、中国生物医学文献、Web of Science、PubMed、EMbase和The Cochrane Library数据库,搜索与根治性膀胱切除术患者肾功能损害的发生率及影响因素有关的文章,检索时限为:建库至2023年9月30日。中文检索词为:膀胱癌、膀胱肿瘤、根治性膀胱切除术、膀胱全切、尿流改道;慢性肾脏病、肾功能损害、肾功能损害、肾功能下降;危险因素、影响因素、相关因素等。英文检索词为:cystectomy、radical cystectomy、urinary diversion、Continent Urinary Reservoir* ; renal insufficiency、chronic、 renal insufficiency、chronic kidney disease*; risk factors、risk factor*、Population at Risk、predict*等。以PubMed为例,具体检索策略见图1。
1.2 纳入与排除标准
1.2.1 纳入标准
(1)研究对象:根治性膀胱切除合并尿流改道术的患者;(2)研究类型:队列研究和病例对照研究;(3)研究内容:根治性膀胱切除术后肾功能损害的发生率及影响因素;(4)结局指标:根治性膀胱切除术后患者是否发生肾功能损害,以eGFR作为评价指标[7]。
1.2.2 排除标准
(1)评论、综述、会议论文及重复发表的文献;(2)数据不全及无法提取有效数据、无法获取全文的文献;(3)非中英文文献。
1.3 文献筛选和数据提取
由2名研究者独立进行文献筛选和数据提取。研究者根据纳入和排除标准对文献的题目及摘要进行初步筛选;通过阅读全文确定最终纳入的文章。提取包括作者、发表年份、研究地区、研究类型、样本量、发生率、尿流改道方式和影响因素的原始数据。在文献筛选与数据提取阶段,当2名研究者意见相左时,引入第3名研究者进行协助以达成共识。
1.4 文献质量评价
由2名研究者独立采用纽卡斯尔-渥太华量表(the newcastle-ottawa scale,NOS)对每项研究进行质量评价[8],该量表包含8个条目,共9分,≥7分为高质量研究。结果有异议时,则征求第3名研究者意见并最终达成一致。
1.5 统计学处理
使用Stata14.0软件进行分析。影响因素提取比值比(odds ratio,OR)合并效应量;发生率效应量采用直接法(近似正态法)进行合并,各效应量均给出点估计值及95%置信区间(confidence interval,CI)。通过卡方检验与 I 2统计量来评估异质性水平。当P≥0.10,I 2≤50%,认为各研究间异质性较低,则采用固定效应模型;相反,若P < 0.10,I 2>50%,则表明研究间异质性较大,采用随机效应模型。当合并结果的异质性较大时,采用逐一删除文献法进行敏感性检验以探讨异质性来源。当上述方法无法排除异质性来源时,进行亚组分析,若仍无法确定异质性的主要来源则使用随机效应模型。采用Egger’ s检验和Begg’ s检验评估纳入文献是否存在发表偏倚问题。以P < 0.05为差异有统计学意义。
2. 结果
2.1 文献筛选结果
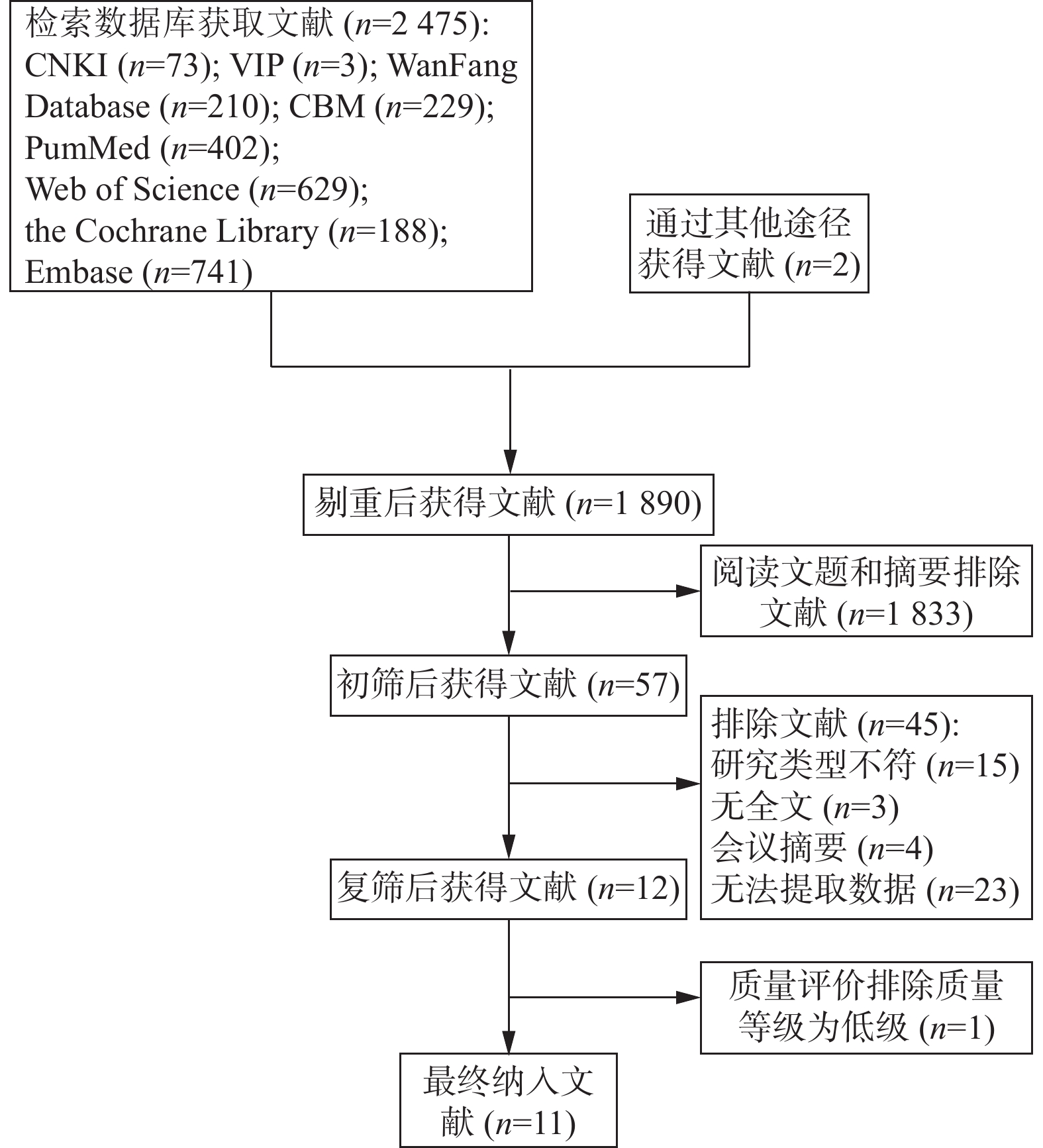
初检获得文献
2475 篇,剔除重复文献后共1890 篇,通过初步筛选剔除明显不符合的文献1833篇,共获得文献57篇。根据纳入和排除标准对剩余文献进行二次筛选,共剔除文献45篇,获得文献12篇,包含低质量文献1篇予以剔除,最终纳入11篇文献[9−19]。文献筛选流程见图2。2.2 纳入研究的基本特征及方法学质量评价结果
共纳入11篇文献,包括8篇病例对照研究[9−12,15−17,19]和3篇队列研究[13−14,18],总样本量
6 083 例,发表时间为2014-2023年。所有文献质量评价结果均≥7分。纳入文献的基本特征及方法学质量评价结果见表1。表 1 纳入研究的基本特征及方法学质量评价(n = 11)Table 1. Basic characteristics of the included studies and methodological quality assessment (n = 11)纳入研究 国家 研究设计 样本量/中位
随访时间(月)尿流改道方式 结局指标
[mL/(min·1.73m2)]肾功能损伤
发生率(%)影响因素 NOS评分 陈少豪等
2017[9]中国 病例对照 156/89
(60~130)35.9%ONB,43.6%IC,
20.5%CU双肾总eGFR
下降≥25%41.70 ③⑤⑦ 7 Ahmadi等
2022[10]美国 病例对照 508/44
(11~85)/ eGFR下降≥10% 12.60 ①④⑨ 7 Elsayed等
2020[11]美国 病例对照 442/25
(12~59)87%IC,13%其他 术后eGFR< 45 37.10 ③④⑥⑦
⑫⑬⑮7 Eisenberg等
2014[12]美国 病例对照 1631 /126
(85~183)23%ONB,76%IC,
1%CUeGFR下降≥10% 27.00 ①④⑤
⑩⑫⑥7 Nishikawa等
2014[13]日本 队列研究 169/103.8±9.8 24.8%CU,23.7%IC,
51.5%ONB双肾总eGFR
下降≥25%46.20 ⑤⑥⑩ 7 Gershman等
2015[14]美国 队列研究 1383 /12073.8%IC,18.7%ONB,
7.5%其他eGFR下降≥10% / ①⑤⑩
⑪⑫7 郑玮等
2018[15]中国 病例对照 103/16
(3~36)48.5%ONB,23.3%IC,
28.2%CU术后eGFR< 60 38.90 ②④⑧ 7 Hatakeyama
等2016[16]日本 病例对照 115/97
(70~125)59.1%ONB,14.8%IU,
26.1%CU术后eGFR< 45 32.20 ①②④⑩ 7 Kwon等
2016[17]韩国 病例对照 866/
49.8
(1~231.4)/ 术后eGFR< 60 25.60 ①④⑨⑬ 8 Lone等
2021[18]美国 队列研究 644/32
(12~56)72%IC,17%ONB,
11%其他术后eGFR< 45 33.00 ④⑪⑫ 7 金滨等
2023[19]中国 病例对照 46/20
(12~67)45.7%IC,54.3%CU 双肾总eGFR
下降≥25%39.10 ⑥⑯ 7 注:影响因素:①年龄;②尿流改道方式;③糖尿病;④术前肾功能;⑤高血压;⑥尿路感染;⑦身体质量指数(body mass index,BMI);⑧术后早期肾功能(术后30 d内eGFR);⑨化疗;⑩术后肾积水;⑪肿瘤分期;⑫吻合口狭窄;⑬急性肾损伤;⑭吻合口狭窄;⑮放疗;⑯围手术期输血缩略式:输尿管皮肤造口(cutaneous ureterostomy,CU);回肠膀胱术(ileal conduit,IC);原位新膀胱(orthotopic neobladder,ONB);开放式根治性膀胱切除术(open radical cystectomy,ORC);机器人辅助腹腔镜根治性膀胱切除术(robotic-assisted radical cystectomy,RARC)。 2.3 根治性膀胱切除术后病人肾功能损害发生率
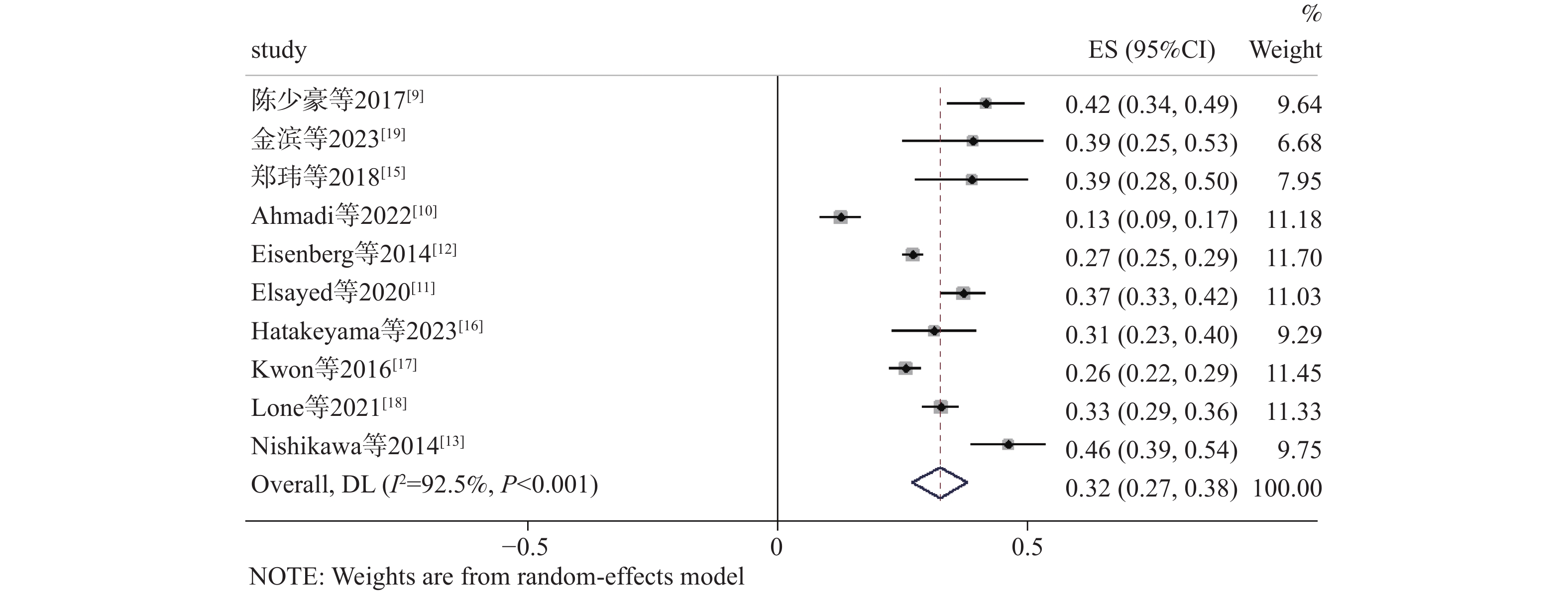
10篇文章[9−13,15−19]报道了根治性膀胱切除术后肾功能损害发生率为12.6%~46.2%。Meta分析结果显示,各研究间存在异质性(I 2 = 92.5%,P < 0.001),使用逐一排除文献法探讨异质性来源,结果显示仍有明显异质性,故采用随机效应模型合并效应量。Meta分析结果显示,根治性膀胱切除术后肾功能损害发生率32%[95%CI (0.27,0.38),P < 0.001],见图3。根据研究时长、研究地区、评价肾功能损害的结局指标和研究设计进行亚组分析进一步探索异质性的来源,见表2。亚组分析结果显示,研究时长在5a及其以上的检出率35%[95%CI(0.29,0.41), P < 0.001]略高于研究时长为1a33%[95%CI (0.24,0.43), P < 0.001];亚洲地区的检出率37%[95%CI(0.28,0.45), P < 0.001]高于欧美地区27%[95%CI (0.19,0.36), P < 0.001];以eGFR下降≥25%为结局指标的检出率40%[95%CI(0.36,0.45), P < 0.001]高于以术后eGFR<60[mL/(min·1.73m2)]为结局指标27%[95%CI (0.24,0.30), P < 0.001]、术后eGFR<45[mL/(min·1.73m2)]为结局指标33%[95%CI (0.29,0.36), P < 0.001]和术后eGFR下降≥10%为结局指标26%[95%CI (0.24,0.28), P < 0.001];队列研究的检出率39%[95%CI (0.26,0.52), P < 0.001]高于病例对照研究29%[95%CI (0.23,0.35), P < 0.001]。
表 2 根治性膀胱切除术后肾功能损害亚组分析结果Table 2. Subgroup analysis of renal impairment after radical cystectomy亚组 纳入研究(项) 异质性检验结果 效应模型 Meta分析结果 I 2(%) P 患病率(%) 95%CI P 研究时长 1 a[12,15,19] 3 70.4 0.034* 随机效应 33 [0.24,0.43] <0.001* 5 a及其以上[9−13,16−18] 7 94.7 <0.001* 随机效应 35 [0.29,0.41] <0.001* 地区 亚洲[9,13,15−17,19] 6 86.5 <0.001* 随机效应 37 [0.28,0.45] <0.001* 欧美[10−12,18] 4 96.1 <0.001* 随机效应 27 [0.19,0.36] <0.001* 结局指标
[mL/(min·1.73m2)]eGFR下降≥25%[9,13,16,19] 4 55.9 0.078 随机效应 40 [0.36,0.45] <0.001* 术后eGFR下降≥10% [10−12] 3 96.9 <0.001* 随机效应 26 [0.24,0.28] <0.001* 术后eGFR<60 [15,17] 2 79.7 <0.001* 随机效应 27 [0.24,0.30] <0.001* 术后eGFR<45 [18] 1 33 [0.29,0.36] <0.001* 研究设计 病例对照[9−12,15−17,19] 8 92.0 <0.001* 随机效应 29 [0.23,0.35] <0.001* 队列研究[13,18] 2 90.1 0.001* 随机效应 39 [0.26,0.52] <0.001* *P < 0.05。 2.4 根治性膀胱切除术后患者肾功能损害影响因素的Meta分析及敏感性分析
对研究数量为3篇及以上的危险因素进行Meta分析,结果显示,年龄大、术前合并高血压、术后发生肾积水、尿路感染和吻合口狭窄是根治性膀胱切除术后病人肾功能损害发生的危险因素,见表3。对合并结果存在明显异质性的高血压[9,12−14](P = 0.014,I 2 = 71.9%)、肾积水[11−14,16](P = 0.004,I 2 = 74.5%)和吻合口狭窄[11−12,14,18](P = 0.011,I 2 = 73.3%)进行敏感性分析,结果显示异质性的主要来源是Eisenberg等[12]的研究,剔除该研究后采用固定效应模型对效应量进行合并,结果得到高血压[HR = 2.14,95%CI (1.32,3.40),P = 0.002,I 2 = 47.1%]、肾积水[HR = 1.89,95%CI (1.50,2.36),P < 0.001,I 2 = 48.4%]和吻合口狭窄[HR = 2.53,95%CI (1.77,3.61),P < 0.001,I 2 = 49.1%]是根治性膀胱切除术患者肾功能损害的危险因素。4篇文献[11−13,19]探讨了尿路感染与肾功能损害的关系,合并效应量进行统计分析,结果显示存在明显异质性(P = 0.002,I 2 = 79.4%),逐一排除文献后得出,Nishikawa等[13]是主要的异质性来源,剔除该研究后采用固定效应模型对效应量进行合并,结果得到尿路感染[HR = 1.351,95%CI (1.13,1.61),P < 0.001,I 2 = 31%]是根治性膀胱切除术患者肾功能损害的危险因素。见表4。
表 3 根治性膀胱切除术后肾功能损害影响因素的Meta分析Table 3. Meta-analysis of influencing factors of renal impairment after radical cystectomy影响因素 纳入文献(项) 异质性检验结果 效应模型 Meta分析结果 I 2(%) P OR 95%CI P 年龄[10,12,14,16-17] 5 9.3 0.353 固定效应 1.03 [1.02,1.04] <0.001* 高血压[9,12−14] 4 71.9 0.014* 随机效应 1.70 [1.17,2.47] 0.005* 术前eGFR[10−12,15−18] 7 98.3 <0.001* 随机效应 0.99 [0.93,1.05] 0.660 肾积水[11−14,16] 5 74.5 0.004* 随机效应 1.84 [1.28,2.36] 0.001* 尿路感染[11−13,19] 4 79.4 0.002* 随机效应 2.34 [1.20,4.59] 0.013* 吻合口狭窄[11-12,14,18] 3 73.3 0.011* 随机效应 2.20 [1.55,3.12] <0.001* *P < 0.05。 2.5. 发表偏倚
以根治性膀胱切除术后肾功能损害检出率为指标进行Begg’ s检验法和Egger’ s检验并绘制漏斗图。漏斗图分析显示,未发现明显不对称分布;Begg’ s检验法(Z=0.63,P = 0.531)和Egger’ s检验(t=1.31,P = 0.228)的结果均表明,存在发表偏倚的可能性较小,漏斗图见图4。
表 4 根治性膀胱切除术后肾功能损害影响因素的Meta分析(剔除异质性来源后)Table 4. Meta-analysis of factors influencing renal impairment after radical cystectomy (after exclusion of sources of heterogeneity)影响因素 纳入文献(项) 异质性检验结果 效应模型 Meta分析结果 I 2(%) P OR 95%CI P 年龄[10,12,14,16,17] 5 9.3 0.353 固定效应 1.03 [1.02,1.04] <0.001* 高血压[9,13-14] 3 47.1 0.150 固定效应 2.14 [1.32,3.40] 0.002* 术前eGFR[10−12,15−18] 7 98.3 <0.001* 随机效应 0.99 [0.93,1.05] 0.660 肾积水[11,13−14,16] 4 48.4 0.121 固定效应 1.89 [1.50,2.36] <0.001* 尿路感染[11−12,19] 3 31.0 0.229 固定效应 1.35 [1.13,1.61] <0.001* 吻合口狭窄[11−12,14,18] 3 49.1 0.14 固定效应 2.53 [1.77,3.61] <0.001* *P < 0.05。 3. 讨论
3.1 根治性膀胱切除术后患者肾功能损害发生率
随机效应模型Meta分析结果显示,根治性膀胱切除术后肾功能损害发生率为32%[95%CI (0.27,0.38),P < 0.001]。根据亚组分析可知,相较于欧美地区亚洲人群肾功能损害的发生率更高,分析原因可能与纳入研究所使用的eGFR计算公式有关,肾脏病饮食改良研究公式(modification of diet in renaldisease study equation,MDRD)中涉及到种族因素。有研究[20]显示,黑色人种的肌肉量、体表面积、血清肌酐水平以及尿素清除率等生理指标较黄色人种高,这些因素会影响到eGFR计算公式的准确性;另一方面不同地区饮食习惯、社会经济状况、医疗资源可及性等环境和生活方式因素也可能影响肾功能的表现[21]。此外,肾功能下降的诊断标准在不同研究中可能存在差异,这会影响到对患者术后肾功能减退程度的判断和检出率。肾功能损害的发生风险会随着时间的推移而增加,带来的不良影响通常发生在出院后,患者已回归社会和家庭,延续护理在其中发挥着重要作用,在这个过程中医护人员应关注肾功能的变化,正确评估肾功能并及时进行肾功能损害的管理和干预。
3.2 根治性膀胱切除术后患者肾功能损害影响因素分析
3.2.1 导致肾功能损害的人口特征学因素
年龄是根治性膀胱切除术后患者的肾功能状态改变的影响因素之一。这与肾脏本身的特点有关,随着年龄的增长,肾小球滤过率和肾单位数目会减少,肾脏血流量和肾小管的重吸收能力也会减弱[22]。另外,排尿功能障碍也与年龄增加有关,而排尿功能障碍会加重肾功能损害。有研究[23]显示,65岁以下男性夜间控制排尿的能力明显高于65岁以上的男性,膀胱癌好发于中老年人,应加强针对膀胱癌患者在保护肾功能方面的健康宣教,包括:尽量避免使用肾毒性的药物、进食适量蛋白质、低盐饮食、适当强度的运动并且按时复查等,以维持肾脏的正常代谢功能。
3.2.2 导致肾功能损害的既往疾病史因素
术前合并高血压与术后晚期肾功能下降独立相关。长期不加控制的高血压会导致肾小球动脉硬化,对肾功能造成影响[9];高血压还可以通过增加肾小球内压力,引起肾小球滤过率的改变,最终导致肾小球滤过功能下降,增大术后肾功能损害发生率[14]。对患有高血压的患者,在术前就应规范管理血压,从而降低手术过程中出现心血管并发症的风险、保护剩余肾功能并促进术后伤口的良好愈合;术后密切观察血压变化,避免过高的血压对肾脏血流灌注造成影响。患者出院后,应注重随访其血压情况,提高患者的服药依从性,必要时进行适当干预,以保障肾功能稳定并促进整体健康状况的改善。
3.2.3 导致肾功能损害的术后并发症因素
根治性膀胱切除术后发生尿路感染可继发急性肾损伤,对患者术后肾功能改变造成影响。术后输出道肠粘膜分泌的黏液可能导致尿液成分改变,增加了细菌黏附和繁殖的风险;同时输尿管支架管和新膀胱内残余尿的存在也容易导致细菌定植,尿路感染成为术后最常出现的并发症[19]。当尿路感染未得到及时有效控制,病原菌可沿输尿管上行至肾脏,引发急性肾盂肾炎。发生急性肾损伤时,不仅加剧了局部的炎症反应,还可能导致肾小管间质纤维化等病理变化,这是从急性肾损伤向慢性肾脏病转变的关键过程[24]。此外,在治疗感染的过程中使用的抗生素和其他药物,本身可能对肾脏产生一定的毒性作用,也加大了对肾功能的损伤。须采取有效的预防措施来预防和减少尿路感染的发生。对于原位新膀胱患者,应注重恢复和改善新膀胱的储尿和排尿功能,通过尿意感知训练、尿控功能训练及排尿功能训练等排尿行为干预培养患者新膀胱自我管理能力;指导患者规范记录排尿日记,必要时进行间歇性清洁导尿干预,以改善尿路感染的情况[25]。而对于泌尿造口患者在院期间就应开始系统的造口护理培训,包括正确清洁造口及其周围皮肤的方法、更换造口袋的技巧与如何识别并处理可能出现的并发症等,出院后通过微信、电话随访和护理门诊等途径定期随访,确保其能够独立完成造口自我管理,从而降低尿路感染的概率[26]。
吻合口狭窄和肾积水与患者术后的肾功能下降密切相关。当吻合口狭窄或尿道结石等导致尿液排出障碍的情况发生时,肾脏产生的尿液无法顺利排出,长期在新膀胱内的尿液会逐渐增高压力,并在肾脏内积聚形成肾积水[11,18]。如果狭窄严重并持续时间长,随着积水的加重,导致肾盂和肾盏扩张,对肾实质产生压迫效应,会使肾小球滤过率下降、肾间质水肿以及肾小管上皮细胞损伤,最终引起肾功能损害[18]。临床上常通过放置输尿管支架管等手术方式解除梗阻[27],对于术后患者则需要定期随访,评估其肾功能、监测新膀胱内的残余尿量并预防尿路感染,防止长期的慢性炎症刺激促使输尿管吻合口及周围组织纤维化,从而引起狭窄;同时,回肠通道患者也可以通过定期进行人工扩张造口来减轻造口狭窄的情况。
3.3 研究的局限性
本系统评价存在以下局限性:(1)纳入研究的异质性较高,可能与研究对象、研究时长、研究地区和肾功能损害的结局指标等差异有关;(2)肾功能损害的影响因素众多,本研究仅对符合纳入和排除标准的研究进行分析;(3)本研究仅对3篇及以上的文章中提到的影响因素进行Meta分析,可能导致结论存在偏倚。
综上所述,通过Meta分析,对根治性膀胱切除术后肾功能损害的发生率及影响因素进行整合,发现肾功能损害发生率较高,且与年龄、高血压病史、术后肾积水、尿路感染及吻合口狭窄等因素密切相关。临床医护人员应加强对术后肾功能的监测,针对部分可干预的影响因素(如术后肾积水、尿路感染等)制定有效措施,以降低肾功能损害的发生率。未来需开展更多设计良好的大样本、多中心的前瞻性研究为根治性膀胱切除术后肾功能损害的原因提供更有说服力的证据,完善其筛查评估工具,帮助医护人员更好地识别肾功能损害高危患者,对其及早进行干预。
-
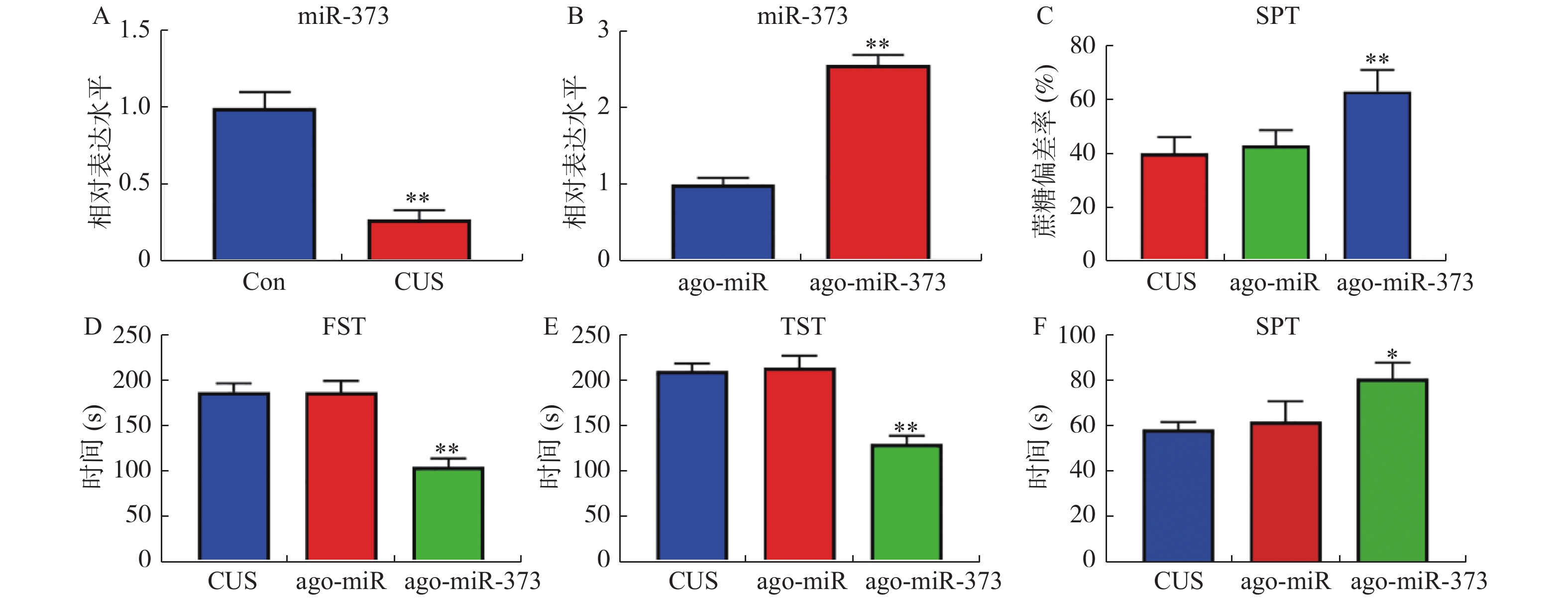
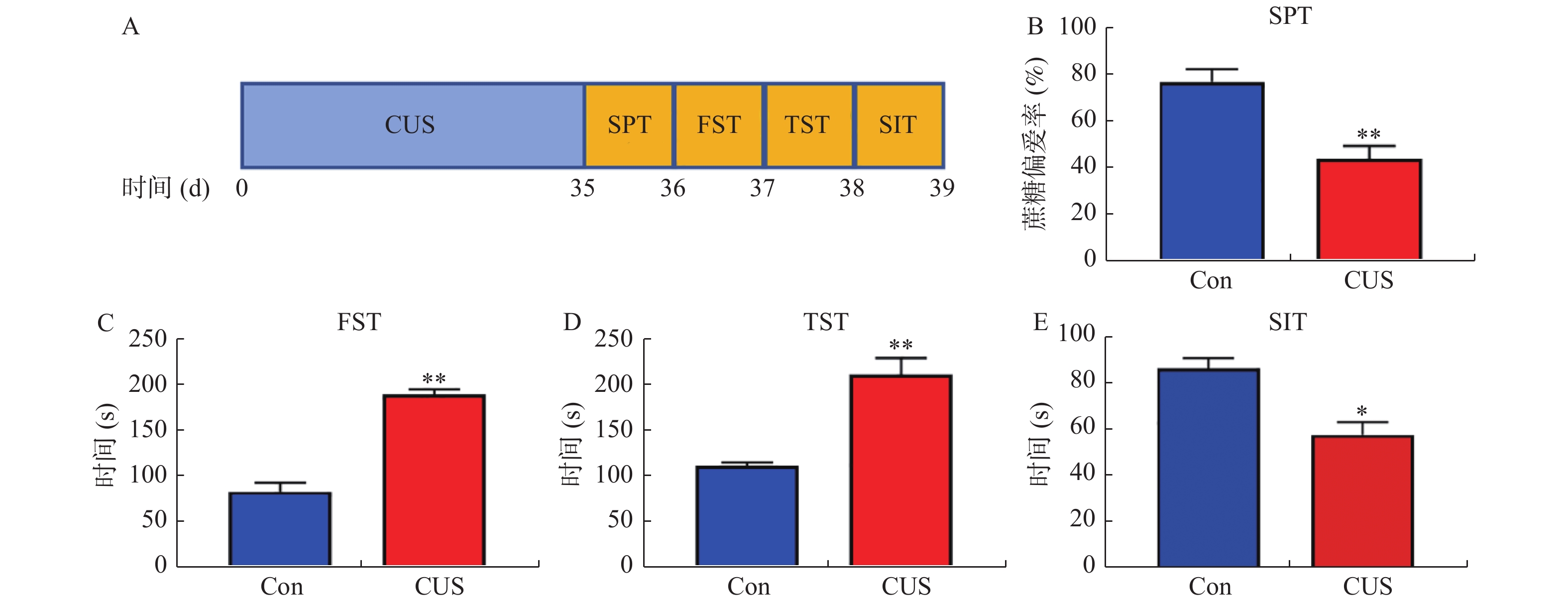
图 2 miR-373缓解抑郁症模型小鼠抑郁样行为
A和B:RT-qPCR检测小鼠中miR-373表达水平的结果。抑郁症小鼠模型尾静脉注射ago-miR及ago-miR-373,测量抑郁样行为的结果:C:SPT;D:FST;E:TST;F:SIT。注:图2A,与Con组比较,*P < 0.05,**P < 0.01;图2B,与ago-miR(无意义序列)比较,*P < 0.05,**P < 0.01;图2C-F,与CUS组比较,*P < 0.05,**P < 0.01。
Figure 2. miR-373 alleviates depression-like behavior in depression model mice
表 1 RT-qPCR引物序列
Table 1. RT-qPCR Primer Series
目标 正向引物(5′-3′) 反向引物(5′-3′) miR-373 ACUCAAAAUGGGGGCGGAAAGC CAGTGCGTGTCGTGGAGT U6 CCCTTCGGGGACATCCGATA TTTGTGCGTGTCATCCTTGC caspase-1 TGGATCTTCACAAGGGCGAC CAACACAGCAACCAGCAGAC NLRP3 CAGGATGGCTCTCGCTTCAT CTGACAGAACCGTGGGACTC IL-1β TGCCACCTTTTGACAGTGATG TTCTTGTGACCCTGAGCGAC IL-18 ACAGGACTGCCATCTTCTGC ATTGTTCCTGGGCCAAGAGG β-actin TTCCAGCCTTCCTTCTTG TGTCAACGTCACACTTCA -
[1] Malhi G S,Mann J J. Depression[J]. Lancet,2018,392(10161):2299-2312. doi: 10.1016/S0140-6736(18)31948-2 [2] Cruz-Pereira J S,Rea K,Nolan Y M,et al. Depression's Unholy Trinity:Dysregulated Stress,Immunity,and the Microbiome[J]. Annu Rev Psychol,2020,71:49-78. doi: 10.1146/annurev-psych-122216-011613 [3] Spellman T,Liston C. Toward Circuit Mechanisms of Pathophysiology in Depression[J]. Am J Psychiatry,2020,177(5):381-390. doi: 10.1176/appi.ajp.2020.20030280 [4] Dubovsky S L,Ghosh B M,Serotte J C,et al. Psychotic Depression:Diagnosis,Differential Diagnosis,and Treatment[J]. Psychother Psychosom,2021,90(3):160-177. doi: 10.1159/000511348 [5] Hammen C. Risk Factors for Depression:An Autobiographical Review[J]. Annu Rev Clin Psychol,2018,14:1-28. doi: 10.1146/annurev-clinpsy-050817-084811 [6] Menke A,Nitschke F,Hellmuth A,et al. Stress impairs response to antidepressants via HPA axis and immune system activation[J]. Brain Behav Immun,2021,93:132-140. doi: 10.1016/j.bbi.2020.12.033 [7] Miller A H,Raison C L. The role of inflammation in depression:from evolutionary imperative to modern treatment target[J]. Nat Rev Immunol,2016,16(1):22-34. doi: 10.1038/nri.2015.5 [8] Beurel E,Toups M,Nemeroff C B. The Bidirectional Relationship of Depression and Inflammation:Double Trouble[J]. Neuron,2020,107(2):234-256. doi: 10.1016/j.neuron.2020.06.002 [9] Nerurkar L,Siebert S,Mcinnes I B,et al. Rheumatoid arthritis and depression:an inflammatory perspective[J]. Lancet Psychiatry,2019,6(2):164-173. doi: 10.1016/S2215-0366(18)30255-4 [10] Yirmiya R,Rimmerman N,Reshef R. Depression as a microglial disease[J]. Trends Neurosci,2015,38(10):637-658. doi: 10.1016/j.tins.2015.08.001 [11] Jia X,Gao Z,Hu H. Microglia in depression:current perspectives[J]. Sci China Life Sci,2020. [12] Winkle M,El-Daly S M,Fabbri M,et al. Noncoding RNA therapeutics-challenges and potential solutions[J]. Nat Rev Drug Discov,2021,20(8):629-651. doi: 10.1038/s41573-021-00219-z [13] Makarova J,Turchinovich A,Shkurnikov M,et al. Extracellular miRNAs and Cell-Cell Communication:Problems and Prospects[J]. Trends Biochem Sci,2021,46(8):640-651. doi: 10.1016/j.tibs.2021.01.007 [14] Allen L,Dwivedi Y. MicroRNA mediators of early life stress vulnerability to depression and suicidal behavior[J]. Mol Psychiatry,2020,25(2):308-320. doi: 10.1038/s41380-019-0597-8 [15] Van Den Berg M M J,Krauskopf J,Ramaekers J G,et al. Circulating microRNAs as potential biomarkers for psychiatric and neurodegenerative disorders[J]. Prog Neurobiol,2020,185:101732. doi: 10.1016/j.pneurobio.2019.101732 [16] Surget A,Wang Y,Leman S,et al. Corticolimbic transcriptome changes are state-dependent and region-specific in a rodent model of depression and of antidepressant reversal[J]. Neuropsychopharmacology,2009,34(6):1363-80. doi: 10.1038/npp.2008.76 [17] Shen J,Li Y,Qu C,et al. The enriched environment ameliorates chronic unpredictable mild stress-induced depressive-like behaviors and cognitive impairment by activating the SIRT1/miR-134 signaling pathway in hippocampus[J]. J Affect Disord,2019,248:81-90. doi: 10.1016/j.jad.2019.01.031 [18] Li B,Han L,Cao B,et al. Use of magnoflorine-phospholipid complex to permeate blood-brain barrier and treat depression in the CUMS animal model[J]. Drug Deliv,2019,26(1):566-574. doi: 10.1080/10717544.2019.1616236 [19] Liu Z,Yang J,Fang Q,et al. MiRNA-199a-5p targets WNT2 to regulate depression through the CREB/BDNF signaling in hippocampal neuron[J]. Brain Behav,2021,11(8):e02107. [20] Yang J,Sun J,Lu Y,et al. Revision to psychopharmacology mRNA and microRNA profiles are associated with stress susceptibility and resilience induced by psychological stress in the prefrontal cortex[J]. Psychopharmacology(Berl),2020,237(10):3067-3093. doi: 10.1007/s00213-020-05593-x [21] Mclarnon J G. Roles of purinergic P2X(7)receptor in glioma and microglia in brain tumors[J]. Cancer Lett,2017,402:93-99. doi: 10.1016/j.canlet.2017.05.004 [22] Illes P,Khan T M,Rubini P. Neuronal P2X7 Receptors Revisited:Do They Really Exist?[J]. J Neurosci,2017,37(30):7049-7062. doi: 10.1523/JNEUROSCI.3103-16.2017 [23] Yue N,Huang H,Zhu X,et al. Activation of P2X7 receptor and NLRP3 inflammasome assembly in hippocampal glial cells mediates chronic stress-induced depressive-like behaviors[J]. J Neuroinflammation,2017,14(1):102. doi: 10.1186/s12974-017-0865-y [24] Albert P R,Le François B,Vahid-Ansari F. Genetic,epigenetic and posttranscriptional mechanisms for treatment of major depression:the 5-HT1A receptor gene as a paradigm[J]. J Psychiatry Neurosci,2019,44(3):164-176. doi: 10.1503/jpn.180209 [25] Yoshino Y,Roy B,Dwivedi Y. Differential and unique patterns of synaptic miRNA expression in dorsolateral prefrontal cortex of depressed subjects[J]. Neuropsychopharmacology,2021,46(5):900-910. doi: 10.1038/s41386-020-00861-y [26] Roy B,Dunbar M,Shelton R C,et al. Identification of MicroRNA-124-3p as a Putative Epigenetic Signature of Major Depressive Disorder[J]. Neuropsychopharmacology,2017,42(4):864-875. doi: 10.1038/npp.2016.175 [27] Xu J,Wang R,Liu Y,et al. FKBP5 and specific microRNAs via glucocorticoid receptor in the basolateral amygdala involved in the susceptibility to depressive disorder in early adolescent stressed rats[J]. Journal of Psychiatric Research,2017,95:102-113. doi: 10.1016/j.jpsychires.2017.08.010 [28] Li C,Feng S,Chen L. MSC-AS1 knockdown inhibits cell growth and temozolomide resistance by regulating miR-373-3p/CPEB4 axis in glioma through PI3K/Akt pathway[J]. Mol Cell Biochem,2021,476(2):699-713. doi: 10.1007/s11010-020-03937-x [29] Peng T,Wang T,Liu G,et al. Effects of miR-373 Inhibition on Glioblastoma Growth by Reducing Limk1 In Vitro[J]. J Immunol Res,2020,2020:7671502. [30] Slowik A,Lammerding L,Hoffmann S,et al. Brain inflammasomes in stroke and depressive disorders:Regulation by oestrogen[J]. J Neuroendocrinol,2018,30(2):9-12. [31] Li Y,Song W,Tong Y,et al. Isoliquiritin ameliorates depression by suppressing NLRP3-mediated pyroptosis via miRNA-27a/SYK/NF-κB axis[J]. J Neuroinflammation,2021,18(1):1. doi: 10.1186/s12974-020-02040-8 [32] Tian D D,Wang M,Liu A,et al. Antidepressant Effect of Paeoniflorin Is Through Inhibiting Pyroptosis CASP-11/GSDMD Pathway[J]. Mol Neurobiol,2021,58(2):761-776. doi: 10.1007/s12035-020-02144-5 [33] Arioz B I,Tastan B,Tarakcioglu E,et al. Melatonin Attenuates LPS-Induced Acute Depressive-Like Behaviors and Microglial NLRP3 Inflammasome Activation Through the SIRT1/Nrf2 Pathway[J]. Front Immunol,2019,10:1511. doi: 10.3389/fimmu.2019.01511 [34] Li X,Luo Z,Gu C,et al. Common variants on 6q16.2,12q24.31 and 16p13.3 are associated with major depressive disorder[J]. Neuropsychopharmacology,2018,43(10):2146-2153. doi: 10.1038/s41386-018-0078-9 [35] Surprenant A,Rassendren F,Kawashima E,et al. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7)[J]. Science,1996,272(5262):735-738. doi: 10.1126/science.272.5262.735 [36] Yang Y,Xing M J,Li Y,et al. Reduced NLRP3 inflammasome expression in the brain is associated with stress resilience[J]. Psychoneuroendocrinology,2021,128:105211. doi: 10.1016/j.psyneuen.2021.105211 [37] Zunszain P A,Anacker C,Cattaneo A,et al. Interleukin-1β:a new regulator of the kynurenine pathway affecting human hippocampal neurogenesis[J]. Neuropsychopharmacology,2012,37(4):939-949. doi: 10.1038/npp.2011.277 [38] Su W J,Zhang T,Jiang C L,et al. Clemastine Alleviates Depressive-Like Behavior Through Reversing the Imbalance of Microglia-Related Pro-inflammatory State in Mouse Hippocampus[J]. Front Cell Neurosci,2018,12:412. [39] Basso A M,Bratcher N A,Harris R R,et al. Behavioral profile of P2X7 receptor knockout mice in animal models of depression and anxiety:relevance for neuropsychiatric disorders[J]. Behav Brain Res,2009,198(1):83-90. doi: 10.1016/j.bbr.2008.10.018 [40] Tan S,Wang Y,Chen K,et al. Ketamine Alleviates Depressive-Like Behaviors via Down-Regulating Inflammatory Cytokines Induced by Chronic Restraint Stress in Mice[J]. Biol Pharm Bull,2017,40(8):1260-1267. doi: 10.1248/bpb.b17-00131 -







 下载:
下载:

 下载:
下载: