Long Non-coding RNA-p21 Regulates the MicroRNA-9 / Sirtuin-1 Signaling Pathway to Reverse Oxaliplatin Resistance in Colorectal Cancer Cells
-
摘要:
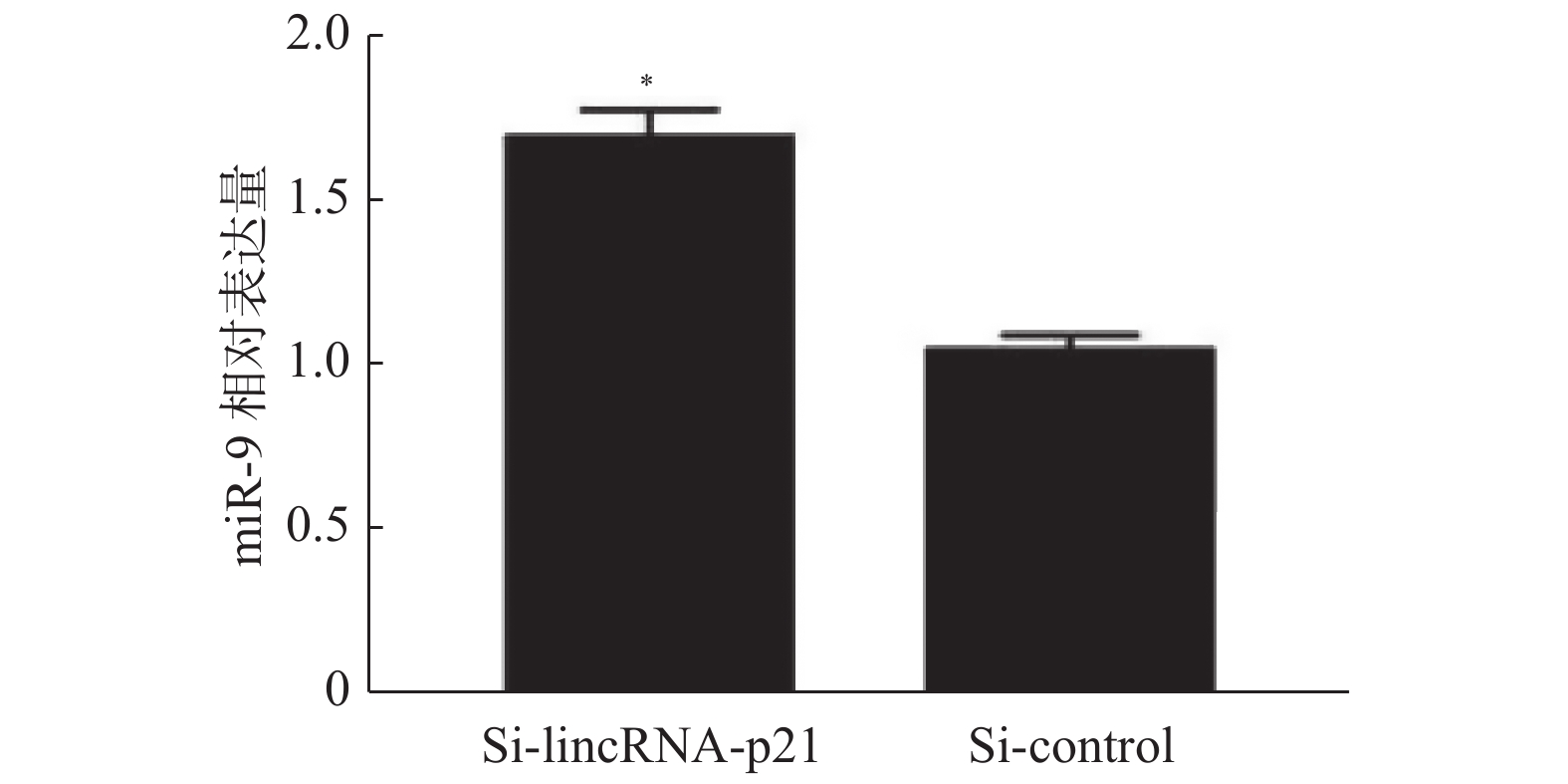
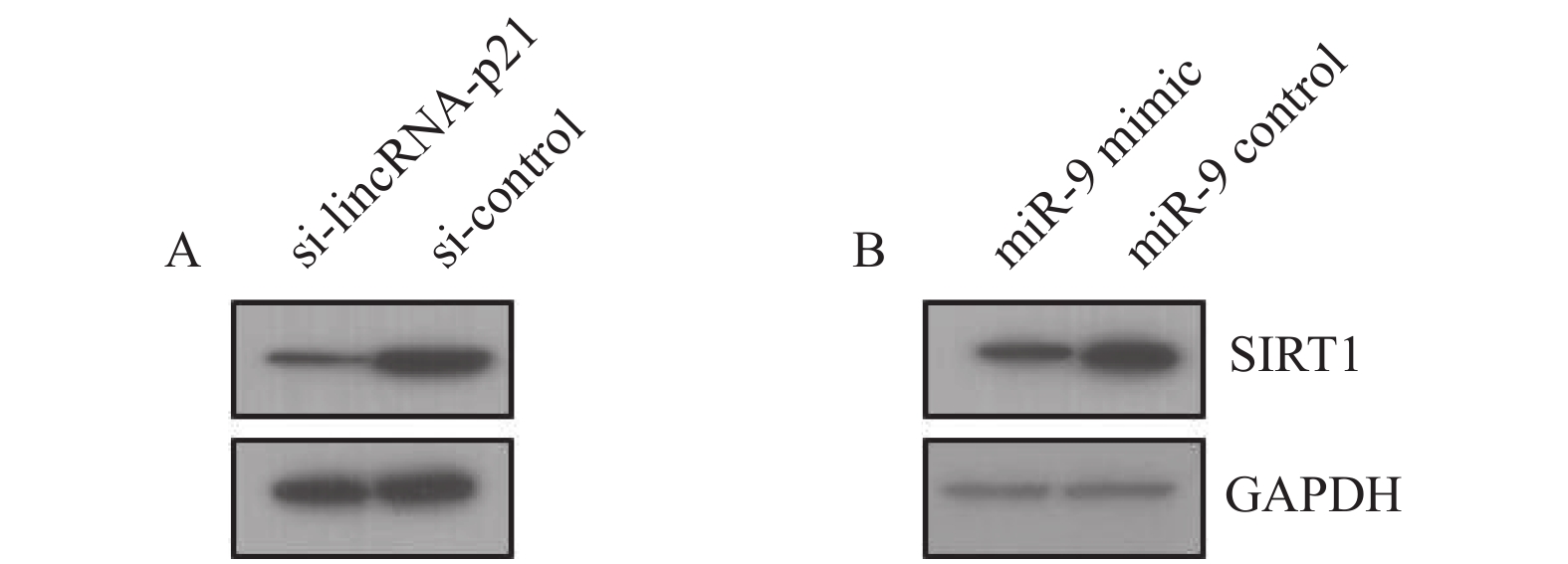
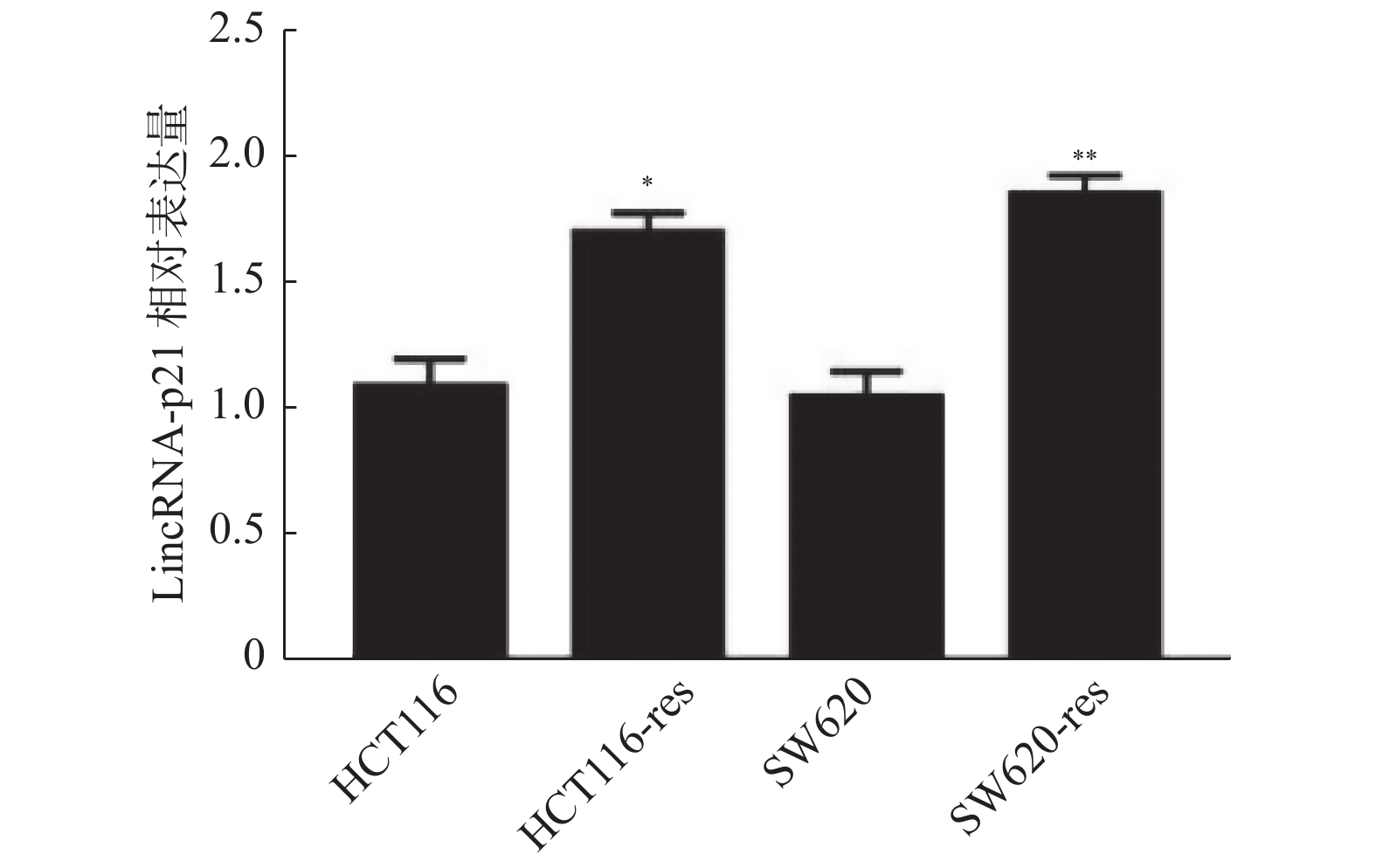
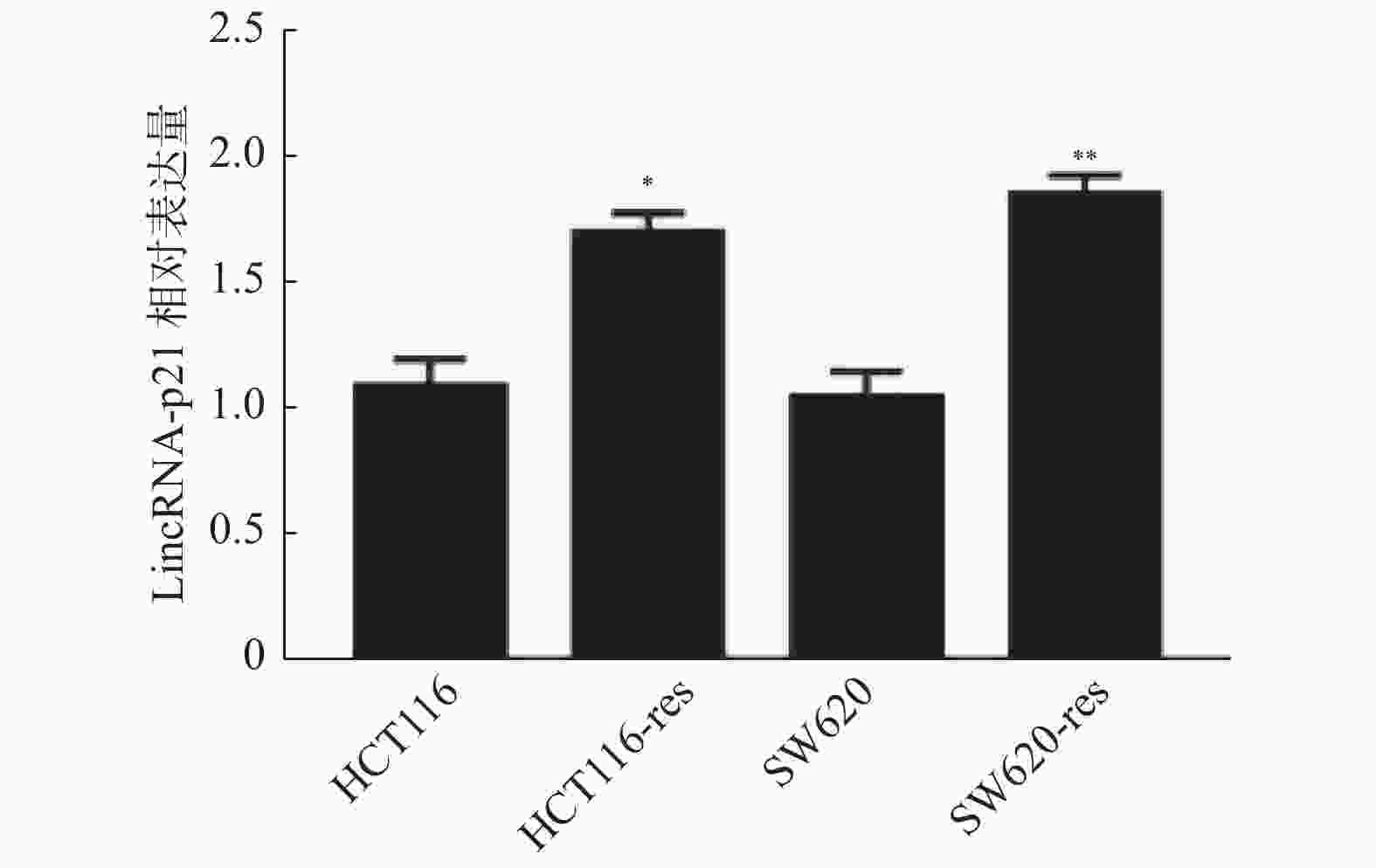
目的 探讨长链非编码RNA(LncRNA)-p21调控微小RNA-9(miR-9)/去乙酰化酶1(SIRT1)信号通路逆转结直肠癌(CRC)奥沙利铂相关的细胞自噬及耐药性的分子机制。 方法 采用qPCR方法LncRNA-p21的表达检测,Westbloting blotting法检测细胞自噬相关蛋白(微管相关蛋白1轻链3-Ⅰ((LC3-I)、微管相关蛋白1轻链3-Ⅱ(LC3-Ⅱ)),自噬底物 (P62)、去乙酰化酶1(Sirtuin-1,SIRT1)、miR-9 的表达水平;克隆形成实验检测细胞活性。 结果 (1)LncRNA-p21 在奥沙利铂耐药的结直肠肿瘤细胞 HCT116,SW620 中高表达,差异有统计学意义(P < 0.001);(2)敲降 LncRNA-p21 可抑制细胞自噬,改善 HCT116 细胞对奥沙利铂的化疗敏感性;(3)敲降 LncRNA-p21 后 miR-9 表达上调,而miR-9 过表达可增强 HCT116 细胞对奥沙利铂的化疗敏感性,差异有统计学意义(P < 0.001);(4)同时,SIRT1 的表达受到 LncRNA-p21 和 miR-9 的调控。 结论 结直肠肿瘤对于化疗药奥沙利铂抵抗可能由LncRNA-p21诱导细胞自噬增强而引起,其过程可能通过 LncRNA-p21调控miR-9/SIRT1信号通路而实现。 -
关键词:
- 奥沙利铂 /
- 长链非编码RNA-p21 /
- miR-9/SIRT1信号通路 /
- 耐药性 /
- 细胞自噬 /
- 结直肠癌
Abstract:Objectives To discuss the molecular mechanism of long non-coding RNA(lncRNA)-P21 regulating (miR-9) /Sirtuin-1(SIRT1) signaling pathway in reversing colorectal cancer (CRC) cell autophagy and drug resistance. Methods Real-time fluorescent quantitative PCR (RT-qPCR) was employed to assess the expression level of LncRNA-p21 in cell lines. Western blotting was performed to measure the expression of SIRT1, miR-9 and autophagy related proteins in CRC cell. Clone formation assay was used to detect the cell activity. Results (1) LncRNA-p21 was highly expressed in oxaliplatin - resistant CRC cells HCT116 and SW620. (2) The knockdown of LncRNA-p21was able to inhibit autophagy and improve the chemotherapy sensitivity of HCT116 cells to oxaliplatin. (3) After LncRNA-p21 was knocked down, the expression of miR-9 was up-regulated, while the overexpression of miR-9 could enhance the chemotherapy sensitivity of HCT116 cells to oxaliplatin. Meanwhile, the expression of SIRT1 was regulated by LncRNA-p21 and miR-9. Conclusion CRC resistance to chemotherapy drug oxaliplatin may be caused by autophagy induced by LncRNA-P21, which may be realized through the regulation of the miR-9 /SIRT1 signaling pathway by LncRNA-P21. -
Key words:
- Oxaliplatin /
- LncRNA-p21 /
- miR-9/SIRT1 signaling pathways /
- Tolerance /
- Autophagy /
- Colorectal cancer
-
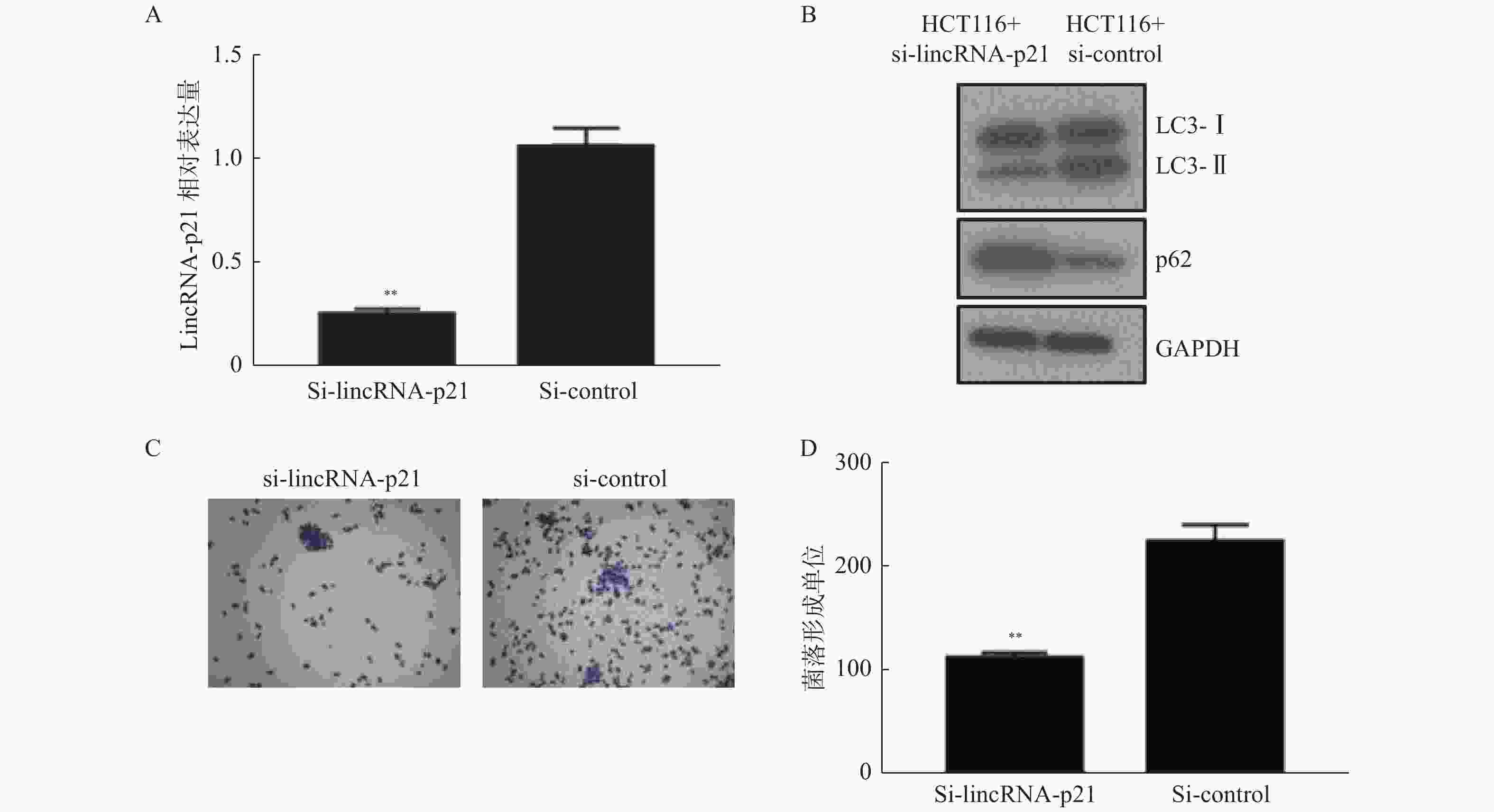
图 2 敲降 LncRNA-p21 能够提高 HCT116 对奥沙利铂的化疗敏感性
A:通过qPCR 检测敲降 HCT116 细胞中 LncRNA-p21的敲降效率;B:敲降 LncRNA-p21 以及对照 HCT116 细胞中检测自噬特异性分子LC3-Ⅱ/LC3-Ⅰ,自噬底物 P62; C、D:将敲降 LncRNA-p21 以及对照HCT116 细胞使用奥沙利铂处理后,检测克隆形成情况。 与对照组比较,**P < 0.001 。
Figure 2. Knockdown lncrNA-P21 can increase the chemosensitivity of HCT116 to oxaliplatin.
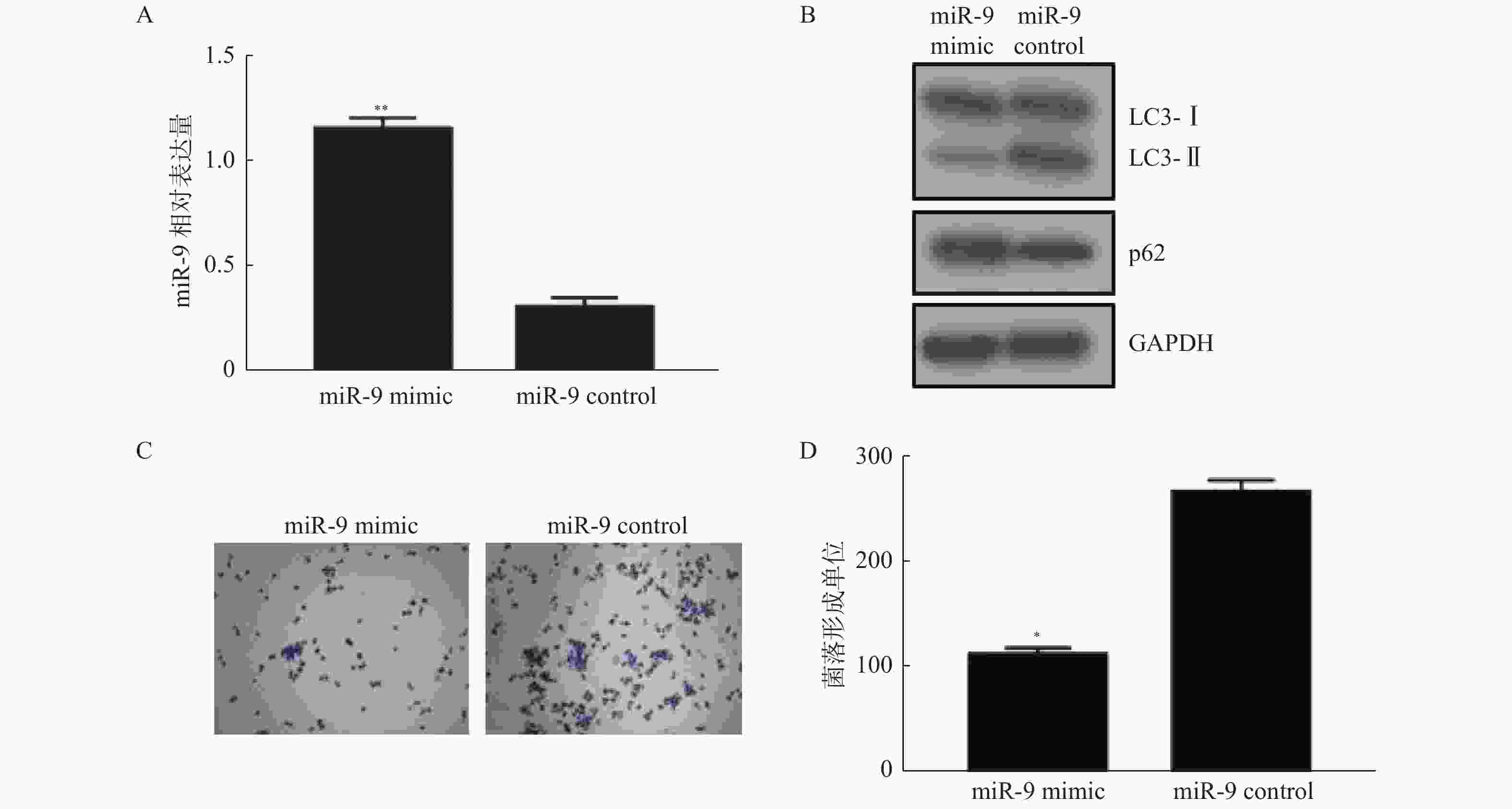
图 4 过表达 miR-9 的增强 HCT116 细胞对奥沙利铂的化疗敏感性
A:通过细胞转染的方式在 HCT116 细胞中过表达 miR-9,使用 qPCR 检测转染效率;B:在过表达miR-9 的细胞中检测自噬特异性分子 LC3-Ⅱ/LC3-Ⅰ,自噬底物 P62;C、D:在过表达 miR-9 的 HCT116 细胞中使用奥沙利铂处理后检测克隆形成,发现过表达 miR-9 可改善 HCT116 细胞对奥沙利铂的化疗抵抗。 与对照组比较,*P < 0.01,**P < 0.001。
Figure 4. Overexpression of miR-9 enhances the chemosensitivity of HCT116 cells to oxaliplatin
-
[1] Hsu H H,Chen M C,Baskaran R,et al. Oxaliplatin resistance in colorectal cancer cells is mediated via activation of ABCG2 to alleviate ER stress induced apoptosis[J]. J Cell Physiol,2018,233(7):5458-5467. doi: 10.1002/jcp.26406 [2] Wang B,Ogata H,Takishima Y,et al. A novel combination therapy for human oxaliplatin-resistant colorectal cancer using oxaliplatin and coxsackievirus A11[J]. Anticancer Res,2018,38(11):6121-6126. doi: 10.21873/anticanres.12963 [3] Munakata K, Uemura M, Tanaka S, et al. Cancer stem-like properties in colorectal cancer cells with low proteasome activity[J]. Clin Cancer Res,2016,22(21):5277-5286. [4] Jeong S,Kim B G,Kim D Y,et al. Cannabidiol overcomes oxaliplatin resistance by enhancing NOS3- and SOD2-induced autophagy in human colorectal cancer cells[J]. Cancers (Basel),2019,11(6):781. doi: 10.3390/cancers11060781 [5] Yang H Z,Ma Y,Zhou Y,et al. Autophagy contributes to the enrichment and survival of colorectal cancer stem cells under oxaliplatin treatment[J]. Cancer Lett,2015,361(1):128-136. doi: 10.1016/j.canlet.2015.02.045 [6] Wu G,Cai J,Han Y,et al. LincRNA-p21 regulates neointima formation,vascular smooth muscle cell proliferation,apoptosis,and atherosclerosis by enhancing p53 activity[J]. Circulation,2014,130(17):1452-1465. doi: 10.1161/CIRCULATIONAHA.114.011675 [7] Jin S,Yang X,Li J,et al. p53-targeted lincRNA-p21 acts as a tumor suppressor by inhibiting JAK2/STAT3 signaling pathways in head and neck squamous cell carcinoma[J]. Mol Cancer,2019,18(1):38. doi: 10.1186/s12943-019-0993-3 [8] Ding G,Peng Z,Shang J,et al. LincRNA-p21 inhibits invasion and metastasis of hepatocellular carcinoma through miR-9/E-cadherin cascade signaling pathway molecular mechanism[J]. Onco Targets Ther,2017,30,(10):3241-3247. [9] Zhou D M,Sun L L,Zhu J,et al. MiR-9 promotes angiogenesis of endothelial progenitor cell to facilitate thrombi recanalization via targeting TRPM7 through PI3K/Akt/autophagy pathway[J]. J Cell Mol Med,2020,24(8):4624-4632. doi: 10.1111/jcmm.15124 [10] Bhardwaj M,Cho H J,Paul S,et al. Vitexin induces apoptosis by suppressing autophagy in multi-drug resistant colorectal cancer cells[J]. Oncotarget,2018,9(3):3278-3291. doi: 10.18632/oncotarget.22890 [11] Lin G L,Ting H J,Tseng T C, et al. Modulation of the mRNA-binding protein HuR as a novel reversal mechanism of epirubicin-triggered multidrug resistance in colorectal cancer cells[J]. PLoS One,2017,12(10):e0185625. doi: 10.1371/journal.pone.0185625 [12] Klionsky D J,Abdelmohsen K,Abe A,et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition)[J]. Autophagy,2016,12(1):1-22. doi: 10.1080/15548627.2015.1100356 [13] Shao Q,Xu J,Deng R,et al. SNHG 6 promotes the progression of colon and rectal adenocarcinoma via miR-101-3p and Wnt/β-catenin signaling pathway[J]. BMC Gastroenterol,2019,19(1):163. doi: 10.1186/s12876-019-1080-3 [14] Tan Y T,Lin J F,Li T,et al. LncRNA-mediated posttranslational modifications and reprogramming of energy metabolism in cancer[J]. Cancer Commun (Lond),2021,41(2):109-120. [15] Wang J,Lei Z J,Guo Y,et al. miRNA-regulated delivery of lincRNA-p21 suppresses β-catenin signaling and tumorigenicity of colorectal cancer stem cells[J]. Oncotarget,2015,6(35):37852-37870. doi: 10.18632/oncotarget.5635 -





 下载:
下载: