M2 Macrophage-derived Exosome miR-1246 Regulates the Growth and Invasion of Gastric Cancer Cells
-
摘要:
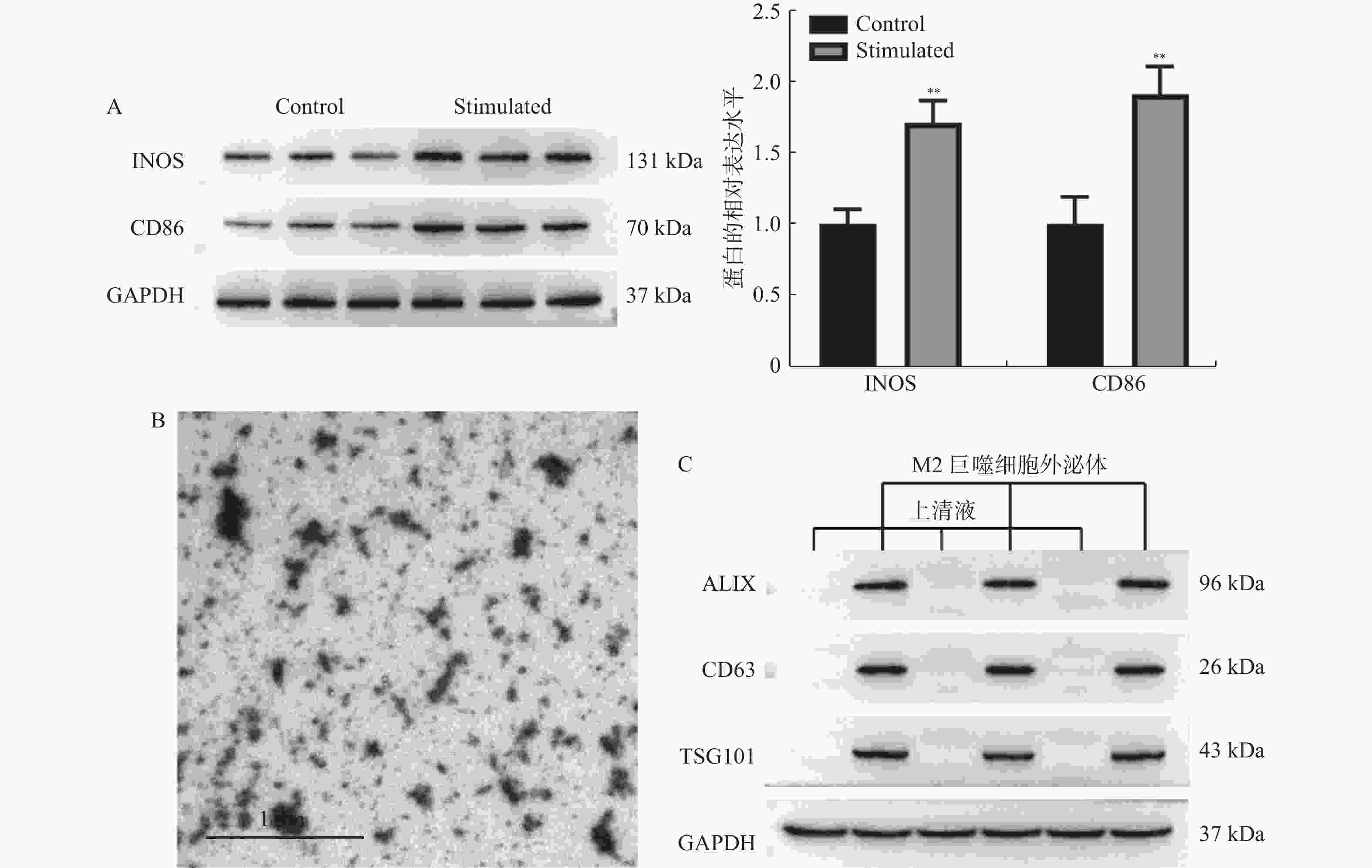
目的 探讨M2巨噬细胞来源的外泌体miR-1246对胃癌AGS细胞增殖,凋亡和侵袭的影响。 方法 采用IL-4和IL-13诱导M2巨噬细胞后,分离其外泌体,并通过透射电镜和免疫印迹法进行鉴定。M2巨噬细胞分别转染NC inhibitor和miR-1246 inhibitor后,分离对应外泌体与AGS细胞共培养,并采用CCK-8,Annexin V-FITC/PI和Transwell分别检测AGS细胞增殖,凋亡和侵袭。TargetScan数据库预测miR-1246下游靶标,并通过双萤光素酶报告基因实验对miR-1246和GSK3B的靶向关系进行验证。 结果 M2巨噬细胞中分离的外泌体大小为50~150 nm,且表达ALIX,CD63和TSG101。M2巨噬细胞来源外泌体增加AGS细胞活力(P < 0.05)和侵袭细胞数(P < 0.01),并降低其凋亡比例(P < 0.01)。敲低外泌体中miR-1246的表达,AGS细胞的表型变化得到回复(P < 0.01)。外泌体miR-1246靶向GSK3B,并调控β-catenin和c-Myc的表达,M2巨噬细胞来源外泌体miR-1246靶向GSK3B促进胃癌细胞增殖和侵袭、并抑制其凋亡(P < 0.001)。 结论 M2巨噬细胞来源外泌体miR-1246靶向GSK3B介导Wnt通路激活促进胃癌细胞增殖和侵袭,并抑制其凋亡。 Abstract:Objective To investigate the effects of M2 macrophage-derived exosome miR-1246 on the proliferation, apoptosis and invasion of AGS cells. Methods After induction of M2 macrophages using LPS and IFN-γ, their exosomes were isolated and identified by transmission electron microscopy and western blot. After M2 macrophages were transfected with NC inhibitor and miR-1246 inhibitor respectively, the corresponding exosomes were isolated and co-cultured with AGS cells, and proliferation, apoptosis, and invasion of AGS cells were detected by CCK-8, Annexin V-FITC/PI and Transwell, respectively. TargetScan database predicted miR-1246 downstream targets and the targeting relationship between miR-1246 and GSK3B was validated by dual-luciferase reporter gene assays. Results The exosomes isolated from M2 macrophages were 30-150 nm in size and expressed ALIX, CD63 and TSG101. M2 macrophage-derived exosomes increased the viability and invasive cell count of AGS cells and decreased their apoptotic ratio. Phenotypic changes in AGS cells were reverted by knocking down the expression of miR-1246 in exosomes. Exosome miR-1246 targets GSK3B and upregulated the expression of β-catenin and c-Myc. Conclusion M2 macrophage-derived exosome miR-1246 mediates Wnt pathway activation to promote proliferation and invasion of gastric cancer cells and inhibit their apoptosis via targeting GSK3B. -
Key words:
- Gastric cancer /
- Macrophages /
- Exosomes /
- miR-1246 /
- Wnt signaling pathway
-
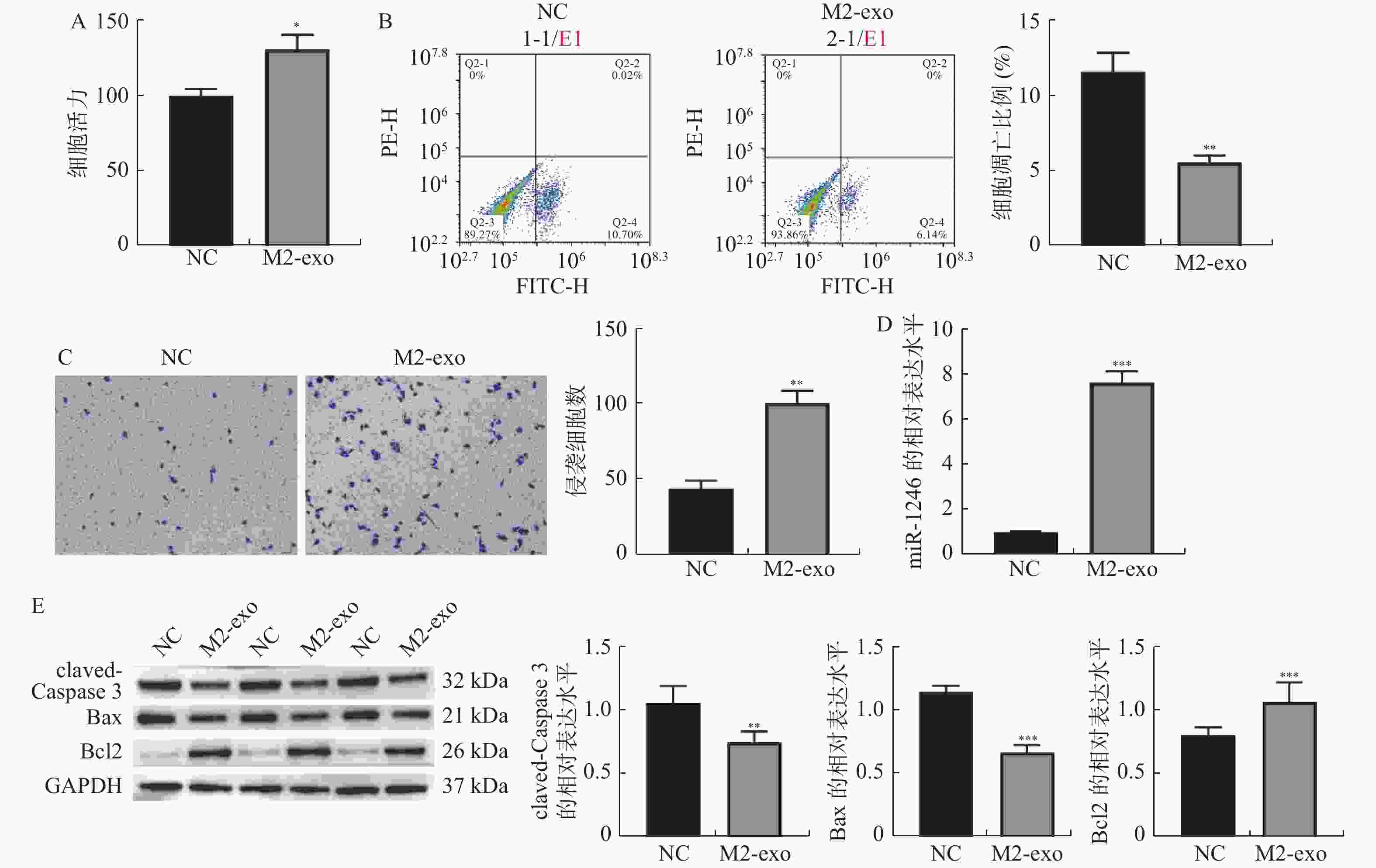
图 2 M2巨噬细胞来源外泌体促进AGS细胞增殖和侵袭,并抑制其凋亡
A:CCK-8检测M2巨噬细胞来源外泌体对AGS细胞活力的影响;B:Annexin V-FITC/PI检测AGS细胞凋亡的流式结果;C:Transwell检测AGS细胞侵袭的代表性图片和统计分析(×40);D:RT-qPCR检测M2巨噬细胞来源外泌体对AGS细胞中miR-1246表达的影响;E:Western blot 检测凋亡相关蛋白claved-caspase3,BAX以及BCL2表达。相较于NC组,*P < 0.05,**P < 0.01,***P < 0.001。
Figure 2. M2 macrophage-derived exosomes promoted the proliferation and invasion of AGS cells,and inhibited their apoptosis
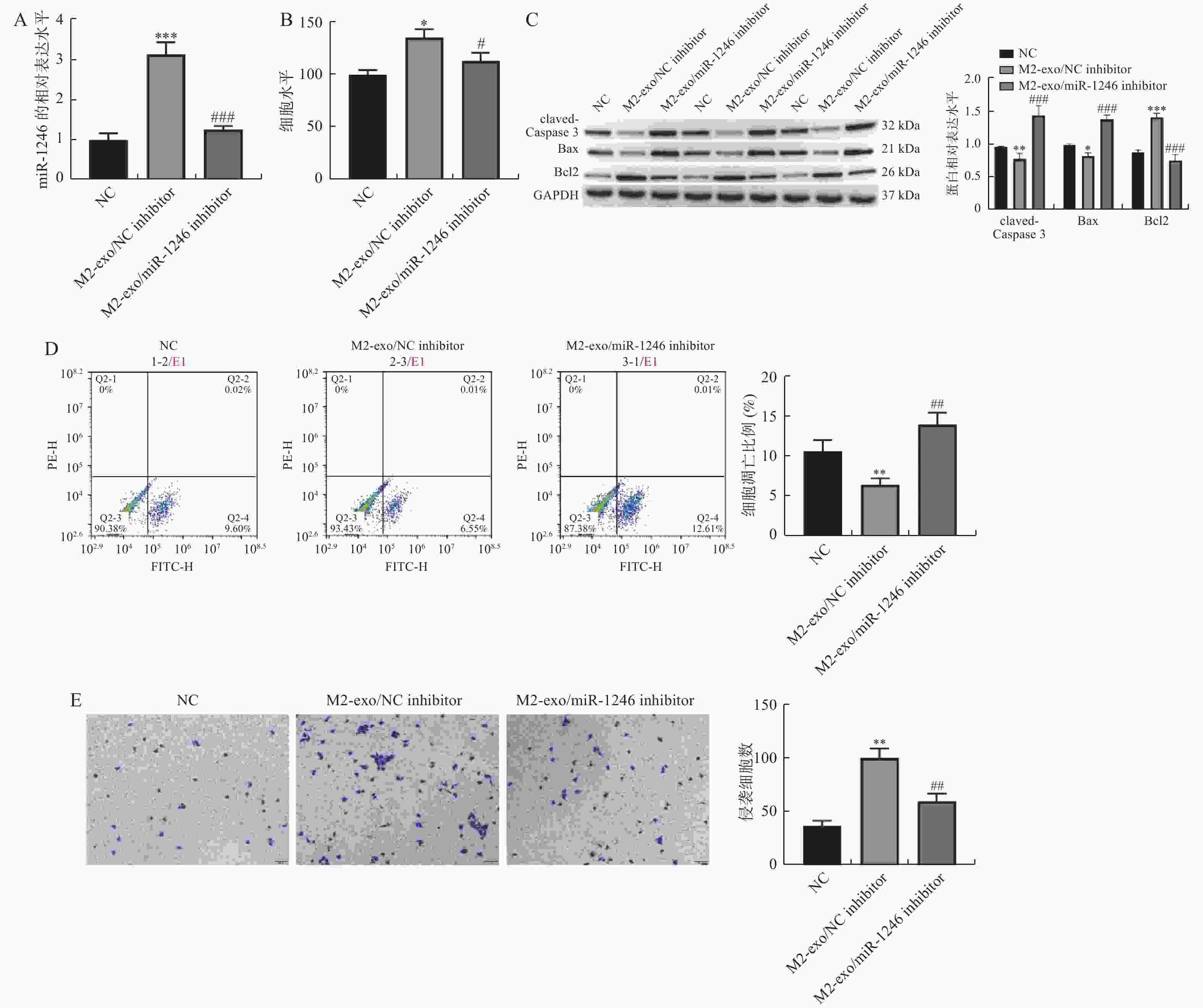
图 3 M2巨噬细胞来源外泌体miR-1246促进AGS细胞增殖和侵袭,并抑制其凋亡
A:RT-qPCR检测各组AGS细胞中miR-1246的表达变化;B:由CCK-8试剂盒检测得到的AGS细胞活力变化;C:Western blot 检测凋亡相关蛋白claved-caspase3,BAX以及BCL2表达;D:AGS细胞凋亡比例的流式代表性图片和统计分析结果;E:Transwell检测AGS细胞的侵袭变化(×40)。相较于NC组,*P < 0.05,**P < 0.01,***P < 0.001;相较于M2-exo/NCinhibitor组,#P < 0.05,##P < 0.01,###P < 0.001。
Figure 3. M2 macrophage-derived exosome miR-1246 promoted the proliferation and invasion of AGS cells,and inhibited their apoptosis
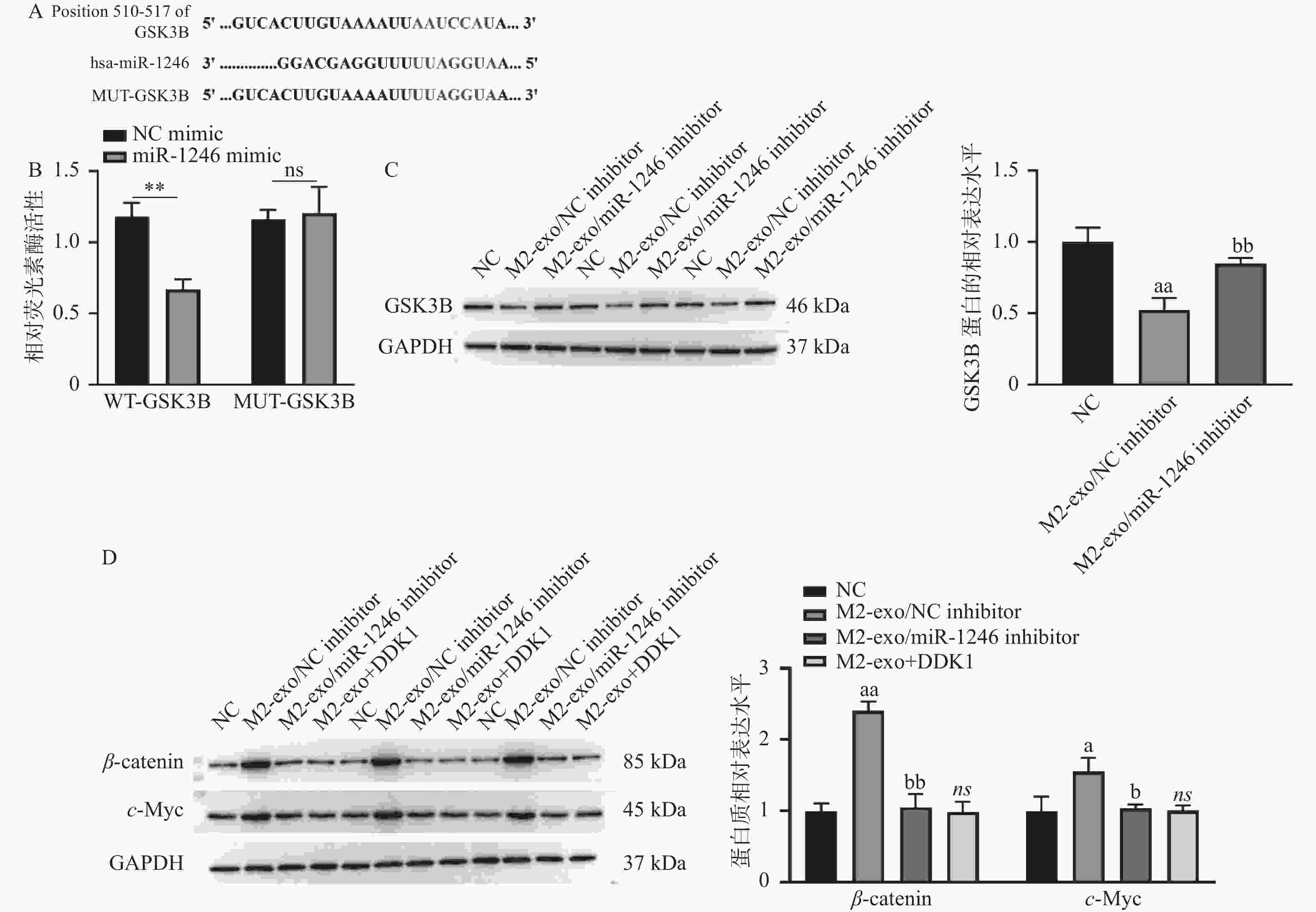
图 4 miR-1246靶向调控Wnt信号通路
A:TargetScan数据库预测得到的miR-1246与GSK3B的潜在结合序列;B:双荧光素酶报告基因实验验证miR-1246与GSK3B的靶向关系;C:WB检测M2巨噬细胞来源外泌体miR-1246对AGS细胞中GSK3B蛋白表达的影响;D:WB检测M2巨噬细胞来源外泌体miR-1246对AGS细胞中Wnt信号通路的影响。相较于NCmimic组,**P < 0.01;相较于NC组,aP < 0.05,aaP < 0.01;相较于M2-exo/NCinhibitor组,bP < 0.05,bbP < 0.01;ns表示差异无统计学意义。
Figure 4. miR-1246 targets the Wnt signaling pathway
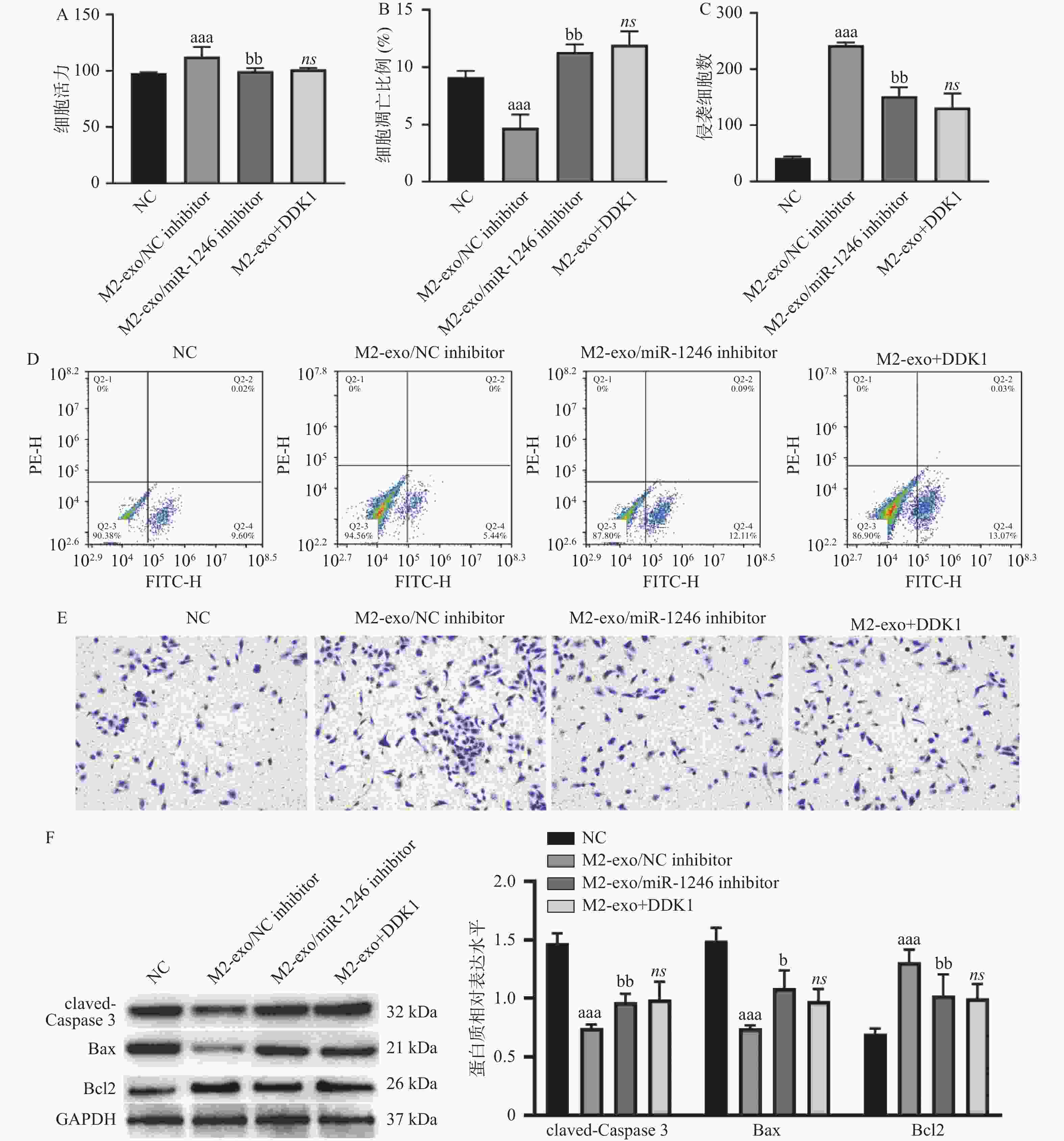
图 5 M2巨噬细胞来源外泌体miR-1246靶向GSK3B促进胃癌细胞增殖和侵袭、并抑制其凋亡
A:由CCK-8试剂盒检测得到的AGS细胞活力变化;B:AGS细胞凋亡比例的统计分析结果;C:Transwell检测AGS细胞的侵袭变化统计分析结果;D:AGS细胞凋亡比例的流式代表性图片;E:Transwell检测AGS细胞的侵袭变化代表性图片(×40);F:Western blot 检测凋亡相关蛋白claved-caspase3,BAX以及BCL2表达。相较于NC组,aP < 0.05,aaP < 0.01,aaaP < 0.001;相较于M2-exo/NCinhibitor组,bP < 0.05,bbP < 0.01;ns表示差异无统计学意义。
Figure 5. M2 macrophage-derived exosome miR-1246 targets GSK3B to promote proliferation and invasion and inhibit apoptosis of gastric cancer cells
-
[1] Thrift A P,El-Serag H B. Burden of gastric cancer[J]. Clin Gastroenterol Hepatol,2020,18(3):534-542. doi: 10.1016/j.cgh.2019.07.045 [2] Fitzmaurice C,Abate D,Abbasi N,et al. Global,regional,and national cancer incidence,mortality,years of life lost,years lived with disability,and disability-adjusted life-years for 29 cancer groups,1990 to 2017: A systematic analysis for the global burden of disease study[J]. JAMA Oncol,2019,5(12):1749-1768. doi: 10.1001/jamaoncol.2019.2996 [3] 曹毛毛,李贺,孙殿钦,等. 2000—2019年中国胃癌流行病学趋势分析[J]. 中华消化外科杂志,2021,20(1):8. [4] Sung H,Ferlay J,Siegel R L,et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660 [5] Arnold M,Abnet C C,Neale R E,et al. Global burden of 5 major types of gastrointestinal cancer[J]. Gastroenterology,2020,159(1):335-349.e15. doi: 10.1053/j.gastro.2020.02.068 [6] Hegde P S,Chen D S. Top 10 challenges in cancer immunotherapy[J]. Immunity,2020,52(1):17-35. doi: 10.1016/j.immuni.2019.12.011 [7] Vitale I,Manic G,Coussens L M,et al. Macrophages and metabolism in the tumor microenvironment[J]. Cell Metab,2019,30(1):36-50. doi: 10.1016/j.cmet.2019.06.001 [8] 王一晨,杨文山,董宪喆,等. 肿瘤相关巨噬细胞的作用综述[J]. 解放军医学院学报,2021,42(12):1315-1321. doi: 10.3969/j.issn.2095-5227.2021.12.017 [9] Xia Y,Rao L,Yao H,et al. Engineering macrophages for cancer immunotherapy and drug delivery[J]. Adv Mater,2020,32(40):e2002054. doi: 10.1002/adma.202002054 [10] Mohapatra S,Pioppini C,Ozpolat B,et al. Non-coding RNAs regulation of macrophage polarization in cancer[J]. Mol Cancer,2021,20(1):24. doi: 10.1186/s12943-021-01313-x [11] 谢玙玙,段昕所. 肿瘤微环境下巨噬细胞的极化和靶向治疗意义[J]. 华西医学,2021,36(5):679-685. [12] Kalluri R,Lebleu V S. The biology,function,and biomedical applications of exosomes[J]. Science,2020,367(6478):eaau6977. [13] 王莹,杨婷蓉,陈雅,等. 外泌体的生物学特征及其作为靶向药物载体在恶性肿瘤的应用[J]. 肿瘤代谢与营养电子杂志,2021,8(6):6. [14] 徐锋,张真发. 肿瘤源性外泌体调节肺癌免疫微环境及作为肺癌生物标志物的应用[J]. 癌症,2021,40(9):6. [15] Mao X,Xu J,Wang W,et al. Crosstalk between cancer-associated fibroblasts and immune cells in the tumor microenvironment: new findings and future perspectives[J]. Mol Cancer,2021,20(1):131. doi: 10.1186/s12943-021-01428-1 [16] Wei L,Sun J,Zhang N,et al. Noncoding RNAs in gastric cancer: implications for drug resistance[J]. Mol Cancer,2020,19(1):62. doi: 10.1186/s12943-020-01185-7 [17] Shi Y,Wang Z,Zhu X,et al. Exosomal miR-1246 in serum as a potential biomarker for early diagnosis of gastric cancer[J]. Int J Clin Oncol,2020,25(1):89-99. doi: 10.1007/s10147-019-01532-9 [18] Qian X,Xie F,Wei H,et al. Identification of key circulating exosomal microRNAs in gastric cancer[J]. Front Oncol,2021,11(1):693360. doi: 10.3389/fonc.2021.693360 [19] Yang Y,Guo Z,Chen W,et al. M2 macrophage-derived exosomes promote angiogenesis and growth of pancreatic ductal adenocarcinoma by targeting E2F2[J]. Mol Ther,2021,29(3):1226-1238. doi: 10.1016/j.ymthe.2020.11.024 [20] Wortzel I,Dror S,Kenific C M,et al. Exosome-mediated metastasis: communication from a distance[J]. Dev Cell,2019,49(3):347-360. doi: 10.1016/j.devcel.2019.04.011 [21] Doyle L M,Wang M Z. Overview of extracellular vesicles,their origin,composition,purpose,and methods for exosome isolation and analysis[J]. Cells,2019,8(7):727. [22] Pittet M J,Michielin O,Migliorini D. Clinical relevance of tumour-associated macrophages[J]. Nat Rev Clin Oncol,2022,19(6):402-421. doi: 10.1038/s41571-022-00620-6 [23] Zheng P,Chen L,Yuan X,et al. Exosomal transfer of tumor-associated macrophage-derived miR-21 confers cisplatin resistance in gastric cancer cells[J]. J Exp Clin Cancer Res,2017,36(1):53. doi: 10.1186/s13046-017-0528-y [24] Yang X,Cai S,Shu Y,et al. Exosomal miR-487a derived from m2 macrophage promotes the progression of gastric cancer[J]. Cell Cycle,2021,20(4):434-444. doi: 10.1080/15384101.2021.1878326 [25] Lin S S,Peng C Y,Liao Y W,et al. MiR-1246 targets CCNG2 to enhance cancer stemness and chemoresistance in oral carcinomas[J]. Cancers (Basel),2018,10(8):272. [26] Xu X,Cao L,Zhang Y,et al. MicroRNA-1246 inhibits cell invasion and epithelial mesenchymal transition process by targeting CXCR4 in lung cancer cells[J]. Cancer Biomark,2018,21(2):251-260. doi: 10.3233/CBM-170317 [27] Zhang Y,Wang X. Targeting the Wnt/β-catenin signaling pathway in cancer[J]. J Hematol Oncol,2020,13(1):165. doi: 10.1186/s13045-020-00990-3 [28] Yu F,Yu C,Li F,et al. Wnt/β-catenin signaling in cancers and targeted therapies[J]. Signal Transduct Target Ther,2021,6(1):307. doi: 10.1038/s41392-021-00701-5 [29] Zhang X,Zhong S,Xu Y,et al. MicroRNA-3646 contributes to docetaxel resistance in human breast cancer cells by GSK-3β/β-catenin signaling pathway[J]. PLoS One,2016,11(4):e0153194. doi: 10.1371/journal.pone.0153194 [30] Yang F,Xiong H,Duan L,et al. MiR-1246 promotes metastasis and invasion of A549 cells by targeting GSK-3β‒mediated Wnt/β-catenin pathway[J]. Cancer Res Treat,2019,51(4):1420-1429. doi: 10.4143/crt.2018.638 -





 下载:
下载: