Effect of miR-29c-3p/IGF1 Molecular Axis on Activation,Proliferation and Apoptosis of Hepatic Stellate Cells
-
摘要:
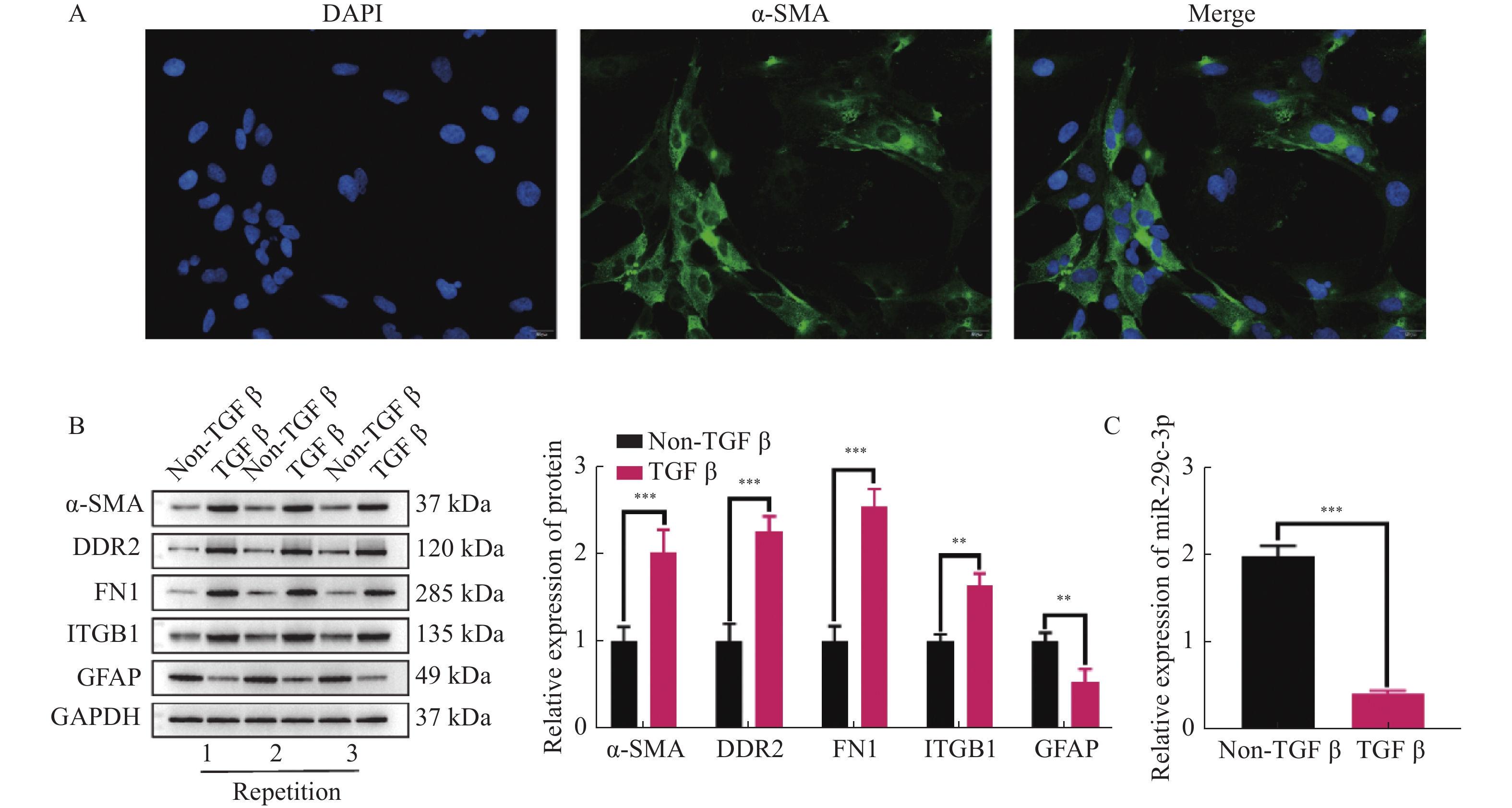
目的 探讨miR-29c-3p通过IGF-1对肝星状细胞(hepatic stellate cells,HSCs)活化,增殖和凋亡的影响。 方法 原代培养小鼠HSCs,并通过免疫荧光检测HSCs标志物ɑ-SMA表达。双荧光素酶报告基因实验验证miR-29c-3p和IGF-1的靶向关系。TGF-β激活HSCs,并且外源性调控miR-29c-3p和IGF-1的表达水平后,分别采用Westernbolt,CCK-8,克隆形成实验和流式细胞术检测活化HSCs中活化相关蛋白(ɑ-SMA,DDR2,FN1,ITGB1和GFAP)的表达,增殖,克隆形成数和凋亡。 结果 ɑ-SMA阳性表达表明成功分离小鼠HSCs。miR-29c-3p mimic可降低野生型IGF-1的荧光素酶活性,但是对突变型IGF-1没有影响。过表达miR-29c-3p和低表达IGF-1能减少ɑ-SMA,DDR2,FN1和ITGB1表达,增加GFAP的表达,并且降低HSCs的增殖活力和克隆形成数,上调其凋亡比例。 结论 miR-29c-3p通过靶向抑制IGF-1表达,进而抑制HSCs活化和增殖,并促进其凋亡。 Abstract:Objective To investigate the effects of miR-29c-3p on the activation, proliferation and apoptosis of hepatic stellate cells (HSCs) via IGF-1. Methods Primary mouse HSCs were cultured and the expression of HSCs marker ɑ-SMA was detected by immunofluorescence. By dual-luciferase reporter gene assay was conducted to Validate the Targeting Relationship between miR-29c-3p and IGF-1. After TGF-β activation of HSCs and exogenous regulation of miR-29c-3p and IGF-1 expression, the expression of activation-related proteins (ɑ-SMA, DDR2, FN1, ITGB1 and GFAP), proliferation, colony-forming number and apoptosis in activated HSCs were detected by Western bolt, CCK-8, colony-forming unit assays and flow cytometry, respectively. Results Positive expression of ɑ-SMA indicated that the successful isolation of mouse HSCs. miR-29c-3p significantly reduced the luciferase activity of wild-type IGF-1, but had no effect on mutant IGF-1. Over-expression of miR-29c-3p and hypo-expression of IGF-1 significantly decreased ɑ-SMA, DDR2, FN1 and ITGB1 expression, increased GFAP expression, and decreased proliferation viability and colony-forming number of HSCs and upregulated their apoptotic ratio. Conclusion miR-29c-3p inhibits the activation and proliferation of HSCs and promotes their apoptosis by targeting IGF-1 expression. -
Key words:
- Alcoholic liver disease /
- Hepatic stellate cells /
- Activation /
- Proliferation /
- Apoptosis /
- miR-29c-3p /
- IGF-1
-
肝内胆管癌是一种具有高度侵袭性的恶性肿瘤[1],预后差,近年来,其发病率逐年升高[2]。腺苷酸激酶4(Adenylate kinase4,AK4)是腺苷酸激酶家族的一员,其分子量为25kDa,别称为AK3L1。多项研究显示AK4促进恶性肿瘤的发生发展[3-5]。但其对肝内胆管癌的作用尚无报道。本实验通过小干扰RNA手段,就AK4对肝内胆管癌细胞HUCCT1增殖、迁移能力的影响作出探究。
1. 资料与方法
1.1 细胞系
本实验所用肝内胆管癌细胞HUCCT1购自上海誉驰生物科技有限公司,该细胞已通过中国科学院昆明动物研究所鉴定明确。该细胞作为肝内胆管癌细胞株之一,常用于肿瘤增殖、迁移的研究。
1.2 小干扰RNA(Small interfering RNA,siRNA)转染细胞
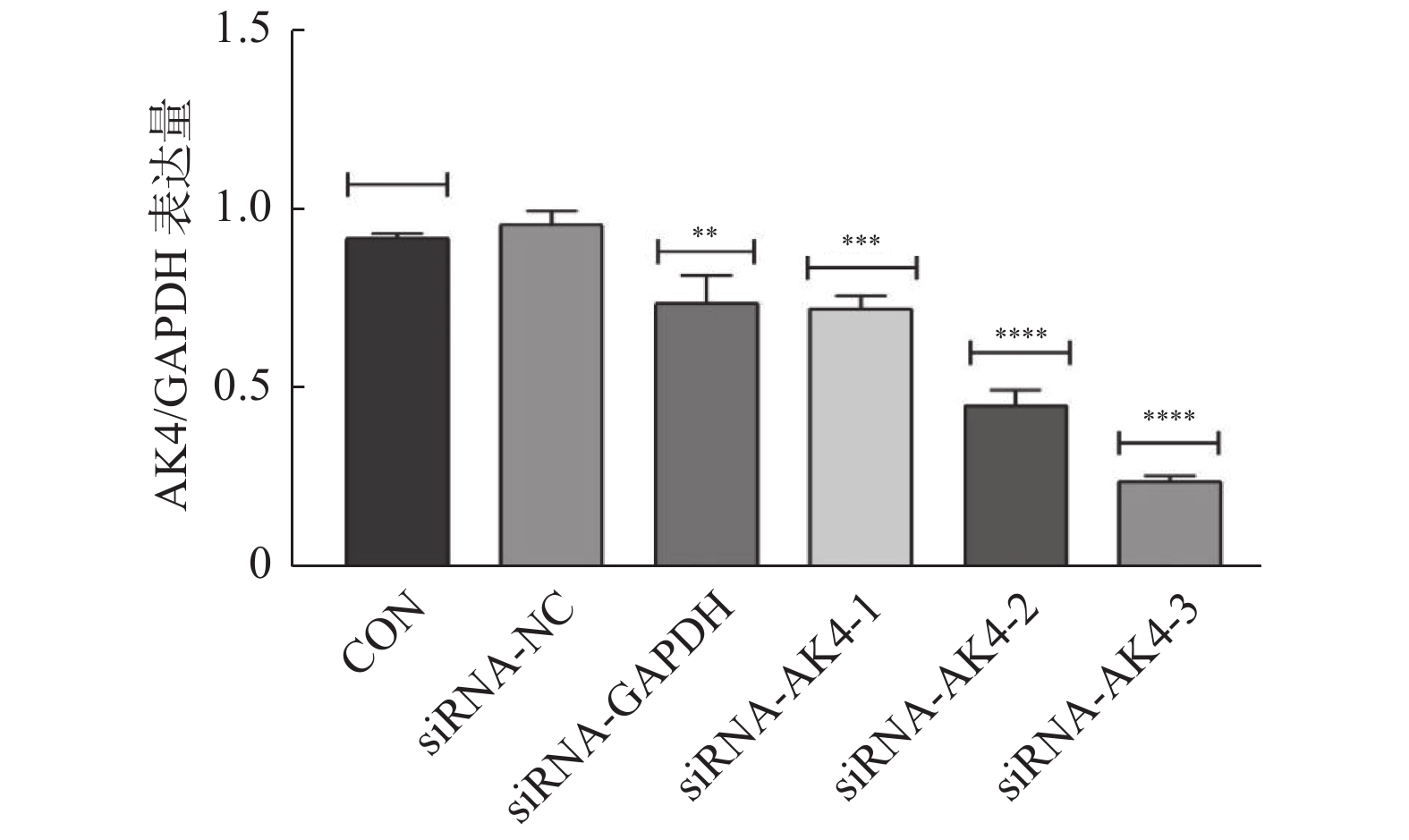
本实验采用siRNA技术以沉默AK4。siRNA购自上海市吉玛基因生物技术有限公司,共计构建6条si-RNA序列,序列设计见表1。本次实验分组为空白对照组(CON)、阴性对照组(siRNA-NC)、阳性对照组(siRNA-GAPDH)、实验组1(siRNA-AK4-1),实验组2(siRNA-AK4-2),实验组3(siRNA-AK4-3)。转染试剂采用上海市吉玛基因生物技术有限公司GP-transfect-Mate。采用免疫印迹法(Western Blot,WB)对实验组1、实验组 实验组3进行si-RNA筛选,其中空白对照组不添加siRNA,阴性对照组基因序列与目的基因序列无同源性,阳性对照组基因序列与内参GAPDH同源。各组间其余实验操作步骤(转染方法、WB、EdU、细胞划痕实验)均一致。
表 1 si-RNA序列Table 1. Sequence of si-RNA built by siRNA technology组别 序列 Antisense Negative control 5′-UUCUCCGAACGUGUCACGUTT-3′ 5′-ACGUGACACGUUCGGAGAATT-3′ GAPDH Positive control 5′-UGACCUCAACUACAUGGUUTT-3′ 5′-AACCAUGUAGUUGAGGUCATT-3′ siRNA-AK4-1 5′-GCGGAAGGGUAUAUAACCUTT-3′ 5′-AGGUUAUAUACCCUUCCGCCT-3′ siRNA-AK4-2 5′-CAGGCUAAGACAGUACAAATT-3′ 5′-UUUGUACUGUCUUAGCCUGTT-3′ siRNA-AK4-3 5′-CACCUAUUCAGUCCAAAGATT-3′ 5′-UCUUUGGACUGAAUAGGUGTT-3′ 转染前1 d将HUCCT1细胞接种至6孔板中,以次日细胞融合度达到60%~80%为宜,用无抗生素的完全培养基进行培养。转染:(1)转染试剂室温备用;(2)按照每孔200 µL无血清培养基(1640培养基)加5~8 µL转染试剂配置转染试剂混合物。静置5 min;(3)按照每孔200 µL无血清培养基(1640培养基)加150/pmol siRNA配置siRNA混合物。静置5 min;(4)将转染试剂混合物滴加到siRNA混合物中,混匀,静置20 min;(5)20 min后将混合液均匀加至6孔板各孔中;(6)各孔另外加入1 600 µL无抗生素完全培养基;(7)孔板放入细胞培养箱中培养48 h,使用免疫印迹检测转染效率。
1.3 免疫印迹实验检测转染效率及siRNA筛选
(1)裂解细胞:使用PMSF(品牌:Beyotime,货号:ST506-2 PMSF)与RIPA裂解液(强)品牌:Beyotime,货号:P0013B)按照200∶1配置细胞裂解液。于冰上充分裂解细胞;(2)测蛋白浓度:取裂解产物于4 ℃离心机12000 r/min,离心30 min。吸取86 µL上清液,使用BCA蛋白浓度测定试剂盒(品牌:Beyotime,货号:P0012 500次)测定蛋白浓度;(3)取80 µL上清液加20 µL SDS-PAGE蛋白上样缓冲液(品牌:Beyotime,货号:P0015L)沸水加热15 min;(4)电泳:配置12%下层胶,5%上层胶,蛋白上样量为2.5 µg,上层胶60 V恒压电泳,下层胶100 V恒压电泳;(5)转膜:甲醇浸泡PVDF膜,胶、膜放置妥当后以300 mA恒流条件下湿转发转膜,时间为30 min;(6)封闭:PVDF膜置于5%脱脂牛奶中封闭,缓慢摇晃,室温封闭2 h;(7):孵育一抗:兔单克隆抗体[EPR7678] to AK3L1抗体,(1∶7000,品牌:Abcam,货号:ab131327)。一抗孵育过夜,4 ℃;(8):孵育二抗:山羊抗兔IgG(H+L)(品牌:Proteintech,货号:SA00001-2,1∶10000),室温孵育2 h;(9)显影:ECL化学发光液孵育1 min后,于成像仪中曝光显影。
1.4 增殖EdU实验
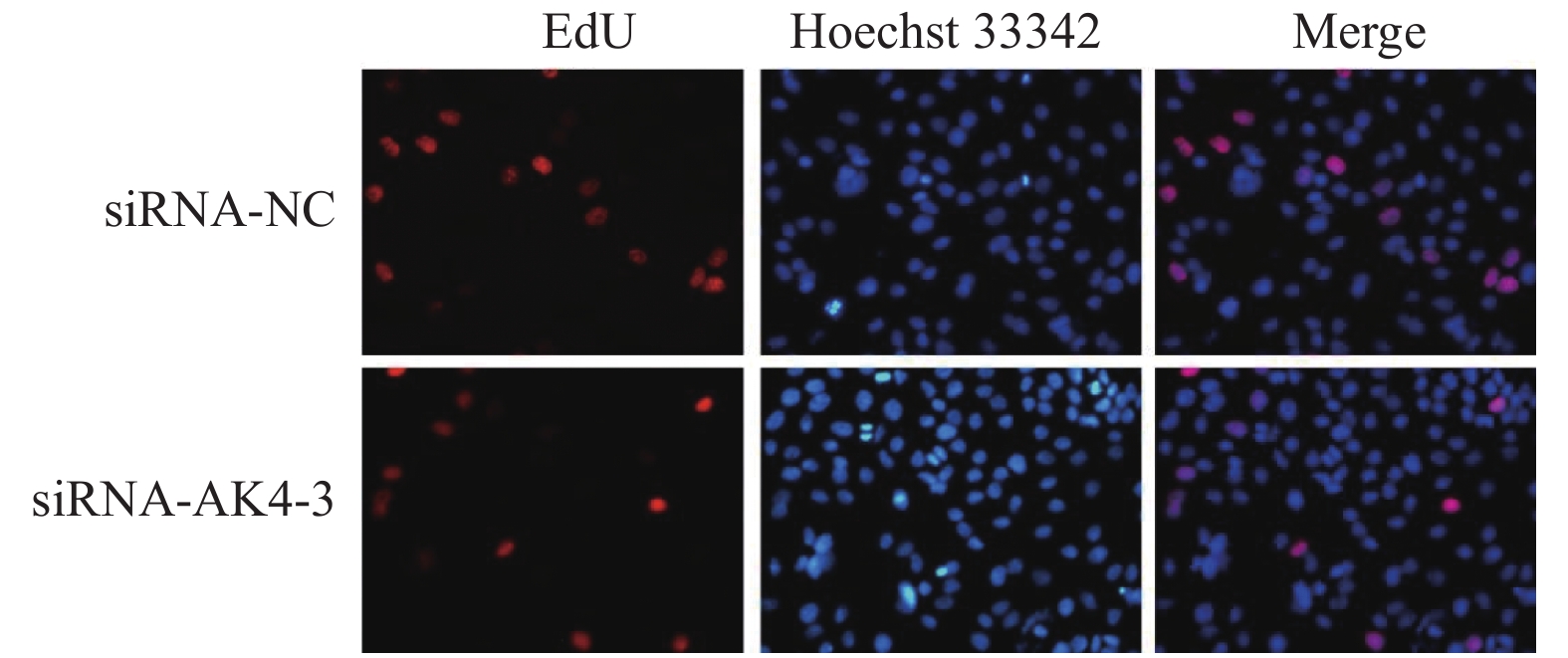
(1)转染细胞:6孔板培养细胞。免疫印迹实验已明确siRNA-AK4-3的沉默效果最好,故本次实验使用siRNA-NC及siRNA-AK4-3做细胞转染。分组亦同。转染完成24 h开始进行EdU实验。(2)工作液孵育:使用BeyoclickTM Edu-555配置2XEdU工作液后(品牌:Beyotime,货号:C0075s),与无抗生素完全培养基等体积加入六孔板中,孵育2 h。(3):固定、染色:每孔1 mL固定液固定15 min,洗涤后加入通透液孵育15 min,Click反应液孵育15 min,1X Hoechst 33342溶液孵育10 min。(4):荧光检测:洗涤液清洗后于倒置荧光显微镜观察。
1.5 细胞划痕实验
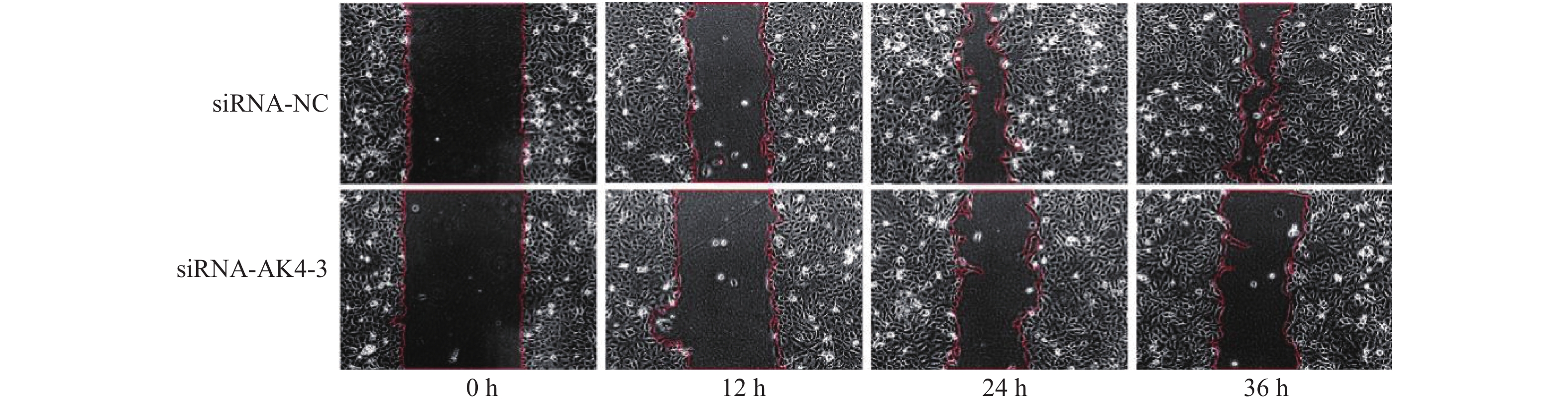
(1)转染细胞:6孔板培养细胞。本次实验分组为siRNA-NC及siRNA-AK4-3。转染完成24 h开始细胞划痕实验。(2)画线:使用直尺于6孔板背面作横行画线。(3)划痕:待细胞融合度为95%~100%时,使用200 µL枪头沿直尺作垂直于画线的划痕。(4)冲洗:使用PBS冲洗孔板3次,动作轻柔,吸净PBS后,加入无血清1640培养液。(5)拍照:每孔以“十”字交叉处上下为定点,于0 h,12 h,24 h,36 h拍照,对比不同时间下各组细胞迁移能力,并进行统计分析。
1.6 统计学处理
数据分析使用GraphPad Prism 8及SPSS 26统计软件,计量资料采用(
$\bar x \pm s $ ),计数资料用t检验,3组及多组计量资料采用单因素方差分析。所有检验取两端。P < 0.05为差异有统计学意义。2. 结果
2.1 siRNA转染效率及筛选
免疫印迹法检测各组后量化结果分别为:空白对照组(CON):(0.9±0.01,)阴性对照组(siRNA-NC):(0.92±0.01),阳性对照组(siRNA-GAPDH):(0.95±0.04),实验组1(siRNA-AK4-1):(0.74±0.08),实验组2(siRNA-AK4-2):(0.45±0.04),实验组3(siRNA-AK4-3):(0.24±0.02)。免疫印迹结果显示各组内参齐,沉默效果较好,其中阳性对照组对GAPDH的沉默效果显著。各siRNA组中siRNA-AK4-3对AK4的沉默效果最好,见图1,2。因此,后期实验使用siRNA-NC作为对照组,siRNA-AK4-3作为实验组。
2.2 增殖EdU实验
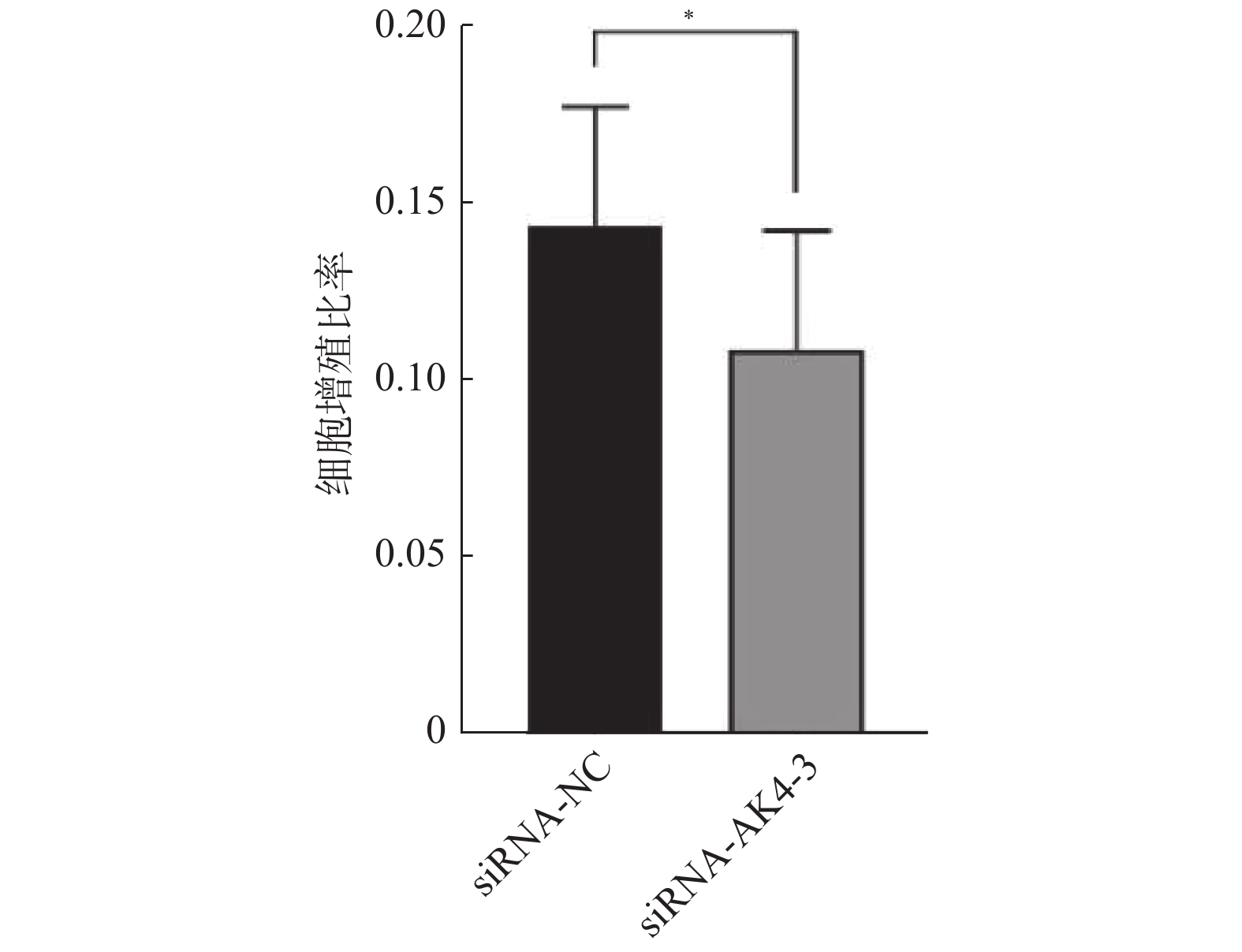
Edu实验结果显示:siRNA-NC组增殖细胞(15.9±4.4)/视野,细胞总数(110.9±22.4)/视野。siRNA-AK4-3组增殖细胞数目(12.8±5.0)/视野,细胞总数(116.7±22.1)/视野。两组增殖比率有差异,差异有统计学意义。siRNA-NC组增殖细胞多于siRNA-AK4-3组,AK4促进细胞增殖,见图3,4。
图3中EdU中增殖的HUCCT1细胞被标记为红色荧光,Hoechst 33342中蓝色荧光标记的为视野下所有活细胞,Merge图由EdU和Hoechst 33342图像合并后得到。
2.3 细胞划痕实验
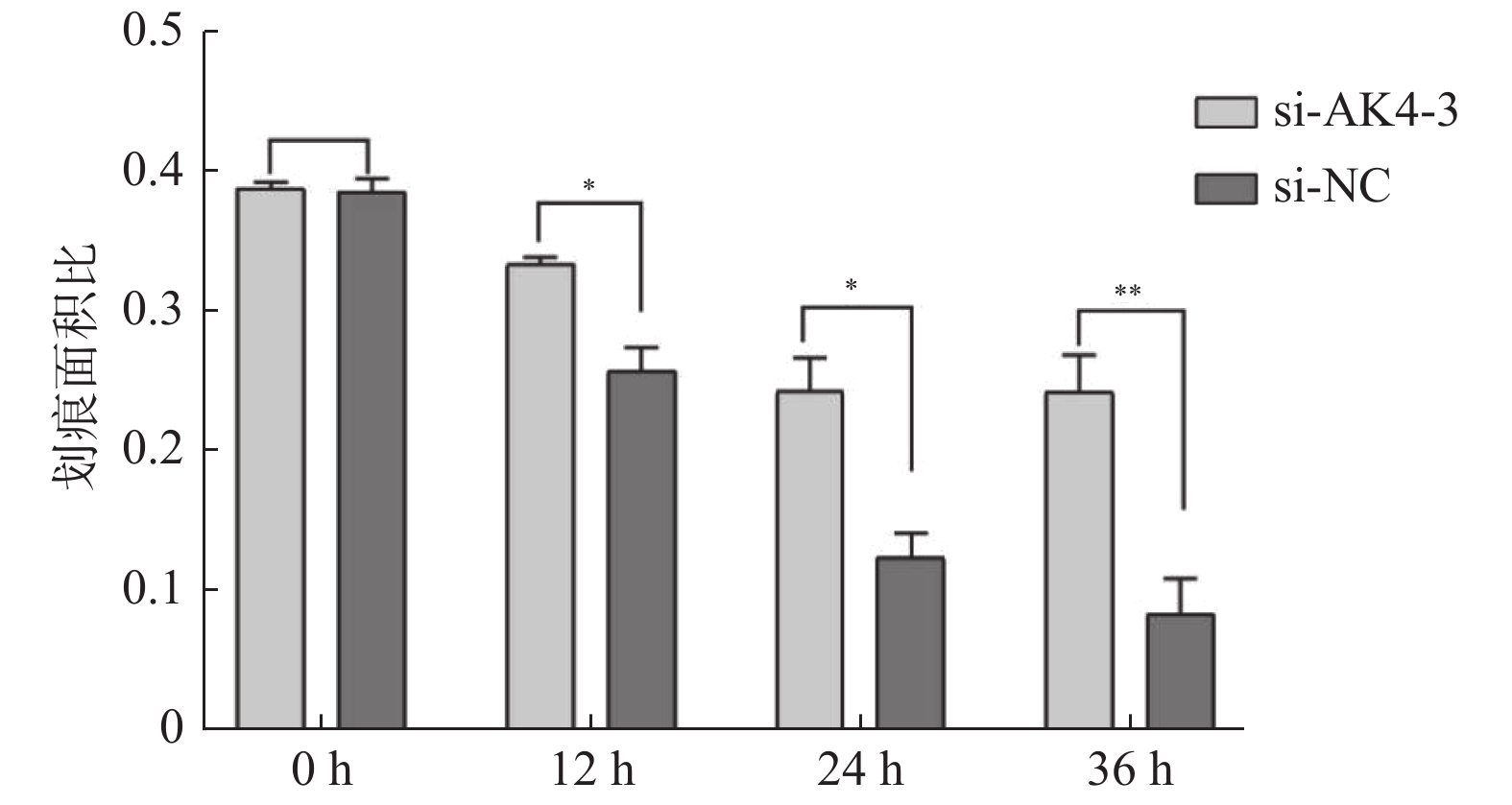
划痕实验取划痕面积/视野总面积,各组面积比见表2,差异有统计学意义,见图5,6。siRNA-NC组细胞迁移面积较siRNA-AK4-3组更大,AK4促进细胞迁移。
表 2 划痕面积比Table 2. Scratch area ratio项目 0 h 12 h 24 h 36 h siRNA-NC 0.39 ± 0.01 0.26 ± 0.017 0.12 ± 0.017 0.08 ± 0.026 siRNA-AK4-3 0.39 ± 0.005 0.33 ± 0.001 0.24 ± 0.024 0.24 ± 0.027 3. 讨论
肝内胆管癌的手术治疗是极其重要的,目前全球范围内术后其平均无瘤生存时间( DFS) 为12 ~ 36 个月[6-7],但胆管癌起病隐匿,多数患者在发现疾病时已属晚期[8],据报道,肝内胆管癌的根治切除率为30%~40% ,其他肝胆恶性肿瘤均比此数据高[1,9]。肝内胆管癌的辅助化疗(吉西他滨联合铂类)在一定程度上实现肿瘤将期,从而获得手术机会[10-12],但其中位生存期仍然不到1 a时间[13-15]。根据Andrew X Zhu的RCT临床研究,靶向药物Ivosidenib使得患者有10.3个月的中位生存期,而安慰剂组仅有7.5个月[16],Abou-Alfa GK等学者也通过RCT实验研究了Ivosidenib在胆管癌中的作用,其结果是实验组的无病生存期为2.7个月(95% CI:1.6~4.2),而安慰剂组的无病生存期为1.4个月(95% CI:1.4~1.6)[17]。A Demols也在胆管癌的靶向治疗上进行了RCT研究,他研究了靶向药Regorafenib对胆管癌作用,最终得出实验组无病生存期为3.0个月(95% CI:2.3~4.9),而对照组无病生存期为1.5个月(95% CI:1.2~2.0),然而实验组的总生存时间和对照组的总生存时间并无统计学差异[18]。可以看出,靶向药能提高患者生存时间,但有研究显示部分靶向药并不能显著提升患者的总生存率[18, 19]。因此需寻找一个更有效的作用靶点。
1944年,美国学者Kalckar在实验中首次发现了肌苷酸[20]。在随后的科学实践中,更名为腺苷酸激酶AK。AK4定位于细胞线粒体基质内,在肝脏、心脏、脑、肾脏、胃肠道组织中富于表达[21],AK4在细胞能量代谢方面表现出特异性[22],因此他与肿瘤应该存在相关性。2012年由台湾地区学者Yi-Hua Jan完成了首例AK4与癌症关系论证的研究:体外试验中shRNA沉默肺癌细胞CL1-5和A549中的AK4后,两株细胞的侵袭能力下降约50%,从而证实AK4促进肺癌细胞的侵袭[3]。连云港市的学者MinMin HUANG在研究中显示AK4在人浆液性卵巢癌组织中高表达。在体内试验中,AK4敲低组的肿瘤体积明显减小,肿瘤重量明显减轻。这些试验均显示AK4促进了人浆液性卵巢癌的发生发展[4]。Jie Zhang等在Her-2阳性乳腺癌中的研究显示AK4的表达水平与肿瘤TNM分期(P = 0∶017)和淋巴结转移(P = 0∶046) 显著相关。体外试验中,MTT法、细胞划痕实验和Transwell试验都显示敲低AK4组的癌细胞增值、迁移、侵袭能力减弱。体外试验也显示敲低了AK4的肿瘤组织体积减小,重量减轻[5]。此后AK4与肿瘤的研究未曾断绝,田华等学者通过免疫组化等方法证实了AK4在肺腺癌中高表达[23]。李辰运的研究显示AK4在胰腺导管腺癌中高表达,并且与肿瘤分期、淋巴结转移、神经受侵、脉管内瘤栓有相关性(P < 0.05)[24]。李绍军等也证实AK4在食管鳞状细胞中高表达[25],夏林等也通过免疫组化的方式证实了AK4在胃癌中高表达[26],尽管我国的多数学者都明确了AK4在大多数肿瘤中的表达,但是很遗憾,仅有少数人通过体内、体外实验论证AK4对相关癌症的影响,无法将他们的研究进一步转化为临床制定治疗方案的依据。
本实验首次论证AK4对肝内胆管癌细胞HUCCT1增殖、迁移的影响。首先予siRNA沉默AK4的表达,再通过EdU检测细胞增殖能力,细胞划痕实验检测细胞迁移能力。本次实验的结论与前人的研究结论相似,即AK4促进肝内胆管癌细胞HUCCT1的增殖、迁移。本实验的不足在于,笔者尚未完成AK4对肝内胆管癌细胞其他生物学能力的影响,如EMT、侵袭等等。因此,笔者接下来即将完成其他细胞生物学行为实验,并且探究在机制方面的变化以及通过体内实验验证结论。本实验结论将为肝内胆管癌的临床分子靶向治疗提供基础实验数据,采用生物医学工程技术干预肝内胆管癌组织中AK4的表达,将有助于肿瘤的综合治疗。
-
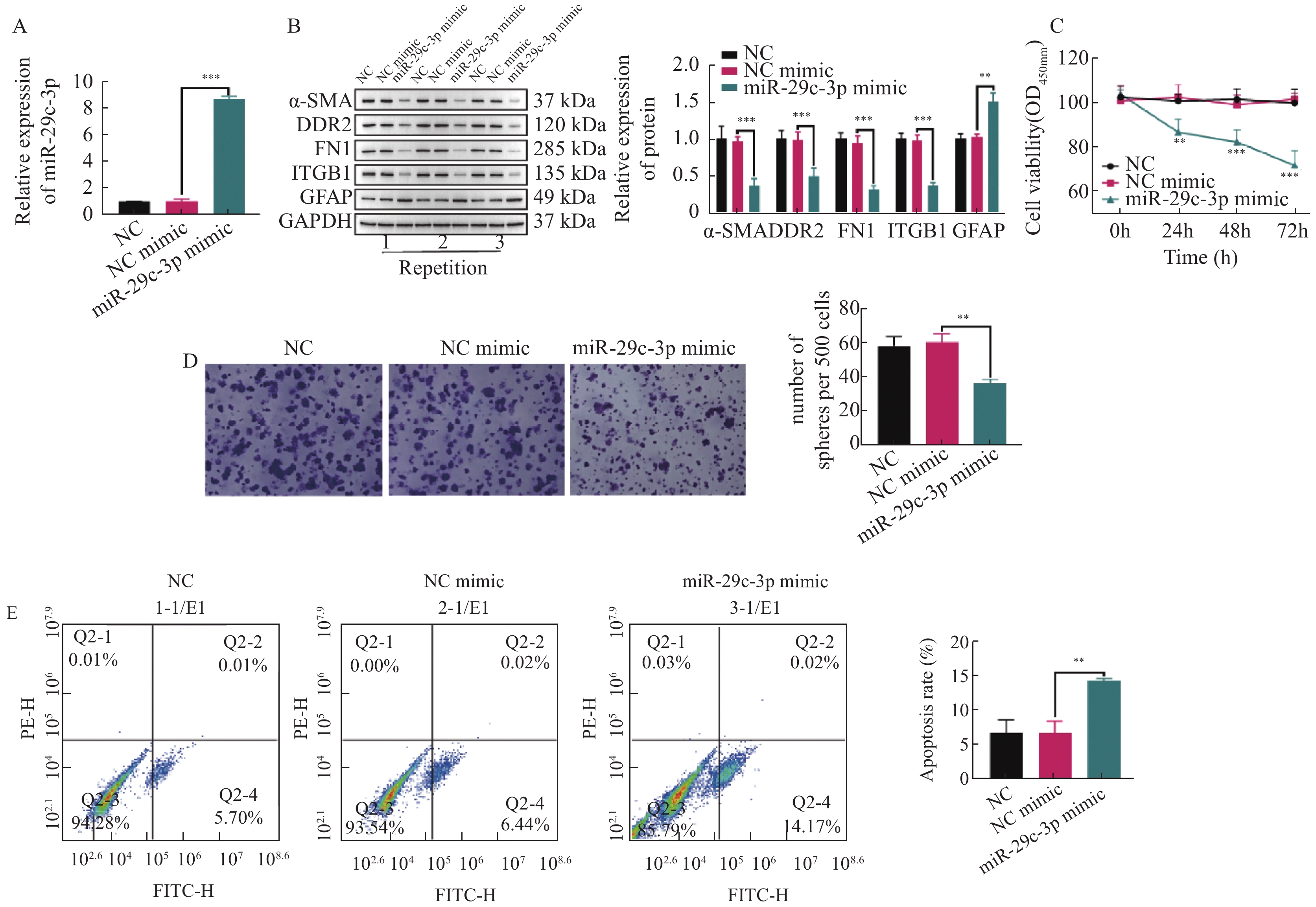
图 2 miR-29c-3p抑制HSCs的活化和增殖,并促进其凋亡
A:采用RT-qPCR检测miR-29c-3p mimic的转染效率;B:通过WB检测miR-29c-3p对活化相关蛋白(ɑ-SMA,DDR2,FN1,ITGB1和GFAP)表达的影响;C:CCK-8试剂盒检测不同组别中TGF-β激活的HSCs增殖活力;D:克隆形成实验检测miR-29c-3p对活化HSCs的克隆形成数的影响;E:流式细胞术检测活化HSCs的凋亡比例。**P < 0.01,***P < 0.001。
Figure 2. miR-29c-3p inhibits the activation and proliferation of HSCs and promotes their apoptosis.
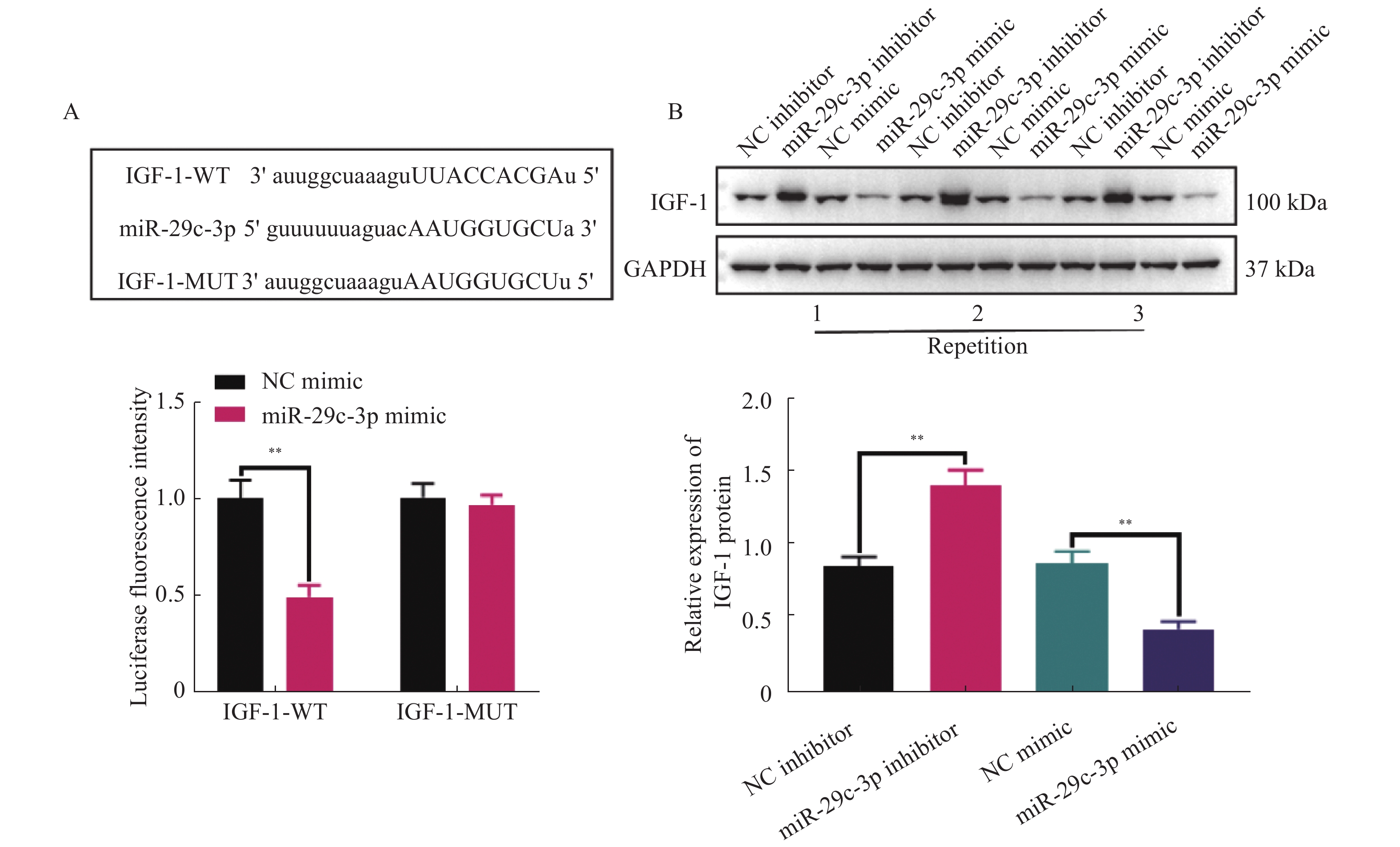
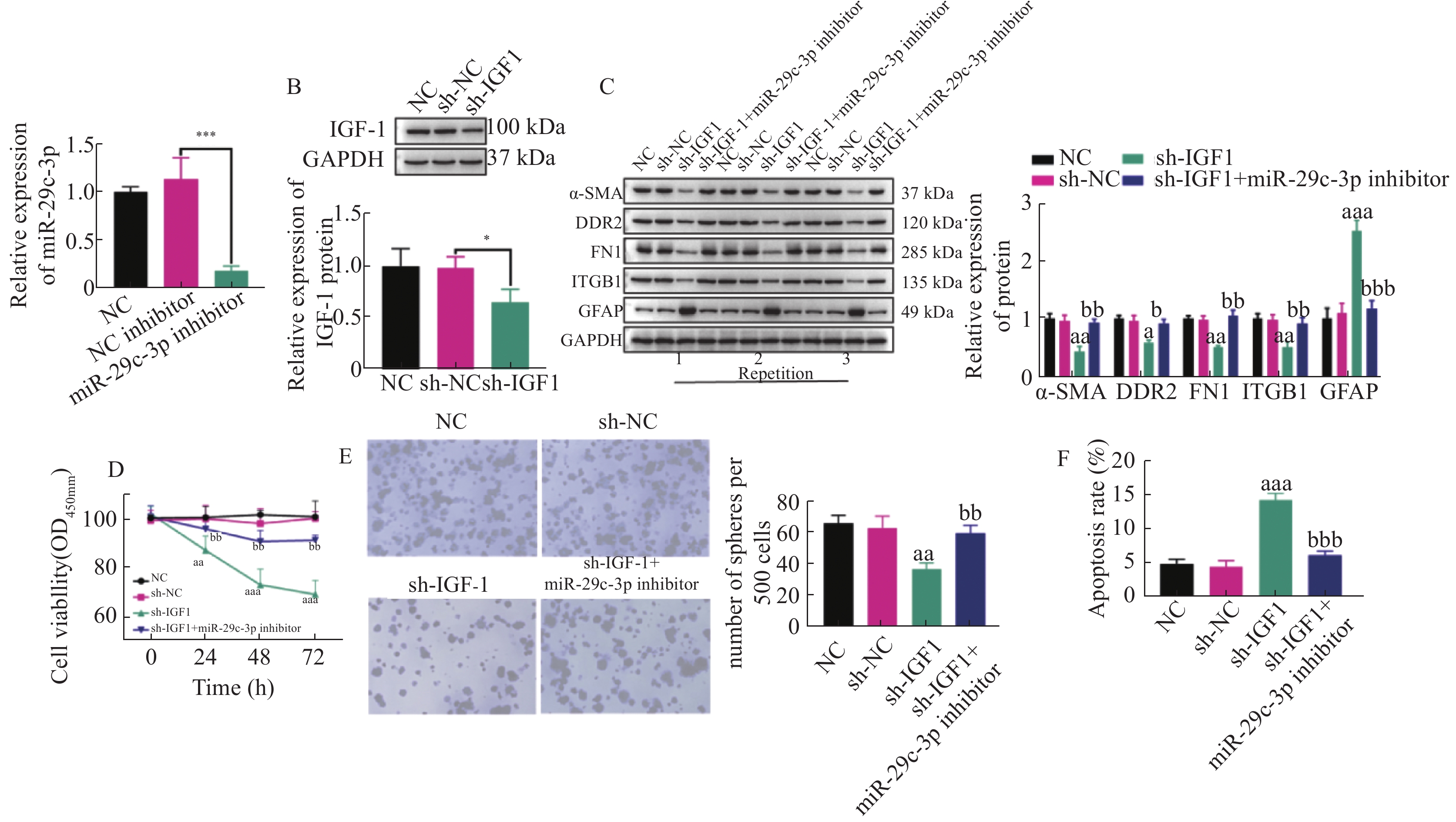
图 4 miR-29c-3p通过IGF-1抑制HSCs的活化和增殖,并促进其凋亡
A: miR-29c-3p inhibior的转染效率;B:通过WB检测得到的sh-IGF-1的转染效率;C:不同组别HSCs中活化相关蛋白(ɑ-SMA,DDR2,FN1,ITGB1和GFAP)表达的表达变化;D:CCK-8实验检测活化的HSCs增殖活力;E:克隆形成实验得到的不同组别中活化HSCs的克隆形成数;F:流式细胞术检测活化HSCs的凋亡比例。与sh-NC组比较,aP < 0.05,aaP < 0.01,aaaP < 0.001;与sh-IGF-1组比较,bP < 0.05,bbP < 0.01,bbbP < 0.001;*P < 0.05,***P < 0.001。
Figure 4. miR-29c-3p inhibits the activation and proliferation of HSCs and promotes their apoptosis through IGF-1.
-
[1] Seitz H K,Bataller R,Cortez-Pinto H,et al. Alcoholic liver disease[J]. Nat Rev Dis Primers,2018,4(1):16. doi: 10.1038/s41572-018-0014-7 [2] 曾赏,李三强,李前辉. 酒精性肝病的研究进展[J]. 世界华人消化杂志,2022,30(12):535-540. [3] 阿比丹·拜合提亚尔,郭津生. 肝纤维化发生时活化肝星状细胞的代谢改变[J]. 中国细胞生物学学报,2021,43(10):2054-2060. [4] Teschke R. Alcoholic liver disease: Current mechanistic aspects with focus on their clinical relevance[J]. Biomedicines,2019,7(3):68. doi: 10.3390/biomedicines7030068 [5] Kordes C,Bock H H,Reichert D,et al. Hepatic stellate cells: Current state and open questions[J]. Biol Chem,2021,402(9):1021-1032. doi: 10.1515/hsz-2021-0180 [6] Bataller R,Brenner D A. Liver fibrosis[J]. J Clin Invest,2005,115(2):209-218. doi: 10.1172/JCI24282 [7] Bartel D P. MicroRNAs: Target recognition and regulatory functions[J]. Cell,2009,136(2):215-233. doi: 10.1016/j.cell.2009.01.002 [8] Michlewski G,Cáceres J F. Post-transcriptional control of miRNA biogenesis[J]. Rna,2019,25(1):1-16. doi: 10.1261/rna.068692.118 [9] Szabo G,Bala S. MicroRNAs in liver disease[J]. Nat Rev Gastroenterol Hepatol,2013,10(9):542-552. doi: 10.1038/nrgastro.2013.87 [10] 安召宏,钟庆,徐启云,等. 肝星状细胞活化和肝细胞性肝癌发生发展中的表观遗传学研究进展[J]. 中国组织化学与细胞化学杂志,2020,29(3):282-286. [11] Pant K,Venugopal S K. Circulating microRNAs: Possible role as non-invasive diagnostic biomarkers in liver disease[J]. Clin Res Hepatol Gastroenterol,2017,41(4):370-377. doi: 10.1016/j.clinre.2016.11.001 [12] Zhang Y J,Hu Y,Li J,et al. Roles of microRNAs in immunopathogenesis of non-alcoholic fatty liver disease revealed by integrated analysis of microRNA and mRNA expression profiles[J]. Hepatobiliary Pancreat Dis Int,2017,16(1):65-79. doi: 10.1016/S1499-3872(16)60098-X [13] Hosseini N,Shor J,Szabo G. Alcoholic hepatitis: A review[J]. Alcohol Alcohol,2019,54(4):408-416. doi: 10.1093/alcalc/agz036 [14] Khomich O,Ivanov A V,Bartosch B. Metabolic hallmarks of hepatic stellate cells in liver fibrosis[J]. Cells,2019,9(1):24. doi: 10.3390/cells9010024 [15] Teschke R. Alcoholic liver disease: Alcohol metabolism,cascade of molecular mechanisms,cellular targets,and clinical aspects[J]. Biomedicines,2018,6(4):106. doi: 10.3390/biomedicines6040106 [16] Kisseleva T,Brenner D. Molecular and cellular mechanisms of liver fibrosis and its regression[J]. Nat Rev Gastroenterol Hepatol,2021,18(3):151-166. doi: 10.1038/s41575-020-00372-7 [17] Shan L,Jiang T,Ci L,et al. Purine signaling regulating HSCs inflammatory cytokines secretion,activation,and proliferation plays a critical role in alcoholic liver disease[J]. Mol Cell Biochem,2020,466(1-2):91-102. doi: 10.1007/s11010-020-03691-0 [18] Chen W,Yan X,Yang A,et al. miRNA-150-5p promotes hepatic stellate cell proliferation and sensitizes hepatocyte apoptosis during liver fibrosis[J]. Epigenomics,2020,12(1):53-67. doi: 10.2217/epi-2019-0104 [19] Chen N,Luo J,Hou Y,et al. miR-29c-3p promotes alcohol dehydrogenase gene cluster expression by activating an ADH6 enhancer[J]. Biochem Pharmacol,2022,203(4):115182. [20] Kilikevicius A,Meister G,Corey D R. Reexamining assumptions about miRNA-guided gene silencing[J]. Nucleic Acids Res,2022,50(2):617-634. doi: 10.1093/nar/gkab1256 [21] Wang X,He Y,Mackowiak B,et al. MicroRNAs as regulators,biomarkers and therapeutic targets in liver diseases[J]. Gut,2021,70(4):784-795. doi: 10.1136/gutjnl-2020-322526 [22] Dichtel L E,Cordoba-Chacon J,Kineman R D. Growth hormone and insulin-like growth factor 1 regulation of nonalcoholic fatty liver disease[J]. J Clin Endocrinol Metab,2022,107(7):1812-1824. doi: 10.1210/clinem/dgac088 [23] Cristin L,Montini A,Martinino A,et al. The role of growth hormone and insulin growth factor 1 in the development of non-alcoholic steato-hepatitis: A systematic review[J]. Cells,2023,12(4):517. doi: 10.3390/cells12040517 [24] Adamek A,Kasprzak A. Insulin-like growth factor (IGF) system in liver diseases[J]. Int J Mol Sci,2018,19(5):1308. doi: 10.3390/ijms19051308 [25] Stanley T L,Fourman L T,Zheng I,et al. Relationship of IGF-1 and IGF-binding proteins to disease severity and glycemia in nonalcoholic fatty liver disease[J]. J Clin Endocrinol Metab,2021,106(2):e520-e533. [26] Takahashi Y. The role of growth hormone and insulin-like growth factor-I in the liver[J]. Int J Mol Sci,2017,18(7):1447. doi: 10.3390/ijms18071447 [27] De La Garza R G,Morales-Garza L A,Martin-Estal I,et al. Insulin-like growth factor-1 deficiency and cirrhosis establishment[J]. J Clin Med Res,2017,9(4):233-247. doi: 10.14740/jocmr2761w [28] Martín-González C,González-Reimers E,Quintero-Platt G,et al. Soluble α-klotho in liver cirrhosis and alcoholism[J]. Alcohol Alcohol,2019,54(3):204-208. doi: 10.1093/alcalc/agz019 [29] Luo P,Zheng M,Zhang R,et al. S-Allylmercaptocysteine improves alcoholic liver disease partly through a direct modulation of insulin receptor signaling[J]. Acta Pharm Sin B,2021,11(3):668-679. doi: 10.1016/j.apsb.2020.11.006 [30] Møller S,Becker U,Juul A,et al. Prognostic value of insulinlike growth factor I and its binding protein in patients with alcohol-induced liver disease. EMALD group[J]. Hepatology,1996,23(5):1073-1078. doi: 10.1002/hep.510230521 期刊类型引用(4)
1. 穆雨,周亚辉. 不同孕周分娩的新生儿颅脑超声评估特点及临床意义. 罕少疾病杂志. 2024(01): 19-20 .  百度学术
百度学术2. 陈慧慧. 颅脑超声在诊断新生儿颅脑疾病的临床应用价值. 现代医用影像学. 2024(06): 1159-1161 .  百度学术
百度学术3. 李艳,刘芬,谢桢,陶琦,田袁静. 高频超声联合低频超声检查诊断新生儿颅脑病变的临床价值研究. 现代生物医学进展. 2022(10): 1932-1936 .  百度学术
百度学术4. 史晶,于宁. 颅脑超声检查联合血清D二聚体、乳酸脱氢酶在不同胎龄早产儿颅脑损伤诊断中的应用. 医学影像学杂志. 2022(12): 2054-2057 .  百度学术
百度学术其他类型引用(2)
-






 下载:
下载:
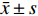

 下载:
下载: