Hsa-let-7a-5p Regulates Proliferation and Apoptosis of Periodontal Ligament Stem Cells
-
摘要:
目的 探讨hsa-let-7a-5p对牙周膜干细胞(periodontal ligament stem cells,PDLSCs)增殖及凋亡的影响。 方法 将let-7a-5p mimics、mimics nc、let-7a-5p inhibitor、inhibitor nc转染进入PDLSCs,通过RT-qPCR测定转染效率,通过CCK-8、细胞周期、EdU实验检测let-7a-5p对PDLSCs增殖的影响,通过细胞凋亡实验检测PDLSCs的凋亡率。 结果 let-7a-5p成功转染进入PDLSCs。let-7a-5p mimics可抑制PDLSCs增殖能力(P < 0.05),促进PDLSCs凋亡(P < 0.01)。let-7a-5p inhibitor可促进PDLSCs增殖能力(P < 0.05),抑制PDLSCs凋亡(P < 0.01)。 结论 hsa-let-7a-5p可抑制PDLSCs增殖,促进PDLSCs凋亡。 -
关键词:
- hsa-let-7a-5p /
- microRNA /
- 牙周膜干细胞 /
- 增殖 /
- 凋亡
Abstract:Objective To investigate the effect of hsa-let-7a-5p on the proliferation and apoptosis of periodontal ligament stem cells (PDLSCs). Methods let-7a-5p mimics, mimics nc, let-7a-5p inhibitor, and inhibitor nc were transfected into PDLSCs, and transfection efficiency was measured by RT-qPCR. The effects of let-7a-5p on PDLSCs proliferation were evaluated by CCK-8, cell cycle, and EdU experiments, while the apoptosis rate of PDLSCs was detected by apoptosis experiments. Results let-7a-5p was successfully transfected into PDLSCs. let-7a-5p mimics inhibited cell proliferation (P < 0.05) and promoted cell apoptosis of PDLSCs (P < 0.01). let-7a-5p inhibitor promoted cell proliferation (P < 0.05) and inhibited cell apoptosis of PDLSCs (P < 0.01). Conclusion hsa-let-7a-5p can inhibit the proliferation of PDLSCs and promote the apoptosis of PDLSCs. -
Key words:
- hsa-let-7a-5p /
- microRNA /
- Periodontal ligament stem cell /
- Proliferation /
- Apoptosis
-
牙周炎(Periodontitis)是指由菌斑生物膜引起的感染性牙周疾病,导致牙周支持组织破坏、牙周袋形成、牙槽骨吸收,最终牙齿松动脱落,是成年人失牙的重要原因之一 [1]。牙周炎不仅危害人类口腔健康,还与心血管疾病 [2]、糖尿病 [3]等全身性疾病有关联。牙周韧带组织中存在的一类具有自我更新、多向分化潜能的间充质干细胞即牙周膜干细胞(periodontal ligament stem cells,PDLSCs),在特定的诱导环境下,可诱导分化成为牙周韧带组织、骨组织、软骨组织、脂肪组织等 [4]。在炎症条件下,PDLSCs的生理功能受到了影响 [5]。因此,探究PDLSCs生理功能的调控机制是研究牙周炎致病机理的重要环节之一。
microRNA是一类长度约为22nt的短序列非编码RNA,其发挥作用的方式主要是通过在细胞胞质中与Argonaute蛋白家族结合形成RNA诱导沉默复合体(RNA-induced silencing complex,RISC),该复合体通过降解和翻译抑制两条途径作用于mRNA介导基因沉默 [6]。microRNA参与了生物生长发育、细胞分化凋亡、肿瘤的形成转移等,并可作为慢性牙周炎的潜在诊断生物标志物,影响其发生发展 [7]。其中,参与调控细胞生长分化的重要miRNA(let-7a)似乎同样参与了牙周炎的进展。然而,其在牙周炎中的具体作用尚未完全明确,研究表明在牙周炎患者的牙龈组织中let-7a表达上调 [8-9],而let-7a-5p在侵袭性牙周炎患者的唾液中下调 [10]。因此,为了进一步阐明let-7a-5p参与牙周炎进展的可能机制,本研究通过过表达/抑制PDLSCs中let-7a-5p的表达水平,探究其对PDLSCs增殖及凋亡的影响,旨在为阐明其在牙周炎中的调控机制提供思路。
1. 材料与方法
1.1 试剂及设备
α-MEM培养基、胎牛血清(FBS)、I型胶原酶、0.25%胰蛋白酶、PBS、双抗、riboFECT CP Transfection Kit(锐博生物,中国)、Cell Counting Kit-8(美仑生物,中国)、细胞周期与细胞凋亡检测试剂盒(美仑生物,中国)、Cell-Light EdU Apollo488 In Vitro Kit(锐博生物,中国)、RNAiso for Small RNA(TaKaRa,日本)、PrimeScriptTM RT Master Mix(Perfect Real Time,Takara,日本)、TB Green® Premix Ex TaqTM II(Tli RNaseH Plus,Takara,日本)、BCA 蛋白检测试剂盒(Beyotime,中国)、细胞凋亡试剂盒(凯基,中国)、has-let-7a-5p mimics、mimics NC、inhibitor、inhibitor NC合成自中国锐博生物科技有限公司。
培养瓶、培养板(Corning,美国)、35 mm激光共聚焦培养皿(NEST,中国)、洁净操作台(苏净净化设备公司,中国)、离心机、QuantStudioTM Real-Time PCR System、酶标仪、超低温冰箱、二氧化碳培养箱(Thermo,美国)、倒置相差显微镜(Leica,德国)、细胞计数仪(Countstar IC1000,中国)、TECHNE梯度PCR仪(TECHNE,英国)、Quawell Q3000 微量紫外分光光度计(QUAWELL,美国)、高速冷冻离心机(Eppendorf,德国)、Agilent NovoCyte 流式细胞仪(Agilent Technologies,美国)、激光共聚焦显微镜(Nikon,日本)。
本实验获昆明医科大学附属口腔医院医学伦理会批准(批准号:KYKQ2020MEC020)。在患者知情同意的情况下,于昆明医科大学口腔医院口腔颌面外科收集因为正畸治疗需要拔除的无疾病的年轻前磨牙,共15颗。
1.2 研究方法
1.2.1 牙周膜干细胞的原代培养
按照课题组前期研究方法分离培养牙周膜干细胞[11]。酶消法消化牙周膜组织块,1000 r/min离心2 min,弃上清。将含有牙周膜组织块的混悬液均匀接种于25 cm2培养瓶,并加入1 mL 20%FBS的α-MEM培养基,于37℃、5% CO2 恒温培养箱中培养。待细胞生长至80%左右,胰酶消化,细胞传代。
1.2.2 hsa-let-7a-5p转染
以1×105个/孔的密度接种PDLSCs于6孔板中,待细胞融合至30%~50%时利用riboFECT CP Transfection Kit将50 nM miRNA mimic,50 nM miRNA mimic nc,100 nM miRNA inhibitor,100 nM miRNA inhibitor nc 转染至PDLSCs中,将培养板置于37℃、5% CO2恒温培养箱中培养以便进行后续实验。
1.2.3 RT-qPCR测定转染效率
转染48 h后利用RNAiso for Small RNA提取miRNA,逆转录试剂盒逆转录成cDNA,设计合成hsa-let-7a-5p引物(合成自广州锐博生物技术有限公司),RT-qPCR检测基因表达,实验结果用2-ΔΔCt法进行分析,U6作为内参:forward primer(5′-3′)CTCGCTTCGGCAGCACA;reverse primer(5′-3′)AACGCTTCACGAATTTGCGT。
1.2.4 CCK-8实验
以3×103个/孔的密度接种PDLSCs于96孔培养板中,待细胞贴壁后,更换不含FBS的α-MEM培养基饥饿过夜。次日,按分组对细胞进行转染。细胞培养0~7 d,每日同一时间,按10 μL/孔加入CCK-8工作液,37℃避光孵育2 h,孵育结束后通过酶标仪在波长为450 nm处测定OD值。
1.2.5 细胞周期
以1×105个/孔的密度接种PDLSCs于6孔板中,待细胞贴壁后更换不含FBS的α-MEM培养基饥饿过夜。细胞融合至30%~50%时按分组进行转染。48 h后,收集细胞至离心管,PBS洗涤,75%乙醇固定细胞4℃静置过夜,固定完成后PBS洗涤细胞,2900 r/min离心5 min沉淀细胞,每个样品加入500 μL染色工作液(按照说明书配置),避光、37℃下继续孵育0.5 h。24 h内于流式细胞仪下将激发波长设置为488 nm对红色荧光及光散射情况进行检测。
1.2.6 EdU实验
以1×105个/孔的密度接种PDLSCs于激光共聚焦皿中,待细胞贴壁后,更换不含FBS的α-MEM培养基饥饿过夜。细胞融合至30%~50%时按分组进行转染。24 h后进行EdU标记即按100 μL/孔更换50 μM EdU培养基,继续孵育24 h。24 h后弃旧培养基,并使用PBS洗涤细胞2次,按50 μL/孔的剂量加入已配置好的细胞固定液,室温下孵育30 min。配置2 mg/mL的甘氨酸对过量醛基进行中和,PBS洗涤细胞,含0.5% TritonX-100的PBS脱色摇床孵育,PBS洗涤细胞,按500 μL/孔加入1×Apollo染色反应液,避光室温摇床孵育30 min,0.5% TritonX-100的PBS清洗细胞3次,DAPI染色2 min,PBS洗涤细胞3次,湿润状态下利用激光扫描共聚焦显微镜进行观察采图。
1.2.7 细胞凋亡
接种PDLSCs于6孔板中,密度为1×105个/孔,待细胞生长融合至30%~50%时按分组进行转染。48 h后,无EDTA 胰酶消化,PBS洗涤细胞2次,每管依次加入500 μL Binding Buffer、5 μL Annexin V-FITC、5 μL Propidium Iodide重悬细胞,混匀,室温避光孵育15 min,1 h内于流式细胞仪下进行检测。
1.2.8 let-7a-5p靶基因预测及功能分析
通过TargetScan、miRDB、miRTarbase 3个网站搜索let-7a-5p的预测靶基因,取三者交集的靶基因进行基因本体(gene ontology,GO)分析和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)生物通路富集分析,得到let-7a-5p靶基因的相关细胞功能和信号通路,使用R language package gplots 绘制GO和KEGG富集气泡图。
1.3 统计学处理
实验数据采用GraphPad Prism 9.0软件进行统计分析及作图。选用Mean±SD对数据进行描述,采用独立样本t检验进行单一变量2组资料间比较,采用单因素方差分析进行多组资料间比较,单因素方差分析有差异后选用tukey’s mutiple comparisons test进行两两比较。以P < 0.05为差异有统计学意义。
2. 结果
2.1 let-7a-5p转染效率测定
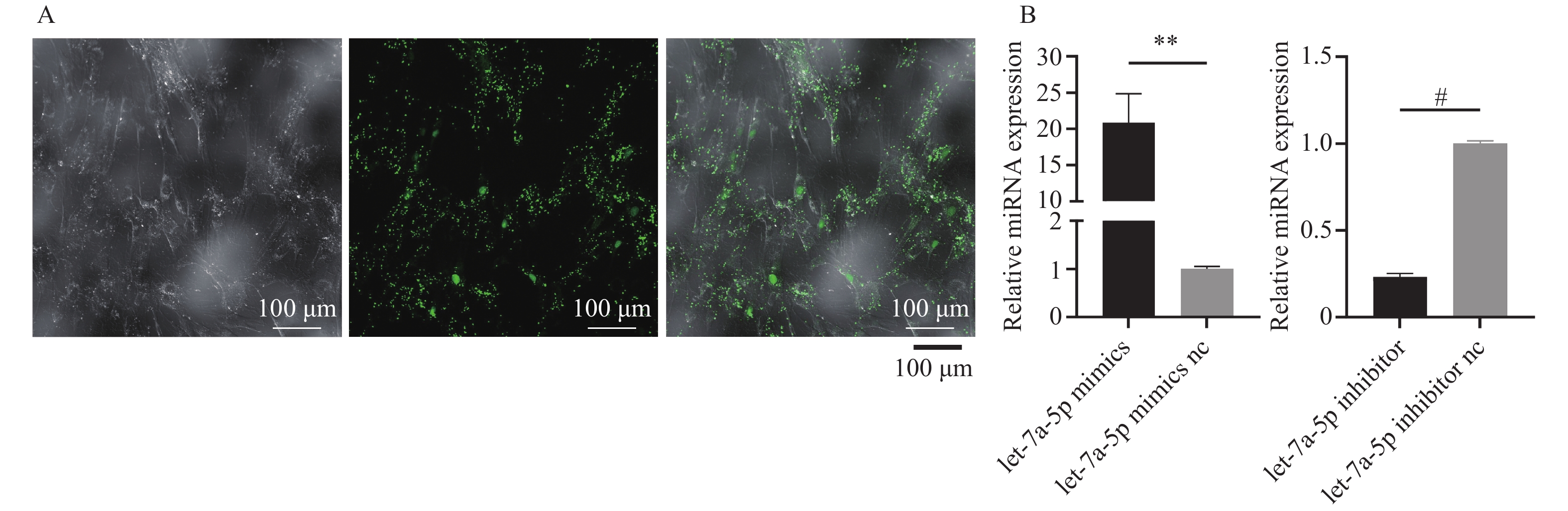
将let-7a-5p mimics、mimics nc、let-7a-5p inhibitor、inhibitor nc转染至PDLSCs 24 h后,激光共聚焦显微镜下观察到大量绿色荧光颗粒分布于PDLSCs胞质中,见图1A。RT-qPCR定量分析转染效率结果显示,转染48 h后,let-7a-5p mimics组的表达量为mimics nc组的20.62倍(P < 0.01)。let-7a-5p inhibitor组的表达量为inhibitor nc组的0.23倍(P < 0.0001),见图1B。提示let-7a-5p成功且有效转染至PDLSCs。
2.2 let-7a-5p抑制牙周膜干细胞增殖
将let-7a-5pmimics及inhibitor转染进PDLSCs后,通过CCK8、EdU、细胞周期实验探究let-7a-5p对PDLSCs增殖能力的影响。CCK-8实验结果显示,第3~7天,let-7a-5p mimics组的增殖能力明显低于mimics nc组(第3天P < 0.001,第4~7天P < 0.0001),见图2A;而在第7天时,let-7a-5p inhibitor组细胞增殖水平高于inhibitor nc组(P < 0.05),见图2B。EdU实验结果显示,转染48 h后,mimics组细胞增殖比例低于mimics nc组(P < 0.05),见图2C;inhibitor组细胞增殖比例高于inhibitor nc组(P < 0.01),见图2D。细胞周期实验中,mimics组的S期+G2/M期比例低于mimics nc组,见图2E;inhibitor组的S期+G2/M期比例高于inhibitor nc组,见图2F。综上结果提示let-7a-5p抑制牙周膜干细胞增殖。
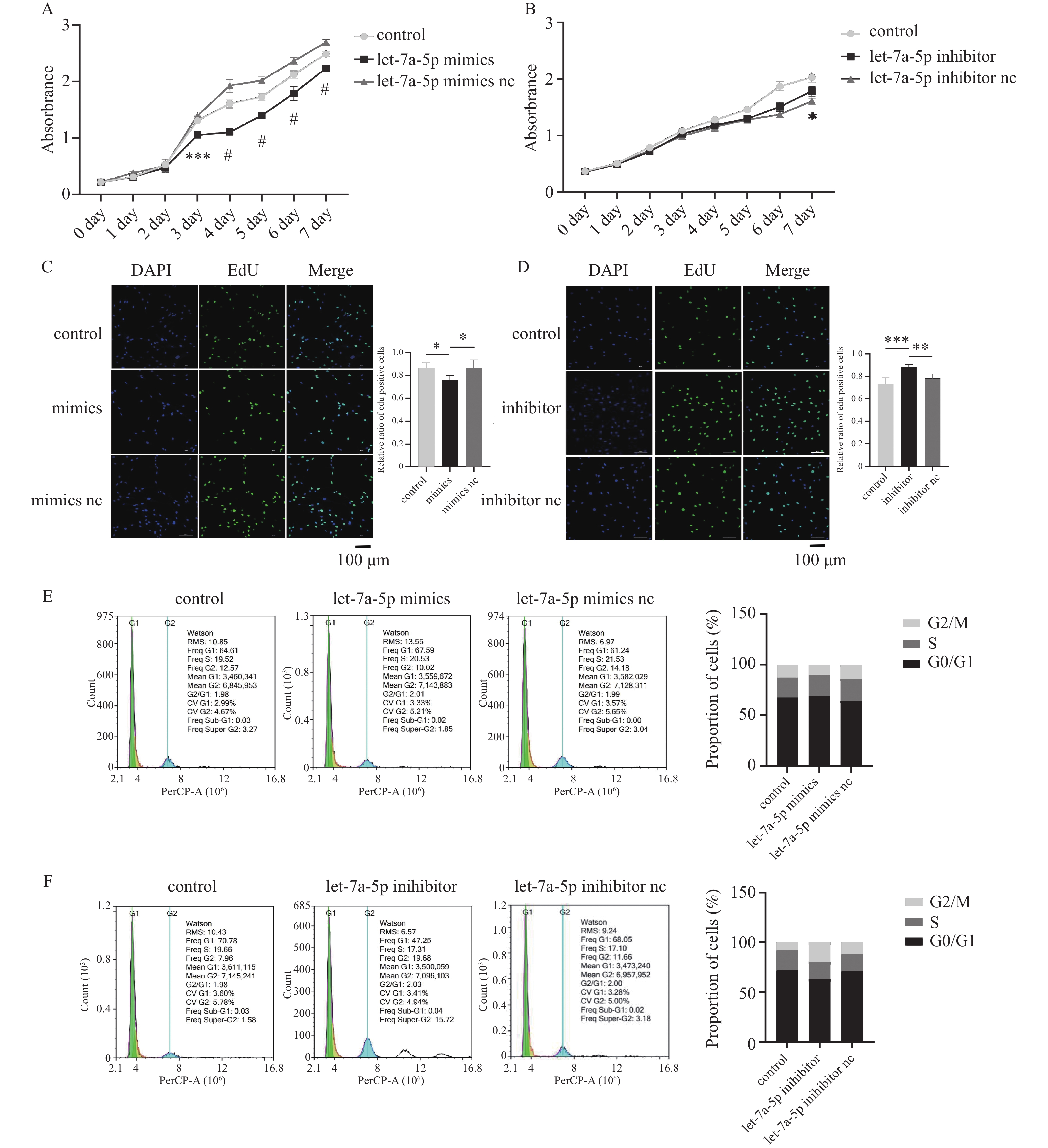 图 2 let-7a-5p抑制牙周膜干细胞增殖A:CCK-8探究let-7a-5p mimics对PDLSCs增殖的影响,n = 4;B:CCK-8探究let-7a-5p inhibitor对PDLSCs增殖的影响,n = 4;C:EdU实验探究let-7a-5p mimics对PDLSCs增殖的影响,n = 5;D:EdU实验探究let-7a-5p inhibitor对PDLSCs增殖的影响,n = 5;E:细胞周期探究let-7a-5p mimics对PDLSCs增殖的影响;F:细胞周期探究let-7a-5p inhibitor对PDLSCs增殖的影响。*P < 0.05,**P < 0.01,***P < 0.001,#P < 0.0001。Figure 2. let-7a-5p inhibits periodontal ligament stem cell proliferation
图 2 let-7a-5p抑制牙周膜干细胞增殖A:CCK-8探究let-7a-5p mimics对PDLSCs增殖的影响,n = 4;B:CCK-8探究let-7a-5p inhibitor对PDLSCs增殖的影响,n = 4;C:EdU实验探究let-7a-5p mimics对PDLSCs增殖的影响,n = 5;D:EdU实验探究let-7a-5p inhibitor对PDLSCs增殖的影响,n = 5;E:细胞周期探究let-7a-5p mimics对PDLSCs增殖的影响;F:细胞周期探究let-7a-5p inhibitor对PDLSCs增殖的影响。*P < 0.05,**P < 0.01,***P < 0.001,#P < 0.0001。Figure 2. let-7a-5p inhibits periodontal ligament stem cell proliferation2.3 let-7a-5p促进牙周膜干细胞凋亡
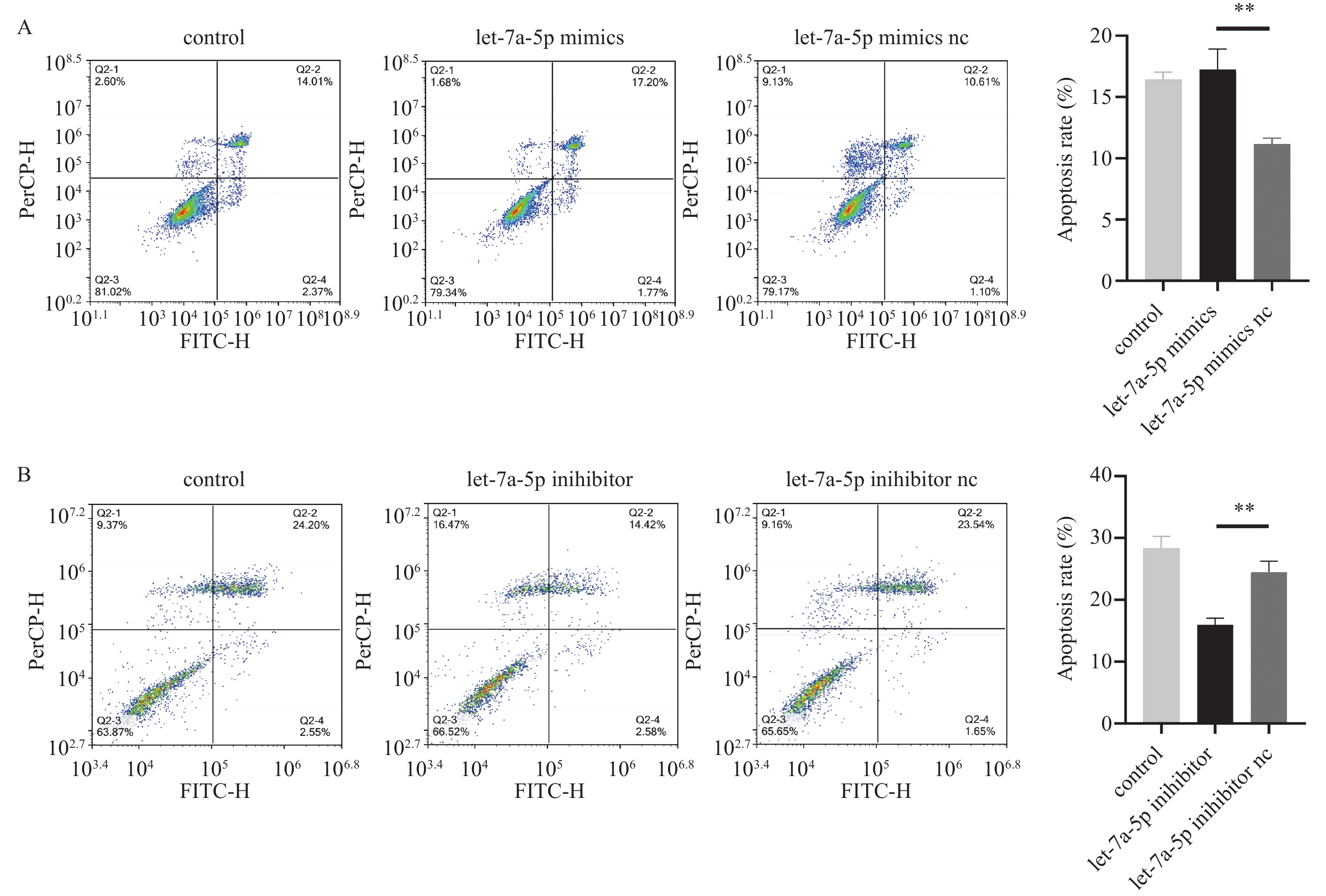
细胞凋亡实验结果显示,在let-7a-5p转染PDLSCs 48 h后,与let-7a-5p mimics nc组相比,let-7a-5p mimics组细胞凋亡率增高,且差异具有统计学意义(P < 0.01),见图3A。与let-7a-5p inhibitor nc组相比,let-7a-5p inhibitor组细胞凋亡率降低,且差异具有统计学意义(P < 0.01),见图3B。表明let-7a-5p促进牙周膜干细胞凋亡。
2.4 let-7a-5p靶基因预测及功能分析
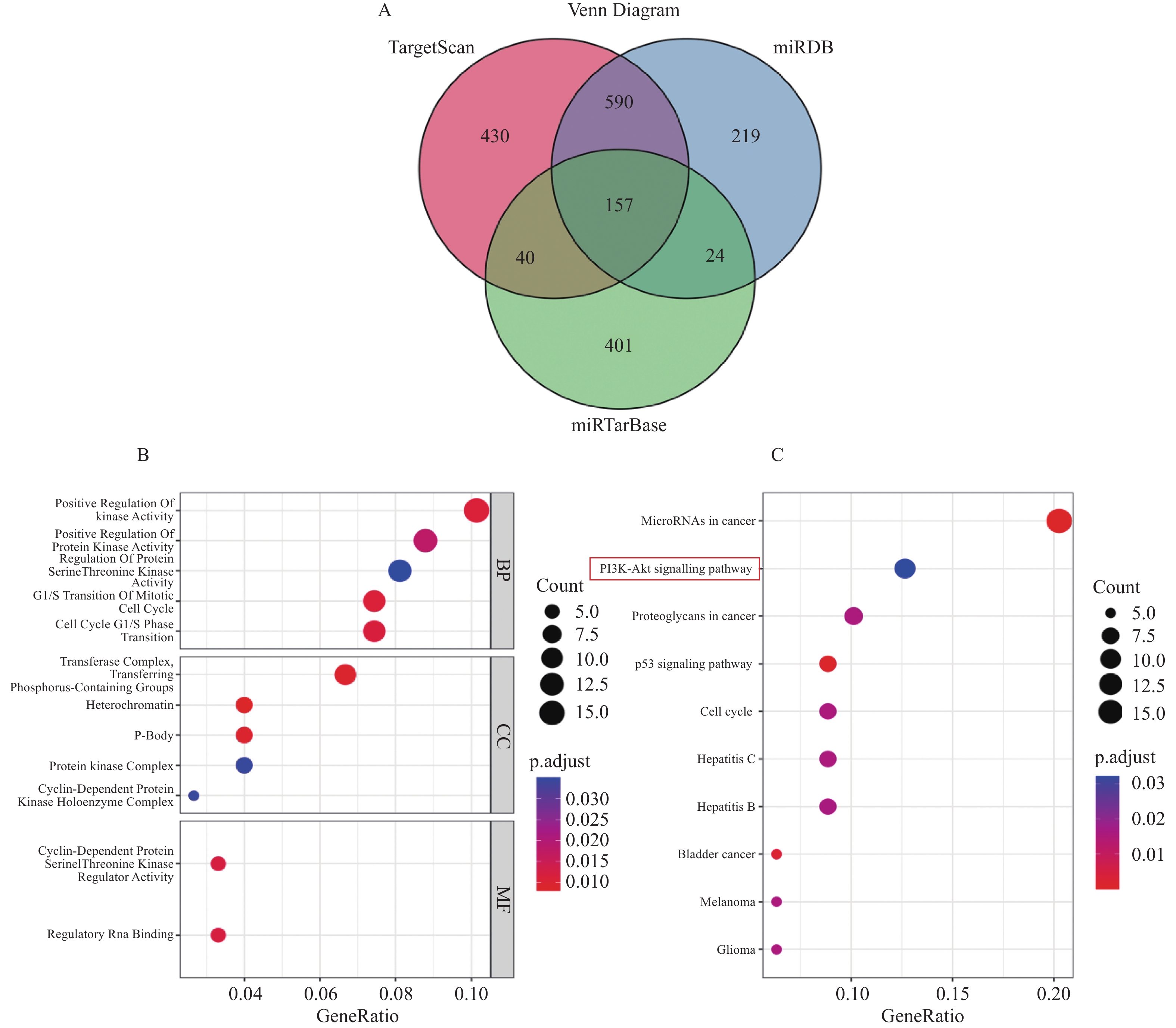
利用TargetScan、miRDB、miRTarbase预测let-7a-5p的靶基因后取三者交集,得到157个靶基因,见图4A,将这157个靶基因进行GO功能注释,得到其主要参与蛋白丝氨酸/苏氨酸激酶的调控、细胞周期等,见图4B。对靶基因进行KEGG信号通路富集分析,得到富集度最高的信号通路为PI3K-Akt通路,表明let-7a-5p的靶基因可能激活该通路影响细胞的代谢、增殖、凋亡,见图4C。
3. 讨论
牙周炎在世界范围内患病率高达45%至50%[12],目前尚未找到根治手段,传统疗法仅能控制炎症进展,难以实现受损牙周组织再生[13]。探究牙周炎发病机制,寻找治愈方法一直以来都是口腔医学领域的研究热点。本研究聚焦于健康者与牙周炎患者口腔中表达水平具有差异的miRNA let-7a-5p对PDLSCs生理功能的影响,从miRNA调控牙周组织中干细胞的角度探究牙周病的发病机制。
细胞瞬时转染是外源基因进入真核细胞的重要研究方法之一。本研究通过转染试剂包裹let-7a-5p mimics/inhibitor,使其顺利进入细胞,实现了let-7a-5p表达水平的上调和抑制。此种方法将模仿成熟miRNA双链体的mimics和可与成熟miRNA形成不可逆结合的inhibitor递送至胞质,即实现了miRNA表达水平的调控[14-16]。省去了构建质粒等载体的繁琐操作,也未采用慢病毒,无需担忧病毒防护。
miRNA是一类非编码RNA,可发挥转录后调控作用,let-7家族属于其中的一大类,多项研究提出let-7可作为肿瘤抑制因子 [17]。作为细胞增殖途径的主要调节因子,参与细胞周期和细胞分裂功能的多个基因可被let-7直接或间接抑制 [18]。例如let-7a-5p在宫颈癌细胞中表达下调,其可调控TGF-β1/ TGFBR1/pSmad3通路,抑制宫颈癌细胞增殖 [19]。let-7a还可通过靶向aurora-B抑制骨肉瘤细胞生长[20]。let-7a亦可通过下调USP32表达抑制乳腺癌细胞增殖 [21]。在非肿瘤细胞中例如人哮喘气道平滑肌细胞,let-7a可抑制其增殖而促进凋亡[22]。然而let-7a-5p对PDLSCs增殖能力的影响却鲜有报道,本研究初步证实了let-7a-5p抑制PDLSCs增殖,这与以往let-7a-5p对细胞功能影响的研究结果一致。
本研究通过CCK-8、细胞周期、EdU实验检测了let-7a-5p对PDLSCs增殖的影响。CCK-8实验发现自第3~4天起各组细胞增殖水平出现明显差异,EdU及细胞周期实验在细胞干预早期(48 h)即可观察到。这归因于3种实验的检测原理不同,CCK-8实验是通过线粒体内脱氢酶将WST-8还原成高度水溶性的橙黄色甲臜产物,其颜色的深浅与正在进行代谢活动的细胞数量成正比 [23],能间接检测细胞总体增殖效果。然而,EdU实验是在DNA合成过程中用可被荧光探针标记的核苷酸类似物EdU替代胸腺嘧啶参与DNA合成,反应细胞增殖情况 [24]。细胞周期实验是通过检测DNA含量以此计算处于有丝分裂各个时期的细胞百分比来测定增殖率 [25]。EdU和细胞周期实验的检测对象均为正在进行DNA合成的细胞,因此在时间和空间上早于检测细胞代谢产物的CCK-8实验。
细胞凋亡是一种不引起炎症反应的程序性细胞死亡,可参与到维持免疫系统的稳态中,异常的细胞凋亡亦会影响疾病的发展 [26]。半乳糖凝集素-1可抑制LPS诱导的PDLSCs自噬和凋亡,促进牙周组织再生 [27]。既往多项研究表明,let-7a可促进多种癌症细胞凋亡。例如let-7a-5p可以通过降低BZW2的表达来抑制肝癌细胞的增殖,促进细胞凋亡 [28]。Let-7a靶向EZH2抑制鼻咽癌细胞增殖并诱导细胞凋亡 [29]。而在本研究中得到let-7a-5p促进PDLSCs凋亡的结果,与以往研究一致。
本研究中还对let-7a-5p靶基因及其相关细胞功能、信号通路富集进行了生物学信息分析。GO功能注释以及KEGG通路分析二者结合来看,let-7a-5p靶基因与PI3K-Akt通路关系密切。PI3K-Akt通路与细胞增殖、凋亡有关[30],亦有研究表明,可通过调节PI3K-Akt信号通路对牙周炎进行治疗[31]。因此在后续的实验探究中本课题组将以PI3K-Akt信号通路为研究对象进行相关试验,探究let-7a-5p影响PDLSCs生理功能的具体机制。
综上所述,本研究证实了let-7a-5p抑制PDLSCs增殖,促进其凋亡。为miRNA调控牙周炎的发展增加了理论基础,也为利用干细胞疗法治疗牙周炎提供了借鉴意义。当然,本研究仅局限于let-7a-5p对PDLSCs增殖、凋亡的影响,为了更完善地阐释其对牙周炎的调控作用,还需进一步探究let-7a-5p对PDLSCs其它生理功能的影响和炎症条件下let-7a-5p对PDLSCs的影响。
-
图 2 let-7a-5p抑制牙周膜干细胞增殖
A:CCK-8探究let-7a-5p mimics对PDLSCs增殖的影响,n = 4;B:CCK-8探究let-7a-5p inhibitor对PDLSCs增殖的影响,n = 4;C:EdU实验探究let-7a-5p mimics对PDLSCs增殖的影响,n = 5;D:EdU实验探究let-7a-5p inhibitor对PDLSCs增殖的影响,n = 5;E:细胞周期探究let-7a-5p mimics对PDLSCs增殖的影响;F:细胞周期探究let-7a-5p inhibitor对PDLSCs增殖的影响。*P < 0.05,**P < 0.01,***P < 0.001,#P < 0.0001。
Figure 2. let-7a-5p inhibits periodontal ligament stem cell proliferation
-
[1] Kwon T,Lamster I B,Levin L. Current concepts in the management of periodontitis[J]. International Dental Journal,2021,71(6):462-476. doi: 10.1111/idj.12630 [2] Isola G,Santonocito S,Lupi S M,et al. Periodontal health and disease in the context of systemic diseases[J]. Mediators of Inflammation,2023,2023:9720947. [3] Păunică I,Giurgiu M,Dumitriu AS,et al. The bidirectional relationship between periodontal disease and diabetes mellitus-A review[J]. Diagnostics (Basel),2023,13(4):681. doi: 10.3390/diagnostics13040681 [4] Seo B M,Miura M,Gronthos S,et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet,2004,364(9429):149-155. doi: 10.1016/S0140-6736(04)16627-0 [5] Zhao X,Lin H,Ding T,et al. Overview of the main biological mechanisms linked to changes in periodontal ligament stem cells and the inflammatory microenvironment[J]. J Zhejiang Univ Sci B,2023,24(5):373-386. doi: 10.1631/jzus.B2200576 [6] Luan X,Zhou X,Trombetta-eSilva J,et al. MicroRNAs and periodontal homeostasis[J]. J Dent Res,2017,96(5):491-500. doi: 10.1177/0022034516685711 [7] Huang P,Jia L. MicroRNA-28-5p as a potential diagnostic biomarker for chronic periodontitis and its role in cell proliferation and inflammatory response[J]. J Dent Sci,2022,17(4):1501-1509. doi: 10.1016/j.jds.2022.04.031 [8] Venugopal P,Koshy T,Lavu V,et al. Differential expression of microRNAs let-7a,miR-125b,miR-100,and miR-21 and interaction with NF-kB pathway genes in periodontitis pathogenesis[J]. J Cell Physiol,2018,233(8):5877-5884. doi: 10.1002/jcp.26391 [9] Lee Y H,Na H S,Jeong S Y,et al. Comparison of inflammatory microRNA expression in healthy and periodontitis tissues[J]. Biocell,2011,35(2):43-49. doi: 10.32604/biocell.2011.35.043 [10] Lee N H,Lee E,Kim Y S,et al. Differential expression of microRNAs in the saliva of patients with aggressive periodontitis: A pilot study of potential biomarkers for aggressive periodontitis[J]. J Periodontal Implant Sci,2020,50(5):281-290. doi: 10.5051/jpis.2000120006 [11] Ma L,Rao N,Jiang H,et al. Small extracellular vesicles from dental follicle stem cells provide biochemical cues for periodontal tissue regeneration[J]. Stem Cell Res Ther,2022,13(1):92. doi: 10.1186/s13287-022-02767-6 [12] Li Q,Yang G,Li J,et al. Stem cell therapies for periodontal tissue regeneration: A network meta-analysis of preclinical studies[J]. Stem Cell Res Ther,2020,11(1):427. doi: 10.1186/s13287-020-01938-7 [13] Tomokiyo A,Wada N,Maeda H. Periodontal ligament stem cells: Regenerative potency in periodontium[J]. Stem Cells Dev,2019,28(15):974-985. doi: 10.1089/scd.2019.0031 [14] Jin H Y,Gonzalez-Martin A,Miletic A V,et al. Transfection of microRNA mimics should be used with caution[J]. Front Genet,2015,6:340. [15] Esau C C. Inhibition of microRNA with antisense oligonucleotides[J]. Methods,2008,44(1):55-60. doi: 10.1016/j.ymeth.2007.11.001 [16] Robertson B,Dalby A B,Karpilow J,et al. Specificity and functionality of microRNA inhibitors[J]. Silence,2010,1(1):10. doi: 10.1186/1758-907X-1-10 [17] Campani V,De Rosa G,Misso G,et al. Lipid nanoparticles to deliver miRNA in cancer[J]. Curr Pharm Biotechnol,2016,17(8):741-749. doi: 10.2174/138920101708160517234941 [18] Johnson C D,Esquela-Kerscher A,Stefani G,et al. The let-7 microRNA represses cell proliferation pathways in human cells[J]. Cancer Res,2007,67(16):7713-7722. doi: 10.1158/0008-5472.CAN-07-1083 [19] Chen Z,Qiu J,Gao Y,et al. Study on the mechanism of let-7a-5p in regulating the proliferation in cervical cancer cells[J]. Clin Transl Oncol,2022,24(8):1631-1642. doi: 10.1007/s12094-022-02810-1 [20] Yu J J,Pi W S,Cao Y,et al. Let-7a inhibits osteosarcoma cell growth and lung metastasis by targeting Aurora-B[J]. Cancer Manag Res,2018,10:6305-6315. doi: 10.2147/CMAR.S185090 [21] Liu C,Chen Z,Fang M,et al. MicroRNA let-7a inhibits proliferation of breast cancer cell by downregulating USP32 expression[J]. Transl Cancer Res,2019,8(5):1763-1771. doi: 10.21037/tcr.2019.08.30 [22] Chen Y,Qiao L,Zhang Z,et al. Let-7a inhibits proliferation and promotes apoptosis of human asthmatic airway smooth muscle cells[J]. Exp Ther Med,2019,17(5):3327-3334. [23] James N,Kini S,Pai S,et al. Comparative evaluation of corneal storage medias used as tooth avulsion medias in maintaining the viability of periodontal ligament cells using the cell counting kit-8 assay[J]. Clin Cosmet Investig Dent,2022,14:87-94. doi: 10.2147/CCIDE.S314478 [24] Sun X,Zhang C,Jin H,et al. Flow cytometric analysis of T lymphocyte proliferation in vivo by EdU incorporation[J]. Int Immunopharmacol,2016,41:56-65. doi: 10.1016/j.intimp.2016.10.019 [25] Rieger A M. Flow cytometry and cell cycle analysis: An overview[J]. Methods Mol Biol,2022,2579:47-57. [26] Xu X,Lai Y,Hua Z C. Apoptosis and apoptotic body: Disease message and therapeutic target potentials[J]. Biosci Rep,2019,39(1):BSR20180992. doi: 10.1042/BSR20180992 [27] Zhang J,Dong X,Yan Q,et al. Galectin-1 inhibited LPS-induced autophagy and apoptosis of human periodontal ligament stem cells[J]. Inflammation,2021,44(4):1302-1314. doi: 10.1007/s10753-021-01417-y [28] Liu L,Zhao J,Peng Y,et al. miR-let-7a-5p inhibits invasion and migration of hepatoma cells by regulating BZW2 expression[J]. Onco Targets Ther,2020,13:12269-12279. doi: 10.2147/OTT.S278954 [29] Cai K,Wan Y,Sun G,et al. Let-7a inhibits proliferation and induces apoptosis by targeting EZH2 in nasopharyngeal carcinoma cells[J]. Oncol Rep,2012,28(6):2101-2106. doi: 10.3892/or.2012.2027 [30] Ersahin T,Tuncbag N,Cetin-Atalay R. The PI3K/AKT/mTOR interactive pathway[J]. Mol Biosyst,2015,11(7):1946-1954. doi: 10.1039/C5MB00101C [31] Xia Z,Li Q,Tang Z. Network pharmacology,molecular docking,and experimental pharmacology explored Ermiao wan protected against periodontitis via the PI3K/AKT and NF-κB/MAPK signal pathways[J]. J Ethnopharmacol,2023,303:115900. doi: 10.1016/j.jep.2022.115900 期刊类型引用(0)
其他类型引用(1)
-






 下载:
下载:
 下载:
下载:

