The Effect of Famotidine on the Metabolism of Metoprolol Tartrate in Human Liver Microsomes
-
摘要:
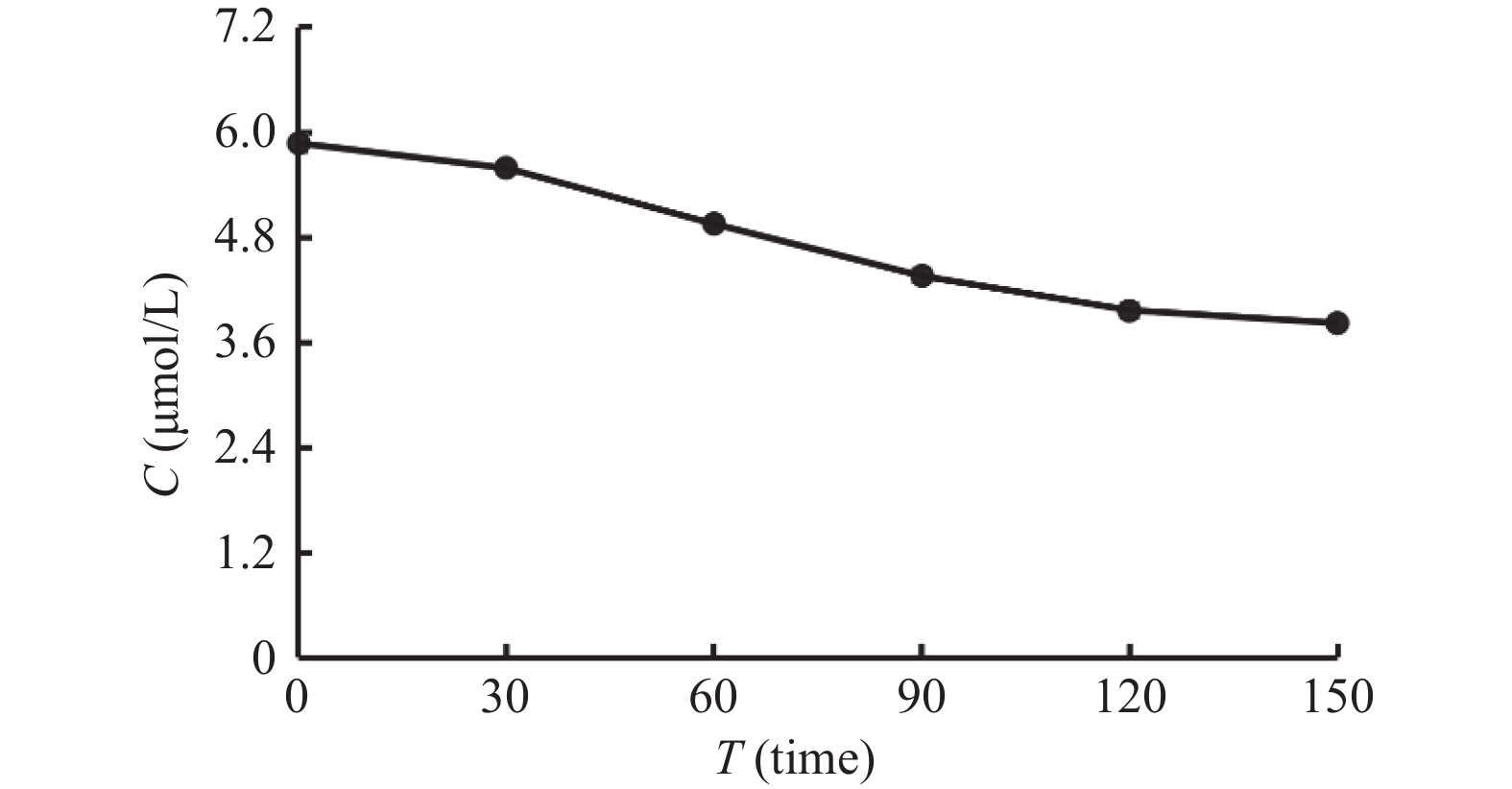
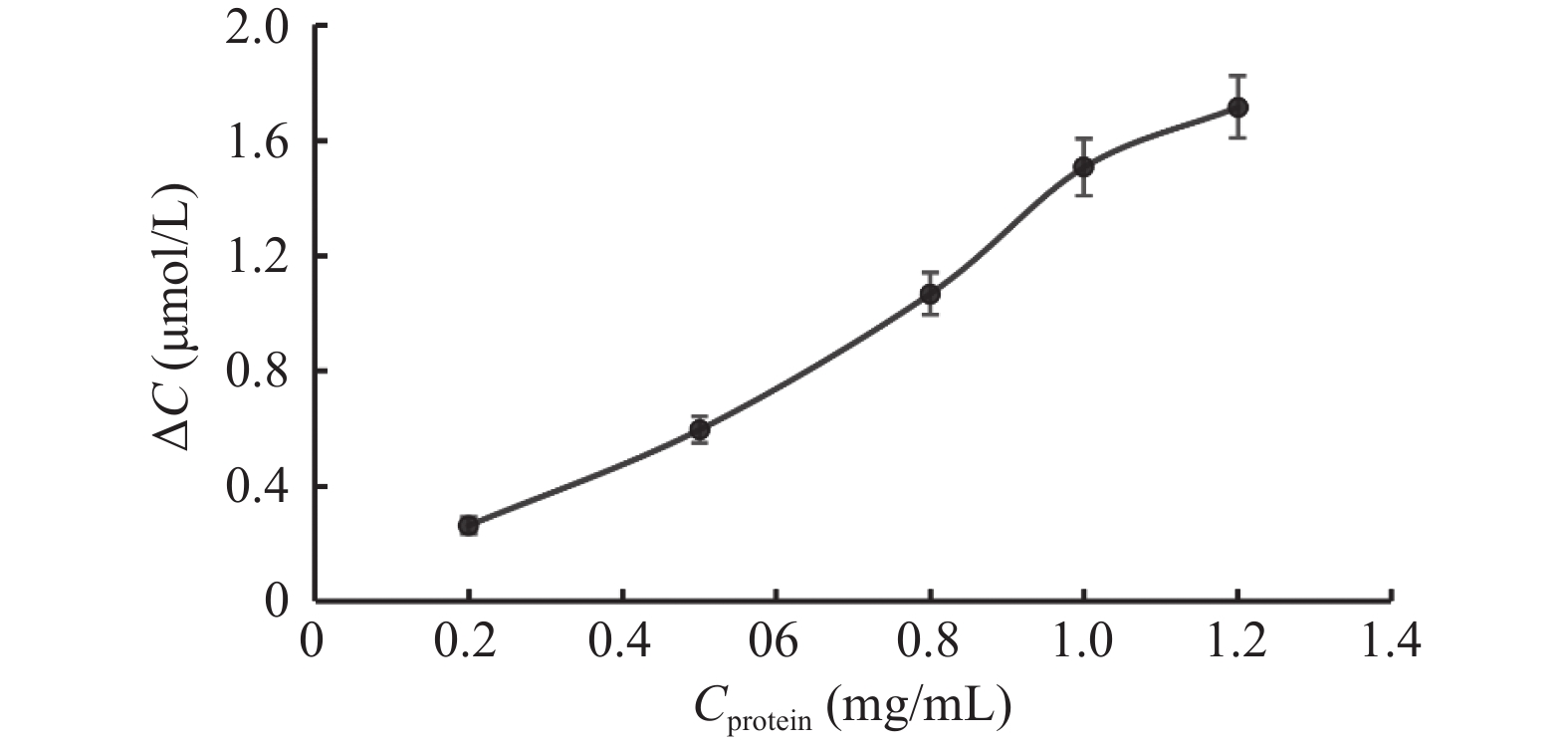
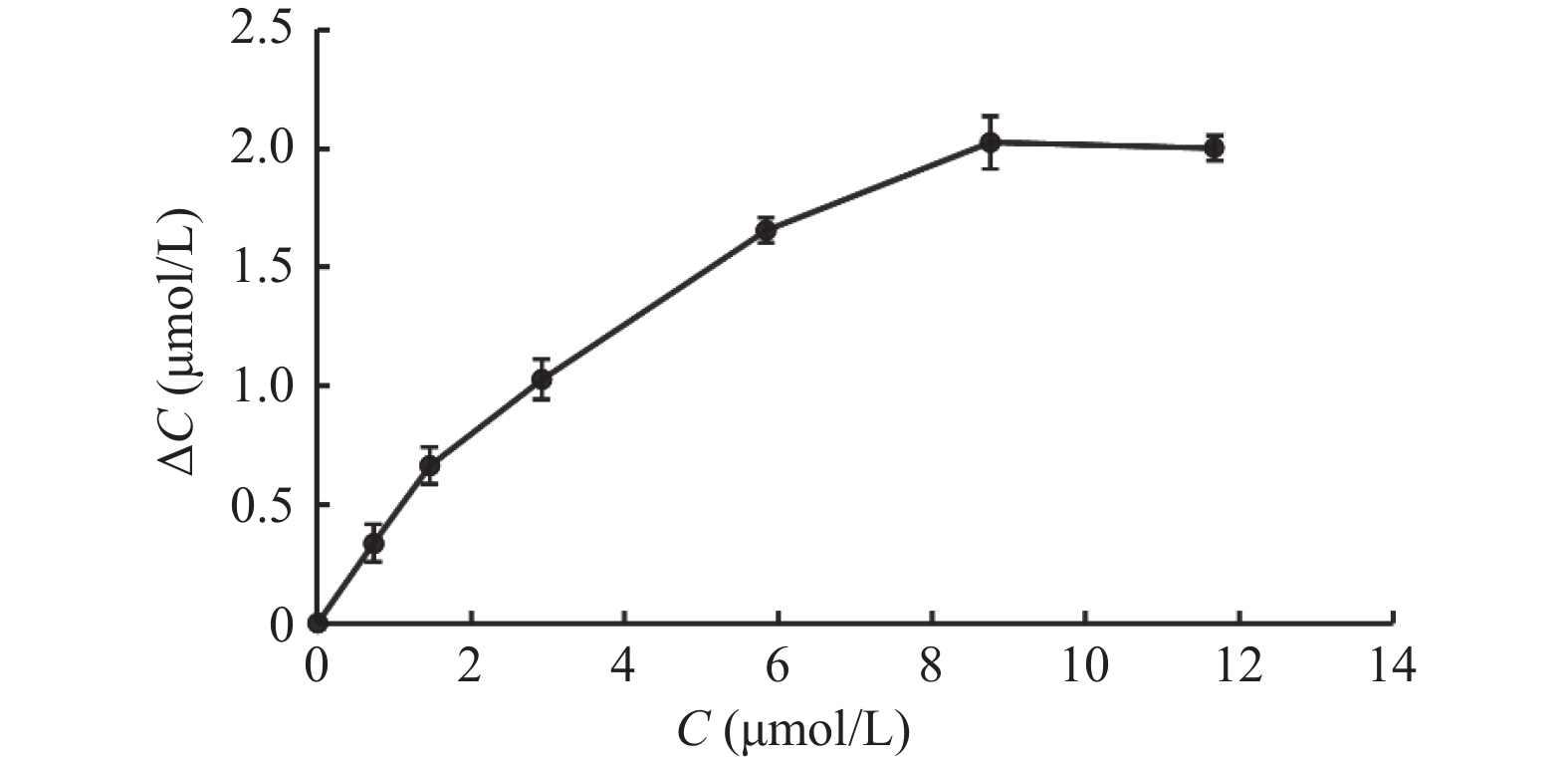
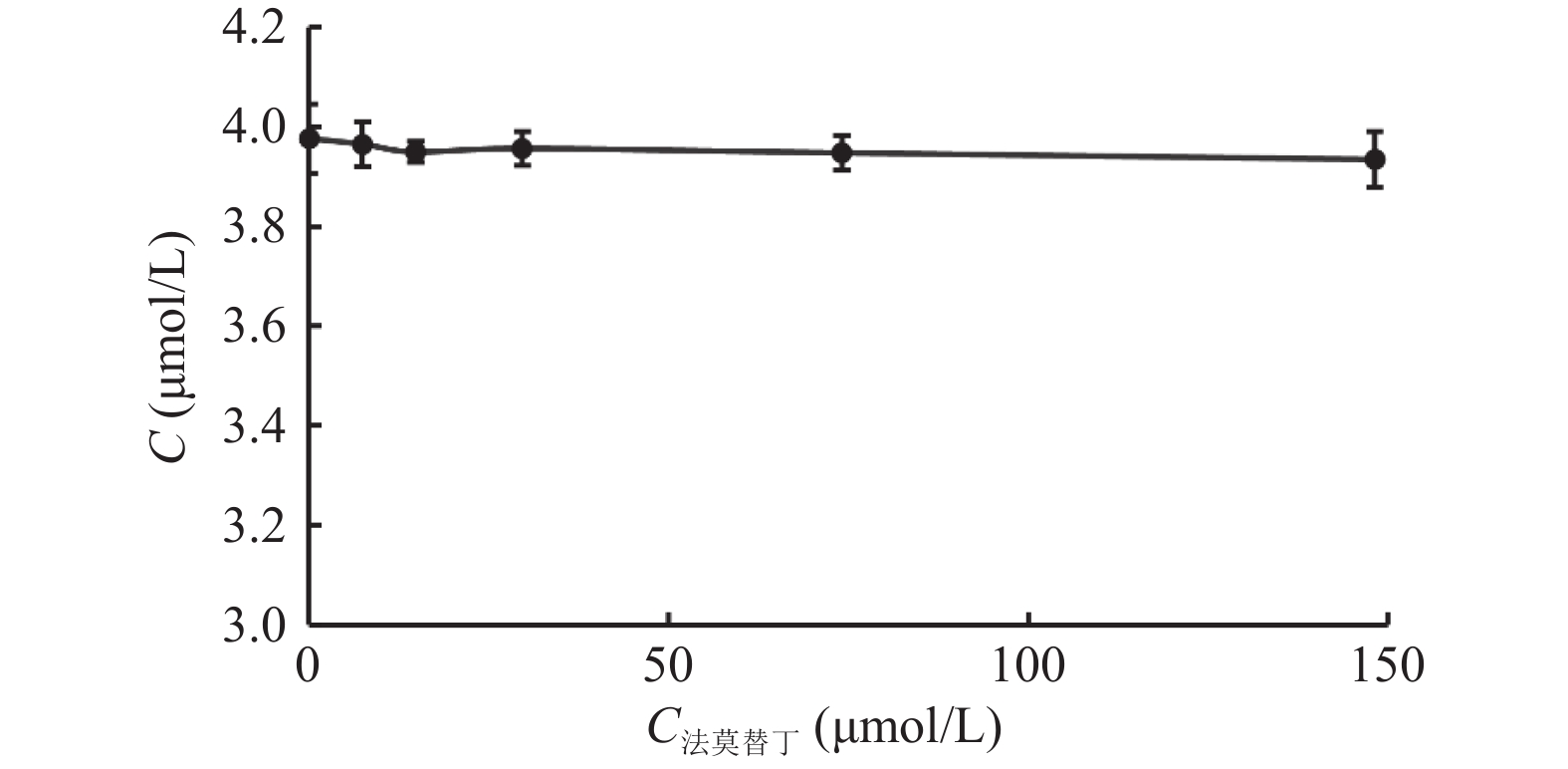
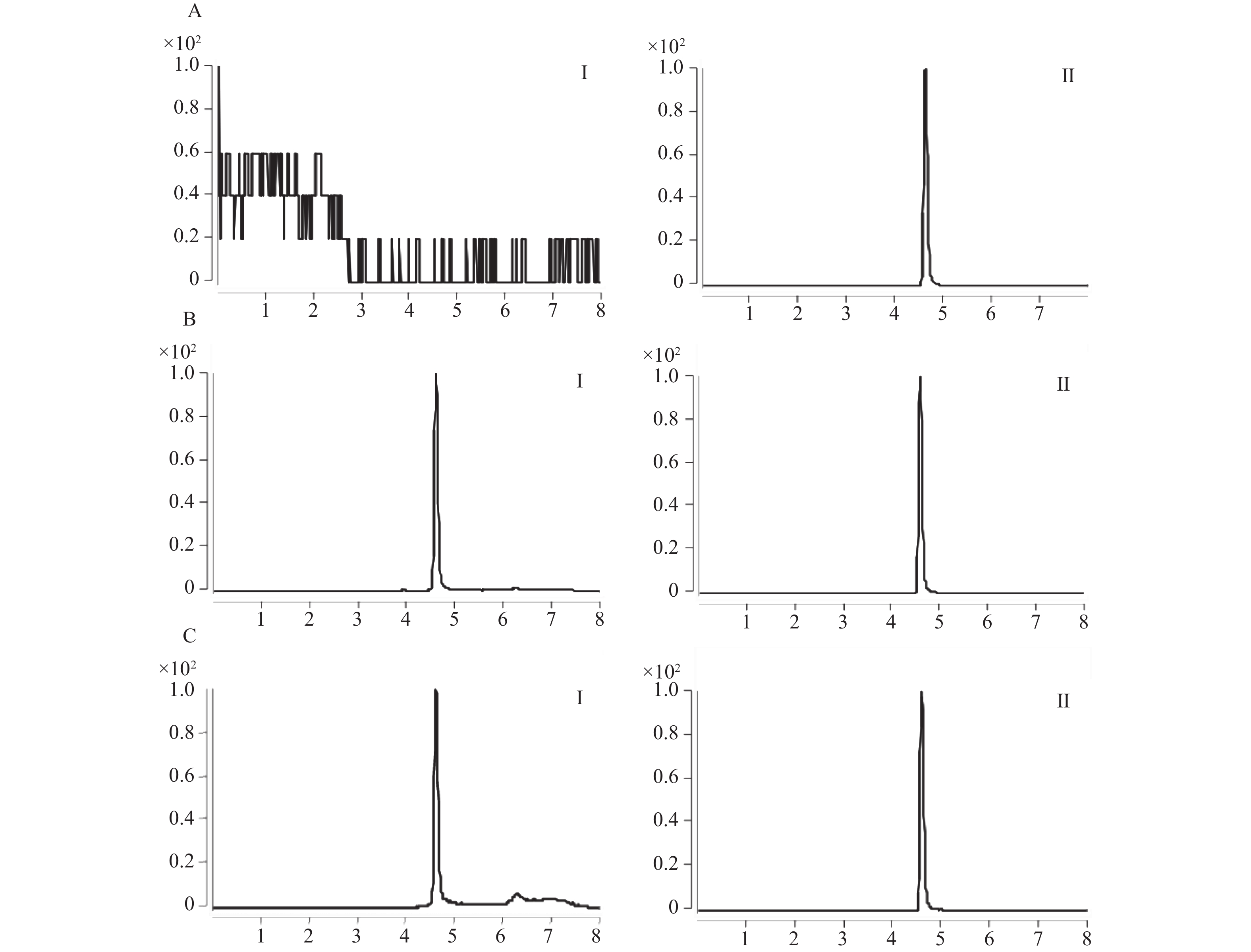
目的 通过体外人肝微粒体孵育体系考察酒石酸美托洛尔的酶促反应动力学,并探究法莫替丁对酒石酸美托洛尔代谢的影响。 方法 建立LC-MS/MS方法测定人肝微粒体孵育体系中酒石酸美托洛尔的浓度。构建人肝微粒体孵育体系,确定最佳孵育时间和蛋白浓度;采用底物减少法,计算酒石酸美托洛尔的酶促反应动力学参数(Vmax和Km);将系列浓度的法莫替丁与酒石酸美托洛尔共同孵育,并测定酒石酸美托洛尔的浓度,考察法莫替丁对酒石酸美托洛尔代谢的影响。 结果 酒石酸美托洛尔在人肝微粒体的最佳孵育时间为60 min,最佳蛋白浓度为1.0 mg/mL;酶促反应动力学参数Vmax = 0.07 µmol/min/mg protein,Km = 7.84 µmol/L。 结论 法莫替丁对酒石酸美托洛尔在人肝微粒体孵育体系中的代谢未产生显著的抑制作用,提示两药联合使用较安全。 Abstract:Objective To explore the enzymatic reaction kinetics of metoprolol tartrate in an in vitro human liver microsome incubation experiment and to explore the effect of famotidine on the metabolism of metoprolol tartrate. Methods An LC-MS/MS method was developed to accurately measure the concentration of metoprolol tartrate in a human liver microsomal incubation system. A human liver microsome incubation system was established to determine the optimal incubation time and protein concentration; using the substrate depletion method, the enzymatic reaction kinetics parameters of metoprolol tartrate (such as Vmax and Km). Series concentrations of famotidine were co-incubated with metoprolol tartrate, and the concentration of metoprolol tartrate was measured to evaluate the effect of famotidine on its metabolism. Results The optimal incubation time for metoprolol tartrate in human liver microsomes was found to be 60 minutes, with an optimal protein concentration of 1.0 mg/mL. The enzymatic reaction kinetics parameters were Vmax = 0.07 µmol/min/mg protein and Km = 7.84 µmol/L. Conclusion The results indicated that famotidine did not produce a significant inhibitory effect on the metabolism of metoprolol tartrate in human liver microsome incubation system, suggesting that the combination of these two drugs may be relatively safe. -
Key words:
- Metoprolol tartrate /
- Famotidine /
- Human liver microsomes /
- LC-MS/MS /
- Kinetics of enzymatic reactions
-
表 1 酒石酸美托洛尔的精密度与准确度结果($ \bar x \pm s $,n = 6)
Table 1. Results of precision and accuracy for metoprolol tartrate($ \bar x \pm s $,n = 6)
理论浓度(µmol/L) 日内精密度 日间精密度 准确度 实测浓度(µmol/L) RSD(%) 实测浓度(µmol/L) RSD(%) 0.36 0.37 ± 0.02 4.60 0.38 ± 0.02 2.51 3.08 0.73 0.70 ± 0.03 4.12 0.71 ± 0.05 0.52 −2.65 5.84 5.81 ± 0.16 2.77 5.76 ± 0.26 9.59 −1.31 9.92 9.97 ± 0.23 2.26 10.04 ± 0.39 4.86 1.13 表 2 酒石酸美托洛尔的提取回收率与基质效应结果($ \bar x \pm s $)
Table 2. Results of extraction recovery and matrix effect for metoprolol tartrate($ \bar x \pm s $)
理论浓度
(µmol/L)提取回收率 RSD(%) 基质效应 RSD(%) 0.73 94.36 ± 0.04 4.37 97.22 ± 0.01 1.35 5.84 94.75 ± 0.03 2.95 97.13 ± 0.02 1.99 9.92 91.16 ± 0.04 4.15 95.41 ± 0.01 1.10 表 3 酒石酸美托洛尔的稳定性试验结果($ \bar x \pm s $,n = 6)
Table 3. Stability test results of metoprolol tartrate($ \bar x \pm s $,n = 6)
理论浓度 (µmol/L) 实测浓度(µmol/L) RSD(%) 0.73 0.69 ± 0.02 2.76 5.84 5.74 ± 0.01 1.05 9.92 9.81 ± 0.08 0.86 -
[1] Leary P J,Tedford R J,Bluemke D A,et al. Histamine H2 receptor antagonists,left ventricular morphology,and heart failure risk: the MESA study[J]. J Am Coll Cardiol,2016,67(13):1544-1552. [2] Yoshihisa A,Takiguchi M,Kanno Y,et al. Associations of acid suppressive therapy with cardiac mortality in heart failure patients[J]. J Am Heart Assoc,2017,6(5):e005110. doi: 10.1161/JAHA.116.005110 [3] Adelborg K,Sundbøll J,Schmidt M,et al. Use of histamine H2 receptor antagonists and outcomes in patients with heart failure: A nationwide population-based cohort study[J]. Clin Epidemiol,2018,10:521-530. doi: 10.2147/CLEP.S162909 [4] Fremont-Smith M,Gherlone N,Smith N,et al. Models for COVID-19 early cardiac pathology following SARS-CoV-2 infection[J]. Int J Infect Dis,2021,113:331-335. doi: 10.1016/j.ijid.2021.09.052 [5] Zhang J,Cai W K,Zhang Z,et al. Cardioprotective effect of histamine H2 antagonists in congestive heart failure: A systematic review and meta-analysis[J]. Medicine (Baltimore),2018,97(15):e0409. [6] Huang Y H,Cai W K,Yin S J,et al. Histamine H2 receptor antagonist exposure was related to decreased all-cause mortality in critical ill patients with heart failure: A cohort study[J]. Eur J Prev Cardiol,2022,29(14):1854-65. doi: 10.1093/eurjpc/zwac122 [7] Cleland J G F,Bunting K V,Flather M D,et al. Beta-blockers for heart failure with reduced,mid-range,and preserved ejection fraction: An individual patient-level analysis of double-blind randomized trials[J]. Eur Heart J,2018,39(1):26-35. doi: 10.1093/eurheartj/ehx564 [8] Dybro A M,Rasmussen T B,Nielsen R R,et al. Metoprolol improves left ventricular longitudinal strain at rest and during exercise in obstructive hypertrophic cardiomyopathy[J]. J Am Soc Echocardiogr,2023,36(2):196-204. doi: 10.1016/j.echo.2022.09.008 [9] Zeng Z,Shen L,Li X,et al. Disruption of histamine H2 receptor slows heart failure progression through reducing myocardial apoptosis and fibrosis[J]. Clin Sci (Lond),2014,127(7):435-448. doi: 10.1042/CS20130716 [10] He G H,Xu G L,Cai W K,et al. Is histamine H2 receptor a real promising target for prevention or treatment of heart failure?[J]. J Am Coll Cardiol,2016,68(18):2029. [11] Levick S P. Histamine receptors in heart failure[J]. Heart Fail Rev,2022,27(4):1355-1372. doi: 10.1007/s10741-021-10166-x [12] Zhang X S,Cai W K,Wang P,et al. Histamine H2 receptor antagonist exhibited comparable all-cause mortality-decreasing effect as β-blockers in critically ill patients with heart failure: A cohort study[J]. Front Pharmacol,2023,14:1273640. doi: 10.3389/fphar.2023.1273640 [13] 国家药典委员会. 中华人民共和国药典: 四部 [S]. 2020年版. 北京: 中国医药科技出版社,2020: 466-471. [14] 高琳,宋可心,任纪平,等. Cocktail探针药物法评价木犀草素对大鼠CYP450酶活性影响[J]. 中国新药杂志,2022,31(6):590-595. doi: 10.3969/j.issn.1003-3734.2022.06.011 [15] 李珊,路明,柳熠鑫,等. 细胞色素P4503A4酶介导的水飞蓟素对吉非替尼代谢的影响[J]. 中国临床药理学杂志,2023,39(11):1587-1591. -






 下载:
下载: