Expression Characteristics and Clinical Pathological Features of TMEM33 in Lung Adenocarcinoma
-
摘要:
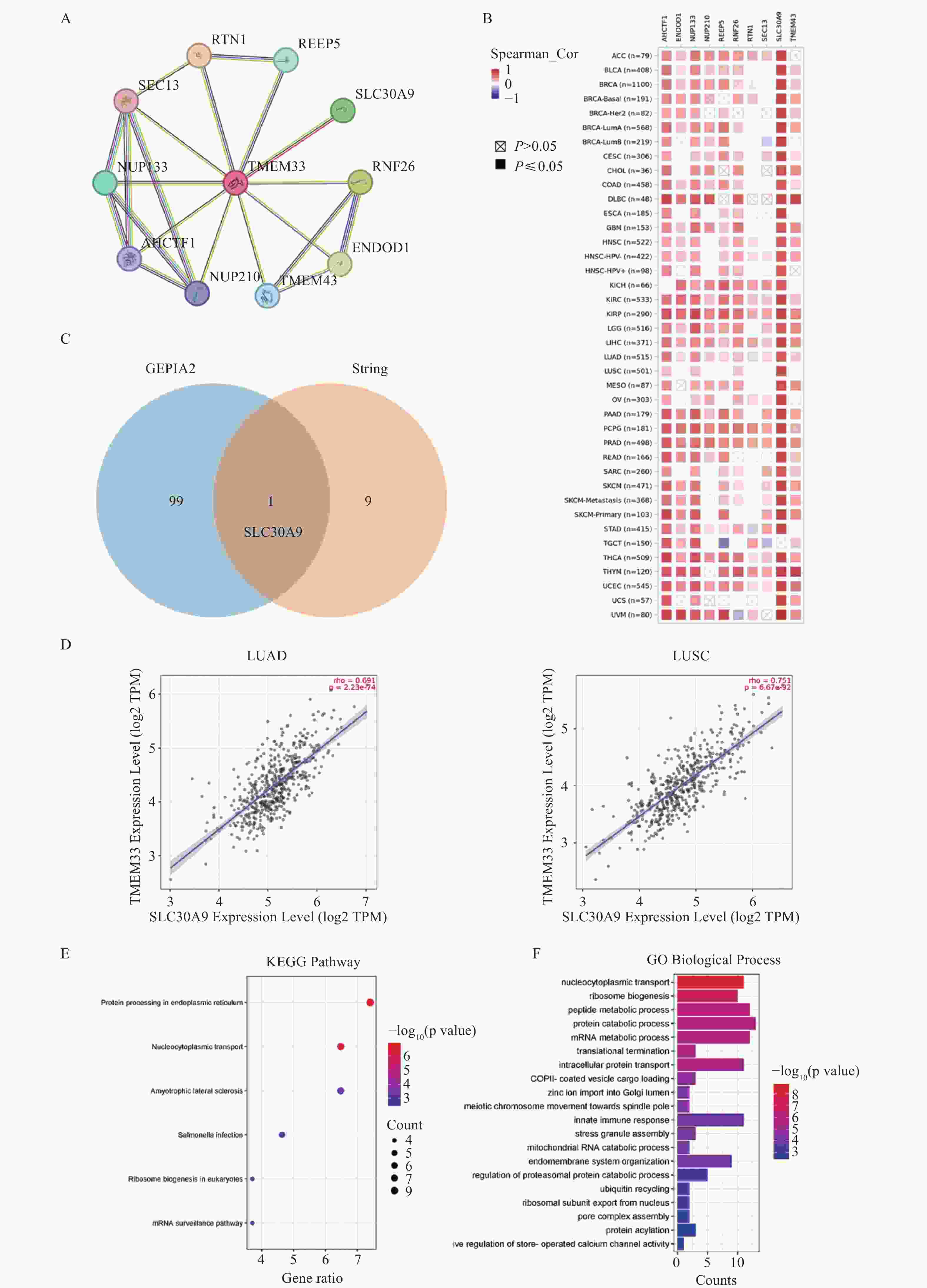
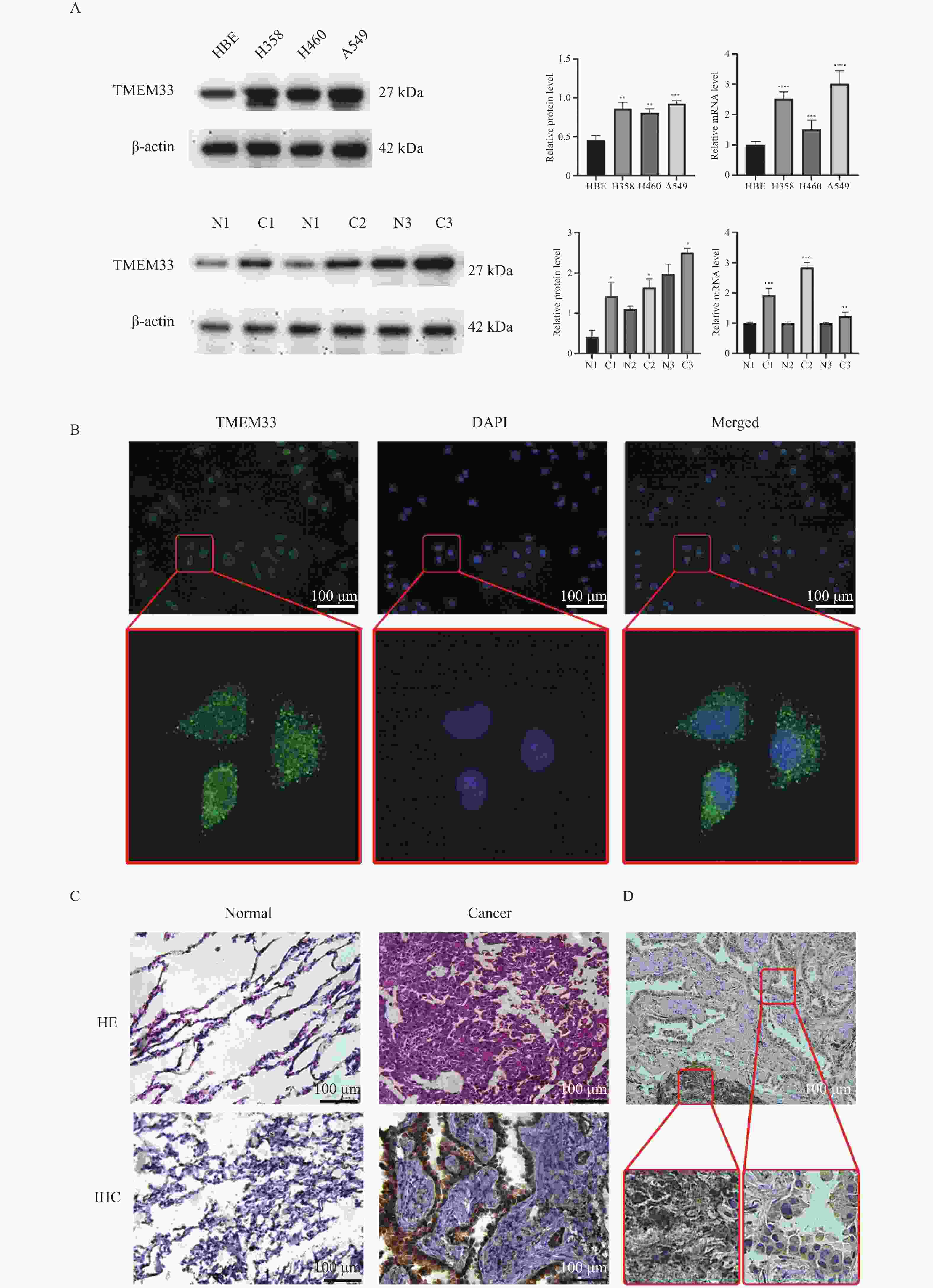
目的 本研究旨在探讨跨膜蛋白33(transmembrane protein 33,TMEM33)在肺腺癌中的表达模式,并分析其与临床病理特征的相关性。 方法 利用公共数据库(如TCGA和GEO)和生物信息学工具对TMEM33在肺癌中的表达数据进行了分析。在4种细胞系中通过免疫印迹技术和实时定量PCR检测了TMEM33的蛋白和mRNA表达水平。还通过细胞免疫荧光和免疫组织化学技术在肺腺癌组织和正常肺组织中评估了TMEM33的表达和定位。 结果 生物信息学分析显示,TMEM33在肺腺癌中的表达水平高于正常肺组织(P < 0.05),TMEM33与SLC30A9的表达具有相关性(P < 0.0001)。Logistic回归分析显示,TMEM33的表达水平与T分期相关(OR = 0.48,P = 0.044)。实验结果显示,在肺腺癌细胞系中,TMEM33的蛋白(P < 0.01)和mRNA(P < 0.001)表达水平都高于正常肺上皮细胞。同样,在肺腺癌组织中,TMEM33的蛋白(P < 0.05)和mRNA(P < 0.01)表达水平都高于癌旁组织。免疫组织化学技术揭示了TMEM33在肺腺癌组织中高表达。 结论 TMEM33在肺腺癌中高表达,与恶性程度和T分期相关,有望成为肺腺癌预后评估和治疗的潜在靶点。 Abstract:Objective This study aimed to explore the expression pattern of transmembrane protein 33 (TMEM33) in lung adenocarcinoma and its correlation with clinical pathological features. Methods Bioinformatics tools and public databases (e.g., TCGA and GEO) were used to analyze TMEM33 expression data in lung cancer. Then, immunoblotting and real-time quantitative PCR were performed to detect TMEM33 protein and mRNA levels in four cell lines. Immunofluorescence and immunohistochemistry were also used to assess TMEM33 expression and localization in lung adenocarcinoma and normal lung tissue samples. Results Bioinformatics analysis revealed higher TMEM33 expression in lung adenocarcinoma than in normal lung tissue (P < 0.05) and a significant correlation between TMEM33 and SLC30A9 expression (P < 0.0001). Logistic regression analysis indicated an association between TMEM33 expression and tumor T stage (OR = 0.48, P = 0.044). Experimental results showed higher TMEM33 protein (P < 0.01) and mRNA (P < 0.001) levels in lung adenocarcinoma cell lines than in normal lung epithelial cells. Similarly, TMEM33 protein (P < 0.05) and mRNA (P < 0.01) levels were higher in lung adenocarcinoma tissues than in adjacent tissues. Immunohistochemistry confirmed high TMEM33 expression in lung adenocarcinoma tissues. Conclusion TMEM33 is highly expressed in lung adenocarcinoma, associated with malignancy and T stage, and may be a potential prognostic and therapeutic target. -
Key words:
- Lung adenocarcinoma /
- TMEM33 /
- Biomarker /
- Clinical pathological features /
- Bioinformatics analysis
-
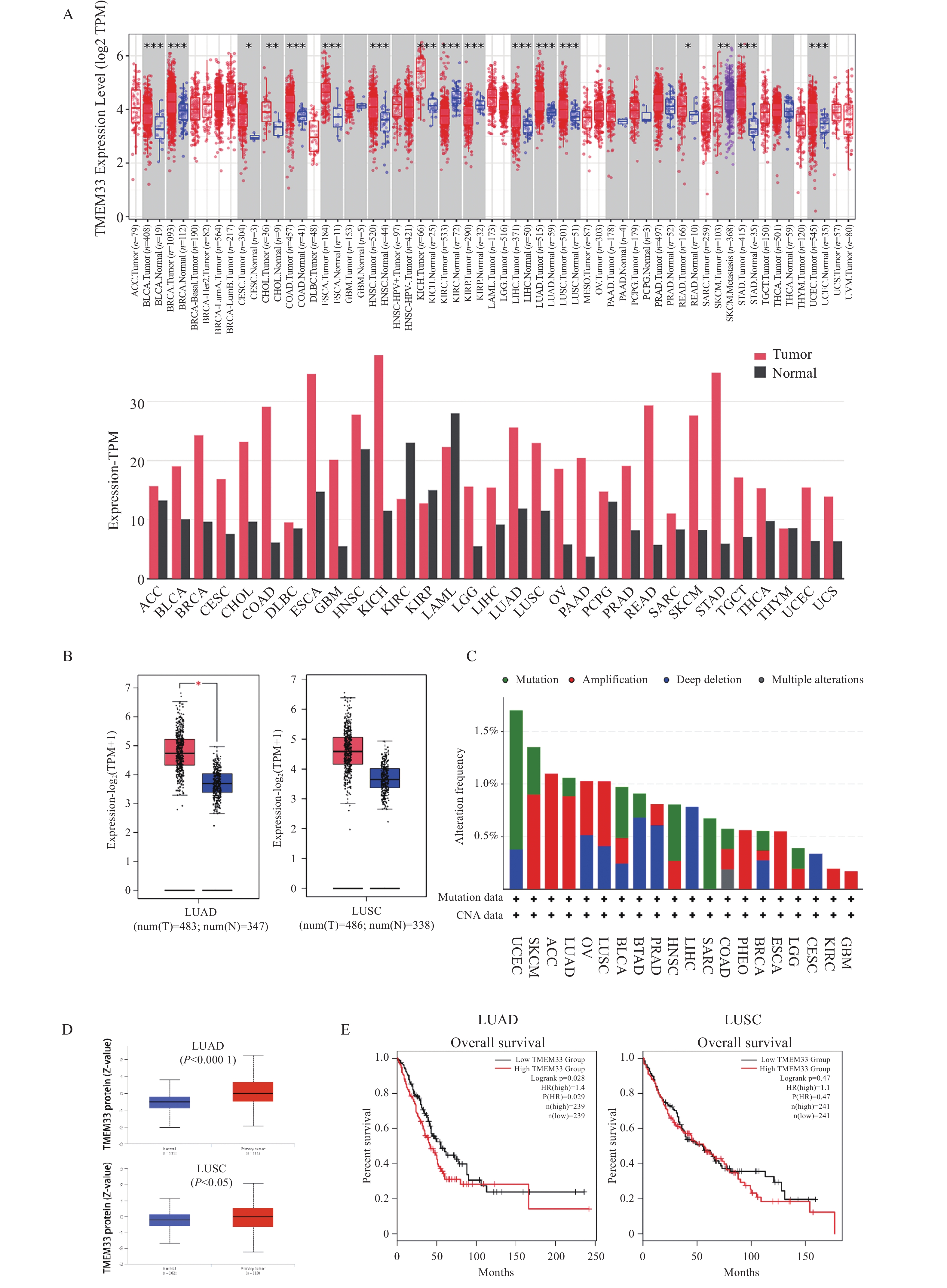
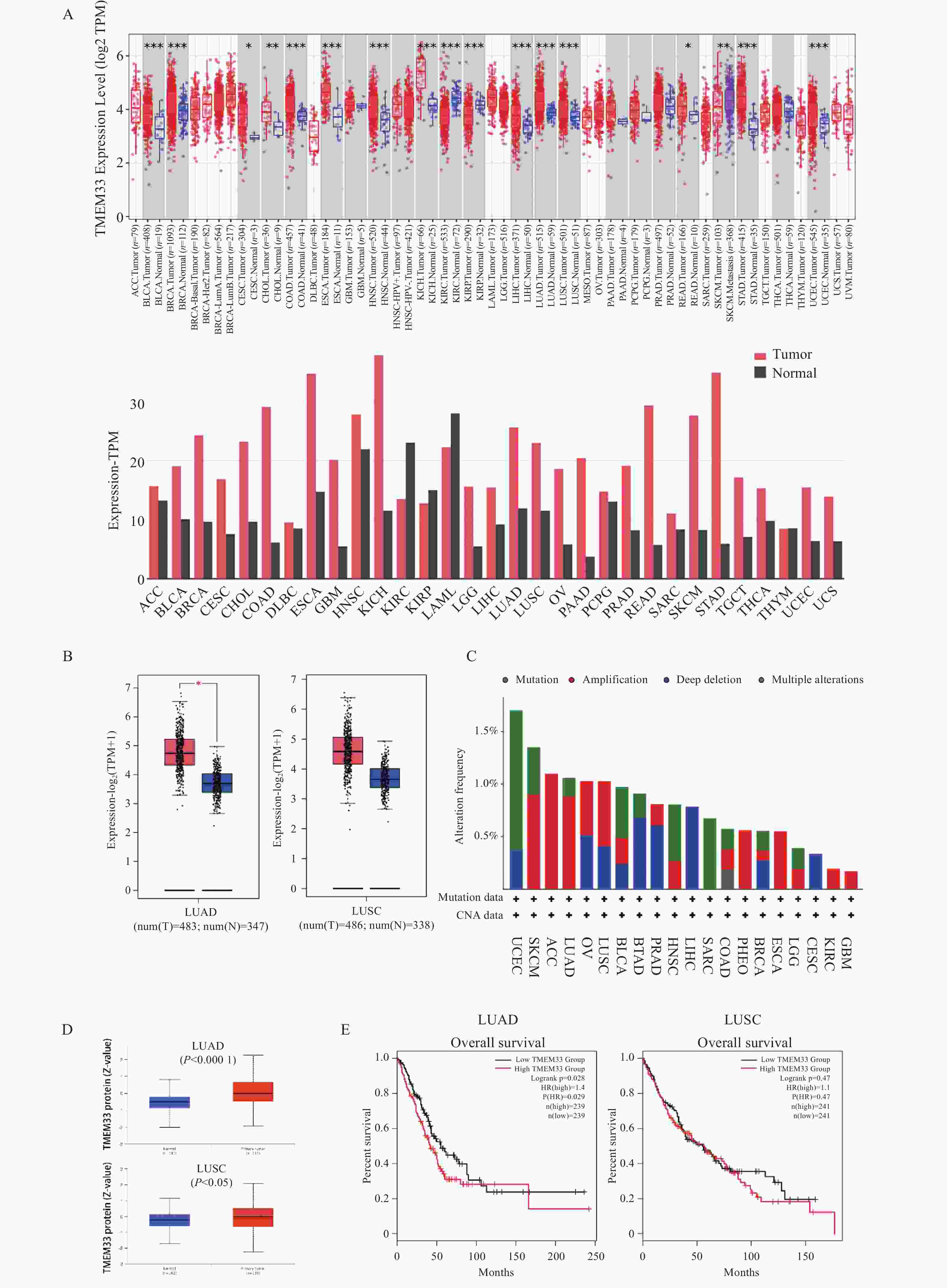
图 1 TMEM33在肺腺癌中的表达与生存分析
A:不同癌症类型中人类 TMEM33 表达水平,与对照组比较,*P < 0.05,**P < 0.01,***P < 0.001;B:肺腺癌和肺鳞癌箱线图数据,GTEx数据库的正常组织被包括作为对照。与对照组比较,*P < 0.05;C:人类泛癌中 TMEM33 的改变频率与突变类型;D:肺腺癌和肺鳞癌中TMEM33的蛋白质组表达谱,与对照组比较,*P < 0.05,****P < 0.0001;E:肺腺癌和肺鳞癌患者的 TMEM33 表达与其预后。
Figure 1. Expression and survival analysis of TMEM33 in lung adenocarcinoma
表 1 TMEM33表达差异的肺腺癌患者的临床病理特征[n(%)]
Table 1. Clinicopathological characteristics of LUAD patients with differential TMEM33 expression [n(%)]
特征 TMEM33高表达
(n = 193)TMEM33低表达
(n = 193)P 年龄(岁) 0.895 <45 8 (4.1) 9 (4.7) > 60 138 (72) 134 (69) 45~60 47 (24) 50 (26) 性别 0.127 女性 89 (46) 105 (54) 男性 104 (54) 88 (46) 临床分期 0.986 Ⅰ期 101 (52) 98 (51) Ⅱ期 48 (25) 48 (25) Ⅲ期 33 (17) 35 (18) Ⅳ期 11 (5.7) 12 (6.2) T分期 0.123 T1 48 (25) 68 (35) T2 117 (61) 104 (54) T3 19 (9.8) 12 (6.2) T4 9 (4.7) 9 (4.7) N分期 0.555 N0 126 (65) 116 (60) N1 38 (20) 46 (24) N2 29 (15) 30 (16) N3 0 (0) 1 (0.5) M分期 > 0.999 M0 182 (94) 181 (94) M1 11 (5.7) 12 (6.2) 表 2 肺腺癌患者临床病理特征与TMEM33表达之间关联的Logistic回归分析
Table 2. Logistic regression analysis of association between clinicopathological characteristics and TMEM33 expression in LUAD patients
特征 优势比(OR) P 年龄(岁) > 60 1.159 (0.431~3.171) 0.769 45~60 1.057 (0.374~3.036) 0.915 性别 男性 1.394 (0.935~2.084) 0.104 临床分期 Ⅱ期 0.79(0.52~1.200) 0.903 Ⅲ期 0.73(0.45~1.190) 0.751 Ⅳ期 0.65(0.29~1.460) 0.790 T分期 T2 0.48(0.33~0.710) 0.044* T3 0.37(0.19~0.710) 0.051 T4 0.34(0.13~0.910) 0.493 N分期 N1 0.93(0.59~1.450) 0.282 N2 0.72(0.43~1.190) 0.605 M分期 M1 0.76(0.33~1.730) 0.830 *P < 0.05。 -
[1] Leiter A,Veluswamy R R,Wisnivesky J P. The global burden of lung cancer: Current status and future trends[J]. Nat Rev Clin Oncol,2023,20(9):624-639. doi: 10.1038/s41571-023-00798-3 [2] Sung H,Ferlay J,Siegel R L,et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660 [3] Li C,Lei S,Ding L,et al. Global burden and trends of lung cancer incidence and mortality[J]. Chin Med J (Engl),2023,136(13):1583-1590. [4] 董晶,商双,高蜀君,等. RNA干扰TMEM33的表达对宫颈癌细胞生长的影响[J]. 复旦学报(医学版),2023,50(2):159-165. [5] Chen H,Zhao X,Li Y,et al. High expression of TMEM33 predicts poor prognosis and promotes cell proliferation in cervical cancer[J]. Front Genet,2022,13:908807. doi: 10.3389/fgene.2022.908807 [6] Zhang J,Lu Q,Pang H,et al. Mir-103a-3p aggravates renal cell carcinoma by targeting TMEM33[J]. Am J Transl Res,2021,13(11):12694-12703. [7] Sakabe I,Hu R,Jin L,et al. TMEM33: A new stress-inducible endoplasmic reticulum transmembrane protein and modulator of the unfolded protein response signaling[J]. Breast Cancer Res Treat,2015,153(2):285-297. doi: 10.1007/s10549-015-3536-7 [8] Urade T,Yamamoto Y,Zhang X,et al. Identification and characterization of TMEM33 as a reticulon-binding protein[J]. Kobe J Med Sci,2014,60(3):E57-65. [9] Zhang D,Oliferenko S. Tts1,the fission yeast homologue of the TMEM33 family,functions in ne remodeling during mitosis[J]. Mol Biol Cell,2014,25(19):2970-2983. doi: 10.1091/mbc.e13-12-0729 [10] Chadrin A,Hess B,San Roman M,et al. Pom33,a novel transmembrane nucleoporin required for proper nuclear pore complex distribution[J]. J Cell Biol,2010,189(5):795-811. doi: 10.1083/jcb.200910043 [11] Savage A M,Kurusamy S,Chen Y,et al. Tmem33 is essential for vegf-mediated endothelial calcium oscillations and angiogenesis[J]. Nat Commun,2019,10(1):732. doi: 10.1038/s41467-019-08590-7 [12] Chi A,Valencia J C,Hu Z Z,et al. Proteomic and bioinformatic characterization of the biogenesis and function of melanosomes[J]. J Proteome Res,2006,5(11):3135-3144. doi: 10.1021/pr060363j [13] Luo H,Hu L,Brito L F,et al. Weighted single-step GWAS and rna sequencing reveals key candidate genes associated with physiological indicators of heat stress in holstein cattle[J]. J Anim Sci Biotechnol,2022,13(1):108. doi: 10.1186/s40104-022-00748-6 [14] Liu F,Ma M,Gao A,et al. Pkm2-TMEM33 axis regulates lipid homeostasis in cancer cells by controlling scap stability[J]. EMBO J,2021,40(22):e108065. doi: 10.15252/embj.2021108065 [15] Zhang H,Wang J,Yang J,et al. TMEM33 as a prognostic biomarker of cervical cancer and its correlation with immune infiltration[J]. Mediators Inflamm,2023,2023:5542181. [16] Ding M,Yu Z,Lu T,et al. N-acetyltransferase 10 facilitates tumorigenesis of diffuse large B-cell lymphoma by regulating AMPK/mtor signalling through n4-acetylcytidine modification of SLC30A9[J]. Clin Transl Med,2024,14(7):e1747. doi: 10.1002/ctm2.1747 [17] Barresi V,Valenti G,Spampinato G,et al. Transcriptome analysis reveals an altered expression profile of zinc transporters in colorectal cancer[J]. J Cell Biochem,2018,119(12):9707-9719. doi: 10.1002/jcb.27285 [18] Gartmann L,Wex T,Grüngreiff K,et al. Expression of zinc transporters zip4,zip14 and znt9 in hepatic carcinogenesis-an immunohistochemical study[J]. J Trace Elem Med Biol,2018,49:35-42. doi: 10.1016/j.jtemb.2018.04.034 -





 下载:
下载: