Correlation Between Silva Type and Prognosis of Cervical HPV-associated Adenocarcinoma
-
摘要:
目的 探讨Silva分型模式在浸润性HPV相关性宫颈腺癌(HPV-associated endocervicalnadenocarcinoma,HPVA)预后判断方面的应用价值。 方法 收集2013年2月至2018年12月在昆明医科大学第三附属医院经病理科诊断为浸润性HPVA病例95例,应用 Silva分型标准重新分类,比较SilvaA、SilvaB、SilvaC 3种亚型的临床病理特征。根据病例资料和随访情况,估计生存率并分析影响因素。 结果 (1)SilvaB、C 亚型与SilvaA亚型相比,肿瘤直径大、肌层浸润深度深、分化差、FIGO分期晚、危险分级级别高,出现盆腹腔淋巴结转移、神经侵犯的比例较高,术后辅助治疗亦较积极(P < 0.05),而在年龄、淋巴脉管侵犯方面无显著差异(P > 0.05);(2)SilvaA型、SilvaB型5 a总体生存率、5 a无病生存率均高于90%,而SilvaC型显著低于50%(P < 0.05);(3)COX比例风险模型多因素分析:盆腹腔淋巴结转移(HR = 12.602,95%CI:2.722~58.333)是影响浸润性HPVA患者OS的独立因素(P = 0.001);FIGO分期是影响浸润性HPVA患者DFS的独立因素(P < 0.05),Ⅱ期、Ⅲ期、IV期与I期相比,其HR值、95%CI分别为5.319(1.597~17.716)、53.365 (5.458~521.734)、25.982(2.169~311.299)。 结论 Silva分型模式与肿瘤直径、分化程度、肌层浸润深度、FIGO分期、盆腹腔淋巴结转移、神经侵犯、危险分级、术后辅助治疗方式方面密切相关,但与年龄、淋巴脉管侵犯不相关。盆腹腔淋巴结转移、FIGO分期是影响宫颈浸润性HPVA患者预后的危险因素。 Abstract:Objective To investigate the application value of Silva typing pattern in prognosis of HPV-associated endocervicalnadenocarcinoma (HPVA). Methods A total of 95 cases of invasive HPVA diagnosed by pathology department in the Third Affiliated Hospital of Kunming Medical University from February 2013 to December 2018 were collected and reclassified by Silva classification criteria. Clinicopathological features. According to the case data and follow-up, the survival rate was estimated and the influencing factors were analyzed. Results (1) Compared with SilvaA subtypes, SilvaB and C subtypes had larger tumor diameter, deeper myometrial invasion, poor differentiation, later FIGO stage, higher risk classification, and a higher proportion of pelvic and abdominal lymph node metastasis and nerve invasion. , postoperative adjuvant therapy was also more active (P < 0.05), but there was no significant difference in age and lymphovascular invasion (P > 0.05); (2) The 5-year overall survival rate and 5-year disease-free survival rate of SilvaA and SilvaB were higher than 90%, while those of SilvaC were significantly lower than 50% (P < 0.05). (3) COX proportional hazards model multivariate analysis: pelvic and abdominal lymph node metastasis (HR = 12.602, 95%CI: 2.722-58.333) was the influence Independent factors of OS in patients with invasive HPVA (P = 0.001); FIGO stage was an independent factor affecting DFS of patients with invasive HPVA (P < 0.05). The 95%CI were 5.319 (1.597-17.716), 53.365 (5.458-521.734), and 25.982 (2.169-311.299). Conclusion Silva classification pattern is closely related to tumor diameter, degree of differentiation, depth of muscle invasion, FIGO stage, pelvic and abdominal lymph node metastasis, nerve invasion, risk classification, postoperative adjuvant therapy, but not age, lymphovascular invasion . Pelvic and abdominal lymph node metastasis and FIGO stage are risk factors affecting the prognosis of cervical invasive HPVA. -
Key words:
- Silva classification /
- HPVA /
- Clinicopathological features /
- Prognosis
-
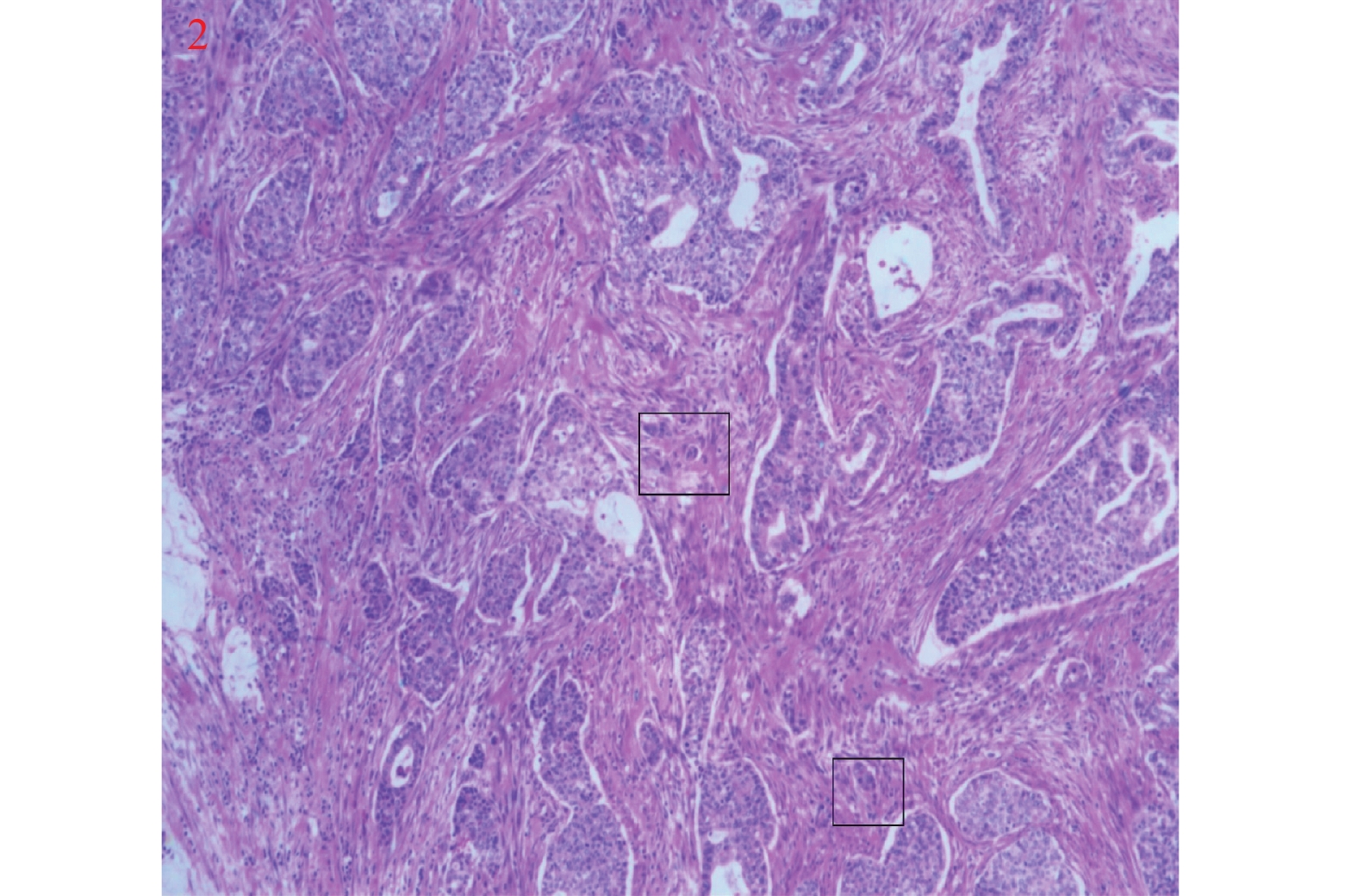
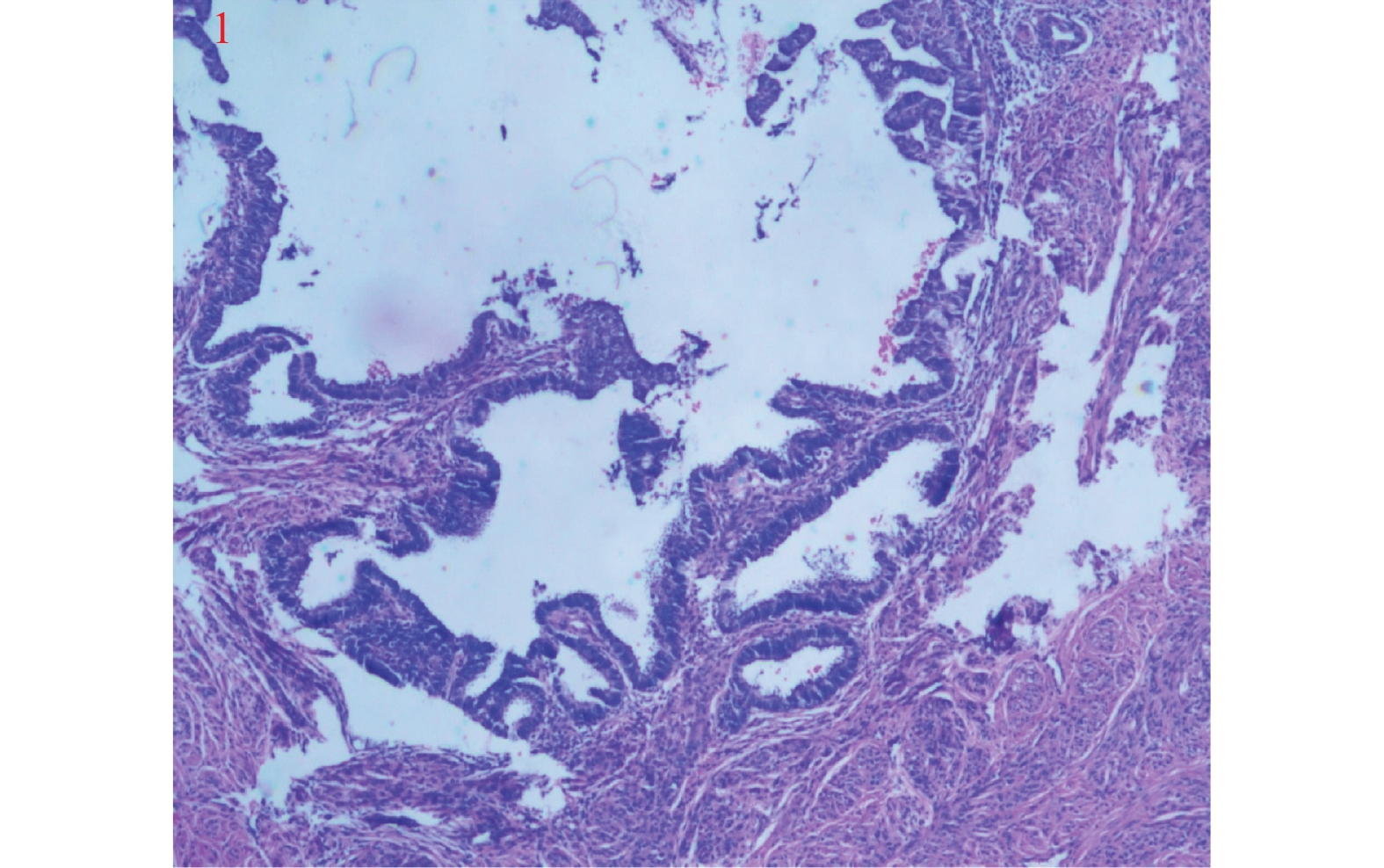
类别 Silva A型 Silva B型 Silva C型 肿瘤侵袭特征 (1)腺体圆形,轮廓完整,成群分布
(2)无单个或游离肿瘤细胞;缺乏实性生长方式,结构上呈高~中分化
(3)腺体内部可有筛状、乳头状等复杂生长方式
(4)无破坏性间质浸润
(5)无淋巴脉管侵犯(1)单个或小群肿瘤细胞从圆形腺体中离出来
(2)肿瘤基底部局灶可见单个、多个或呈线性排列的癌细胞
(3)缺乏实性生长方式,结构上呈高 ~中分化
(4)轮廓完整的腺体局灶形成破坏性间质浸润;周围间质见纤维组织增生、炎症反应
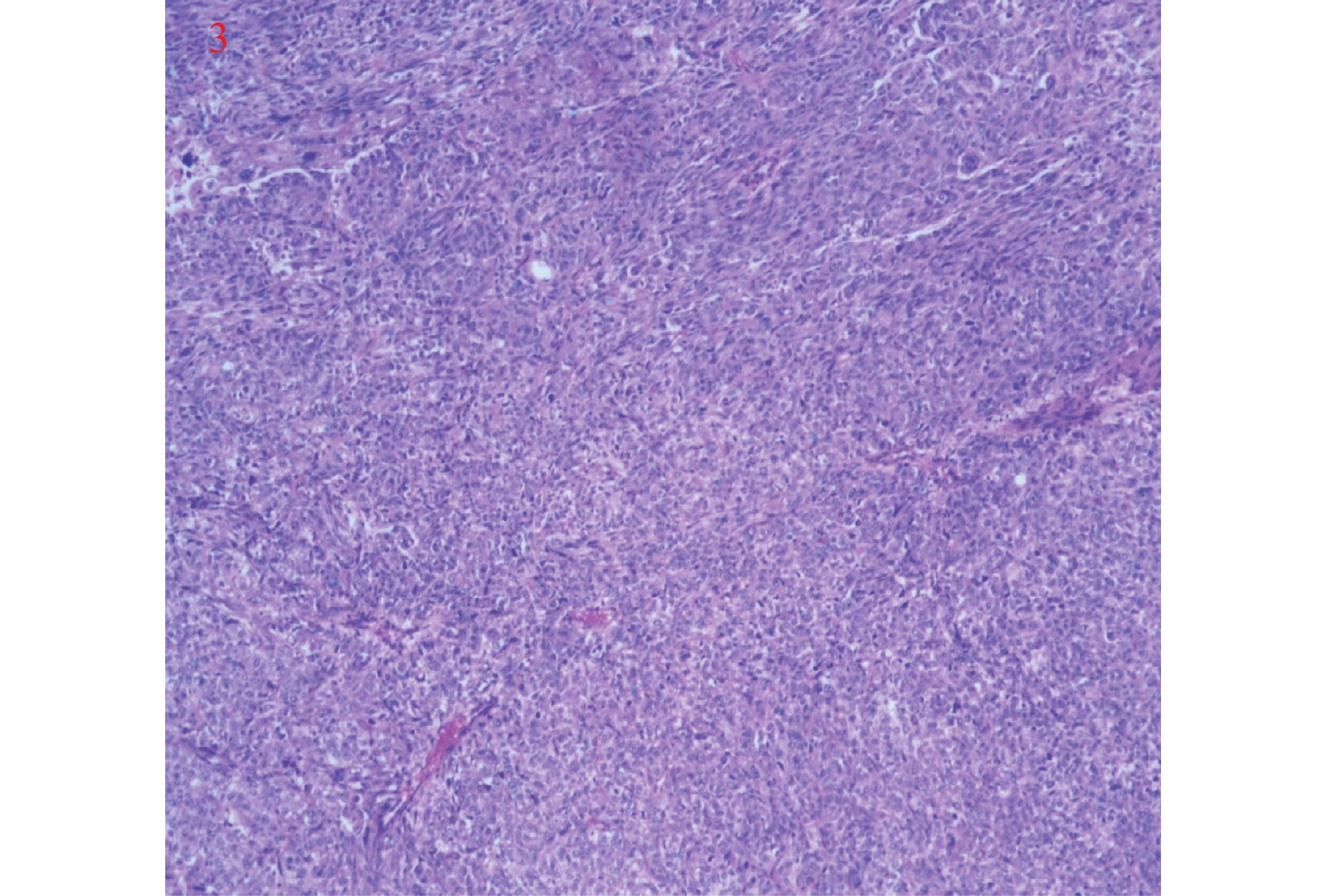
(5)可见淋巴脉管侵犯(1)腺体成角或管腔细小、其间穿插以开放性腺体
(2)腺体呈乳头状生长或在黏液湖中呈融合性生长方式充满低倍镜视野(4倍或 5 mm)
(3)实性或分化差的成分(高级别结构)忽视细胞核级别
(4)弥漫破坏性间质浸润,伴间质广泛的促纤维结缔组织增生反应为特征
(5)可见淋巴脉管侵犯表 2 95例浸润性HPVA患者不同Silva分型的临床病理特征情况表[n(%)]
Table 2. Clinicopathological characteristics of different Silva types in 95 patients with invasive HPVA [n(%)]
临床病理特征 n 分型 χ2 P SilvaA SilvaB SilvaC 年龄(岁) 0.024 0.988* ≤40 21 4(19.05) 12(57.14) 5(23.81) > 40 74 13(17.57) 43(58.11) 18(24.32) 肿瘤直径(cm) 19.570 < 0.001* ≤4 57 16(28.07) 35(61.40) 6(10.53) > 4 38 1(2.63) 20(52.63) 17(44.74) 分化程度 42.354 < 0.001* 低 24 0(0) 7(29.17) 17(70.83) 中 68 14(20.59) 48(70.59) 6(8.82) 高 3 3(100) 0(0) 0(0) 肌层浸润深度 26.073 < 0.001** < 1/2 43 16(37.21) 24(55.81) 3(6.98) ≥1/2 52 1(1.92) 31(59.62) 20(38.46) FIGO分期 16.971 0.002* I 期 69 16(23.19) 43(62.32) 10(14.49) Ⅱ期 23 1(4.35) 12(52.17) 10(43.48) Ⅲ期 2 0(0) 0(0) 2(100) Ⅳ期 1 0(0) 0(0) 1(100) 盆腹腔淋巴结转移 7.955 0.017* 无 77 17(22.08) 45(58.44) 15(19.48) 有 18 0(0) 10(55.56) 8(44.44) 淋巴脉管侵犯 4.225 0.119* 无 84 17(20.24) 49(58.33) 18(21.43) 有 11 0(0) 6(54.55) 5(45.45) 神经侵犯 9.423 0.004* 无 87 17(19.54) 53(60.92) 17(19.54) 有 8 0(0) 2(25.00) 6(75.00) 危险分级 20.610 < 0.001* 高危 18 0(0) 10(55.56) 8(44.44) 中危 21 0(0) 13(61.90) 8(38.10) 低危 56 17(30.36) 32(57.14) 7(12.50) 术后辅助治疗方式 20.262 0.005* 无 15 4(26.67) 11(73.33) 0(0) 化疗 28 7(25.00) 18(64.29) 3(10.71) 放疗 14 1(7.14) 4(28.57) 9(64.29) 放化疗 28 4(14.29) 15(53.57) 9(32.14) 放化疗 + 其它 10 1(10.00) 7(70.00) 2(20.00) *P < 0.05。 表 3 95例浸润性HPVA患者临床病理特征单因素变量分析[n(%)]
Table 3. Univariate analysis of clinicopathological characteristics of 95 patients with invasive HPVA [n(%)]
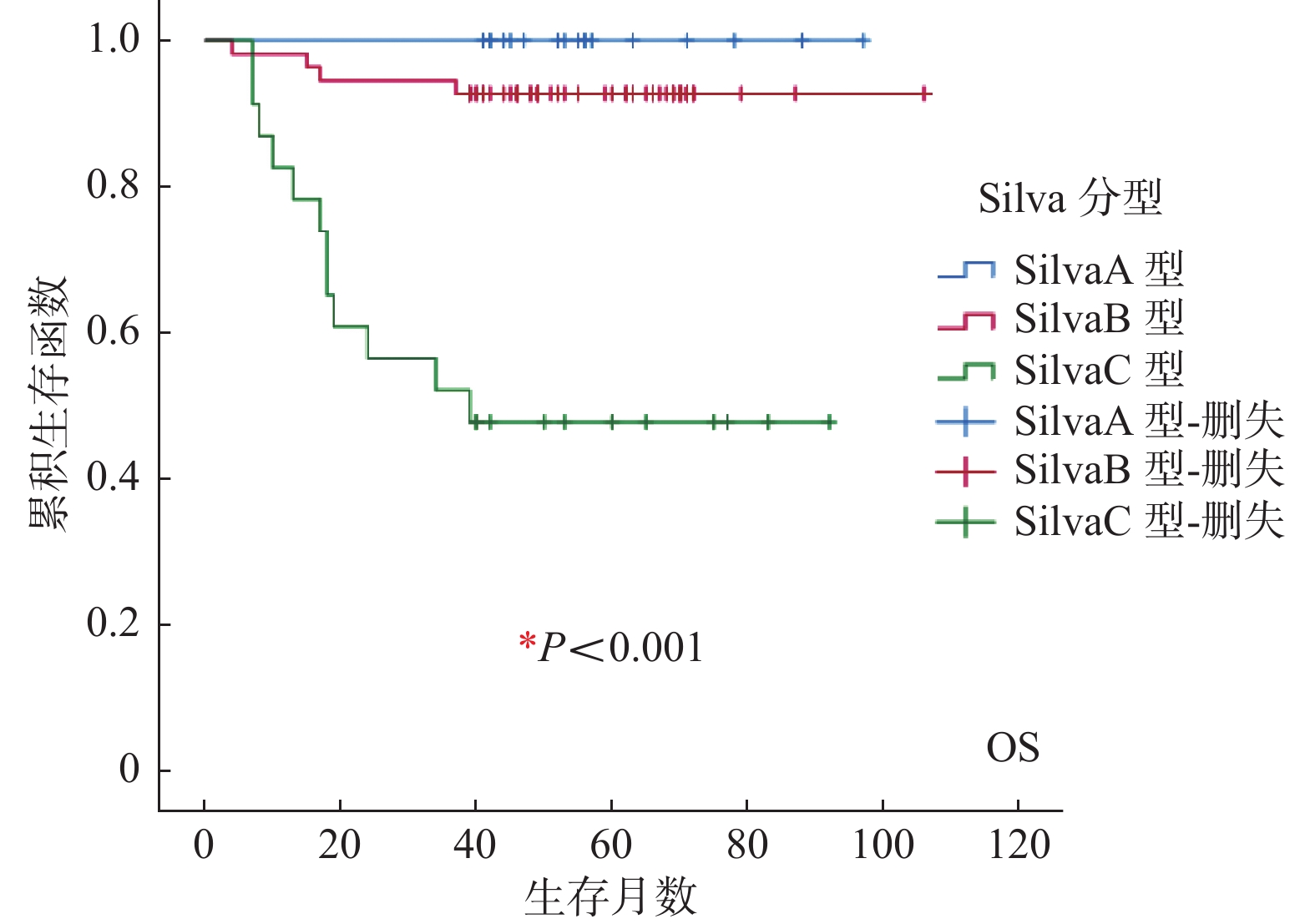
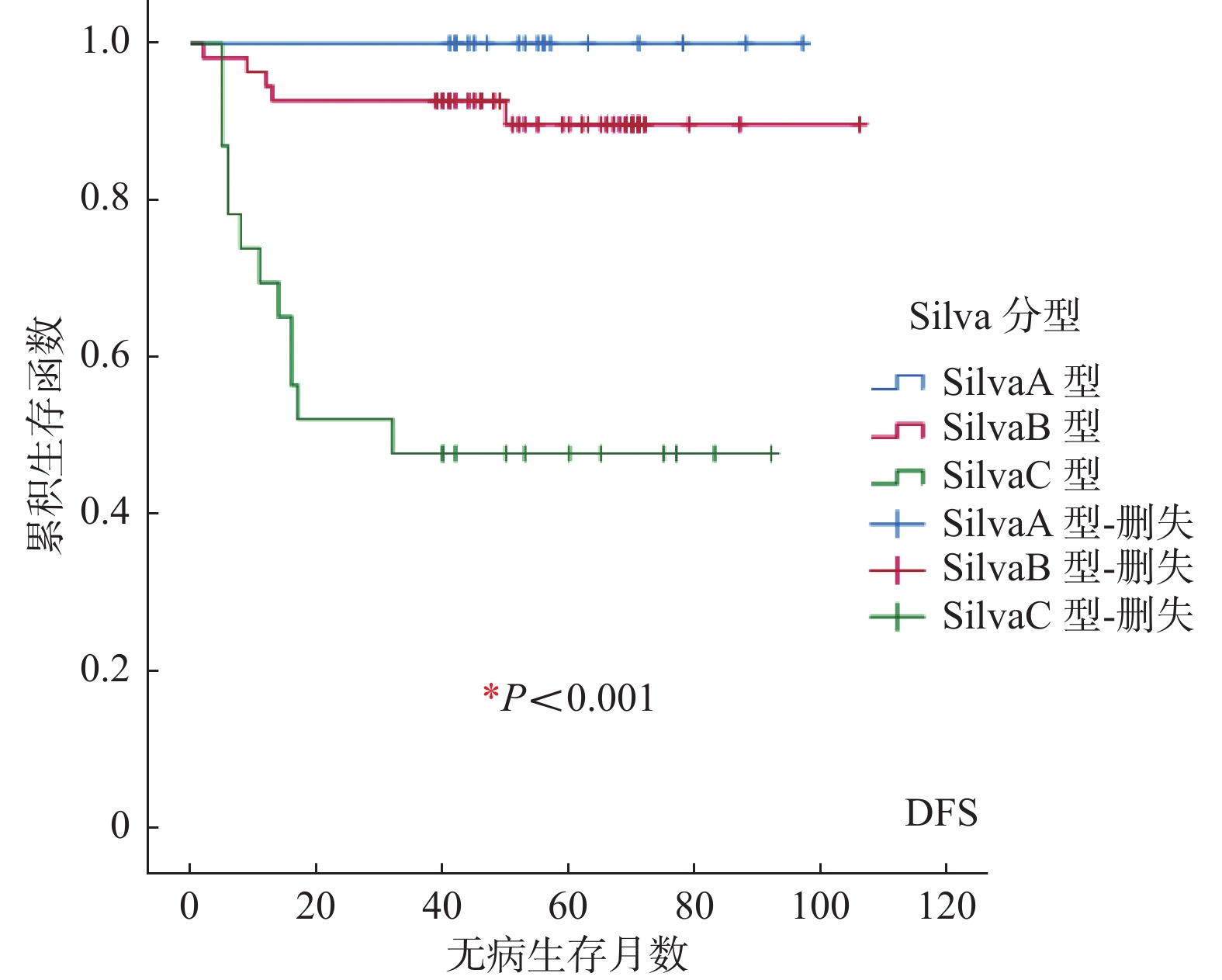
临床病理特征 n OS(月) χ2 P DFS(月) χ2 P 死亡(n) 5 a总体生存率% 复发(n) 5 a无病生存率% Silva分型 Silva A型 17 0 100.00 30.961 < 0.001* 0 100.00 28.109 < 0.001* Silva B型 55 4 92.73 5 90.91 Silva C型 23 12 47.83 12 47.83 年龄(岁) ≤40 21 2 90.48 0.995 0.319* 2 90.48 1.251 0.263* > 40 74 14 81.08 15 79.73 肿瘤直径(cm) ≤4 57 2 96.49 18.412 < 0.001* 3 94.74 16.265 < 0.001* > 4 38 14 63.16 14 63.16 分化程度 高 3 0 100.00 35.241 < 0.001* 0 100.00 39.195 < 0.001* 中 68 3 95.59 3 95.59 低 24 13 45.83 14 41.67 肌层浸润深度 < 1/2 43 0 100.00 15.591 < 0.001* 1 97.67 13.331 < 0.001* ≥1/2 52 16 69.23 16 69.23 FIGO分期 I 期 69 3 95.65 94.560 < 0.001* 4 94.20 77.443 < 0.001* Ⅱ期 23 10 56.52 10 56.52 Ⅲ期 2 2 0 2 0 Ⅳ期 1 1 0 1 0 盆腹腔淋巴结转移 无 77 4 94.81 56.095 < 0.001* 5 93.51 50.752 < 0.001* 有 18 12 33.33 12 33.33 淋巴脉管侵犯 无 84 12 85.71 4.646 0.031* 13 84.52 4.021 0.045* 有 11 4 63.64 4 63.64 神经侵犯 无 87 11 87.36 15.447 < 0.001* 12 86.21 14.441 < 0.001* 有 8 5 37.50 5 37.50 危险分级 低危 18 1 94.44 57.482 < 0.001* 2 88.89 51.785 < 0.001* 中危 21 3 85.71 3 85.71 高危 56 12 78.57 12 78.57 术后辅助治疗方式 无 15 0 100.00 19.892 0.001* 0 100.00 16.917 0.002* 化疗 28 2 92.86 2 92.86 放疗 14 7 50.00 7 50.00 放化疗 28 6 78.57 6 78.57 放化疗+其它 10 1 90.00 2 80.00 *P < 0.05。 表 4 95例浸润性HPVA患者临床病理特征多因素变量COX比例风险模型分析
Table 4. Multivariate COX proportional hazards model analysis of clinicopathological characteristics of 95 patients with invasive HPVA
临床病理特征 OS 临床病理特征 DFS B SE Wald P HR 95%CI B SE Wald P HR 95%CI 盆腹腔淋
巴结转移
(参照组为无)2.534 0.782 10.504 0.001* 12.602 2.722~58.333 FIGO分期II期
(参照组为I期)1.671 0.614 7.411 0.006* 5.319 1.597~17.716 III期 3.977 1.163 11.689 0.001* 53.365 5.458~521.734 IV期 3.257 1.267 6.609 0.010** 25.982 2.169~311.299 *P < 0.05。 -
[1] Gustinucci D,Giorgi Rossi P,Cesarini E,et al. Use of cytology,E6/E7 mRNA,and p16INK4a-Ki-67 to define the management of human papillomavirus (HPV)-positive women in cervical cancer screening[J]. Am J Clin Pathol,2016,145(1):35-45. doi: 10.1093/ajcp/aqv019 [2] Eduardo M,Campaner A,Silva M. Apoptosis phenomena in squamous cell carcinomas and adenocarcinomas of the uterine cervix[J]. Pathol Oncol Res,2015,21(4):887-92. doi: 10.1007/s12253-015-9906-y [3] Fang J,Zhang H,Jin S. Epigenetics and cervical cancer:From pathogenesis to therapy[J]. Tumor Biol,2014,35(6):5083-5093. doi: 10.1007/s13277-014-1737-z [4] Cree I,White V,Indave B,et al. Revising the WHO classification:Female genital tract tumours[J]. Histopathology,2020,76(1):151-156. doi: 10.1111/his.13977 [5] Abu-Rustum N,Yashar C,Bean S,et al. NCCN guidelines insights:Cervical cancer,version1.2020[J]. J NatlL Compr Canc Ne,2020,18(6):660-666. doi: 10.6004/jnccn.2020.0027 [6] 徐红,张静. 美国国立综合癌症网络《2020年宫颈癌临床实践指南》病理内容更新解读[J]. 中华病理学杂志,2021,50(1):9-13. [7] 宗丽菊,陈杰,向阳. 宫颈腺癌病理分类及分型的研究进展[J]. 现代妇产科进展,2020,29(7):543-545. doi: 10.13283/j.cnki.xdfckjz.2020.07.011 [8] Stolnicu S,Barsan I,Hoang L,et al. International endocervical adenocarcinoma criteria and classification (IECC):A new pathogenetic classification for invasive adenocarcinomas of the endocervix[J]. Am J Surg Pathol,2018,42(2):214-226. doi: 10.1097/PAS.0000000000000986 [9] 戈文舜,李美平,耿文,等. Silva分型在HPV相关性子宫颈腺癌及原位腺癌中的应用及临床意义[J]. 临床与实验病理志,2022,38(1):31-35. [10] 李悦敏. 宫颈腺癌Silva分型系统临床病理特征与预后的相关性分析[D]. 长春: 吉林大学硕士学位论文, 2021. [11] Peters W,Liu P,Barrett R,et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix[J]. J Clin Oncol,2000,18(8):1606-1613. doi: 10.1200/JCO.2000.18.8.1606 [12] Sedlis A,Bundy B,Rotman M,et al. A randomized trial of pelvic radiation therapy versus no further therapy in selected patients with stage IB carcinoma of the cervix after radical hysterectomy and pelvic lymphadenectomy:A gynecologic oncology group study[J]. Gynecol Oncol,1999,73(2):177-183. doi: 10.1006/gyno.1999.5387 [13] Diaz De Viva A,Roma,A,Park K,et al. Invasive endocervical adenocarcinoma:Proposal for a new pattern-based classification system with significant clinical implications:A multi-institutional study[J]. Int J Gynecol Pathol,2013,32(6):592-601. doi: 10.1097/PGP.0b013e31829952c6 [14] Roma A,Mistretta T,Diaz De Vivar A,et al. New pattern-based personalized risk stratification system for endocervical adenocarcinoma with important clinical implications and surgical outcome[J]. Gynecol Oncol,2016,141(1):36-42. doi: 10.1016/j.ygyno.2016.02.028 [15] Roma A,Diaz De Vivar A,Park K,et al. Invasive endocervical adenocarcinoma:A new pattern-based classification system with important clinical significance[J]. Am J Surg Pathol,2016,39(5):667-672. [16] 赵晶晶,刘一瑶,于静,等. 腺癌浸润方式Silva分型系统对58例宫颈腺癌患者预后判断的影响[J]. 中国妇产科临床杂志,2019,20(4):301-304. doi: 10.13390/j.issn.1672-1861.2019.04.004 [17] Byun J,Cho H,Park H,et al. Clinical significance of the pattern-based classification in endocervical adenocarcinoma,usual and variants[J]. Int J Clin Oncol,2019,24(10):1264-1272. doi: 10.1007/s10147-019-01472-4 [18] Wang W,Song G,Lin J,et al. Study of the revisited,revised,and expanded Silva pattern system for chinese endocervical adenocarcinoma patients[J]. Hum Pathol,2019,84:35-43. doi: 10.1016/j.humpath.2018.08.029 [19] 孟召静. 宫颈腺癌临床特点及预后相关因素分析[D]. 福州 : 福建医科大学硕士学位论文, 2012. [20] 宋光耀,王玮,王亚萍,等. Silva分型在子宫颈腺癌中的应用及临床意义[J]. 中华妇产科杂志,2019,66(1):13-18. doi: 10.3760/cma.j.issn.0529-567x.2019.01.004 [21] Spaans V,Scheunhage D,Barzaghi B,et al. Independ- ent validation of the prognostic significance of invasion patterns in endocervical adenocarcinoma:Pattern a pre- dicts excellent survival[J]. Gynecol Oncol,2018,151(2):196-201. doi: 10.1016/j.ygyno.2018.09.013 期刊类型引用(1)
1. 孙彦珍,孙雪骐,杨慧,王建. HPV相关性宫颈腺癌Silva分型同临床病理特征及预后的关联性分析. 实用妇科内分泌电子杂志. 2024(04): 1-3 .  百度学术
百度学术其他类型引用(1)
-






 下载:
下载: