Dendrobium Nobile Polysaccharide Improves Myocardial Injury in Diabetic Rats by Regulating Plin5 Mediated Fatty Acid β Oxidation of Cardiomyocytes
-
摘要:
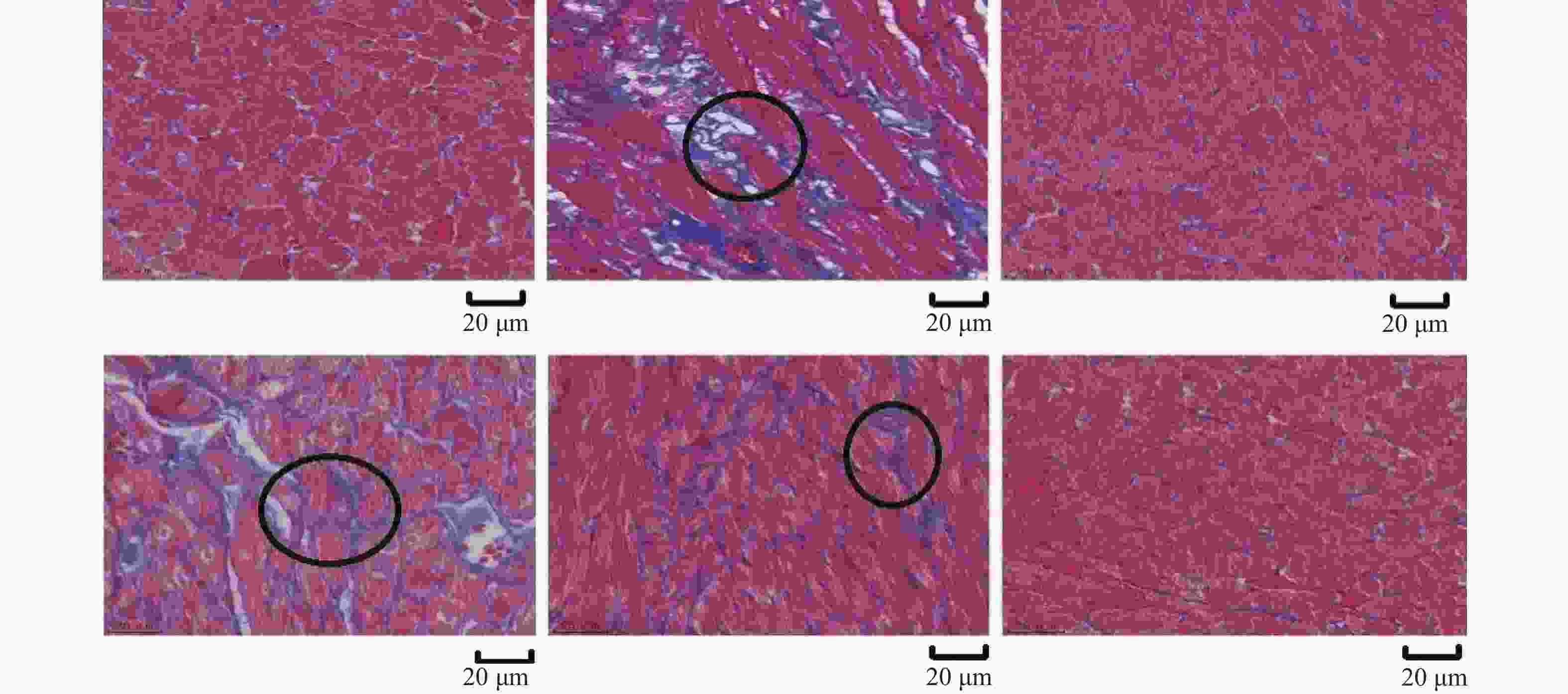
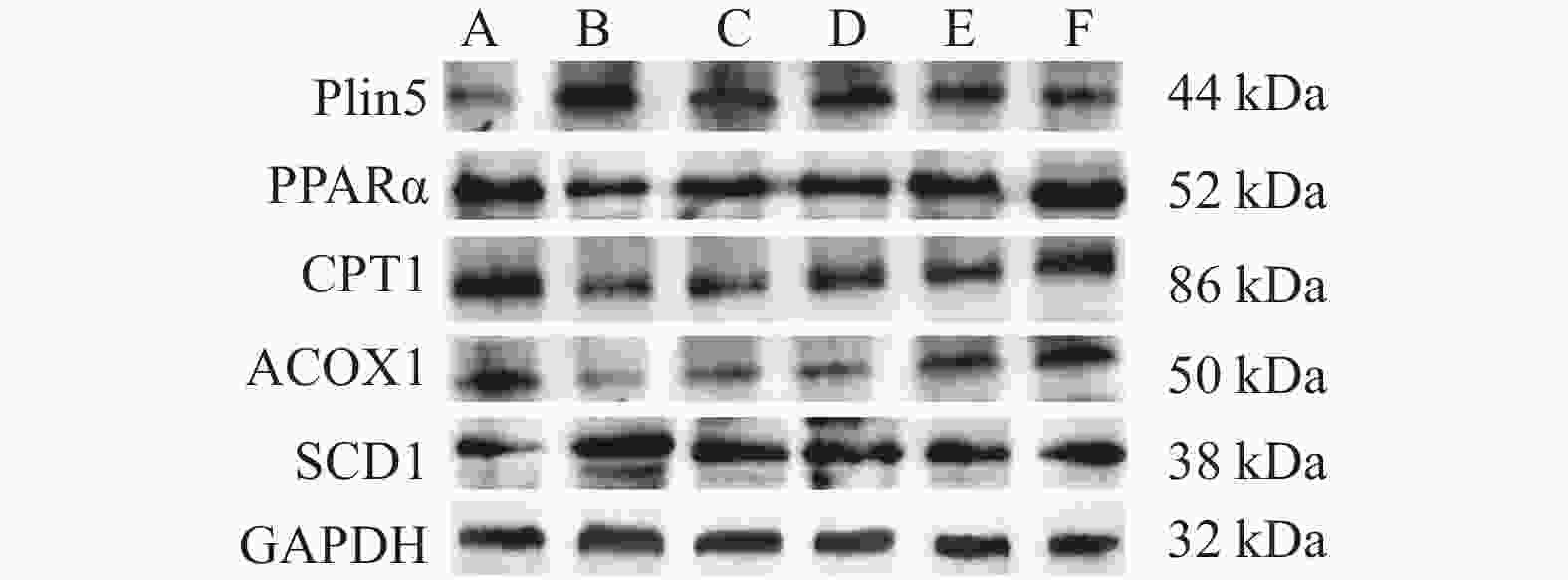
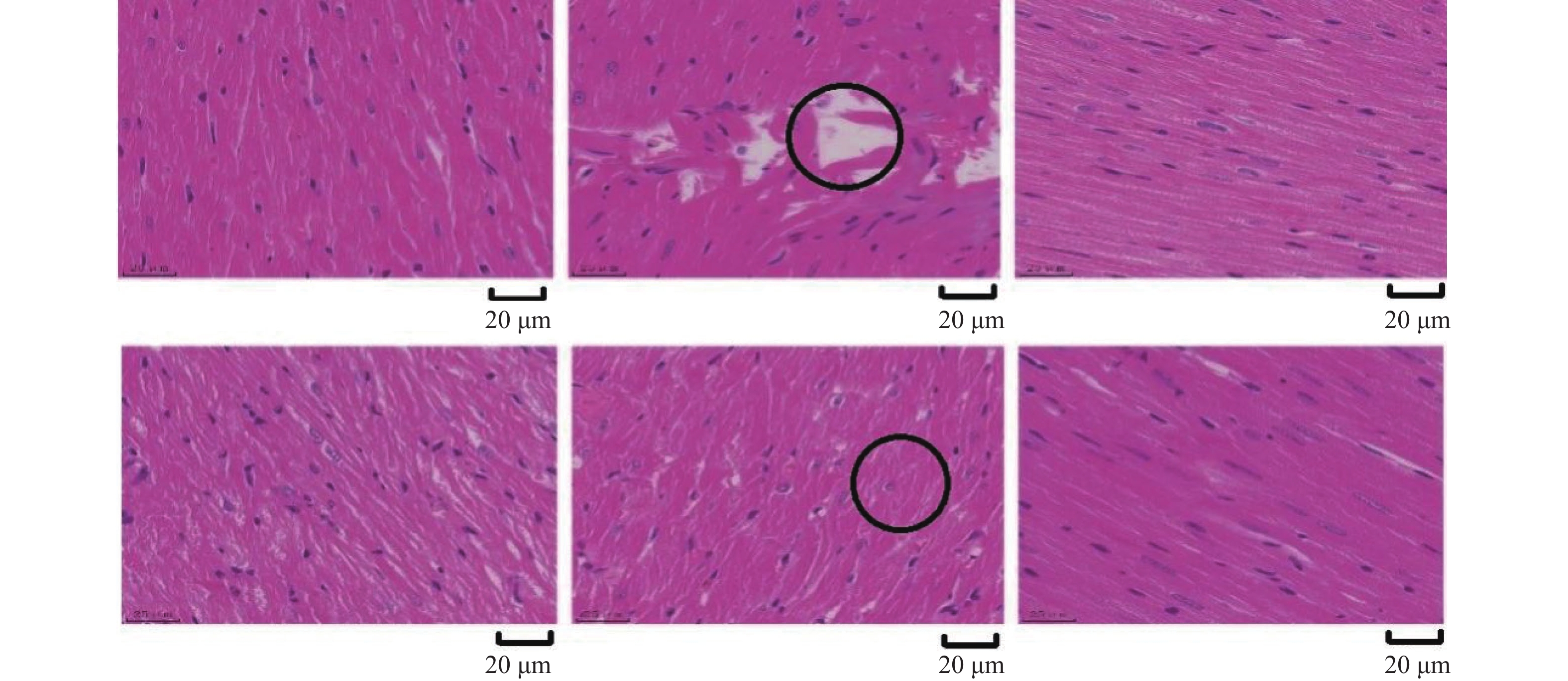
目的 从Plin5调节心肌细胞脂肪酸β氧化信号通路探究金钗石斛多糖干预糖尿病大鼠心肌损伤的作用机制。 方法 清洁级雄性SD大鼠共72只,将其分为正常组(n = 10)以及造模组(n = 62),正常组给予普通饲料喂养,造模组给予高脂高糖饮食2月+一次性STZ注射构建糖尿病心肌损伤动物模型,构建模型成功后,将造模组SD大鼠分为5组,分别为模型组、单硝酸异山梨酯片组、金钗石斛多糖低剂量组、中剂量组和高剂量组(n = 10),药物治疗4周后,处死大鼠,收集心脏,检测心肌组织病理学(HE和Masson染色)、心脂质含量(TG、TC、HDL-C和LDL-C)、心肌炎性因子(IL-1α、IL-1β、IL-6和TNF-α)和抗氧化指标(SOD、GSH、MDA和ROS),收集血液检测心功能、胰岛素和血糖水平,采用Western blot检测心肌组织中Plin5、SCD1、CPT1A、ACOX1和PPARα蛋白表达特点。 结果 组织病理学HE和Masson染色显示正常组大鼠的心肌纤维整齐排列,模型组大鼠出现心肌纤维断裂,与模型组相比,金钗石斛多糖各治疗组可见不同程度减轻;相较于正常组,模型组血糖和胰岛素抵抗指数升高(P < 0.05),胰岛素下降(P < 0.05),相较于模型组,金钗石斛多糖3个组血糖和胰岛素抵抗指数降低(P < 0.05),低剂量组、中剂量和硝酸异山梨酯片组胰岛素水平没有升高(P > 0.05),金钗石斛多糖高剂量组胰岛素含量升高(P < 0.05);相较于正常组,模型组TG、TC和LDL-C升高(P < 0.05),HDL-C降低(P < 0.05),相较于模型组,金钗石斛多糖治疗组以及阳性药物组TG、TC和LDL-C降低(P < 0.05),HDL-C升高(P < 0.05);相较于正常组,模型组AST、CK、CK-MB、LDH、a-HBDH以及CTnl升高(P < 0.05),相较于模型组,金钗石斛多糖3个治疗组和阳性药物组上述6个指标降低(P < 0.05);相较于正常组,模型组心肌IL-1α、IL-1β、IL-6和TNF-α升高(P < 0.05),相较于模型组,金钗石斛多糖3个治疗组和阳性药物组上述炎性因子指标降低(P < 0.05);相较于正常组,模型组SOD和GSH降低(P < 0.05),MDA和ROS升高(P < 0.05);相较于模型组,金钗石斛多糖3个治疗组和阳性药物组SOD及GSH升高(P < 0.05),MDA和ROS降低(P < 0.05);与正常组相比,模型组大鼠心肌组织中Plin5和SCD1升高(P < 0.05),PPARα、CPT1以及ACOX1降低(P < 0.05),与模型组相比,金钗石斛多糖各个治疗组和阳性药物组Plin5和SCD1均降低(P < 0.05),而PPARα、CPT1以及ACOX1升高(P < 0.05)。 结论 金钗石斛多糖能够通过Plin5调节脂肪酸β氧化,进而降低心肌脂质含量、炎症反应和氧化应激,保护糖尿病心肌损伤大鼠心脏,提高心功能。 Abstract:Objective To explore the mechanism of Dendrobium nobium polysaccharide on myocardial injury in diabetic rats by regulating the fatty acid β oxidation signaling pathway of cardiomyocytes from Plin5. Methods A total of 72 male SD rats of a clean grade were divided into a control group (n = 10) and a modeling group (n = 62). The control group was fed regular diet, while the modeling group was given a high-fat, high-sugar diet for two months, along with a single STZ injection to establish a diabetic myocardial injury animal model. After successfully creating the model, the modeling group of SD rats was further divided into five subgroups: the model group, the isosorbide mononitrate tablet group, the low-dose Dendrobium nobium polysaccharide group, the medium-dose group, and the high-dose group (n = 10). After 4 weeks of drug treatment, rats were euthanized, and their hearts were collected to detect the myocardial hemopathology (using HE and Masson staining), lipid levels (TG, TC, HDL-C and LDL-C), inflammatory factors (IL-1α, IL-1β, IL-6 and TNF-α) and antioxidant indexes (SOD, GSH, MDA and ROS). Blood samples were taken to assess cardiac function, insulin and blood sugar levels, and Western blot was used to detect the expression characteristics of Plin5, SCD1, CPT1A, ACOX1 and PPARα proteins. Results Histopathology with HE and Masson staining showed that in the normal group, the myocardial fibers of rats were neatly arranged, whereas in the model group, there was fibrous rupture. Compared to the model group, different degrees of improvement were seen in all treatment groups with Dendrobium polysaccharides. Blood sugar and insulin resistance index increased in the model group compared to the normal group (P < 0.05), with insulin levels decreasing (P < 0.05). Compared to the model group, the three groups treated with Dendrobium polysaccharides showed reduced blood sugar and insulin resistance index (P < 0.05). In the low-dose, mid-dose, and isosorbide dinitrate tablet groups, insulin levels did not increase (P > 0.05), while the high-dose Dendrobium polysaccharides group exhibited an increase in insulin content (P < 0.05). Compared to the normal group, TG, TC and LDL-C in the model group were remarkably increased (P < 0.05), while HDL-C was remarkably decreased (P < 0.05). Compared to the model group, TG, TC and LDL-C in the three Dendrobium polysaccharide groups and the positive drug group were remarkably decreased (P < 0.05), while HDL-C was remarkably increased (P < 0.05). Compared to the normal group, AST, CK, CK-MB, LDH, a-HBDH and CTnl in the model group were remarkably increased (P < 0.05). Compared to the model group, the above 6 indexes in the 3 Dendrobium polysaccharide treatment groups and positive drug group were remarkably decreased (P < 0.05). Compared to the normal group, IL-1α, IL-1β, IL-6 and TNF-α in the the model group were remarkably increased (P < 0.05), and they were remarkably decreased in the three Dendrobium polysaccharide treatment groups and the positive drug group compared to the model group (P < 0.05); compared to normal group, SOD and GSH in model group were remarkably decreased (P < 0.05), MDA and ROS were remarkably increased (P < 0.05), compared to the model group, SOD and GSH in the three treatment groups and the positive drug group were increased (P < 0.05), while MDA and ROS were decreased (P < 0.05). Compared to normal group, Plin5 and SCD1 in model group were increased (P < 0.05), and protein expressions of PPARα, CPT1 and ACOX1 were decreased (P < 0.05). Compared to model group, Plin5 and SCD1 were remarkably increased (P < 0.05). Compared to the model group, Plin5 and SCD1 were remarkably decreased in all treatment groups and positive drug groups (P < 0.05), while PPARα, CPT1 and ACOX1 were remarkably increased (P < 0.05). Conclusion Dendrobium nobium polysaccharide can regulate fatty acid β oxidation through Plin5, thereby reducing myocardial lipid content, inflammation, and oxidative stress, protecting diabetic myocardial injury in rats, and improving heart function. -
表 1 各组大鼠血糖、胰岛素以及胰岛素抵抗指数比较 ($\bar x \pm s $ )
Table 1. Comparison of blood glucose,insulin and insulin resistance index of rats in each group ($\bar x \pm s $ )
组别 血糖(U/L) 胰岛素(IL/L) 胰岛素抵抗指数 正常组 5.52 ± 0.80 18.65 ± 2.42 4.35 ± 0.23 模型组 21.76 ± 4.52* 12.65 ± 4.50* 12.13 ± 0.95* 阳性药组 21.30 ± 4.35 13.25 ± 2.43 13.06 ± 0.84 低剂量组 18.34 ± 3.86#^ 13.48 ± 3.04 11.05 ± 0.78#^ 中剂量组 17.40 ± 4.17#^ 13.78 ± 2.79 10.86 ± 0.63#^ 高剂量组 16.62 ± 3.40#^ 14.32 ± 2.35# 9.56 ± 0.56#^ F 61.1324 8.9705 340.7878 P 0.00△ 0.001△ 0.00△ 与正常组相比,*P < 0.05;与模型组相比,#P < 0.05;与阳性药物组相比,^P < 0.05;△P < 0.05。 表 2 各组大鼠心肌组织中血脂相关指标比较 [($\bar x \pm s $ ),mmol/L]
Table 2. Comparison of blood lipid related indexes in myocardial tissue of rats in each group [($\bar x \pm s $),mmol/L]
组别/指标 心肌TG 心肌TC 心肌HDL-C 心肌LDL-C 正常组 0.44 ± 0.06 2.56 ± 0.28 1.58 ± 0.22 0.72 ± 0.09 模型组 1.28 ± 0.12* 4.45 ± 0.76* 0.91 ± 0.20* 2.08 ± 0.23* 阳性药组 1.07 ± 0.10# 4.10 ± 0.56# 1.04 ± 0.21# 1.85 ± 0.30# 低剂量组 0.84 ± 0.14#^ 3.28 ± 0.32#^ 1.23 ± 0.28#^ 1.40 ± 0.32#^ 中剂量组 0.79 ± 0.14#^ 3.19 ± 0.34#^ 1.30 ± 0.23#^ 1.36 ± 0.29#^ 高剂量组 0.76 ± 0.16#^ 3.13 ± 0.30#^ 1.34 ± 0.19#^ 1.28 ± 0.26#^ F 204.7500 31.2820 28.5811 105.2781 P 0.00△ 0.00△ 0.00△ 0.00△ 注:与正常组相比,*P < 0.05;与模型组相比,#P < 0.05;与阳性药物组相比,^P < 0.05;△P < 0.05。 表 3 各组大鼠心肌酶谱指标比较($\bar x \pm s $)
Table 3. Comparison of myocardial zymogram indexes of rats in each group($\bar x \pm s $)
组别/指标 AST(U/L) CK(U/L) CK-MB(U/L) LDH(U/L) a-HBDH(U/L) CTnl(ng/L) 正常组 68.54 ± 7.74 22.50 ± 3.38 18.46 ± 2.36 80.25 ± 10.24 150.23 ± 7.71 55.32 ± 7.89 模型组 169.67 ± 35.62* 50.35 ± 10.23* 44.32 ± 9.87* 168.35 ± 20.25* 330.65 ± 47.65* 128.68 ± 20.21* 阳性药组 120.24 ± 28.32# 30.26 ± 6.89# 27.40 ± 6.25# 110.54 ± 15.45# 230.34 ± 40.24# 76.34 ± 15.14# 低剂量组 146.52 ± 28.54# 45.37 ± 8.92# 38.65 ± 5.79# 144.32 ± 17.65# 286.54 ± 42.36# 106.34 ± 16.72# 中剂量组 135.54 ± 26.65# 40.35 ± 8.05# 33.48 ± 6.82# 136.48 ± 16.36# 270.35 ± 35.14# 90.24 ± 19.23# 高剂量组 133.54 ± 25.65# 38.28 ± 7.78# 29.79 ± 4.89# 130.36 ± 13.26# 265.25 ± 38.14# 85.32 ± 17.30# F 36.0055 37.8922 36.4293 79.7554 62.0769 61.1717 P 0.00△ 0.00△ 0.00△ 0.00△ 0.00△ 0.00△ 注:与正常组相比,*P < 0.05;与模型组相比,#P < 0.05;与阳性药物组相比,^P < 0.05;△P < 0.05。 表 4 各组大鼠炎性因子比较[($\bar x \pm s $ ),ng/L]
Table 4. Comparison of inflammatory factors of rats in each group[($\bar x \pm s $ ),ng/L]
组别/指标 心肌IL-1a 心肌IL-1b 心肌IL-6 心肌TNF-a 正常组 0.08 ± 0.01 0.14 ± 0.02 0.46 ± 0.08 1.45 ± 0.12 模型组 0.32 ± 0.08* 0.38 ± 0.08* 1.21 ± 0.25* 4.65 ± 0.32* 阳性药组 0.27 ± 0.12# 0.29 ± 0.03# 0.84 ± 0.07# 3.23 ± 0.43# 低剂量组 0.24 ± 0.03#^ 0.25 ± 0.04#^ 0.86 ± 0.15# 3.30 ± 0.35# 中剂量组 0.20 ± 0.04#^ 0.21 ± 0.03#^ 0.74 ± 0.12#^ 2.65 ± 0.30#^ 高剂量组 0.16 ± 0.02#^ 0.17 ± 0.02#^ 0.64 ± 0.10#^ 2.18 ± 0.32#^ F值 23.0144 57.2727 57.1680 255.6314 P值 0.00△ 0.00△ 0.00△ 0.00△ 与正常组相比,*P < 0.05;与模型组相比,#P < 0.05;与阳性药物组相比,^P < 0.05;△P < 0.05。 表 5 各组大鼠心肌组织中氧化应激指标比较[($\bar x \pm s $),ng/L]
Table 5. Comparison of oxidative stress indexes in myocardial tissues of rats in each group [($\bar x \pm s $),ng/L]
组别/指标 心肌MDA(nmol/L) 心肌SOD(U/mL) 心肌ROS(%) 心肌GSH(ug/L) 正常组 5.50 ± 0.52 880.56 ± 28.89 30.56 ± 5.08 654.23 ± 29.37 模型组 10.45 ± 0.76* 290.42 ± 120.32* 88.92 ± 9.02* 230.54 ± 30.50* 阳性药组 7.68 ± 0.57# 470.72 ± 98.35# 54.26 ± 7.08# 326.56 ± 37.92# 低剂量组 7.79 ± 0.62# 465.57 ± 67.56# 56.62 ± 8.84# 330.46 ± 44.45# 中剂量组 6.92 ± 0.56#^ 592.34 ± 80.24#^ 44.09 ± 7.92#^ 396.78 ± 40.42#^ 高剂量组 6.22 ± 0.58#^ 763.68 ± 99.41#^ 38.09 ± 9.03#^ 440.24 ± 38.45#^ F 157.4209 109.8176 164.3076 458.2505 P 0.00△ 0.00△ 0.00△ 0.00△ 注:与正常组相比,*P < 0.05;与模型组相比,#P < 0.05;与阳性药物组相比,^P < 0.05;△P < 0.05。 表 6 大鼠心肌组织中Plin5及其介导的脂肪酸β氧化相关蛋白的相对表达量[($\bar x \pm s $ ),相应蛋白/GAPDH]
Table 6. Relative expression of Plin5 and its related proteins mediated fatty acid Beta oxidation in rat myocardial tissue[($\bar x \pm s $),Corresponding protein /GAPDH]
组别/指标 Plin5 PPARα CPT1 ACOX1 SCD1 正常组 0.26 ± 0.04 1.15 ± 0.08 1.32 ± 0.06 0.62 ± 0.04 0.54 ± 0.07 模型组 1.07 ± 0.12* 0.56 ± 0.05* 0.32 ± 0.07* 0.19 ± 0.03* 1.52 ± 0.10* 阳性药组 0.85 ± 0.08# 0.76 ± 0.06# 0.40 ± 0.06# 0.24 ± 0.04# 1.28 ± 0.08# 低剂量组 0.72 ± 0.08#^ 0.85 ± 8.92#^ 0.56 ± 0.08#^ 0.25 ± 0.03# 1.25 ± 0.09# 中剂量组 0.57 ± 0.06#^ 1.14 ± 8.05#^ 0.58 ± 0.06#^ 0.48 ± 0.05#^ 1.05 ± -0.10#^ 高剂量组 0.45 ± 0.05#^ 1.38 ± 0.78#^ 1.08 ± 0.07#^ 0.58 ± 0.06#^ 1.06 ± 0.12#^ F 70.4866 64.8240 229.6860 121.3902 110.2535 P 0.00△ 0.00△ 0.00△ 0.00△ 0.00△ 与正常组比较,*P < 0.05;与模型组相比,#P < 0.05;与阳性药物组相比,^P < 0.05;△P < 0.05。 -
[1] Ghosh N,Chacko L,Bhattacharya H,et al. Exploring the complex relationship between diabetes and cardiovascular complications: Understanding diabetic cardiomyopathy and promising therapies[J]. Biomedicines,2023,11(4):1126. doi: 10.3390/biomedicines11041126 [2] Bansal S,Burman A,Tripathi A K. Advanced glycation end products: Key mediator and therapeutic target of cardiovascular complications in diabetes[J]. World Journal of Diabetes,2023,14(8):1146. doi: 10.4239/wjd.v14.i8.1146 [3] 郑天圣,佟雪巍,张伊桐,等. 2 型糖尿病心血管并发症发病机制的研究进展[J]. 基础医学与临床,2022,42(5):814. doi: 10.3969/j.issn.1001-6325.2022.05.020 [4] 郭振,樊迪,唐其柱. 活性氧在糖尿病心肌病中的作用机制研究进展[J]. 解放军医学杂志,2020,45(12):1294-1298. doi: 10.11855/j.issn.0577-7402.2020.12.14 [5] 葛淑瑜,杨文娟,孙萍萍,等. 心肌底物能量代谢在糖尿病心肌病中的研究进展[J]. 心电与循环,2021,40(4):450-452. [6] Miner G E,So C M,Edwards W,et al. PLIN5 interacts with FATP4 at membrane contact sites to promote lipid droplet-to-mitochondria fatty acid transport[J]. Developmental Cell,2023,58(14): 1250-1265. e6. [7] Blaibel D,Fernandez C J,Pappachan J M. Acute worsening of microvascular complications of diabetes mellitus during rapid glycemic control: The pathobiology and therapeutic implications[J]. World Journal of Diabetes,2024,15(3):311. doi: 10.4239/wjd.v15.i3.311 [8] Alkholifi F K,Devi S,Yusufoglu H S,et al. The cardioprotective effect of Corosolic Acid in the Diabetic rats: A possible mechanism of the PPAR-γ pathway[J]. Molecules,2023,28(3):929. doi: 10.3390/molecules28030929 [9] ALTamimi J Z,AlFaris N A,Alshammari G M,et al. Esculeoside A decreases diabetic cardiomyopathy in streptozotocin-treated rats by attenuating oxidative stress,inflammation,fibrosis,and apoptosis: Impressive role of Nrf2[J]. Medicina,2023,59(10):1830. doi: 10.3390/medicina59101830 [10] Verma V K,Malik S,Mutneja E,et al. Morin ameliorates myocardial injury in diabetic rats via modulation of inflammatory pathways[J]. Laboratory Animal Research,2024,40(1):1-13. doi: 10.1186/s42826-024-00192-9 [11] Huang Q,Tian H,Tian L,et al. Inhibiting Rev-erbα-mediated ferroptosis alleviates susceptibility to myocardial ischemia-reperfusion injury in type 2 diabetes[J]. Free Radical Biology and Medicine,2023,209:135-150. doi: 10.1016/j.freeradbiomed.2023.09.034 [12] 吴梦龄,范艳,杨榆青,等. 金钗石斛多糖通过下调CYP2E1表达改善非酒精性脂肪肝病大鼠症状[J]. 西部医学,2020,32(4):505-509,514. doi: 10.3969/j.issn.1672-3511.2020.04.010 [13] 张俊青,吴芹,龚其海,等. 金钗石斛生物总碱对脂多糖激活星形胶质细胞产生炎症因子的影响[J]. 中国药理学通报,2011,27(6):824-827. doi: 10.3969/j.issn.1001-1978.2011.06.020 [14] 刘莹莹,武俊紫,李伟,等. 金钗石斛多糖对2型糖尿病大鼠心肌组织凋亡相关蛋白的影响[J]. 中西医结合心脑血管病杂志,2018,16(18):2621-2626. doi: 10.12102/j.issn.1672-1349.2018.18.007 [15] 刘莹莹,武俊紫,李伟,等. 金钗石斛多糖对2型糖尿病大鼠心肌组织中RIP蛋白表达影响[J]. 辽宁中医药大学学报,2017,19(12):44-48. [16] Pang M,Li Y,Gu W,et al. Recent advances in epigenetics of macrovascular complications in diabetes mellitus[J]. Heart,Lung and Circulation,2021,30(2):186-196. [17] Da Dalt L,Cabodevilla A G,Goldberg I J,et al. Cardiac lipid metabolism,mitochondrial function,and heart failure[J]. Cardiovascular Research,2023,119(10):1905-1914. doi: 10.1093/cvr/cvad100 [18] Krizanac M,Mass Sanchez P B,Schröder S K,et al. Lipid-independent regulation of PLIN5 via IL-6 through the JAK/STAT3 axis in Hep3B cells[J]. International Journal of Molecular Sciences,2023,24(8):7219. doi: 10.3390/ijms24087219 [19] Cinato M,Mardani I,Miljanovic A,et al. Cardiac Plin5 interacts with SERCA2 and promotes calcium handling and cardiomyocyte contractility[J]. Life Science Alliance,2023,6(4):e202201690 . doi: 10.26508/lsa.202201690 [20] Du T,Xiang L,Zhang J,et al. Vitamin D improves hepatic steatosis in NAFLD via regulation of fatty acid uptake and β-oxidation[J]. Frontiers in Endocrinology,2023,14:1138078. doi: 10.3389/fendo.2023.1138078 [21] Burgin H,Sharpe A J,Nie S,et al. Loss of mitochondrial fatty acid β‐oxidation protein short‐chain Enoyl‐CoA hydratase disrupts oxidative phosphorylation protein complex stability and function[J]. The FEBS Journal,2023,290(1):225-246. doi: 10.1111/febs.16595 -






 下载:
下载: