Study on the Regulatory Mechanism of Inhibiting miR-153-3p to Delay Intervertebral Disc Degeneration via Nrf2 Regulation
-
摘要:
目的 探讨人髓核细胞中miR-153-3p与Nrf2表达与椎间盘退变的相关机制。 方法 以H2O2构建髓核细胞氧化损伤模型,将miR-153-3p inhibitor-NC、si-Nrf2-NC 、miR-153-3p inhibitor、si-Nrf2 按分组转染至髓核细胞,利用RT-qPCR和western blot实验检测转染效率,采用CCK-8法检测细胞活力,流式细胞仪检测细胞内活性氧ROS 水平、线粒体膜电位下降的比值;RT-qPCR检测Nrf2、MMP-3、Col-Ⅱ、PINK1、Parkin、p62、p38 MAPK的表达量,双荧光素酶报告实验测量荧光素酶活性。 结果 (1)经H2O2处理的HNPCs细胞活力下降及线粒体膜电位降低、ROS水平提高、Col-Ⅱ表达减少,MMP-3、P62、p38 MAPK表达均升高,PINK1、Parkin表达均降低(P < 0.05),Nrf2无明显变化(P > 0.05)。(2)抑制经H2O2处理的髓核细胞miR-153-3p表达,其细胞活力及线粒体膜电位提高、ROS水平下降、Col-Ⅱ表达增加, MMP-3、P62、p38 MAPK表达均降低;而PINK1、Parkin及Nrf2表达均升高(P < 0.05)。(3)抑制经H2O2处理的髓核细胞miR-153-3p表达,同时沉默Nrf2表达,可见细胞活力及线粒体膜电位下降、ROS水平升高、Col-Ⅱ表达减少,且其MMP-3、P62、p38 MAPK表达升高;Nrf2、PINK1、Parkin 表达降低(P < 0.05)。(4)双荧光素酶活性分析显示miR-153-3p与 Nrf2间存在结合位点和结合关系,关系呈负相关(P < 0.05)。 结论 抑制miR-153-3p表达可缓解H2O2诱导的髓核细胞退变和纤维化,激活受损髓核细胞自噬、延缓髓核细胞凋亡,这一作用与Nrf2调控PINK1/Parkin途径、p38 MAPK炎性反应通路相关。 -
关键词:
- 椎间盘退变 /
- 人髓核细胞 /
- miR-153-3p /
- Nrf2
Abstract:Objective To investigate the correlation mechanism between miR-153-3p and Nrf2 expression in human nucleus pulposus cells and intervertebral disc degeneration (IDD). Methods The oxidative damage model of nucleus pulposus cells was duplicated induced by H2O2. MiR-153-3p inhibitor-NC, si-NRF2-NC, miR-153-3p inhibitor, and si-NRF2 were transfected into nucleus pulposus cells according to the grouping require. The transfection efficiency was detected by RT-qPCR and western blot. The cell viability was determined by the CCK-8 assay, when the intracellular reactive oxygen species (ROS) levels and the ratio of mitochondrial membrane potential decline were measured by flow cytometry, RT-qPCR was used to detect the expression levels of Nrf2, MMP-3, Col II, PINK1, Parkin, P62, and p38 MAPK. And dual luciferase reporter assay was used to measure luciferase activity. Results (1) HNPCs treated with H2O2 showed a decrease in HNPCs cell viability, a reduction in mitochondrial membrane potential, an increase in ROS levels, and a decrease in Col II expression (P < 0.05). And the expression of MMP-3, P62, and p38 MAPK increased, while the expression of PINK1 and Parkin decreased. There was no significant change in Nrf2(P > 0.05). (2) Inhibition of miR-153-3p expression in nucleus pulposus cells treated with H2O2 led to increased cell viability, elevated mitochondrial membrane potential, reduced ROS levels, and enhanced Col-II expression, accompanied by decreased expression of MMP-3, P62, and p38 MAPK, while simultaneously increasing the expression of PINK1, Parkin, and Nrf2 (P < 0.05). (3) When miR-153-3p expression was inhibited and Nrf2 expression was silenced in nucleus pulposus cells treated with H2O2, a notable decline in cell viability and mitochondrial membrane potential was observed, along with a marked increase in ROS levels. Additionally, Col-II expression decreased, whereas the expression of MMP-3, P62, and p38 MAPK increased. However, the expression of Nrf2, PINK1, and Parkin decreased (P < 0.05). (4) Dual-luciferase assay analysis revealed binding sites and a binding relationship between miR-153-3p and Nrf2, indicating a negative correlation between miR-153-3p and Nrf2 (P < 0.05). Conclusion Inhibition of miR-153-3p expression can alleviate H2O2 induced degeneration and fibrosis of nucleus pulposus cells, activate autophagy of damaged nucleus pulposus cells, and delay apoptosis of nucleus pulposus cells. This effect is related to the PINK1/Parkin pathway and p38 MAPK inflammatory response pathway regulated by Nrf2. -
Key words:
- Intervertebral disc degeneration /
- Human nucleus pulposus cells /
- miR-153-3p /
- Nrf2
-
椎间盘退变(intervertebral disc degeneration,IDD)是椎间盘结构的退化和损伤,通常是由于长期的生物力学压力、年龄相关的变化或损伤导致的,可引起多种脊椎退行性疾病[1]。当椎间盘受到损伤或老化时,细胞内氧化应激水平增加,引起蛋白质、脂质和DNA的氧化损伤,从而导致细胞结构及代谢功能退化,进一步加速椎间盘的退变过程。氧化应激可引发多种生物学反应和信号通路的激活,如炎症反应、细胞凋亡、线粒体功能异常等[2]。而IDD涉及细胞衰老、细胞凋亡、自噬、炎症反应等病理过程,其最主要的表现为髓核细胞(nucleus pulposus cells,NPCs)的增殖、衰老和凋亡、表型发生改变,以及II型胶原(type II collagen,COL-Ⅱ)、蛋白多糖的含量逐渐减少[3−4],可见氧化应激造成的NPCs损伤是IDD发生发展的重要因素之一[5]。机体在氧化应激状态下,其内活性氧簇(reactive oxygen species,ROS)增加。课题组早期研究结果显示过氧化氢(H2O2)可引起腰椎髓核细胞ROS含量增加、细胞活力下降、线粒体膜电位下降、II型胶原含量减少[6],从而构建腰椎髓核细胞损伤模型。
微小RNA (microRNAs,miRNAs)能够通过特定的配对与靶基因的mRNA结合,从而调控基因的表达,在细胞的分化、增殖、凋亡等过程中发挥重要调控作用。已有研究发现miRNA和氧化应激之间的联系是双向的,氧化应激诱导几种miRNA的上调或下调,许多miRNA可以调节氧化应激反应[7]。目前研究显示,它在神经、心肌组织展现出负向调节作用,能够抑制神经突的生长[8],而敲低miR-153-3p可以显著降低心肌细胞的肥大效果[9]。在肿瘤疾病如肺癌、胃癌、乳腺癌等相关研究中,结果显示miR-153-3p可能靶向多种通路调控肿瘤细胞的增殖、侵袭和迁移[10-12]。此外,有研究表明抑制miR-153-3p表达可上调核因子E2相关因子(nuclear factor erythroid 2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response elements,ARE)通路从而减轻H2O2引起的H9C2细胞损伤[13]。笔者在早期的实验中发现,H2O2诱导的损伤腰椎髓核细胞中miR-153-3p含量增加。Nrf2是1种调控抗氧化应激的关键转录因子,它可以进入细胞核并与包含细胞保护基因的ARE序列结合,可激活靶基因的转录,参与氧化应激和ROS代谢过程,增强细胞抗氧化能力。虽然在课题组早期实验中,H2O2诱导的损伤腰椎髓核细胞中的Nrf2表达与对照组无明显差异,但是在正常髓核细胞中抑制miR-153-3p的表达,会引起Nrf2表达的增加[4],为进一步探讨抑制miR-153-3p通过调控Nrf2表达延缓IDD进程的机制,研究改变IDD进程的作用靶点,以期为防治IDD提供新思路及理论依据。
1. 材料与方法
1.1 材料
1.1.1 实验细胞
人正常腰椎髓核细胞(human nucleus pulposus cells,Catalog #4800),购于Sciencell公司。
1.1.2 试剂
MonScript™ RTIIIAll-in-One Mix with dsDNase(Monad,货号MR05101),荧光定量QPCR试剂盒(Biosharp,货号BL698A),TriQuick Reagent(Solarbio,货号R1100),高效RIPA组织/细胞裂解液(Solarbio,货号 R0010),蛋白酶抑制剂混合液(100xPIC)(Solarbio,货号P6730),ECL化学发光底物(超敏)(Biosharp,货号BL523A),actin(Solarbio,货号K006153P),PCNA(Solarbio,货号K000323P),Nrf2(abcam,货号ab137550),山羊抗兔IgG(abcam,货号ab6721),ATP检测试剂盒(碧云天,货号S0026),CCK-8 试剂盒(Solarbio,货号CA1210),荧光定量QPCR试剂盒(Biosharp,货号BL698A),活性氧检测试剂盒(碧云天,货号S0033S),线粒体膜电位检测试剂盒(碧云天,货号C2006)。
1.1.3 设备
组织匀浆机(IKA,型号T18),低温离心机(Eppendofr,型号5418R),超微量核酸检测仪(遂真,型号FC-
1100 ),金属恒温水浴锅(上海齐欣,型号HWS-28),普通离心机(上海卢湘仪,型号TD4),水平摇床(其林贝尔,型号TS-3D),多功能酶标仪(美国MD,型号FilterMax F3),电泳仪(Bio-Rad,型号PowerPac Basic),蛋白转印模块(Bio-Rad,型号Mini Trans-Blot Cell),凝胶成像系统(上海天能,型号Tanon 5200),台式恒温培养振荡器摇床(上海智诚,型号ZWYR-2102C),发光检测仪(Promega,型号GloMax20/20),流式细胞仪(BECKMAN COULTER,型号CytoFLEX),细胞计数仪(广州牛顿光学研究院有限公司,型号CytoCube),荧光显微镜(Nikon,型号Ts2-FL)。1.2 研究方法
1.2.1 分组
实验分为:(1)对照组;(2)H2O2组;(3)H2O2 + miR-153-3p inhibitor-NC + si-Nrf2-NC;(4)H2O2 + miR-153-3p inhibitor + si-Nrf2-NC;(5)H2O2 + miR-153-3p inhibitor + siRNA-Nrf2。
1.2.2 标本处理方法
对照组采用髓核细胞培养基体外培养。H2O2诱导髓核细胞损伤模型:将髓核细胞培养基体外培养并予200 μmol/L H2O2处理6 h。miR-153-3p inhibitor是1段序列跟miR-153-3p 序列互补的miRNA,miR-153-3p inhibitor NC是1段无意序列的miRNA,起对照作用;siRNA-Nrf2是1段能跟Nrf2结合并降解Nrf2的miRNA,si-Nrf2-NC是1段无意序列的miR,起对照作用。实验时,按照分组进行相应的转染等处理。
1.2.3 检测指标及方法
采用CCK-8 检测各组细胞活力,流式检测各组细胞线粒体膜电位及ROS,RT-qPCR检测各组的基质金属蛋白酶-3(matrix metalloproteinase-3,MMP-3)、COL-Ⅱ、Nrf2、磷酸酶张力蛋白同源物诱导的假定蛋白激酶1(PTEN-induced kinase 1),PINK1、E3泛素连接酶Parkin、泛素结合蛋白p62、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)表达含量。
CCK-8 法检测细胞活力:取对数生长期细胞,以
2000 个/孔密度接种至96孔板中,各组均转染相应质粒,细胞培养24 h后每孔加入10 μL CCK-8溶液,孵育1 h,测定450 nm波长吸光度值。每组设置3个复孔,取平均值。RT-qPCR测定mRNA表达:将按分组处理好的细胞,总RNA提取后,反转录cDNA,根据试剂盒说明书进行qPCR,检测Nrf2、MMP-3、Col-Ⅱ、PINK1、Parkin、p62、p38 MAPK的表达量。相对表达量用2-△△Ct法计算。基因引物序列见表1。
表 1 引物序列Table 1. primer sequence基因 引物序列 产物长度/bp 序列号 PINK1 F TTGCCCCTAACACGAGGAAC 95 NM_032409.3 R ACGTGCTGACCCATGTTGAT Parkin F GACAGCAGGAAGGACTCACC 123 XM_011535863.1 R GCTGCACTGTACCCTGAGTT P62 F ACTGCTCCAACCTCATCTGC 96 NM_001193357.2 Homo R TAAGCTGAAGCCCTGTGTCC p38 MAPK F ATGCGTCTGACAGGAACACC 108 NM_001315.3 Homo R CGCAAAGTTCATCTTCGGCA Nrf2 F GCCAACTACTCCCAGGTTGC 122 NM_006164.5 Homo R AACGTAGCCGAAGAAACCTCA MMP-3 F AGCCAACTGTGATCCTGCTT 102 NM_002422.5 Homo R TTCCTGAGGGATTTGCGCC Col-Ⅱ F AGGACTCTGCACTGAATGGC 106 NM_001844.5 Homo R TCTGCCCAGTTCAGGTCTCT β-actin F GTCATTCCAAATATGAGATGCGT 121 NM_001101.5 R GCTATCACCTCCCCTGTGTG Western blot测定蛋白表达:将按分组处理好的细胞接种于6孔板中培养24 h。细胞转染质粒后,预冷的 PBS 洗涤3次,加入RIPA裂解液(含蛋白酶抑制剂),提取细胞总蛋白,测定每组蛋白样品浓度。取5 μL蛋白预Marker和30 μg蛋白样品进行 SDS-PAGE 凝胶电泳,转至PVDF膜。转膜后封闭1.5 h,剪下Marker目的条带和内参条带所在区域的膜。将膜放入相应的1∶20一抗稀释液中4 ℃孵育过夜,洗膜后再结合二抗1.5 h。最后,加入显影液显影,使用ECL化学发光液于多功能凝胶成像系统进行曝光成像。利用蛋白条带的吸光度计算蛋白表达量。
流式细胞仪检测HNPCs内活性氧ROS 水平:细胞按分组处理后,收集上清液,离心弃去上清。用2 mL的含1 mL /L ROS 探针的完全培养液重悬细胞,在37 ℃避光孵育30 min;用无菌PBS洗涤2次,流式细胞仪异硫氰酸荧光素通道检测荧光,按活性氧检测试剂盒说明书测定细胞中ROS含量,每组进行3次重复实验。
流式细胞仪检测HNPCs线粒体膜电位下降的比值:细胞按分组处理后,收集上清液,离心弃去上清。JC-1工作液配制:按照每50 µL JC-1(200X)加入8 mL超纯水的比例稀释JC-1,剧烈Vortex充分溶解并混匀JC-1,然后再加入2 mL JC-1染色缓冲液(5X),混匀后即为JC-1染色工作液;按照每1 mL JC-1染色缓冲液(5X)加入4 mL蒸馏水的比例,配制适量的JC-1染色缓冲液(1X)。向细胞培养孔中加入0.5 mL的JC-1工作液,置于细胞培养箱中37 ℃孵育20 min,用JC-1染色缓冲液(1X)洗涤2次然后用300 μL JC-1染色缓冲液(1X)重悬,将细胞培养板置于激光共聚焦显微镜下观察并记录结果,使用FlowJo V10进行分析。
双荧光素酶报告实验测量荧光素酶活性:采用双荧光素酶报告分析检测miR-153-3p在293T细胞中与Nrf2的结合作用。
1.3 统计学处理
实验所得计量资料数据先进行正态性性检验,均符合正态分布的数组采用均数±标准差($ \bar x \pm s $)描述,非正态分布数据采用中位数进行描述。对于符合正态分布数组进行方差齐性检验,方差齐的数据的多样本组间比较采用单因素方差分析后多重比较,LSD法进行组间两两比较;非正态分布数据及方差不齐的数据的多重比较采用Kruskal-Wallis秩和检验。检验水准取双侧α = 0.05,P < 0.05为差异有统计学意义。数据分析采用IBM SPSS Statistics 26软件进行。
2. 结果
2.1 沉默效果验证实验
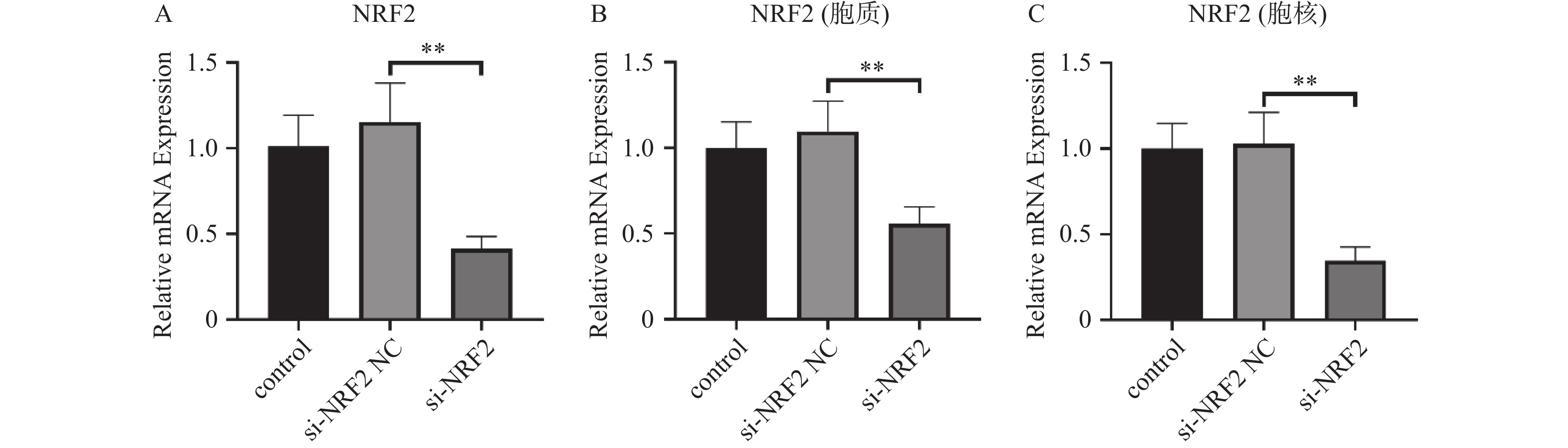
Nrf2沉默效果验证实验结果显示,si-Nrf2-NC组Nrf2相对表达量为(1.15±0.23)、si- Nrf2组Nrf2相对表达量为(0.41±0.07);与si- Nrf2-NC比较,si-Nrf2组,在mRNA水平髓核细胞中Nrf2表达量显著降低且差异具有统计学意义(P < 0.05)。在蛋白水平,细胞核中si- Nrf2-NC组Nrf2相对表达量为(1.03±0.15)、si- Nrf2组Nrf2相对表达量为(0.34±0.06);细胞质中si- Nrf2-NC组Nrf2相对表达量为(1.10±0.14)、si- Nrf2组Nrf2相对表达量为(0.55±0.07)。髓核细胞质、细胞核中 Nrf2蛋白表达量均显著降低,且差异具有统计学意义(P < 0.05),见图1。
2.2 沉默Nrf2表达逆转抑制miR-153-3p表达对 HNPCs氧化损伤的缓解作用
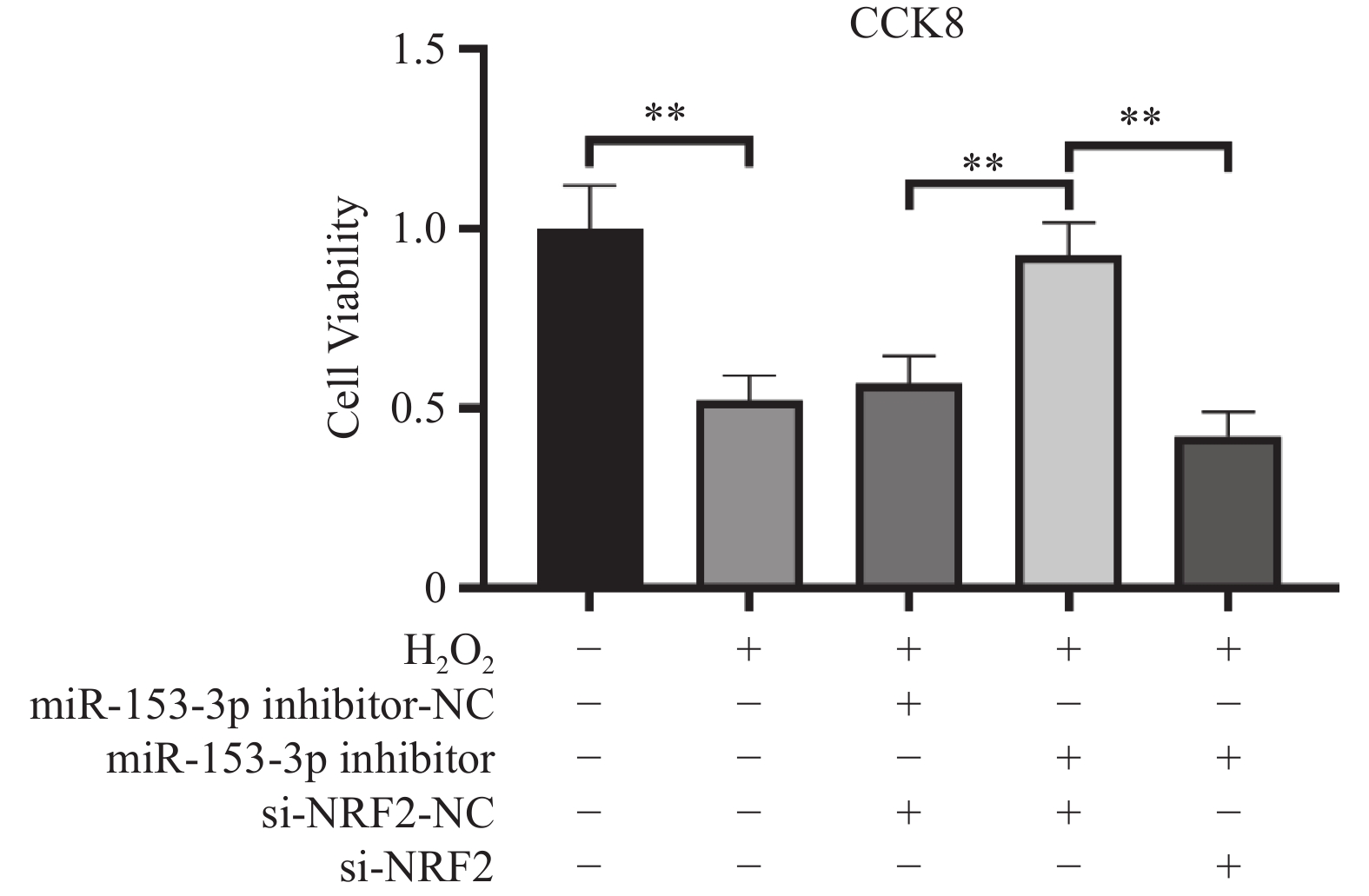
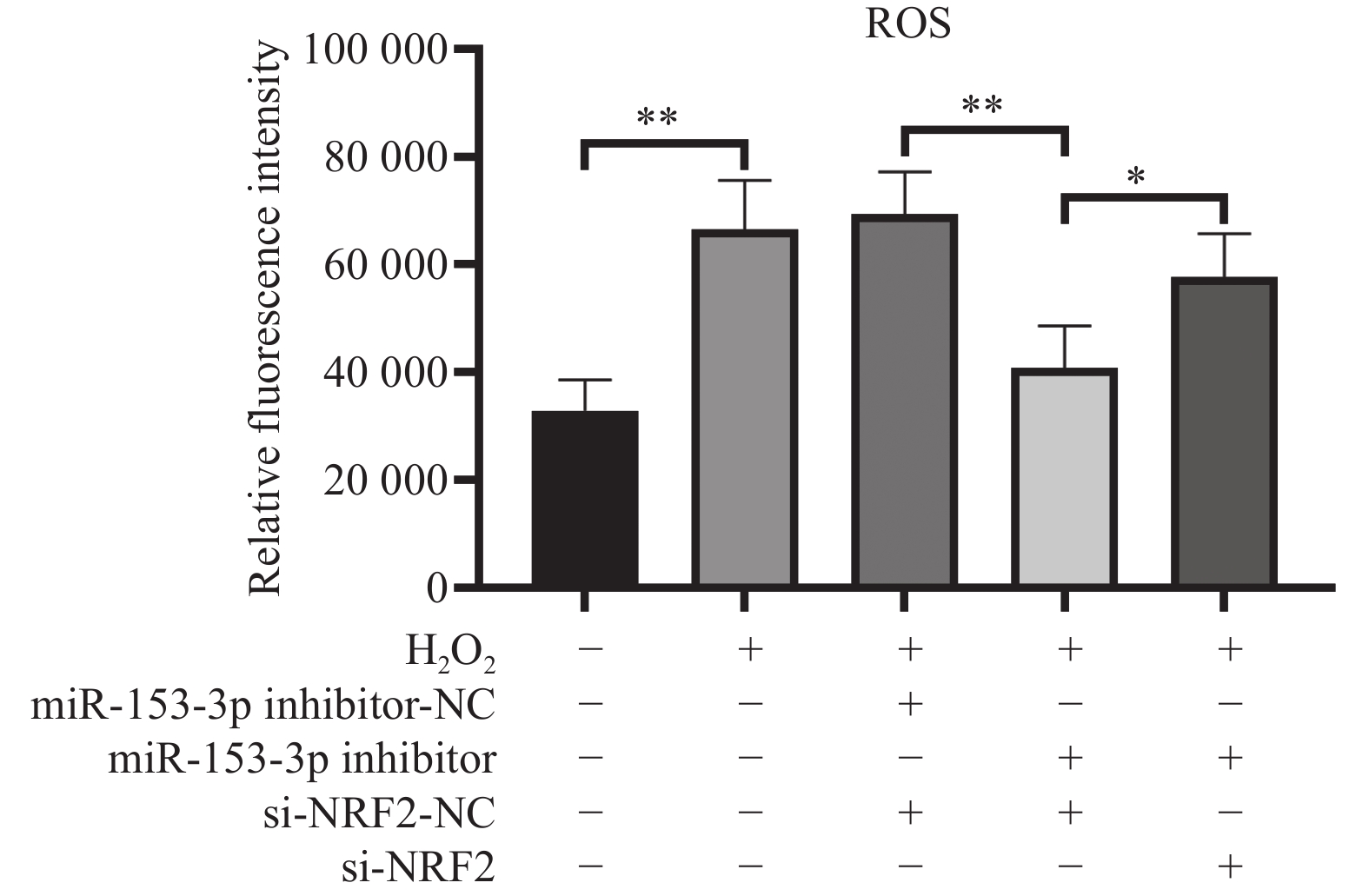
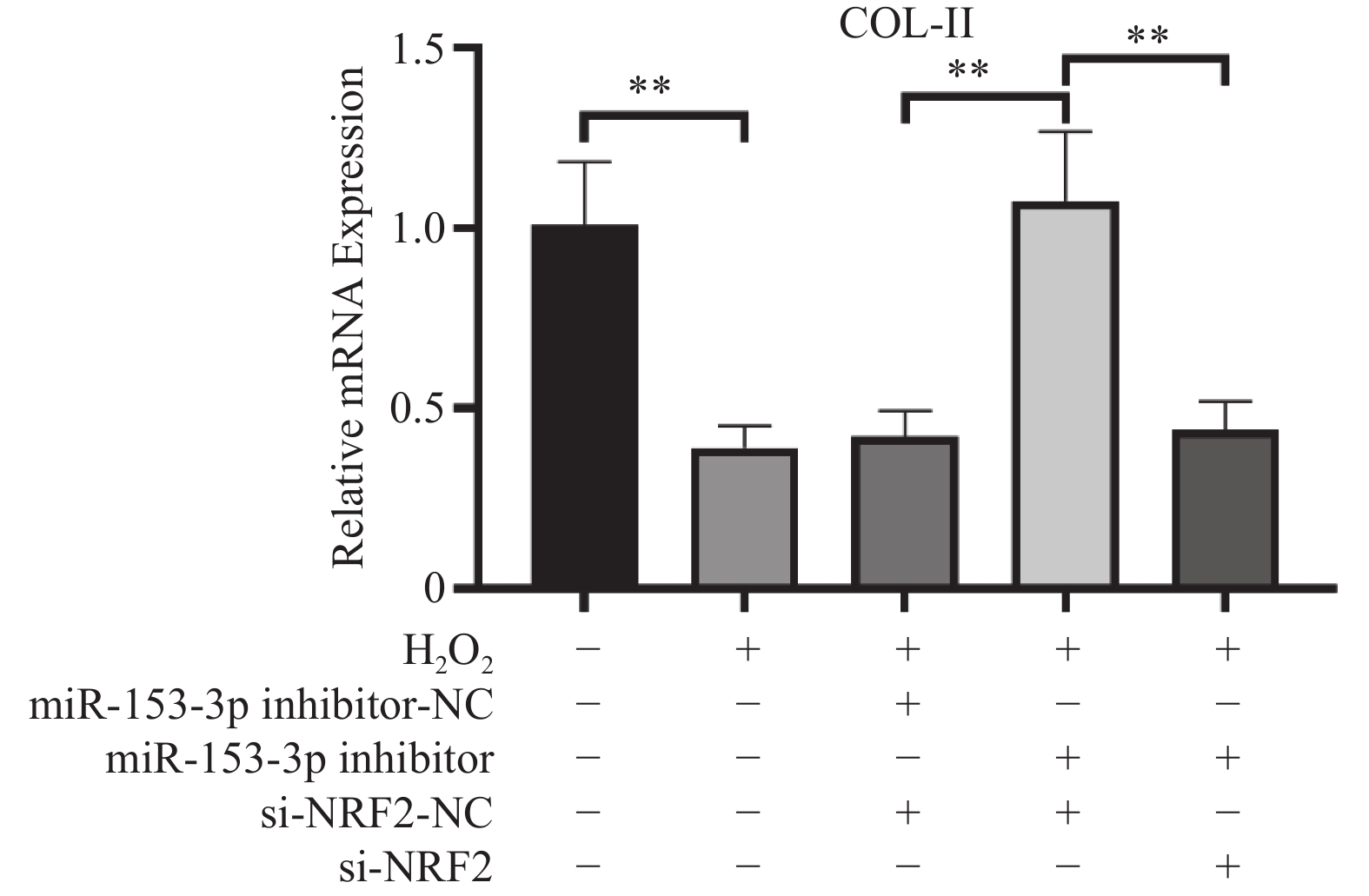
结果显示:(1)与对照组比较,H2O2组HNPCs活力及线粒体膜电位显著降低、ROS水平均显著提高、Col Ⅱ表达减少(P < 0.05)。(2)与H2O2 + miR-153-3p inhibitor-NC + si-Nrf2-NC组比较,H2O2 + miR-153-3p inhibitor + si-Nrf2-NC组细胞活力及线粒体膜电位提高、 ROS水平下降、Col Ⅱ表达增加(P < 0.05);与对照组比较没有明显差异(P > 0.05),说明抑制miR-153-3p表达能逆转H2O2诱导的HNPCs细胞氧化损伤。(3)与H2O2 + miR-153-3p inhibitor + si-Nrf2-NC组比较,H2O2 + miR-153-3p inhibitor + siRNA-Nrf2组细胞活力及线粒体膜电位显著下降、ROS水平均明显升高、Col Ⅱ表达减少(P < 0.05),与H2O2 组比较没有明显差异(P > 0.05);说明沉默Nrf2的表达,可以逆转抑制miR-153-3p 表达对H2O2诱导的HNPCs氧化损伤的缓解作用。这表明了miR-153-3p通过调节Nrf2的表达调控HNPCs的氧化应激,见图2、图3、图4与表2。
表 2 流式检测各组线粒体膜电位($\bar x \pm s$,n = 3)Table 2. Flow cytometry detection of mitochondrial membrane potential in each group($\bar x \pm s$,n = 3)分组 线粒体膜电位下降比例 F P ①对照组 16.13 ± 1.65▲ 39.713 0.00 ②H2O2组 7.84 ± 0.95 ③H2O2 + miR-153-3p inhibitor-NC + si-Nrf2-NC 8.63 ± 0.79∗ ④H2O2 + miR-153-3p inhibitor + si-Nrf2-NC 15.03 ± 1.72▲ ⑤H2O2 + miR-153-3p inhibitor + siRNA-Nrf2 6.03 ± 0.76∗ 组③、⑤组间比较,*P < 0.05;组①、④分别与组②、③、⑤比较,▲P < 0.05。 2.3 沉默Nrf2表达对HNPCs中Nrf2、MMP-3、PINK1、Parkin、p62、p38 MAPK的表达的影响
结果显示:(1)与对照组比较,H2O2组HNPCs 中MMP-3、p62、p38MAPK在mRNA水平表达均升高,PINK1、Parkin在mRNA水平表达均降低(P < 0.05),Nrf2无明显变化。(2)与H2O2+ miR-153-3p inhibitor-NC + si-Nrf2-NC组比较,H2O2+ miR-153-3p inhibitor + si-Nrf2-NC组HNPCs 中MMP3、P62、p38MAPK在mRNA水平表达均降低;Nrf2、PINK1、Parkin 在mRNA水平表达均升高(P < 0.05)。(3)与H2O2 + miR-153-3p inhibitor + si-Nrf2-NC组比较,H2O2 + miR-153-3p inhibitor + siRNA-Nrf2组HNPCs 中MMP3、p62、p38MAPK在mRNA水平表达均升高;Nrf2、PINK1、Parkin 在mRNA水平表达均降低(P < 0.05),见图5。
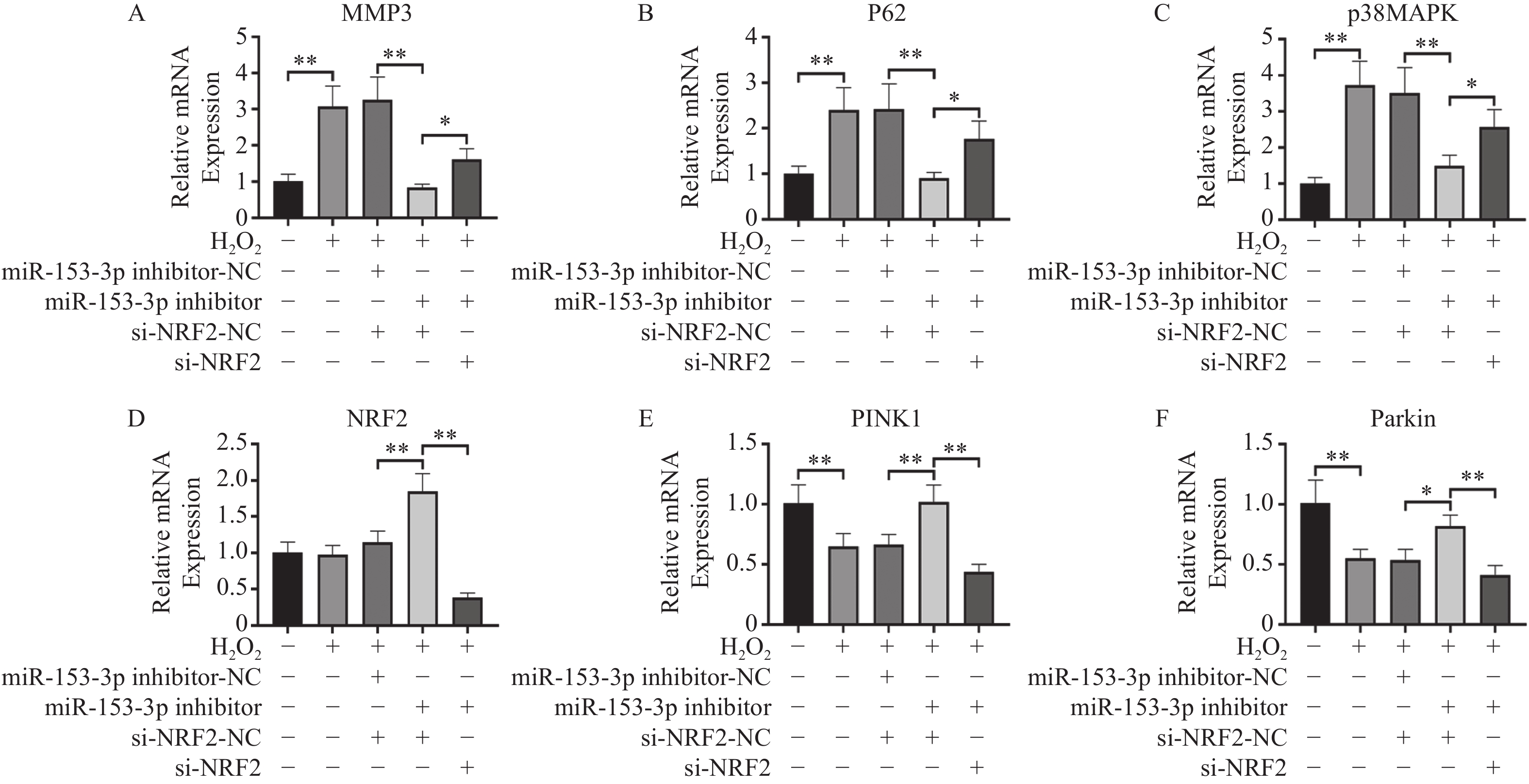 图 5 RT-qPCR检测各组Nrf2、MMP-3、PINK1、Parkin、p62、p38 MAPK的相对表达量($ \bar x \pm s$,n = 3)A:各组MMP3表达;B:各组p62表达;C:各组p38MAPK表达;D:各组Nrf2表达E:各组PINK1表达;F:各组Parkin表达;*P < 0.05,**P < 0.01;+:阳性标本处理;-:阴性标本处理。Figure 5. RT-qPCR detection of relative expression levels of Nrf2,MMP-3,PINK1,Parkin,p62,p38 MAPK in each group($ \bar x \pm s$,n = 3)
图 5 RT-qPCR检测各组Nrf2、MMP-3、PINK1、Parkin、p62、p38 MAPK的相对表达量($ \bar x \pm s$,n = 3)A:各组MMP3表达;B:各组p62表达;C:各组p38MAPK表达;D:各组Nrf2表达E:各组PINK1表达;F:各组Parkin表达;*P < 0.05,**P < 0.01;+:阳性标本处理;-:阴性标本处理。Figure 5. RT-qPCR detection of relative expression levels of Nrf2,MMP-3,PINK1,Parkin,p62,p38 MAPK in each group($ \bar x \pm s$,n = 3)2.4 双荧光素酶活性分析
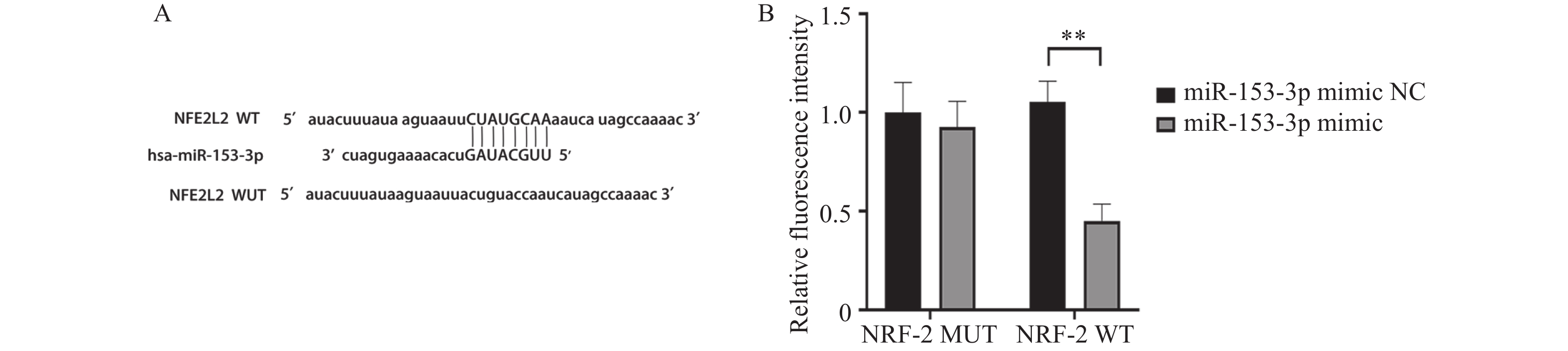
采用双荧光素酶报告分析检测了miR-153-3p在 293T 细胞中与 Nrf2的结合作用,生物信息学分析平台TargetScan 预测了miR-153-3p与 Nrf2的结合作用,而突变型的Nrf2 则无此结合位点。在 Nrf2-WT 野生型的 293T 细胞中,荧光素酶活性在过表达miR-153-3p时显著降低(P < 0.05),而在Nrf2-MUT 突变型的细胞中过分析miR-153-3p 则对荧光素酶活性无显著影响。这表明在293T 细胞中,miR-153-3p与 Nrf2间存在结合位点和结合关系,见图6。
3. 讨论
3.1 抑制miR-153-3p表达可缓解H2O2诱导的髓核细胞退变纤维化
在椎间盘退变的病理变化中,细胞外基质的合成及分解代谢紊乱,引起细胞外基质结构的重建,主要表现为蛋白多糖含量减少和Ⅱ型胶原向Ⅰ型胶原转变,导致髓核组织的水结合能力丧失,最终诱发椎间盘退变。细胞纤维化相关蛋白(蛋白聚糖和II型胶原) 减少和基质蛋白分解相关酶(MMPs)增加是椎间盘退变的关键表型变化之一。目前的研究已证实基质金属蛋白酶3(MMP-3)基因与椎间盘退行性变发生密切关系,MMP-3含量在退变椎间盘中显著高于非退变椎间盘,且在退变越严重的椎间盘中含量越高[14]。周树良等[15]研究表明IDD患者髓核组织中Col-Ⅱ基因与蛋白的表达量均降低,且退变越严重,其表达量越低。因此,笔者研究了在抑制miR-153-3p表达的同时沉默Nrf2的表达对氧化应激髓核细胞中MMP-3、Col-Ⅱ的影响,结果表明,在经过 H2O2处理后,MMP-3表达量显著增加,Col-Ⅱ表达量却显著降低。提示,在H2O2诱导下,髓核细胞外基质会发生降解和减少,因此,H2O2可诱导髓核细胞发生退变纤维化表型。髓核细胞经过H2O2处理后,抑制其miR-153-3p表达,会引起Nrf2表达量显著升高,MMP-3表达量显著减低(P < 0.01),Col-Ⅱ 表达量显著升高,表明抑制miR-153-3p表达后能缓解H2O2诱导的髓核细胞退变纤维化。同时利用si-Nrf2靶向沉默Nrf2表达后,MMP-3表达明显增加,Col-Ⅱ 表达量显著降低,这表明沉默Nrf2表达能逆转抑制miR-153-3p表达对H2O2诱导髓核细胞发生退变纤维化的缓解。结果提示miR-153-3p是治疗IDD的一个靶点,可以通过抑制miR-153-3p表达来缓解氧化应激引起的髓核细胞退变,而这一治疗作用的机制是通过上调Nrf2这一调控抗氧化应激的关键转录因子实现的。
3.2 抑制miR-153-3p可通过Nrf2调控PINK1/Parkin自噬途径延缓NPCs凋亡
自噬是一种维持细胞正常生理活动和能量代谢平衡的自我保护机制,会把细胞内受损、变性、衰老的细胞器或者蛋白质运输至自噬溶酶体中进行降解、循环及再利用[16]。线粒体既可以产生活性氧,也会被氧化应激损伤攻击 [17]。线粒体自噬是退行性疾病中重要的细胞抗氧化途径,它通过自噬途径对受损线粒体的选择性降解和循环利用,改善线粒体在氧化应激过程中的功能障碍,维持线粒体质量控制[18]。线粒体自噬调节信号通路中研究最广泛的PINK1/Parkin通路 [19]。当线粒体发生去极化,线粒体外膜蛋白PINK1不断积累,选择性地招募胞质Parkin到受损的线粒体自噬上,Parkin 是一种E3泛素连接酶,通过泛素化作用连接 LC3,诱导线粒体自噬的发生[20]。膜型LC3、p62是判断细胞中自噬水平高低的重要标志[21]。自噬形成后,LC3-I酶解掉一小段多肽,转变为LC3-II,因此,LC3-II比值的大小与自噬水平呈正比。p62可连接LC3 和泛素化的底物,被整合到自噬体中,在自噬溶酶体中被降解,因此随着自噬水平增高,p62水平降低。最近研究证实,在神经元中,Nrf2通过激活PINK1启动子的ARE序列,作为PINK1基因的一种新的转录调控因子,Nrf2转录上调的PINK1对线粒体有保护作用,PINK1还通过清除受损的线粒体和减少ROS等多种机制参与线粒体稳态的维持,使细胞在细胞存活方面具有优势[22-23]。因此,在课题组的研究中,经过 H2O2处理后的HNPCs中的P62表达量显著上调,线粒体膜电位下降、ROS含量显著升高,提示在H2O2诱导后,HNPCs线粒体自噬水平下降,线粒体损伤增大,内源性ROS 产生增多。抑制miR-153-3p表达后,Nrf2表达量显著升高,PINK1、Parkin表达量显著上调,P62表达量显著下调,线粒体膜电位下降、ROS含量显著升高,表明抑制miR-153-3p表达后能激活受损髓核细胞自噬延缓髓核细胞凋亡;同时利用siNrf2靶向沉默Nrf2表达后,Nrf2表达量显著降低,PINK1、Parkin表达量显著降低,P62表达量显著上调,ROS含量显著升高、线粒体膜电位显著下降,说明抑制miR-153-3p表达后能激活受损髓核细胞自噬延缓髓核细胞凋亡这一作用与Nrf2调控的PINK1/Parkin自噬途径相关。这为IDD发病机制的探索提供了新思路以及潜在的治疗新靶点。
3.3 抑制miR-153-3p以延缓IDD与Nrf2调控p38 MAPK炎性反应通路有关
近年来,研究表明IDD与 TNF-α、IL-6、IL-1、COX-2、IL-8,IL-10等促炎症因子有关,而这些的促炎因子的表达都与 MAPK(丝裂原活化蛋白激酶) 息息相关。P38 MAPK 是MAPK家族中的重要成员,ROS增加可使NPCs中大量表达活化的p38 MAPK,并增加TNF-α、IL-1β及IL-6等炎症介质的产生以及MMP-3等蛋白酶的表达[24]。与非衰老细胞相比,p38 MAPK 基因在衰老的椎间盘细胞中表达上调[25]。课题组研究了在抑制miR-153-3p表达的同时沉默Nrf2的表达对氧化应激髓核细胞中p38 MAPK的影响,结果表明,在经过H2O2处理后,p38 MAPK表达量显著增加;而抑制受损髓核细胞的miR-153-3p表达后,Nrf2表达量显著升高,p38 MAPK表达量显著下降(P < 0.01)。与之相比,利用si-Nrf2靶向沉默Nrf2表达后,p38 MAPK表达有所回升。这提示了miR-153-3p、Nrf2与p38 MAPK炎性反应通路有一定相关性,抑制miR-153-3p表达,可以通过Nrf2调控p38 MAPK炎性反应通路,延缓IDD的进程。
本研究探讨了抑制miR-153-3p通过调控Nrf2表达延缓IDD进程的机制,结果显示抑制miR-153-3p表达后, Nrf2表达量明显增加,双荧光素酶活性分析显示miR-153-3p与 Nrf2间存在结合位点和结合关系,说明miR-153-3p与 Nrf2呈负相关关系。抑制miR-153-3p表达可缓解H2O2诱导的髓核细胞退变和纤维化,激活受损髓核细胞自噬延缓髓核细胞凋亡,这一作用与Nrf2调控PINK1/Parkin自噬途径相关;与此同时,抑制miR-153-3p表达,还可以通过Nrf2调控p38 MAPK炎性反应通路,延缓IDD的进程。这些都提示了miR-153-3p可作为调控Nrf2以改变IDD进程的作用靶点,为防治IDD提供新思路及理论依据。本研究为miR-153-3p/ Nrf2轴在椎间盘退变疾病的作用提供了基础,但是目前研究仅为体外细胞研究的阶段,未来可以此为基础,结合祖国医学丰富的医药、治疗手段,在miR-153-3p/ Nrf2轴层面进行进一步的动物实验研究以发掘治疗椎间盘退变疾病的药物和治疗方法。
-
图 5 RT-qPCR检测各组Nrf2、MMP-3、PINK1、Parkin、p62、p38 MAPK的相对表达量($ \bar x \pm s$,n = 3)
A:各组MMP3表达;B:各组p62表达;C:各组p38MAPK表达;D:各组Nrf2表达E:各组PINK1表达;F:各组Parkin表达;*P < 0.05,**P < 0.01;+:阳性标本处理;-:阴性标本处理。
Figure 5. RT-qPCR detection of relative expression levels of Nrf2,MMP-3,PINK1,Parkin,p62,p38 MAPK in each group($ \bar x \pm s$,n = 3)
表 1 引物序列
Table 1. primer sequence
基因 引物序列 产物长度/bp 序列号 PINK1 F TTGCCCCTAACACGAGGAAC 95 NM_032409.3 R ACGTGCTGACCCATGTTGAT Parkin F GACAGCAGGAAGGACTCACC 123 XM_011535863.1 R GCTGCACTGTACCCTGAGTT P62 F ACTGCTCCAACCTCATCTGC 96 NM_001193357.2 Homo R TAAGCTGAAGCCCTGTGTCC p38 MAPK F ATGCGTCTGACAGGAACACC 108 NM_001315.3 Homo R CGCAAAGTTCATCTTCGGCA Nrf2 F GCCAACTACTCCCAGGTTGC 122 NM_006164.5 Homo R AACGTAGCCGAAGAAACCTCA MMP-3 F AGCCAACTGTGATCCTGCTT 102 NM_002422.5 Homo R TTCCTGAGGGATTTGCGCC Col-Ⅱ F AGGACTCTGCACTGAATGGC 106 NM_001844.5 Homo R TCTGCCCAGTTCAGGTCTCT β-actin F GTCATTCCAAATATGAGATGCGT 121 NM_001101.5 R GCTATCACCTCCCCTGTGTG 表 2 流式检测各组线粒体膜电位($\bar x \pm s$,n = 3)
Table 2. Flow cytometry detection of mitochondrial membrane potential in each group($\bar x \pm s$,n = 3)
分组 线粒体膜电位下降比例 F P ①对照组 16.13 ± 1.65▲ 39.713 0.00 ②H2O2组 7.84 ± 0.95 ③H2O2 + miR-153-3p inhibitor-NC + si-Nrf2-NC 8.63 ± 0.79∗ ④H2O2 + miR-153-3p inhibitor + si-Nrf2-NC 15.03 ± 1.72▲ ⑤H2O2 + miR-153-3p inhibitor + siRNA-Nrf2 6.03 ± 0.76∗ 组③、⑤组间比较,*P < 0.05;组①、④分别与组②、③、⑤比较,▲P < 0.05。 -
[1] 张嘉军,刘勇,许德荣,郭建伟,王华聪. 椎间盘退变的机制及其治疗综述[J]. 临床医学进展,2020,10(10):2302-2310. [2] 王延海,张雷明,冯艳艳. 大黄素改善高糖条件中人肾小球血管内皮细胞炎症、氧化应激及凋亡作用的研究[J]. 中国临床药理学杂,2023,39(10):1422-1426. [3] 杨召,苑珍珍. 炎性因子在中医药治疗椎间盘退变中的机制研究[J]. 中国矫形外科杂志,2021,29(24):2246-2248. [4] 李敬超. 红景天苷通过Nrf2/ARE信号通路缓解椎间盘退变的研究 [D]. 天津:天津医科大学,2020. [5] 寇裕,顾勇,陈亮. 黑磷调控氧化应激-炎症级联效应延缓椎间盘退变的机制[J]. 中国组织工程研究,2024,28(15):2338-2345. [6] 庾珊,肖林,龚东平,等. miR-153-3p对于腰退行性病变调节机制的初步探讨[J]. 昆明医科大学学报,2023,44(8):53-58. [7] Ebrahimi S O,Reiisi S,Shareef S. miRNAs,oxidative stress,and cancer: A comprehensive and updated review.[J]. Journal of Cellular Physiology,2020,235(11):8812-8825. doi: 10.1002/jcp.29724 [8] 郭静,吴琦,蔡旖斐,等. miR-153-3p调控神经突的生长[J]. 中华实用诊断与治疗杂志,2019,33(7):650-653. [9] 张丽霞,周露玙,许胜,等. MiR-153-3p调控异丙肾上腺素诱导的心肌肥大机制研究[J]. 转化医学杂志,2019,8(4):199-202+212. [10] 崔文洁,袁杰清,施海,等. lncRNA KTN1-AS1调节miR-153-3p/NFAT5轴对非小细胞肺癌细胞增殖、迁移和侵袭的影响[J]. 中国比较医学杂志,2023,33(2):22-30. [11] 张曹,何亚琴,钱海权,等. miR-153-3p通过靶向FZD3调控胃癌SGC7901细胞的增殖、侵袭与迁移[J]. 中国肿瘤生物治疗杂志,2021,28(9):885-892. [12] 孙蕾,王华,姜珏,等. miR-153-3p靶向下调Rho相关螺旋蛋白激酶1(ROCK1)基因抑制乳腺癌细胞增殖及迁移[J]. 细胞与分子免疫学杂志,2020,36(2):138-144. [13] 黄兆琦,许卫,黄炯华,等. 下调miR-153-3p可促进Nrf2表达从而减轻H2O2诱导的H9C2细胞损伤[J]. 中国病理生理杂志,2020,36(7):1249-1254. [14] Zou X,Zhang X,Han S,et al. Pathogenesis and therapeutic implications of matrix metalloproteinases in intervertebral disc degeneration: A comprehensive review[J]. Biochimie,2023,214(PtB):27-48. [15] 周树良,徐良,钱学峰,等. 椎间盘退变程度与髓核中miRNA-142-3p、混合谱系激酶3及白细胞介素1β的相关性[J]. 中国组织工程研究,2024,28(2):165-171. [16] D'Arcy M S. Cell death: a review of the major forms of apoptosis,necrosis and autophagy[J]. Cell Biology International,2019,43(6):582-592. doi: 10.1002/cbin.11137 [17] 庞延,卢健棋,唐梅玲,等. 强心汤对慢性心力衰竭模型大鼠梗死心肌区组织活性氧及PINK1/parkin介导的线粒体自噬的影响[J]. 中医杂志,2023,64(7):722-728. [18] Picca A,Faitg J,Auwerx J,et al. Mitophagy in human health,ageing and disease.[J]. Nature Metabolism,2023,5(12):2047-2061. doi: 10.1038/s42255-023-00930-8 [19] 潘世鸿,刘瑞端. 线粒体自噬与椎间盘退变[J]. 中国组织工程研究,2024,28(36):5872-5876. [20] Quinn P M J,Moreira P I,Ambrosio A F,et al. PINK1/PARKIN signalling in neurodegeneration and neuroinflammation[J]. Acta Neuropathologica Communications,2020,8(1):189. doi: 10.1186/s40478-020-01062-w [21] Jahanian S,Pareja-Cajiao M,Gransee H M,et al. Autophagy markers LC3 and p62 in aging lumbar motor neurons[J]. Experimental Gerontology,2024,194:112483. [22] 魏思灿,林天来,黄玲,等. 槲皮素通过PINK1/parkin通路激活线粒体自噬减轻大鼠脑缺血再灌注损伤[J]. 中国病理生理杂志,2020,36(12):2251-2257. [23] Song C,Zhang A,Zhang M,et al. Nrf2/PINK1-mediated mitophagy induction alleviates sodium fluoride-induced hepatic injury by improving mitochondrial function,oxidative stress,and inflammation[J]. Ecotoxicology and Environmental Safety,2023,252:114646. doi: 10.1016/j.ecoenv.2023.114646 [24] Han Y,Li X,Yan M,et al. Oxidative damage induces apoptosis and promotes calcification in disc cartilage endplate cell through ROS/MAPK/NF-κB pathway: Implications for disc degeneration[J]. Biochem Biophys Res Commun,2019,516(3):1026-1032. doi: 10.1016/j.bbrc.2017.03.111 [25] Shi Z W,Zhu L,Song Z R,et al. Roles of p38 MAPK signalling in intervertebral disc degeneration[J]. Cell Prolif,2023,56(8):e13438. -






 下载:
下载:
 下载:
下载:

