Association between Systemic Immune-Inflammation Index and Disease Activity in Patients with Systemic Lupus Erythematosus
-
摘要:
目的 通过评估全身免疫炎症指数(systemic immune inflammatory index,SII)水平与系统性红斑狼疮(systemic lupus erythematosus,SLE)患者的疾病活动度之间的关系,探索SLE患者疾病活动度简便评估的新方法; 方法 收集在昆明医科大学第一附属医院风湿免疫科就诊的SLE患者临床资料,根据系统性红斑狼疮活动指数(SLEDAI)分组,比较、分析SII水平与疾病活动的相关性,绘制接受者工作特征曲线(receiver operating characteristic curve,ROC),评价SII对SLE疾病活动度的预测价值。 结果 SLE患者疾病轻度活动组的SII水平显著低于重度活动组(经Bonferroni校正,P < 0.05/3 = 0.017),SII水平与SLEDAI评分存在相关性(r=0.130, P < 0.05),ROC曲线下面积为0.581( P < 0.05)。 结论 SII可作为反映 SLE 疾病活动度的一种简便、快速的参考指标。 -
关键词:
- 系统性红斑狼疮 /
- 全身免疫炎症指数 /
- 系统性红斑狼疮活动指数
Abstract:Objective To explore a new method for assessing disease activity in patients with systemic lupus erythematosus (SLE) by evaluating the relationship between the level of the systemic immune-inflammatory index (SII) and disease activity in SLE patients. Methods Clinical data of SLE patients who treated in the Department of Rheumatology and Immunology of First Affiliated Hospital of Kunming Medical University were collected. Patients were grouped based on the Systemic Lupus Erythematosus Disease Activity Index (SLEDAI). The correlation between SII level and disease activity was compared and analyzed, and Receiver operating characteristic curve (ROC) was plotted to evaluate the predictive value of SII for SLE disease activity. Results The SII levels in the mild active group of SLE patients were significantly lower than that in the severe active group (Bonferroni correction, P < 0.05/3 = 0.017). There was a correlation between SII levels and SLEDAI scores (r = 0.130, P < 0.05), with an area under the ROC curve of 0.581 (P < 0.05). Conclusion SII can serve as a simple and quick reference indicator for reflecting disease activity in SLE. -
系统性红斑狼疮(systemic lupus erythematosus,SLE)作为最常见的自身免疫性疾病之一,可侵犯多系统导致器官功能障碍。炎症反应失调是SLE发生、发展的关键环节,高度活化的淋巴细胞来源DNA可能诱导巨噬细胞M2b极化[1-2],从而诱导炎症反应失调,是导致疾病进展和器官损害加重的主要因素。血液系统的损害是SLE较为常见的系统损害[3],包括红细胞、中性粒细胞、淋巴细胞、血小板等多种血液成分的异常。临床上根据患者疾病活动情况,需给予不同阶梯水平的个性化治疗[4],以期达到疗效最大化、副作用最小化的目标。目前对于SLE的疾病活动程度评估最常用的方法是系统性红斑狼疮疾病活动指数(systemic lupus erythematosus disease activity index,SLEDAI) [5],可从临床表现到实验室指标对SLE患者进行全面的评估,但其评价项目多,时间及费用成本较高,故而寻找一种快速、简便的评价方法是临床上的迫切需求。
全身免疫炎症指数(systemic immune inflammatory index,SII)于2014年首次被提出用于评估肝细胞癌患者的预后[6],通过中性粒细胞、淋巴细胞和血小板的相互关系来表现体内自身免疫炎症的活跃程度,后来陆续在脑梗死后感染[7]、脑出血[8]、溃疡性结肠炎[9]等疾病中被发现具有预测和评估预后的价值,以其评价方法简单快速而广受关注。因此,假设SLE患者的SII水平在不同的疾病活动程度中存在差异,可以通过这种差异快速评估SLE的疾病活动程度。
1. 资料与方法
1.1 研究对象
本研究已通过昆明医科大学第一附属医院伦理委员会的批准[(2023)伦审L第21号],入组前所有研究参与者本人和(或)法定监护人均被详细告知实验研究的目的和所有内容,并经其同意参与本研究。
筛选本研究中心数据库中于2015年4月至2018年12月期间在昆明医科大学第一附属医院就诊的SLE患者,收集患者的一般资料和临床数据。
研究参与者纳入标准:(1)符合1997年修订的美国风湿病学会制定的SLE分类标准[10];(2)年龄16岁~65岁;(3)自愿参加本研究并签署知情同意书。
研究参与者排除标准:(1)明确诊断或疑诊其他自身免疫性疾病;(2)证实存在急、慢性感染(近1个月内),如肺部感染、泌尿系感染、胃肠道感染、寄生虫感染等或慢性炎症;(3)合并恶性肿瘤;(4)其他严重临床疾病如心力衰竭、心肌梗死、肾衰竭;(5)原发的血液系统疾病;(6)妊娠期或哺乳期妇女。
1.2 资料采集
1.2.1 一般资料收集
对每位患者予以独立编号,收集患者年龄、性别、住院号等一般资料,分别由2名经验丰富的风湿免疫科医师采用SLEDAI评分表对研究参与者进行评估,并达成一致,按照此评分标准将患者分为轻度活动组(< 7分),中度活动组(7~12分),重度活动组(> 12分);或无活动组(≤ 8分)和活动组(> 8分)[5]。
1.2.2 临床资料收集
在患者入选后第1天清晨空腹采血获取血常规的检查结果,收集每位患者的白细胞计数(WBC)、中性粒细胞计数(N)、淋巴细胞计数(L)、血小板计数(PLT)并计算出每位患者的SII值,具体计算方法为:SII = 血小板计数($ \times {10}^{9}/\mathrm{L} $)×中性粒细胞计数($ \times {10}^{9}/\mathrm{L} $)/淋巴细胞计数($ \times {10}^{9}/\mathrm{L} $)[4]。
1.3 统计学处理
人口学资料和临床资料的统计分析采用IBM SPSS 24.0软件进行。使用Kolmogorov-Smirnov检验验证数据的正态性,服从正态分布的计量资料用均数±标准差($ {\bar x}\pm s $)表示,非正态分布的计量资料用M(Q1,Q3)表示。采用Kruskal-Wallis检验分析3组间非正态分布的计量资料,采用单因素方差分析3组间正态分布的计量资料,结果使用Bonferroni校正(P < 0.05/3 = 0.017),分类资料使用Person卡方检验(P < 0.05)。通过 Spearman 相关分析评价 SII 与 SLEDAI 评分的相关性;绘制ROC曲线用以评价SII对于区分SLE患者疾病活动状态的预测价值(P < 0.05),P < 0.05为差异有统计学意义。
2. 结果
2.1 一般资料
根据纳入及排除标准,共纳入514例患者,其中13例患者因临床资料不全而被剔除,最终入选501例患者,其中,轻度活动134例(男/女 = 11/123),中度活动166例(男/女 = 16/150),重度活动201例(男/女 = 20/181)各组间性别构成及年龄差异无统计学意义(P > 0.05),3组间WBC、N差异无统计学意义,L、PLT差异有统计学意义(P > 0.05),二者水平随疾病活动程度加重而降低,P < 0.05,见表1。
表 1 按疾病活动度分组SLE患者一般资料和SII值的比较Table 1. Comparison of general information and SII values among SLE patients grouped by disease activity项目 SLE疾病活动度分组 $ {\chi }^{2} $/F P 轻度活动组 中度活动组 重度活动组 例数[n(%)] 134(26.74) 166(33.13) 201(40.11) − − 性别(男/女) 11/123 16/150 20/181 0.306 0.858 年龄(岁) 35(25.75,45.00) 34(26.00,47.00) 32(24.00,44.51) 2.731 0.255 WBC(×109/L) 4.96(3.79,6.34) 4.87(3.69,7.39) 4.82(3.17,7.19) 1.088 0.580 N(×109/L) 3.14(2.32,4.23) 3.20(2.22,5.29) 3.46(1.88,5.41) 1.835 0.400 L(×109/L) 1.31(0.91,1.77) 1.10(0.77,1.54) 0.89(0.56,1.32) 37.602 < 0.001* PLT(×109/L) 202.50(149.00,248.00) 182.00(138.25,258.50) 177.00(121.50,226.50) 9.598 0.008* SLEDAI 4.00(2.00,6.00) 10.00(8.00,12.00) 18.00(15.00,22.00) 441.34 < 0.001* SII 468.54(252.48,808.33) 578.11(300.34, 1027.66 )616.07(326.68, 1203.04 )9.569 0.008* *P < 0.05。 2.2 SII组间差异
经正态性检验,3组SLE患者的SII数值均为非正态分布数据,使用Kruskal-Wallis检验分析,各组间SII值存在组间差异(P = 0.008),见表1,进一步进行多重比较(结果经Bonferroni校正,P < 0.05/3 = 0.017,差异有统计学意义),结果显示轻度活动度组SII值显著低于重度活动组(P = 0.002),轻度活动组SII值低于中度活动组,差异无统计学意义(P = 0.032),中度活动组和重度活动组SII值无统计学差异(P = 0.379)。
2.3 SII与SLEDAI的相关性
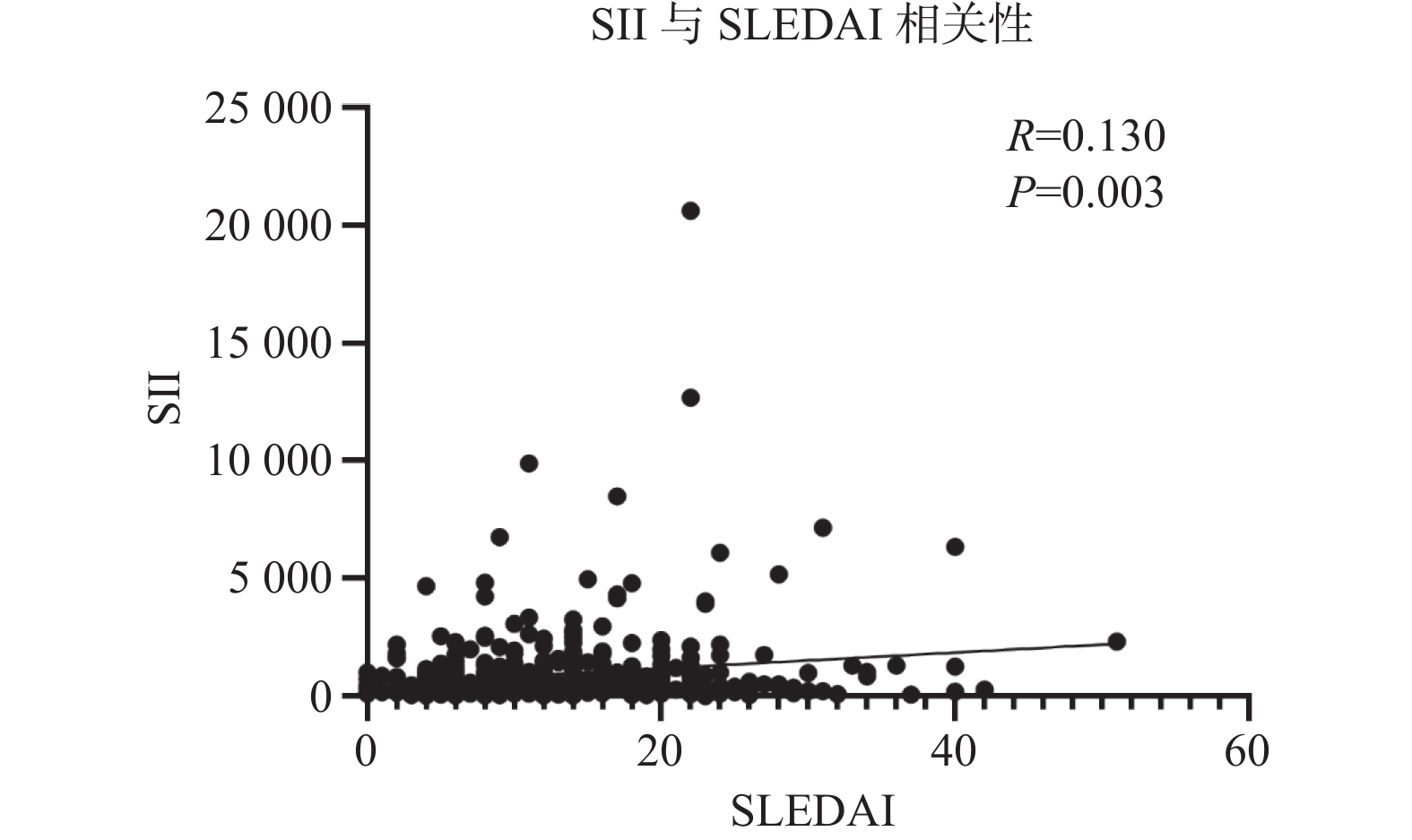
经Spearman 相关分析结果显示 SLE 患者SII值与 SLEDAI 评分呈正相关关系(r 为 0.132,95%CI0.042~0.219,P = 0.003),见图1。
2.4 利用SII预测SLE是否活动的ROC曲线
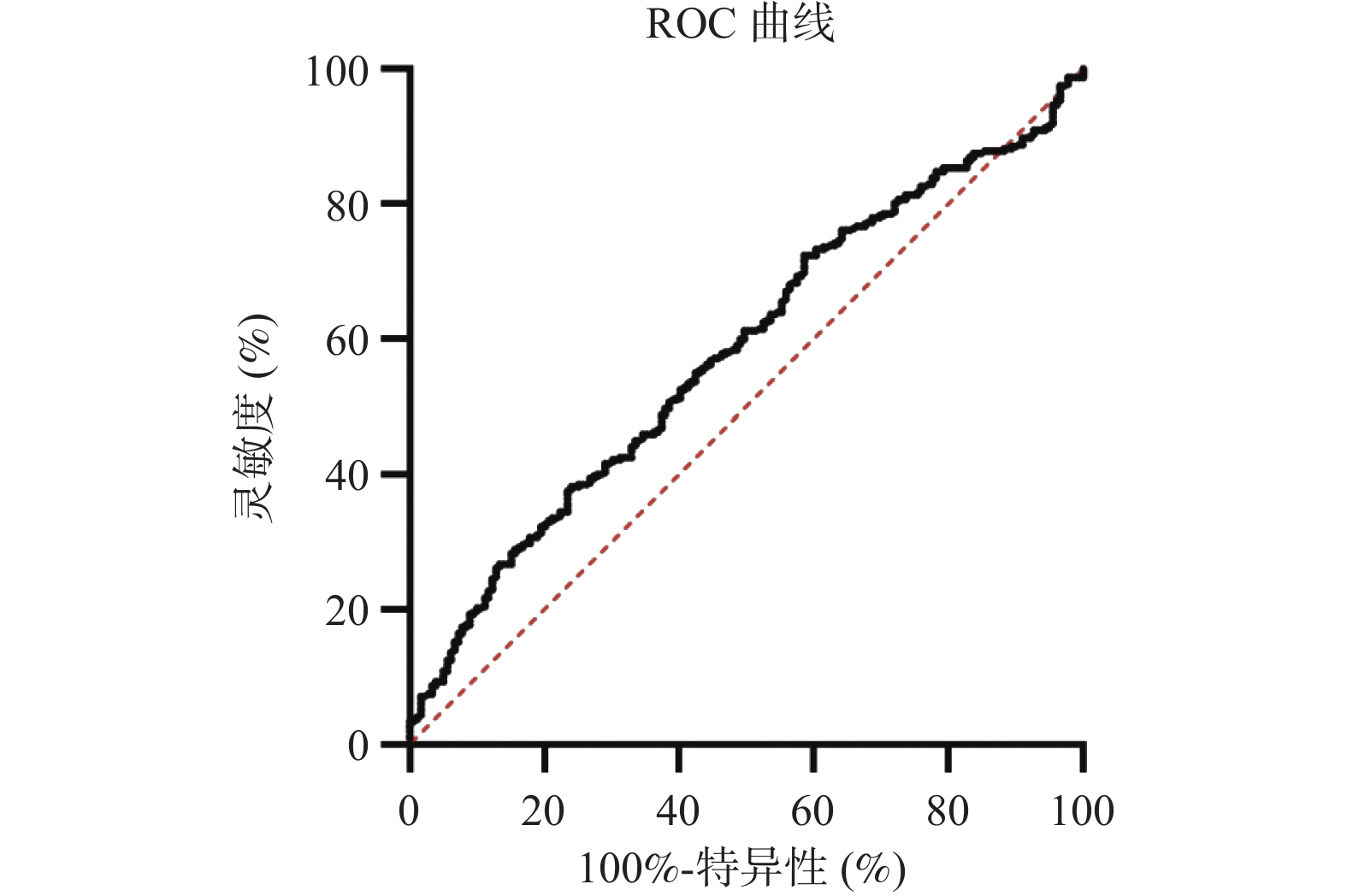
ROC曲线结果显示,利用SII预测SLE患者是否为无活动或活动(SLEDAI评分 ≤ 8分为无活动, SLEDAI评分>8分为疾病活动),ROC曲线下面积为0.581(95%CI 0.530~0.632,P = 0.003),最佳截断值为821.4,敏感性为38.2%,特异性为76.00%,见表2、图2。
表 2 SII值对SLE疾病活动度的预测价值Table 2. Predictive value of SII for the disease activity of SLE指标 Cut-Off 灵敏度(%) 特异性(%) 曲线下
面积95%CI P SII 821.4 38.2 76.00 0.581 0.530~0.632 0.003 3. 讨论
3.1 SLE的疾病特点和评估方法
众所周知,SLE的自身抗体及炎症介质诱导了疾病的发生和发展,其发病机制尚不完全明确,可能与遗传、环境、内分泌等多种因素有关[11],目前研究已经发现其复杂的免疫状态改变,既有致病性抗体的过度活化[12],也有补体系统的丢失[13],中性粒细胞凋亡增多[14],调节性淋巴细胞的减少[15],抗血小板抗体的生成等,表现出自身免疫稳态丧失,这种改变与SLE疾病的进程密切相关,免疫调节治疗是目前SLE治疗的主要手段,早期治疗可以显著减缓器官功能损害[16],但随之而来的药物副作用(例如感染、代谢紊乱等)也增加了患者的身体及经济负担,如何准确且快速的评估病情,为个性化精准治疗提供支持是目前研究的热点。SLEDAI-2000作为目前应用最广泛的SLE疾病活动评估工具,涵盖了临床表现、检验指标、影像学指标等24个评分项目,对于SLE的疾病评估准确性较好,但同时,其繁琐的评估步骤,较多的检查项目,降低了临床医师诊治和评估的效率,之前的研究显示利用中性粒细胞/血小板比值[17]、血小板/淋巴细胞比值[18] 等相关比值指标均可有效的评估SLE的病情,可能是快速评估SLE疾病活动度的潜在方法。
3.2 SII在SLE患者评价中的应用价值
SII作为一个简便快速的评估指标,越来越受到研究者的关注,它整合了炎症免疫的发动者(中性粒细胞、淋巴细胞)和受害者(血小板)的相关关系。在SLE患者中,中性粒细胞体现了关键炎症介质如趋化因子和细胞因子[19] 的过表达,淋巴细胞体现了信号分子表达的上调[20]、对抑制信号反应的钝化[21],而血小板则受到抗血小板抗体和抗心磷脂抗体的负面影响[22],三者的调控失衡是SLE疾病进展的显著特点。SII具备评估简单,可重复性强,费用低廉的特点,在其他多种疾病中的应用价值已经获得了肯定,但目前尚无研究针对SLE患者的SII研究。本研究结果显示,SII在SLE疾病轻度活动和重度活动的患者中具有明显的差异,这种差异侧面表现了免疫炎症在SLE疾病活动中的贡献,但SLE作为一个多系统受累的疾病,包括肾脏、关节、呼吸等多脏器的损害,SII并不能较为完整的概括其疾病特点,所以本研究的相关性分析及ROC结果不够理想,未来可联合更多系统的指标如尿素氮/白蛋白比等指标,进行大样本、多中心的研究,有望找到更加快速、准确评价SLE疾病活动度的指标。
-
表 1 按疾病活动度分组SLE患者一般资料和SII值的比较
Table 1. Comparison of general information and SII values among SLE patients grouped by disease activity
项目 SLE疾病活动度分组 $ {\chi }^{2} $/F P 轻度活动组 中度活动组 重度活动组 例数[n(%)] 134(26.74) 166(33.13) 201(40.11) − − 性别(男/女) 11/123 16/150 20/181 0.306 0.858 年龄(岁) 35(25.75,45.00) 34(26.00,47.00) 32(24.00,44.51) 2.731 0.255 WBC(×109/L) 4.96(3.79,6.34) 4.87(3.69,7.39) 4.82(3.17,7.19) 1.088 0.580 N(×109/L) 3.14(2.32,4.23) 3.20(2.22,5.29) 3.46(1.88,5.41) 1.835 0.400 L(×109/L) 1.31(0.91,1.77) 1.10(0.77,1.54) 0.89(0.56,1.32) 37.602 < 0.001* PLT(×109/L) 202.50(149.00,248.00) 182.00(138.25,258.50) 177.00(121.50,226.50) 9.598 0.008* SLEDAI 4.00(2.00,6.00) 10.00(8.00,12.00) 18.00(15.00,22.00) 441.34 < 0.001* SII 468.54(252.48,808.33) 578.11(300.34, 1027.66 )616.07(326.68, 1203.04 )9.569 0.008* *P < 0.05。 表 2 SII值对SLE疾病活动度的预测价值
Table 2. Predictive value of SII for the disease activity of SLE
指标 Cut-Off 灵敏度(%) 特异性(%) 曲线下
面积95%CI P SII 821.4 38.2 76.00 0.581 0.530~0.632 0.003 -
[1] Li B, Yue Y, Dong C, et al. Blockade of macrophage autophagy ameliorates activated lymphocytes-derived DNA induced murine lupus possibly via inhibition of proinflammatory cytokine production[J]. Clinical and experimental rheumatology,2014,32(5):705-714. [2] Zhao H, Wen Z, Xiong S. Activated Lymphocyte-Derived DNA Drives Glucose Metabolic Adaptation for Inducing Macrophage Inflammatory Response in Systemic Lupus Erythematosus[J]. Cells,2023,12(16):2093. [3] Li M,Wang Y,Zhao J,et al. Chinese SLE treatment and research group (CSTAR) registry 2009-2019: Major clinical characteristics of chinese patients with systemic lupus erythematosus[J]. Rheumatology and Immunology Research,2021,2(1):43-47. doi: 10.2478/rir-2021-0001 [4] 2020 Chinese guidelines for the diagnosis and treatment of systemic lupus erythematosus] [J]. Zhong Hua Nei Ke Za Zhi,2020,59(3): 172-185. [5] Gladman D D,Ibañez D,Urowitz M B. Systemic lupus erythematosus disease activity index 2000[J]. The Journal of Rheumatology,2002,29(2):288-291. [6] Hu B,Yang X R,Xu Y,et al. Systemic immune-inflammation index predicts prognosis of patients after curative resection for hepatocellular carcinoma [J]. Clinical Cancer Research : An Official Journal of the American Association for Cancer Research,2014,20(23): 6212-6222. [7] 周先岭,江伟,张季,等. 脑梗死后肺部感染全身免疫炎症指数和外周血NLR与RDW及PLR水平及其预后评价[J]. 中华医院感染学杂志,2024(8):1173-1177. [8] 揭伟,刘微波,刘莎,等. 蛛网膜下腔出血患者外周血NLR、LMR、PLR和SII值变化的临床意义[J]. 脑与神经疾病杂志,2024,32(6):345-349. [9] 高苑苑,刘传,董卫国. 全身免疫炎症指数与溃疡性结肠炎疾病活动度的相关性研究[J]. 临床内科杂志,2024,41(4):254-258. [10] Hochberg M C. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis and Rheumatism,1997,40(9):1725. [11] Carroll M. Innate immunity in the etiopathology of autoimmunity[J]. Nature immunology,2001,2(12):1089-1090. [12] Kim J, Gross J A, Dillon S R, et al. Increased BCMA expression in lupus marks activated B cells, and BCMA receptor engagement enhances the response to TLR9 stimulation[J]. Autoimmunity,2011,44(2):69-81. [13] 王景鸿,潘璐,卢冰如,等. 补体C3、C4及CRP、ESR与系统性红斑狼疮疾病活动度的相关性分析[J]. 国际检验医学杂志,2024,45(11):1327-1330,1337. doi: 10.3969/j.issn.1673-4130.2024.11.010 [14] Midgley A,Mclaren Z,Moots R J,et al. The role of neutrophil apoptosis in juvenile-onset systemic lupus erythematosus[J]. Arthritis and Rheumatism,2009,60(8):2390-2401. doi: 10.1002/art.24634 [15] 陈恬,倪晓薇,刘万莉,等. 系统性红斑狼疮患者血小板减少与淋巴细胞亚群、调节性T细胞及其细胞因子的相关性分析[J]. 免疫学杂志,2023,39(8):722-728. [16] Rua-figueroa Fernández de Larrinoa Í,Lozano M J C,Fernández-cid C M,et al. Preventing organ damage in systemic lupus erythematosus: The impact of early biological treatment[J]. Expert Opinion on Biological Therapy,2022,22(7):821-829. doi: 10.1080/14712598.2022.2096406 [17] 马立花,王湘宇,杨一帆,等. 536例系统性红斑狼疮患者中性粒细胞/淋巴细胞比值与疾病活动度的关联性分析[J]. 昆明医科大学学报,2022,43(2):78-81. [18] 古彦琴. PLR与SLE疾病活动度及其肾脏损害的相关性研究 [D]. 乌鲁木齐:新疆医科大学,2023. [19] Jog N R,Wagner C A,Aberle T,et al. Neutrophils isolated from systemic lupus erythematosus patients exhibit a distinct functional phenotype[J]. Frontiers in Immunology,2024,15:1339250. doi: 10.3389/fimmu.2024.1339250 [20] Becker L V,Da Silva Pereira Saccol R,Morsch V M,et al. Activity and expression of E-NTPDase is altered in peripheral lymphocytes of systemic lupus erythematosus patients[J]. Clinica Chimica Acta; International Journal of Clinical Chemistry,2019,488:90-97. doi: 10.1016/j.cca.2018.10.032 [21] Salata M,Golbus J,Richardson B C. Diminished response to an inhibitory signal in lymphocytes from patients with systemic lupus erythematosus[J]. Clinical and Experimental Immunology,1988,71(3):439-444. [22] Melki I,Allaeys I,Tessandier N,et al. Platelets release mitochondrial antigens in systemic lupus erythematosus [J]. Science Translational Medicine,2021,13(581):5928 -






 下载:
下载:
 下载:
下载:

