Metformin Protects Type II Diabetic Kidneys by Regulating PARP-1 Activity
-
摘要:
目的 研究二甲双胍通过调控多聚(ADP-核糖)聚合酶1(PARP-1)的活性,对2型糖尿病肾脏的保护作用及其机制。 方法 Wistar大鼠分为正常组(n = 12),DN组(n = 12),DN+DPQ组(n = 12),DN+二甲双胍组(n = 12)以及DN+二甲双胍+DPQ组(n = 12)。建模后检测各组大鼠空腹血糖含量,尿素氮含量,肌酐含量以及尿蛋白浓度等生化指标,HE染色和TUNEL染色观察肾脏病理情况,Western blot 检测PARP-1,iNOS,NF-κB及caspase-3的蛋白表达,ELISA检测炎性因子TNF-α及IL-1β的表达,免疫组化测定3-硝基酪氨酸(3-nitrotyrosine,3-NT)的表达。 结果 (1)3组治疗组大鼠的各项生化指标相较于DN组均有下降,其中DN + 二甲双胍 + DPQ组大鼠生化指标改变最为明显(P < 0. 01);(2)3组治疗组大鼠PARP-1的表达较于DN组下降,其中DN + 二甲双胍 + DPQ组的表达下降最为明显( P < 0.05);(3)3组治疗组大鼠肾脏组织的病理变化及肾脏细胞的凋亡较于DN组减缓,其中DN + 二甲双胍 + DPQ组的改善最为明显;(4)3组治疗组大鼠炎性因子的表达以及NF-kB,iNOS及3-NT的表达较于DN组下降,其中DN + 二甲双胍 + DPQ组的表达下降最为明显( P < 0.05)。 结论 二甲双胍通过调控PARP-1的表达,下调DN模型中NF-kB的表达,抑制NF-kB/iNOS/NO通路,抑制氧化损伤,减轻炎症反应,从而起到在糖尿病导致的高糖环境下,对肾脏的保护作用。 Abstract:Objective To investigate the protective effect of metformin on the kidney in type II diabetes mellitus (T2DM) by regulating the activity of poly (ADP-ribose) polymerase 1 (PARP-1) and investigate the mechanism of this effect. Methods Wistar rats were divided into normal group (n = 12), DN group (n = 12), DN + DPQ group (n = 12), DN + metformin group (n = 12) and DN + metformin + DPQ group (n = 12). After model establishment, biochemical parameters such as fasting glucose content, urea nitrogen content, creatinine content, and urine protein concentration were measured in each group of rats.HE staining and TUNEL staining were used to observe the renal pathology, Western blot was applied to detect the protein expression of PARP-1, iNOS, NF-κB and caspase-3.The expression of inflammatory factors TNF-α and IL-1β was detected by ELISA, and the expression of 3-nitrotyrosine (3-NT)was determined by immunohistochemistry. Results (1)The biochemical indexes of rats in the three treatment groups decreased compared with those in the DN group, with the most obvious changes in the DN + metformin + DPQ group (P < 0.01) ; (2) The expression of PARP-1 in rats in the three treatment groups decreased compared to the DN group, with the most significant decrease in the DN + metformin + DPQ group ( P < 0.05); (3) The pathological changes of kidney tissue and apoptosis of kidney cells in the three treatment groups were alleviatedcompared with the DN group, with the most significant decrease in the expression of DN + metformin + DPQ group; (4) The expression of inflammatory factors as well as the expression of NF-kB, iNOS and 3-NT decreased in the three treatment groups compared with the DN group, with the most significant decrease in the DN + metformin + DPQ group ( P < 0.05). Conclusion Metformin plays a role in protecting the kidney under the high glucose environment caused by diabetes through regulating the expression of PARP-1, down-regulating the expression of NF-kB in the DN model, inhibiting NF-kB/iNOS/NO pathway, inhibiting oxidative damage, and reducing inflammation. -
Key words:
- Diabetic nephropathy /
- Metformin /
- PARP-1 /
- Oxidative stress
-
2型糖尿病(type 2 diabetes mellitus,T2DM)是以胰岛素分泌缺陷,胰岛素功能受损为特征的代谢性疾病[1]。糖尿病肾病(diabetes nephropathy,DN)是糖尿病最常见的并发症之一[2]。据调查表明,约25%的糖尿病患者在诊断为2型糖尿病10年后,会发展成为糖尿病肾病[3]。二甲双胍通过抑制糖异生降低空腹血糖,缓解糖尿病及其并发症[4]。但二甲双胍缓解糖尿病肾病的机制还亟须明确。多聚(ADP-核糖)聚合酶1(ADP-ribose polymerase 1,PARP-1)参与糖尿病及其并发症的发生与发展[5-7]。有研究表明,二甲双胍能够抑制PARP-1的表达,改善心肌梗死大鼠心室重构[8]。本文主要研究目的是通过研究二甲双胍对PARP-1的表达调控,探讨二甲双胍对2型糖尿病肾脏的保护作用及其机制。
1. 材料与方法
1.1 动物
清洁级Wistar大鼠[体重(228.9±0.5) g]购于昆明医科大学动物实验中心(许可证号:1107271911000520)。动物饲养室的室温(22±1) ℃,相对湿度55%~65%,自由摄食饮水,适应性饲养一周后开始实验。
1.2 药品与试剂
二甲双胍、链脲左霉素(streptozocin,STZ)购自美国sigma公司,一抗Caspase-3抗体,PARP-1抗体,iNOS抗体,β-actin抗体购自美国abcam公司,NF-kB p65抗体,p-P65抗体,以及通用二抗购自美国CST公司;NT小鼠抗大鼠单克隆抗体购自美国Santa Cruz biotechnolog公司,ELISA试剂盒购自美国R&D公司,BCA试剂盒购于碧云天。
1.3 模型制备
大鼠随机分为对照组和DN模型组。对照组(12只):大鼠腹腔注射氯氨酮 70 mg/kg 麻醉后从右背部入口分离右肾,不做任何处理,关闭切口。术后1周予标准饲料。标准饲料喂养大鼠4周后,一次性腹部注射等量生理盐水;DN模型组(48只)[9]:大鼠腹腔注射氯氨酮 70 mg/kg 麻醉后行右肾切除术,术后1周予高脂饲料。高脂饲料喂养4周后,一次性腹部注射65 mg/kg STZ(溶于0.1 mmol/L柠檬酸缓冲液,pH = 4.5)。注射STZ 72 h后,心脏采血,用血糖仪测定血糖(BG),全自动仪检测血肌酐(Cr)。判断标准:(1)BG≥16.7 mmol/L伴胰岛素敏感性下降;(2)糖尿病肾病早期肾脏肥大,肌酐清除率(Ccr)增加或出现微量白蛋白尿。建模成功后一周,将DN模型组随机分为四组治疗组:DN组,DN + DPQ组,DN + 二甲双胍组以及DN + 二甲双胍 + DPQ组。DN组(12只):等量二甲亚砜腹部注射给药。DN+DPQ组(12只):10 m/kg DPQ溶解于100 μL二甲亚砜中腹部注射给药。DN+二甲双胍组(12只):200 mg/kg 二甲双胍腹部注射给药。DN + 二甲双胍 + DPQ组(12只):200 mg/kg 二甲双胍+10 mg/kg DPQ腹部注射给药。各组按计量每日给药1次,持续28 d。末次给药24 h后代谢笼收集尿液,离心(2 000 r/min,10 min)后取上清检测尿蛋白含量。大鼠脱颈致死后摘除肾脏,-80 ℃,保存。摘眼球取血及肝脏检测各项指标。部分肾组织固定脱水后,制成4 μm厚度的切片,供后续实验使用。
1.4 HE染色和TUNEL染色观察肾脏病理情况
切片经二甲苯脱蜡并水化后,一部分行HE染色。使用苏木精染色5 min,分别浸入酸水及氨水中分色5 min,流水冲洗1 h,待冲掉染色剂后置于蒸馏水片刻,依次浸入70%,90%酒精中各10 min,予以酒精伊红染色液染色2 min。一部分行TUNEL染色,阳性细胞现棕色,正常细胞现蓝色。
1.5 Western blot 检测蛋白含量
取适量肾脏组织加入组织裂解液提取总蛋白,根据试剂盒说明使用BCA试剂盒测定蛋白浓度,蛋白变性后转膜至PVDF膜,脱脂奶粉室温封闭后,加入一抗Caspase-3抗体(1∶
1000 ,ab49822),PARP-1抗体(1∶500,ab227244),iNOS抗体(1∶250,ab15323),NF-kB p65抗体(1∶1000 ,8242 ),p-P65抗体(1∶1000 ,3033 )4 ℃过夜,后加入二抗(1∶2 000,ab205719)室温下孵育2 h。ECL法显影,β-actin(abcam,8226)为内参,目的蛋白与β-actin蛋白灰度比为相对蛋白含量。1.6 免疫组化检测3-NT表达
切片脱蜡水化后加入3-NT一抗(1∶100,ab191308)在4 ℃下染色过夜,然后用适当的二级抗体在37 ℃下染色30 min。然后,盖玻片用Prolong Gold抗褪色试剂与DAPI(invitrogen,carlsbad,CA)密封。PBS代替一抗做参照,DBA显色,用激光扫描共聚焦显微镜(LSM710,Carl Zeiss,德国)采集图像,用Image-Pro Plus 6.0进行分析。
1.7 Elisa测定TNF-α及IL-1β浓度
取适量大鼠肾脏组织,采用酶联免疫吸附法(ELISA)检测中TNF-α及IL-1β的浓度。将组织充分研磨制成组织匀浆,4 ℃,2 000 r/min离心15 min,取上清液根据ELISA试剂盒的说明进行检测。
1.8 统计学处理
通过Graph-Pad Prism 5.0 软件(GraphPad Software,San Diego,CA)进行Kolmogorov-Smirnov D检验数据的正态性。正态分布的连续性变量均以平均数±标准差(mean ± SD)表示,并通过Graph-Pad Prism 5.0 软件进行统计分析。组间比较采用单因素方差分析,如有差异进一步用t检测两两比较,P < 0.05为差异有统计学意义。
2. 结果
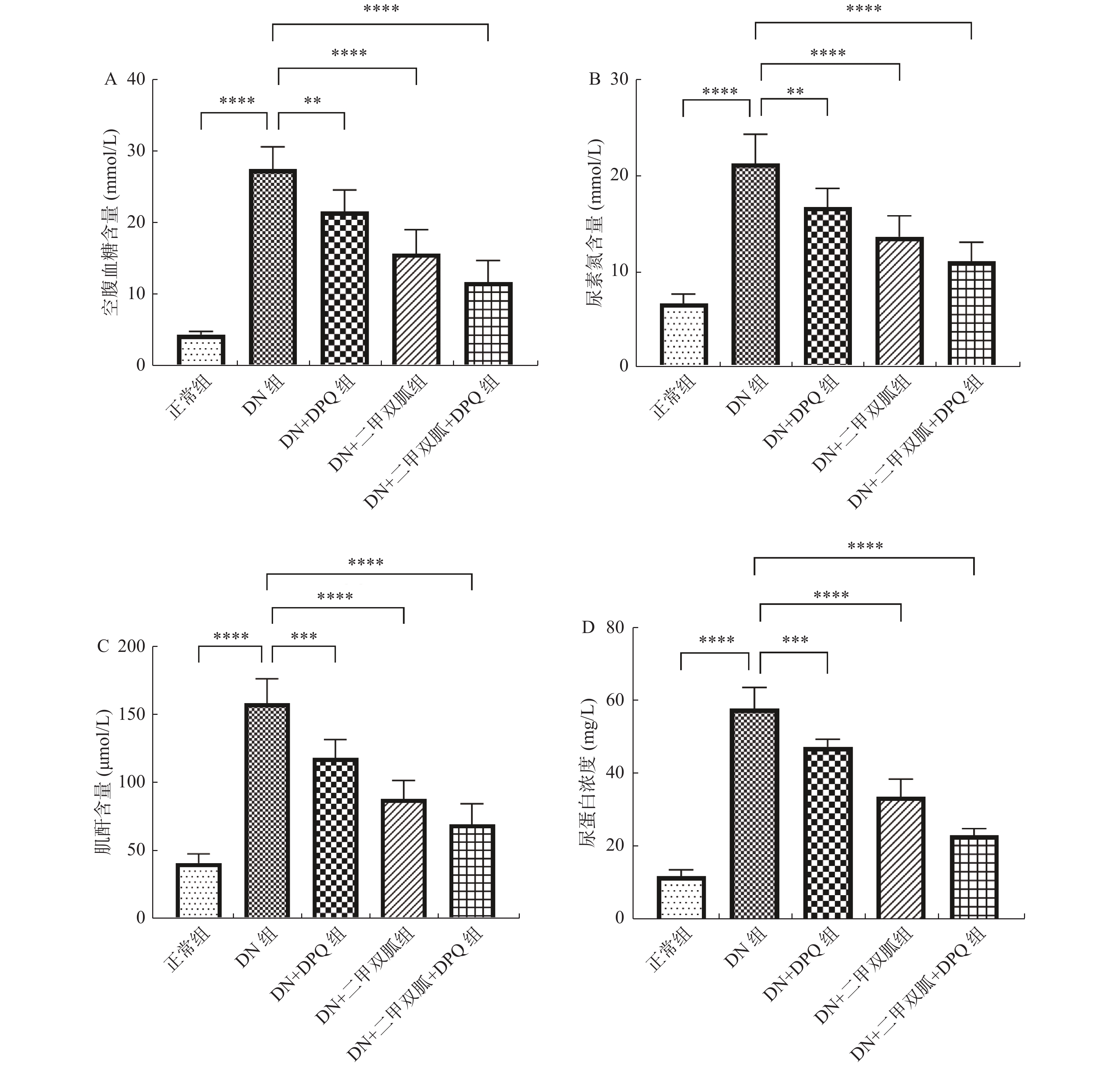
2.1 各组大鼠生化指标
与正常组相比,DN组大鼠空腹血糖含量,尿素氮含量,肌酐含量以及尿蛋白浓度等各项生化指标均有上升(P <
0.0001 )。DN + DPQ组,DN + 二甲双胍组以及DN + 二甲双胍 + DPQ组大鼠的各项生化指标相较于DN组均有下降,其中DN + 二甲双胍 + DPQ组大鼠生化指标改变最为明显(P < 0. 01),见 图1 A-D。2.2 各组大鼠PARP-1表达
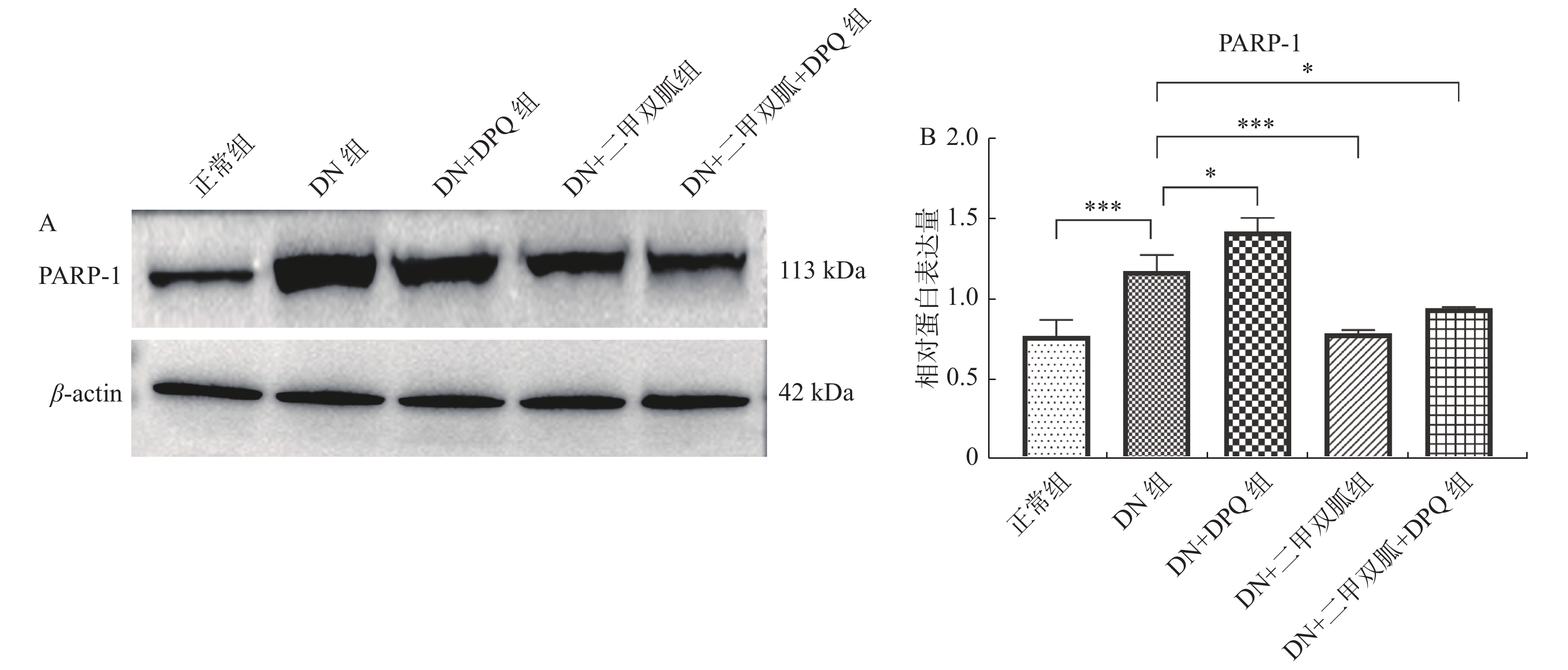
与正常组相比,DN组PARP-1的表达升高(P < 0.001),DN + DPQ组,DN + 二甲双胍组以及DN + 二甲双胍 + DPQ组PARP-1的表达与DN组相比下降,其中DN + 二甲双胍 + DPQ组的表达下降最为明显( P < 0.05),见 图2。
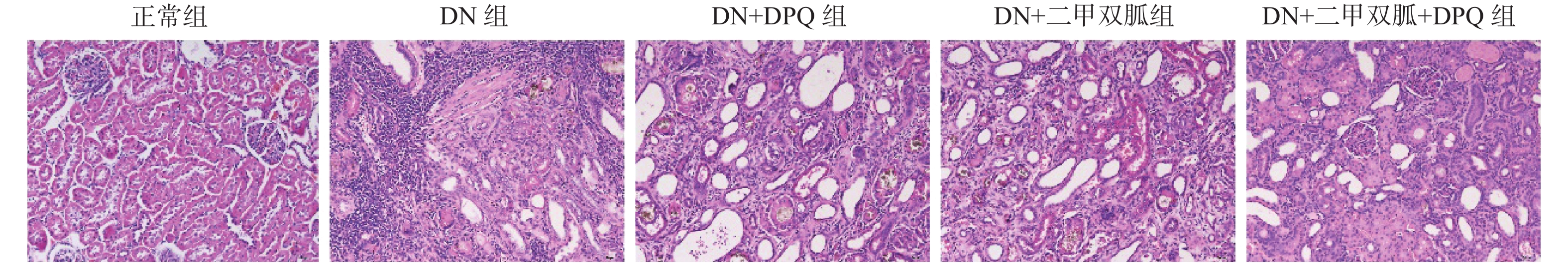
2.3 大鼠肾脏组织病理学
与正常组相比,DN组肾间质可见炎症细胞浸润,肾小球肥大增生,结构模糊,肾小球系膜增厚且出现肿胀,肾小管空泡变性。DN + DPQ组,DN + 二甲双胍组以及DN + 二甲双胍 + DPQ组大鼠肾间质均可见少量炎症细胞浸润,肾小球系膜增生及肾小管空泡变性与DN组相比减轻,其中DN + 二甲双胍 + DPQ组大鼠改善效果最为明显,见图3。
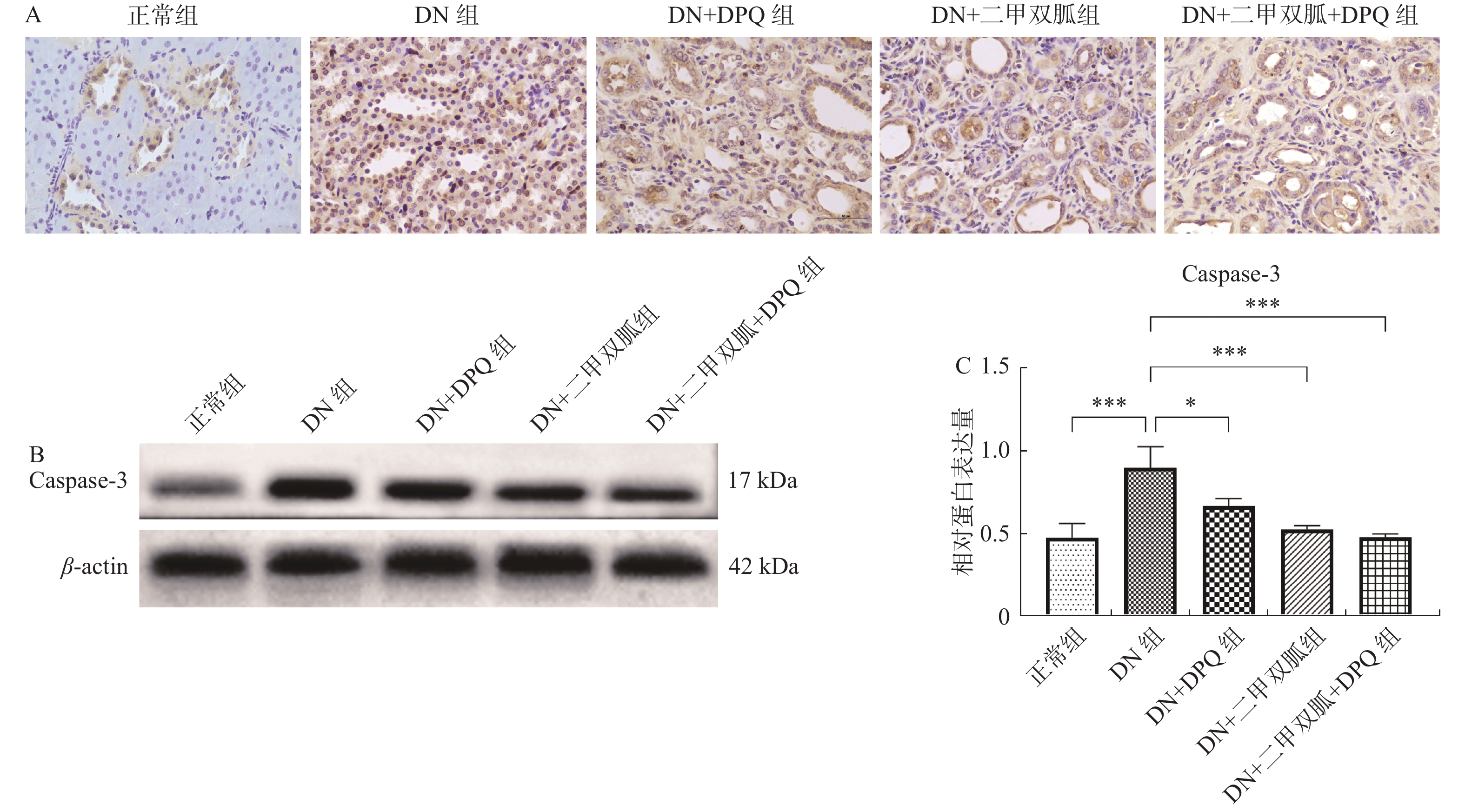
2.4 二甲双胍通过降低PARP-1表达减轻大鼠肾脏细胞凋亡
与正常组相比,DN组肾脏切片可见大量细胞凋亡,DN + DPQ组,DN + 二甲双胍组以及DN + 二甲双胍 + DPQ组的细胞凋亡与DN组相比减少,其中DN + 二甲双胍 + DPQ组的表达下降最为明显(图4A)。同时,与正常组相比,DN组Caspase-3的表达升高(P < 0.001),DN + DPQ组,DN + 二甲双胍组以及DN + 二甲双胍 + DPQ组Caspase-3的表达与DN组相比下降,其中DN + 二甲双胍 + DPQ组的表达下降最为明显( P < 0.05),见 图4B。
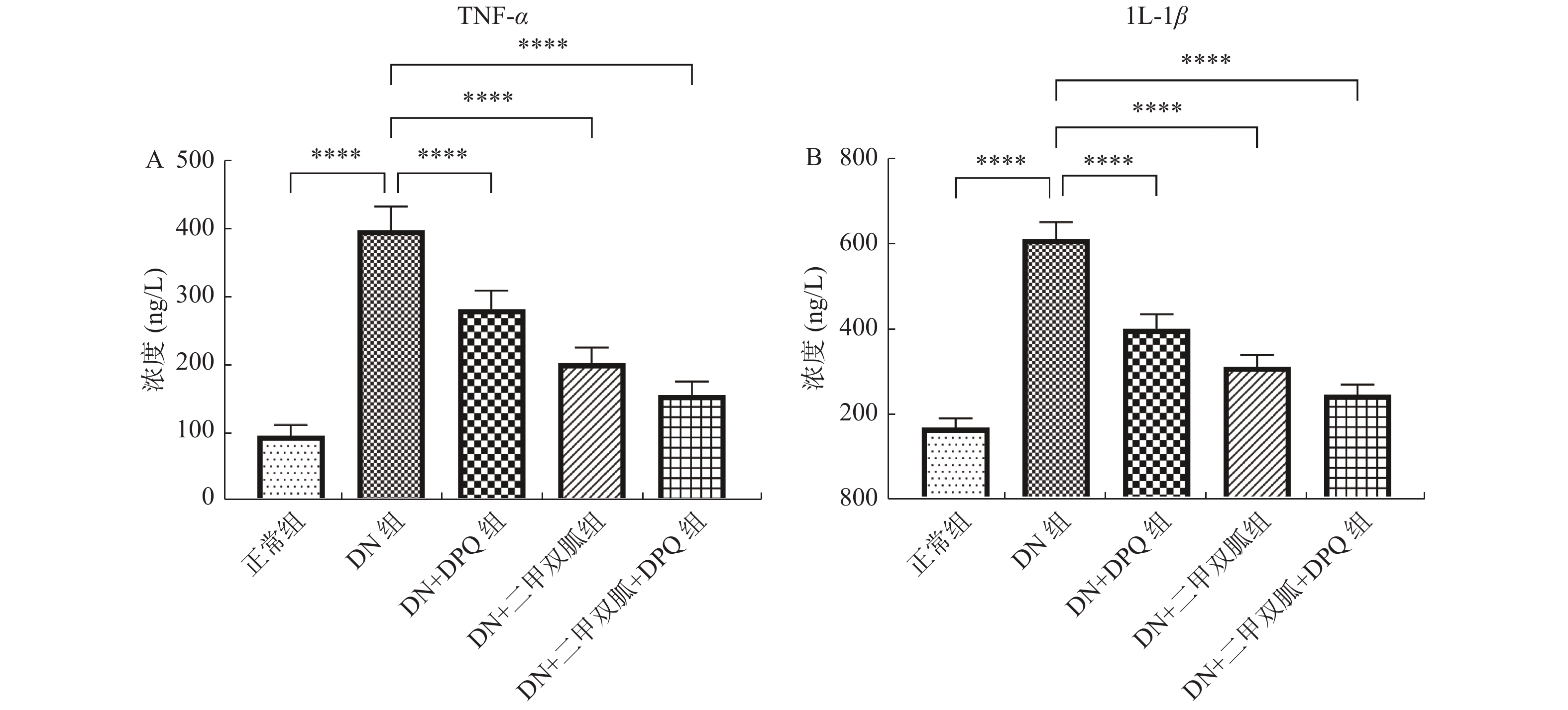
2.5 二甲双胍通过降低PARP-1表达降低TNF-α及IL-1β的表达
与正常组相比,DN组TNF-α及IL-1β的表达升高(P <
0.0001 ),DN + DPQ组,DN + 二甲双胍组以及DN + 二甲双胍 + DPQ组TNF-α及IL-1β的表达与DN组相比下降,其中DN + 二甲双胍 + DPQ组TNF-α及IL-1β的表达下降最为明显(P <0.0001 ),见图5。2.6 二甲双胍通过降低PARP-1表达降低NF-κB的表达
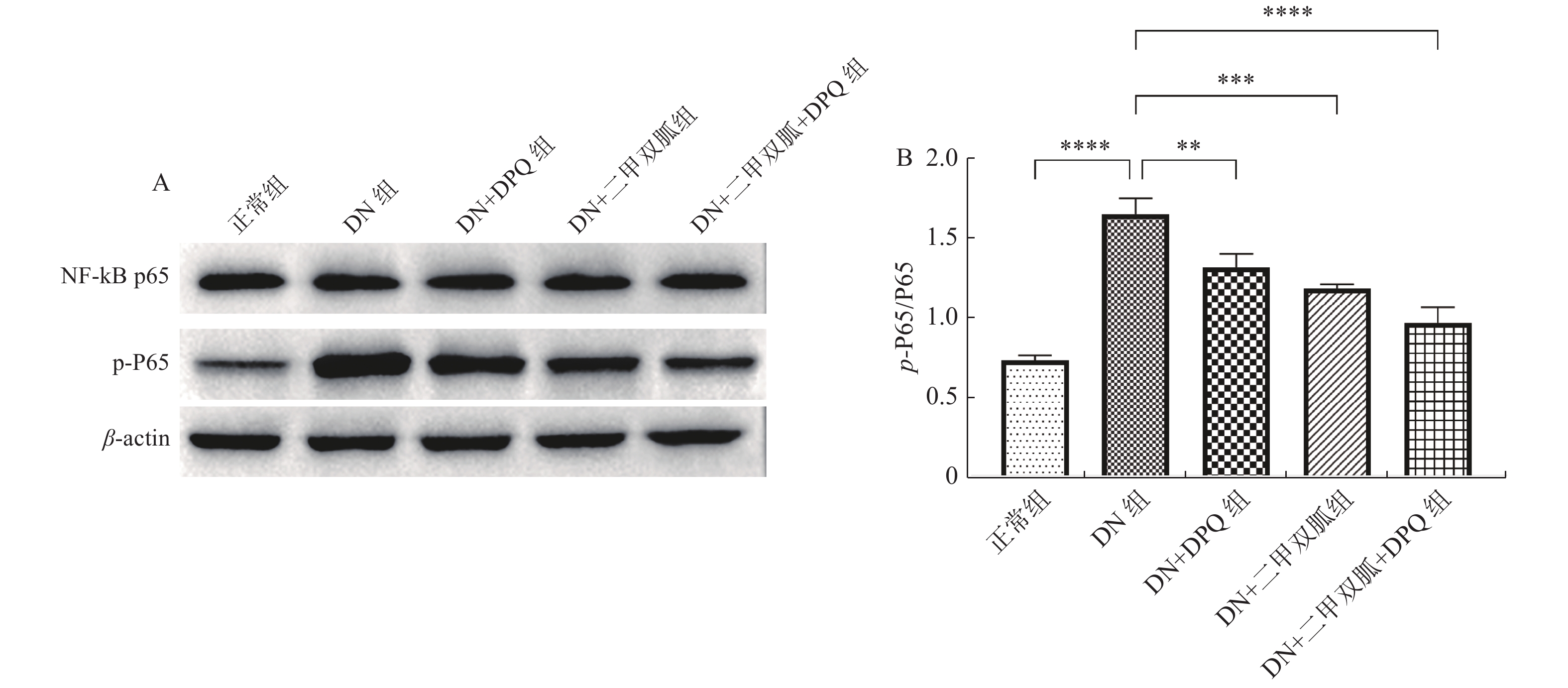
与正常组相比,DN组NF-κB的表达升高(P <
0.0001 ),DN + DPQ组,DN + 二甲双胍组以及DN + 二甲双胍 + DPQ组NF-κB的表达与DN组相比下降,其中DN + 二甲双胍 + DPQ组NF-κB的表达下降最为明显(P < 0.01),见 图6。2.7 二甲双胍通过降低PARP-1表达降低iNOS的活性
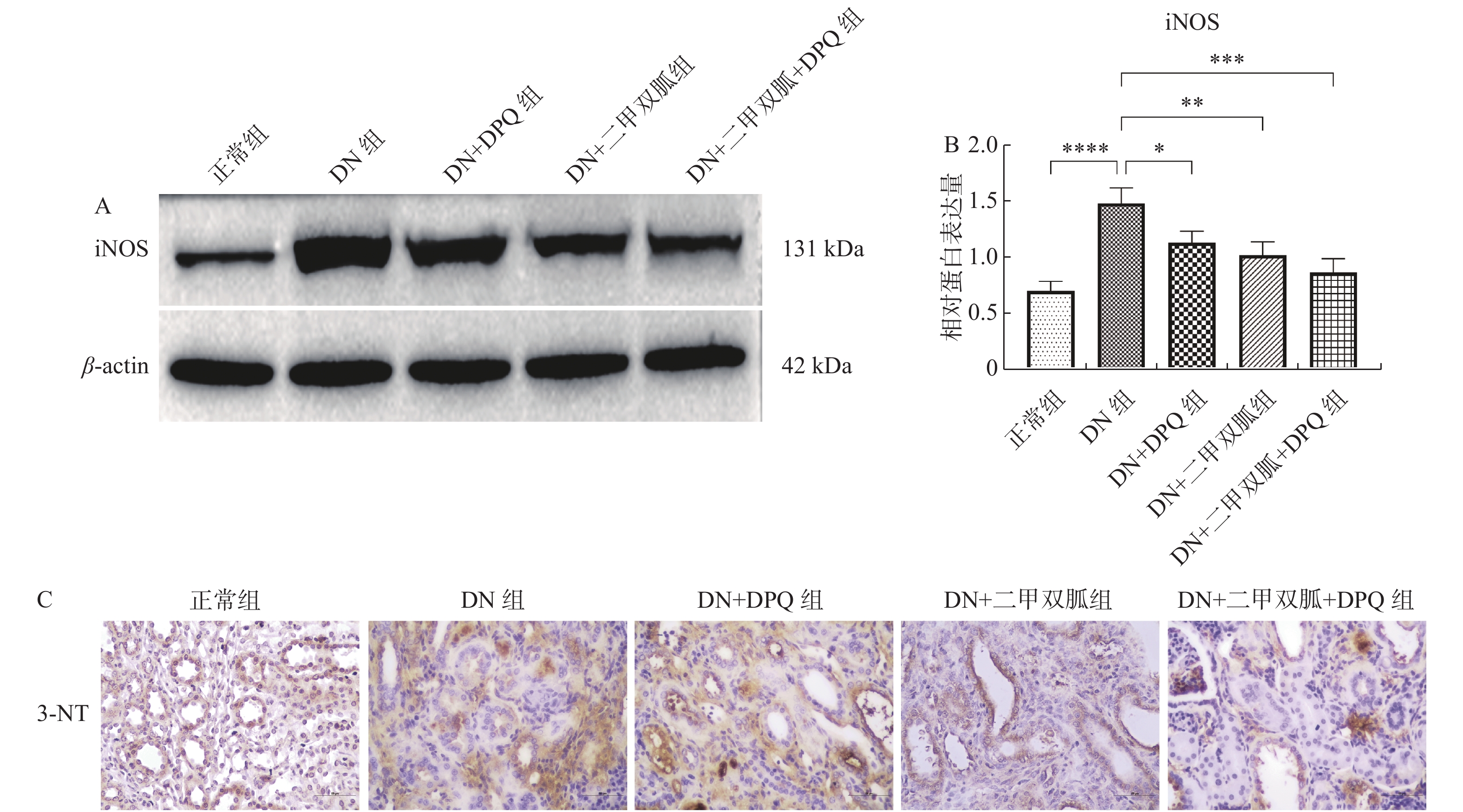
与正常组相比,DN组iNOS的表达升高(P <
0.0001 ),DN + DPQ组,DN + 二甲双胍组以及DN + 二甲双胍 + DPQ组iNOS的表达与DN组相比下降,其中DN + 二甲双胍 + DPQ组的表达下降最为明显(P < 0.05),见 图7A。同时,与正常组相比,3-硝基酪氨酸(3-nitrotyrosine,3-NT)在DN组的表达升高,且集中在肾小管,DN + DPQ组,DN + 二甲双胍组以及DN + 二甲双胍 + DPQ组3-NT的表达与DN组相比下降,其中DN + 二甲双胍 + DPQ组的表达下降最为明显,见图7B。3. 讨论
糖尿病肾病(diabetes nephropathy,DN),又称糖尿病肾小球硬化症,是糖尿病患者最主要的并发症之一,其主要特征是在高糖环境下微血管病变导致的肾小球硬化和肾功能缺失,在临床上表现为尿蛋白异常,最后发展为肾脏坏死[10-13]。脂肪酸代谢障碍是糖尿病及其并发症的原发病理生理改变,其中游离脂肪酸(free fatty acid,FFA)增高是脂代谢紊乱的特征之一[14]。有研究证明,在糖尿病肾病中,脂毒性是进展性肾小管间质损伤的重要病理机制之一,而FFA会导致严重的小管间质炎症和肾小管上皮细胞的凋亡等[15]。而肾小管上皮细胞的凋亡增多可导致慢性肾脏损伤和肾纤维化,加速糖尿病肾病的病理变化[16]。作为2型糖尿病的一线口服药,二甲双胍能够降低糖异生,减少肠道对葡萄糖的吸收并增加外周组织对胰岛素的敏感性[17]。其主要的降糖机制为增加周围组织对糖的无氧酵解,对肝糖原异生的抑制,改善周围组织对胰岛素抵抗,并控制葡萄糖在肠道内的吸收,提高胰岛素的降糖作用[9]。有研究证明[9],二甲双胍可减轻肾小球系膜扩张,降低尿蛋白含量,减少糖尿病诱导的尿中8-羟基脱氧鸟苷(8-Hydroydeoyguanosine,8-OhdG)水平。另有文献表明,二甲双胍以剂量依赖性降低肾组织中的血红素加氧酶-1(hemeoxygenase-1,HO-1),肿瘤坏死因子-α(tumor necrosis factor α,TNF-α),白介素-6(Interleukin-6,IL-6)mRNA 的表达水平,表明二甲双胍可通过降低肾脏氧化应激,炎症,纤维化水平等机制发挥肾脏保护作用[18, 19]。但二甲双胍对糖尿病肾病的治疗机制尚未明确。本文探究二甲双胍通过调控PARP-1的表达,抑制NF-kB/iNOS/NO通路的活性,抑制氧化损伤,减轻炎症反应,从而起到在糖尿病导致的高糖环境下,对肾脏的保护作用及其对应的机制。
二甲双胍能激活AMP依赖的蛋白激酶(AMPK)及其下游介质,其中包括多聚(ADP-核糖)聚合酶1(poly(ADP—ribose)polymerase,PARP-1)[20-22]。PARP-1是一类催化聚ADP核糖化的核酶,具有修复DNA损伤、调控基因转录、促细胞分裂和维持染色质及基因组稳定等生理功能[23, 24]。作为DNA断裂传感器,PARP中的锌指蛋白结构能够识别DNA单链或双链断裂的缺口,从而启动PARP的催化活性[25]。在高糖环境下,细胞大量生成活性氧簇(ROS)和活性氮簇(RNS),造成DNA单链或双链断裂,从而激活PARP[23]。PARP-1过度活化会造成细胞坏死以及细胞凋亡[26]。当DNA双链受损严重时,PARP-1诱导的修复过程会消耗大量NAD,并造成细胞坏死。同时,PARP-1蛋白的主要的结构域之一核定位信号(NLS)片段是caspase蛋白的底物,caspase表达升高会造成PARP-1的裂解与功能丧失,最终导致DNA降解,发生细胞凋亡。[27-29]有研究报道PARP-1可能通过ERK通路以及JNK通路参与细胞凋亡[30]。我们的实验结果同样证明,与正常鼠相比,DN模型中PARP-1的表达升高,且肾脏细胞凋亡增多,加入二甲双胍能下调PARP-1 的表达,改善肾脏组织的病理变化,且减少肾脏细胞的凋亡,证明糖尿病高糖环境下造成的DNA损伤激活PARP-1,并导致大量肾脏细胞凋亡,而二甲双胍能抑制PARP-1的活性,改善肾脏组织的病理变化,减缓肾脏细胞的凋亡。
有研究证明,各种炎性因子的释放增加,如TNF-α,IL-1等,可促进炎性巨噬细胞的浸润,导致肾小球基底膜增厚,加速肾小球的硬化[13]。二甲双胍与PARP-1活性抑制剂DPQ均能降低DN模型大鼠中炎性因子TNF-α及IL-1β的高表达,且减轻肾间质可见炎症细胞浸润,且联合使用二甲双胍与PARP-1活性抑制剂DPQ对炎症的抑制效果最明显,说明二甲双胍通过抑制炎症发生对糖尿病肾脏起保护作用,且其机制对与PARP-1的表达调控有关。同时,二甲双胍与PARP-1活性抑制剂DPQ下调NF-κB在DN模型中的高表达。在真核细胞NF-κB蛋白是Rel蛋白家族的核转录因子,主要结构是二聚体,且以p65(RelA)/p50含量最多。作为参与调控多种蛋白调控的核转录因子,NF-κB能有效地诱导多种细胞因子(如IL-1,IL-6,IL-8,TNF 等)的基因表达。肾小球系膜细胞核内的NF-κBp65的表达明显上调,促进下游的炎性因子高表达,进一步使肾脏的炎症反应增强,从而促进了DN的发展[31-33]。
在高血糖的诱导下,机体发生氧化应激,体内高活性分子活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen specie,RNS)产生明显过剩,氧化系统和抗氧化系统失衡,从而导致组织损伤[34]。作为RNS的重要组成之一,一氧化氮(NO)由一氧化氮合酶(NOS)催化L-精氨酸生成。NOS有神经元型NOS(ncNOS)、内皮型NOS(ecNOS)和诱导型NOS(iNOS)三种异构体。在高糖环境下,超氧阴离子(O2-)抑制ecNOS并活化NF-κB刺激iNOS表达,iNOS催化合成大量的NO[34-35]。当O2-大量过剩,可触发DNA断裂,激活PARP-1[35-37]。同时,PARP-1可以与NF-κB结合,并参与调控含有NF-κB结合位点的诱生酶iNOS的活性。当RNS/ROS水平升高,蛋白质络氨酸发生硝基化损伤,并生成3-硝基络氨酸(3-nitrotyrosine,3-NT)[38]。实验结果证明,二甲双胍与PARP-1活性抑制剂DPQ均能降低DN模型大鼠中iNOS与3-NT的表达,且联合使用二甲双胍与PARP-1活性抑制剂DPQ效果最明显,说明二甲双胍通过调控PARP-1的表达,抑制氧化损伤。
综上,二甲双胍通过调控PARP-1的表达,下调DN模型中NF-kB的表达,抑制NF-kB/iNOS/NO通路,抑制氧化损伤,减轻炎症反应,从而起到在糖尿病导致的高糖环境下,对肾脏的保护作用。
-
-
[1] Li X,Li C,Li X,et al. Involvement of histone lysine methylation in p21 gene expression in rat kidney in vivo and rat mesangial cells in vitro under diabetic conditions[J]. J Diabetes Res,2016,2016(10):1-12. [2] 林善锬. 糖尿病肾病[J]. 中华内科杂志,2005,44(3):229-231. doi: 10.3760/j.issn:0578-1426.2005.03.028 [3] Rogacka D,Audzeyenka I,Rychowski M,et al. Metformin overcomes high glucose-induced insulin resistance of podocytes by pleiotropic effects on SIRT1 and AMPK[J]. Biochim Biophys Acta Mol Basis Dis,2017,1864(1):115-125. [4] Foretz M,Hébrard S,Leclerc J,et al. Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathway via a decrease in hepatic energy state[J]. J Clin Invest,2010,120(7):2355-2369. doi: 10.1172/JCI40671 [5] El-Bassossy,Hany M. PARP-1 inhibition alleviates diabetic cardiac complications in experimental animals[J]. Eur J Pharmacol,2016,791:444-454. doi: 10.1016/j.ejphar.2016.09.008 [6] Guzyk M M,Tykhomyrov A A,Nedzvetsky V S,et al. Poly (ADP-Ribose) polymerase-1 (PARP-1) inhibitors reduce reactive gliosis and improve angiostatin levels in retina of diabetic rats[J]. Neurochem Res,2016,41(10):2526-2537. [7] Waldman M,Nudelman V,Shainberg A,et al. PARP-1 inhibition protects the diabetic heart through activation of SIRT1-PGC-1α axis[J]. Experimental Cell Research,2018,373(1-2):112-118. doi: 10.1016/j.yexcr.2018.10.003 [8] 陈小兰,颜安华,郑道国. 二甲双胍通过调控PARP-1活性对心肌梗死大鼠模型发挥保护作用[J]. 中国药师,2019,22(8):1401-1406. doi: 10.3969/j.issn.1008-049X.2019.08.006 [9] Anisimov V N J A. Metformin for aging and cancer prevention[J]. Aging (Albang NY),2010,2(11):760-774. [10] 管鑫娟,姚伟峰. 糖尿病肾病[J]. 解放军医学院学报,2012,17(1):116-117. [11] 杨倩,关天俊. 糖尿病肾病的诊治进展[J]. 世界临床药物,2018,39(2):93-97. [12] 孙志强. 糖尿病肾病研究进展[J]. 中华实用诊断与治疗杂志,2010,24(6):539-541. [13] 张舒媛,王东超,李博,等. 糖尿病肾病研究进展[J]. 世界中医药,2015(10):1621-1625. doi: 10.3969/j.issn.1673-7202.2015.10.044 [14] Denhez B,Rousseau M,Spino C,et al. Saturated fatty acids induce insulin resistance in podocytes through inhibition of IRS1 via activation of both IKKβ and mTORC1[J]. Sci Rep,2020,10(1):21628. doi: 10.1038/s41598-020-78376-1 [15] Su Y,Chen Q,Ju Y,et al. Palmitate induces human glomerular mesangial cells fibrosis through CD36-mediated transient receptor potential canonical channel 6/nuclear factor of activated T cell 2 activation[J]. Biochim Biophys Acta Mol Cell Biol Lipids,2020,1865(12):158793. doi: 10.1016/j.bbalip.2020.158793 [16] Xu Y,Gao H,Hu Y,et al. High glucose-induced apoptosis and necroptosis in podocytes is regulated by UCHL1 via RIPK1/RIPK3 pathway[J]. Exp Cell Res,2019,382(2):111463. doi: 10.1016/j.yexcr.2019.06.008 [17] Alicic R Z, Rooney M T, Tuttle K R. Diabetic kidney disease: Challenges, progress, and possibilities[J]. Clin J Am Soc Nephrol,2017,12(12):2032-2045. doi: 10.2215/CJN.11491116 [18] Lee M J,Feliers D,Mariappan M M,et al. A role for AMP-activated protein kinase in diabetes-induced renal hypertrophy[J]. Am J Physiol Renal Physiol,2007,292(2):F617. [19] Satriano J,Mansoury H,Deng A,et al. Transition of kidney tubule cells to a senescent phenotype in early experimental diabetes[J]. Am J Physiol Cell Physiol,2010,299(2):C374. [20] Shang F,Zhang J,Li Z,et al. Cardiovascular Protective Effect of Metformin and Telmisartan:Reduction of PARP1 Activity via the AMPK-PARP1 Cascade[J]. PLos One,2016,11(3):e0151845. [21] 耿彦平 王,谷剑. 二甲双胍对急性心肌梗死后心肌梗死面积及心功能的影响[J]. 临床荟萃,2016,31(7):805-808. [22] 林芳芳 张,牛姗姗. 二甲双胍预防糖尿病合并心肌梗死患者再梗死的效果观察[J]. 实用糖尿病杂志,2018,14(3):39. [23] 赵丽,梁晓春. 多聚(ADP-核糖)聚合酶与糖尿病周围神经病变[J]. 医学研究杂志,2011,40(8):23-25. doi: 10.3969/j.issn.1673-548X.2011.08.008 [24] 凌亦凌 朱 赵. 多聚(ADP-核糖)聚合酶与细胞损伤[J]. 中国病理生理杂志,2002,18(1):104-107. doi: 10.3321/j.issn:1000-4718.2002.01.033 [25] Pacher P,Szabo C. Role of the Peroxynitrite-Poly(ADP-Ribose)Polymerase Pathway in Human Disease[J]. Am J Palhol,2008,173(1):2-13. [26] Liang E S,Bai W W,Wang H,et al. PARP-1(Poly[ADP-Ribose] Polymerase 1)Inhibition Protects From Ang Ⅱ(Angiotensin Ⅱ)-Induced Abdominal Aortic Aneurysm in Mice[J]. Hypertension,2018,72(5):1189-1199. doi: 10.1161/HYPERTENSIONAHA.118.11184 [27] Chen H,Liu J,Wang B,et al. Protective effect of lncRNA CRNDE on myocardial cell apoptosis in heart failure by regulating HMGB1 cytoplasm translocation through PARP-1[J]. Arch Pharm Res,2020,43(12):1325-1334. doi: 10.1007/s12272-020-01290-7 [28] Luo H,Liang H,Chen Y,et al. miR-7-5p overexpression suppresses cell proliferation and promotes apoptosis through inhibiting the ability of DNA damage repair of PARP-1 and BRCA1 in TK6 cells exposed to hydroquinone[J]. Chem Biol Interact,2018,283:84-90. doi: 10.1016/j.cbi.2018.01.019 [29] Nan L,Xie Q,Chen Z,et al. Involvement of PARP-1/AIF Signaling Pathway in Protective Effects of Gualou Guizhi Decoction Against Ischemia-Reperfusion Injury-Induced Apoptosis[J]. Neurochem Res,2020,45(2):278-294. doi: 10.1007/s11064-019-02912-3 [30] Chowdhury P,Dey P,Ghosh S,et al. Reduction of metastatic potential by inhibiting EGFR/Akt/p38/ERK signaling pathway and epithelial-mesenchymal transition after carbon ion exposure is potentiated by PARP-1 inhibition in non-small-cell lung cancer[J]. BMC Cancer,2019,19(1):829. doi: 10.1186/s12885-019-6015-4 [31] Leng Y P,Qiu N,Fang W J,et al. Involvement of Increased Endogenous Asymmetric Dimethylarginine in the Hepatic Endoplasmic Reticulum Stress of Type 2 Diabetic Rats[J]. PLoS One,2014,9(2):e97125. [32] Lhotak S,Sood S,Brimble E,et al. ER stress contributes to renal proximal tubule injury by increasing SREBP-2-mediated lipid accumulation and apoptotic cell death[J]. Am J Physiol Renal Physiol,2012,303(2):F266. doi: 10.1152/ajprenal.00482.2011 [33] Lupachyk S,Watcho P,Stavniichuk R,et al. Endoplasmic Reticulum Stress Plays a Key Role in the Pathogenesis of Diabetic Peripheral Neuropathy[J]. Diabetes,2013,62(3):944-952. doi: 10.2337/db12-0716 [34] Paravicini T M,Touyz R M J D C. NADPH Oxidases,Reactive Oxygen Species,and Hypertension:Clinical implications and therapeutic possibilities[J]. Diabetes Care,2008,31(Supplement 2):S170-S180. [35] 李宏. PARP-1与氧化应激在糖尿病神经病变发病机制中的作用[J]. 检验医学与临床,2011,8(3):334-338. [36] 王燕萍,潘晓东,姜苏原,等. 氧化应激可通过NF-κB-iNOS-NO信号通路诱导小鼠胰岛β细胞凋亡[J]. 中国应用生理学杂志,2009,25(2):255-259. [37] 陆春丽,孙明谨,褚加成,等. 利拉鲁肽通过下调iNOS改善糖尿病前期小鼠胰岛功能[J]. 湖北医药学院学报,2018,37(4):17-20+105. [38] 苑天彤,冯丽辉,迟继铭,等. 何首乌提取物对糖尿病肾病早期大鼠肾组织iNOS和NT表达的影响[J]. 中国中医药科技,2015,22(3):280-283. 期刊类型引用(7)
1. 张丽莎,程玲,阴苗苗,张楠,张静,王海芳. 利拉鲁肽联合二甲双胍与缬沙坦治疗合并骨质疏松的糖尿病肾病患者的疗效. 川北医学院学报. 2024(03): 363-366 .  百度学术
百度学术2. 刘丹阳,吴振永,孙亚茹,崔玉秀. 二甲双胍介导NF-κB信号通路对糖尿病肾病细胞损伤的保护作用. 激光生物学报. 2024(03): 275-283 .  百度学术
百度学术3. 史大虎,王朝辉,陈科峰. 丹红注射液联合二甲双胍治疗对老年糖尿病肾病患者血糖、胰岛素用量及肾功能的影响. 检验医学与临床. 2023(09): 1269-1272 .  百度学术
百度学术4. 戚燕芝,吴艳萍. 服用二甲双胍的2型糖尿病患者进行碘造影剂检查的研究进展. 国际医药卫生导报. 2023(24): 3537-3541 .  百度学术
百度学术5. 盛青江. 不同剂量二甲双胍对急性心肌梗死合并2型糖尿病患者PCI术后造影剂肾病发病率的影响. 数理医药学杂志. 2022(04): 548-550 .  百度学术
百度学术6. 陶钧. 甘精胰岛素与二甲双胍对2型糖尿病的治疗效果分析. 糖尿病新世界. 2022(11): 88-90+94 .  百度学术
百度学术7. 王亚丽. 青少年1型糖尿病患儿生活质量与家庭亲密度和适应性的相关性研究. 糖尿病新世界. 2021(24): 34-37 .  百度学术
百度学术其他类型引用(2)
-






 下载:
下载:
 下载:
下载:

