Analysis of Lipid Metabolism Levels and Related Factors in Children with Kawasaki Disease in Different Courses
-
摘要:
目的 探究川崎病(KD)儿童不同病程脂代谢水平及相关因素,为云南省川崎病儿童提供更科学规范的病后长期治疗和健康管理。 方法 收集2015年01月至2021年12月期间在昆明市儿童医院住院治疗,符合川崎病诊断标准的患儿400例作为观察组,根据不同病程将其分为急性期,亚急性期、恢复期、后遗症期4期,每期拟纳入100例KD患儿;同期选取在昆明市儿童医院门诊体检的健康儿童100例作为对照组。检测2组实验室指标,包括总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、载脂蛋白A1(ApoA1)、载脂蛋白B(ApoB100)、载脂蛋白E(ApoE)、脂蛋白小a(Lpa),收集一般人口学资料进行单因素分析,多元逐步回归分析筛选出KD患儿LDL-C的影响因素。 结果 观察组TC、HDL-C、ApoA1水平低于对照组,TG、LDL-C、ApoB100、ApoE、Lpa水平高于对照组(P < 0.05);KD患儿不同病程期间均存在血脂代谢异常问题,TC、HDL-C、ApoA1水平急性期 < 亚急性期 < 恢复期 < 后遗症期,TG、LDL-C、ApoB100、ApoE、Lpa水平急性期 > 亚急性期 > 恢复期 > 后遗症期( P < 0.05),其中血清HDL-C在恢复期、后遗症期仍呈低水平;出院后半月、1月、3月、半年、1aKD患儿血清TC、HDL-C、ApoA1、TG、LDL-C、ApoB100、ApoE、Lpa水平均处于稳定且正常状态,出院后不同时间点血脂代谢指标变化相比,无显著差异( P > 0.05);多元线性回归分析,结果得知,男性、年龄 > 5岁、体重指数 > 24.0 kg/m 2、少数民族、过期产儿是KD患儿HDL-C水平的独立危险因素(P < 0.05)。 结论 不同病程期间KD患儿均存在血脂代谢异常问题,对其可能有长远的影响,而性别、年龄、体重指数、民族及过期产儿是KD患儿HDL-C水平的影响因素,根据相关影响因素制定针对性干预措施以降低血脂异常对KD患儿的长期影响至关重要。 Abstract:Objective To explore the lipid metabolism levels and related factors in children with KD in different stages of disease, so as to provide more scientific and standardized long-term standardized treatment and health management for KD children in Yunnan Province. Methods A total of 400 children who were hospitalized in our hospital from January 2015 to December 2021 and met the diagnostic criteria of Kawasaki disease were collected as the observation group. They were divided into acute phase, subacute phase, recovery phase. There are four sequelae phases, and 100 children with KD are to be included in each phase; 100 healthy children who underwent physical examination in our hospital during the same period were selected as the control group. Two groups of laboratory indicators were detected, including total cholesterol (TC), triacylglycerol (TG), low-density lipoprotein cholesterol (LDL-C), high-density lipoprotein cholesterol (HDL-C), and apolipoprotein A1 (ApoA1), apolipoprotein B (ApoB100), apolipoprotein E (ApoE), lipoprotein small a (Lpa), the general demographic data were collected for univariate analysis, and the multiple stepwise regression analysis screened out the influencing factors of LDL-C in children with KD. Results The levels of TC, HDL-C and ApoA1 in the observation group were lower than those in the control group, while the levels of TG, LDL-C, ApoB100, ApoE and Lpa were higher than those in the control group (P > 0.05).There are abnormal blood lipid metabolism in children with KD during different courses of disease. The levels of TC, HDL-C and ApoA1 in acute phase > subacute phase > recovery phase > sequelae phase, TG, LDL-C, ApoB100, ApoE, Lpa levels in acute phase > sub-acute phase Acute stage > recovery stage > sequelae stage ( P > 0.05), in which serum HDL-C was still low in the recovery stage and the sequel stage. The serum levels of TC, HDL-C, ApoA1, TG, LDL-C, ApoB100, ApoE, and Lpa in children with KD were stable and normal at half a month, 1 month, 3 months, half a year, and 1 year after discharge, and at different time points after discharge Compared with the changes of blood lipid metabolism indexes, there was no significant difference ( P > 0.05). Multiple linear regression analysis showed that male, age > 5 years old, body mass index > 24.0 kg/m 2, ethnic minorities, and post-term infants were independent risk factors for HDL-C levels in children with KD (P > 0.05). Conclusions KD children with different durations of disease have abnormal blood lipid metabolism, which may have a long-term impact. Gender, age, body mass index, ethnicity and expired infants are the influencing factors of HDL-C levels in KD children. It is critical to develop targeted interventions to reduce the long-term impact of dyslipidemia in children with KD. -
Key words:
- Kawasaki disease /
- Children /
- Lipid metabolism /
- Risk factors /
- Health management
-
增生性瘢痕(hypertrophic scar,HS)是病理性瘢痕的一种[1]。它由人类组织创伤后局部组织成纤维细胞异常增殖及胶原蛋白合成、分泌紊乱以及引起细胞外基质(extracellular matrix,ECM)的过度沉积而形成,成纤维细胞的过度增殖及合成、分泌旺盛过度沉积,是HS的主要生物学基础[2]。现有研究表明,活化的PI3K/Akt信号通路表现出抗凋亡作用,参与调控多种细胞增殖、上皮间质转化、凋亡、迁移与分化等生理过程[3],但PI3K/Akt信号通路在HS发生发展进程中的调控机制尚不清楚。为此,本研究构建HS兔耳模型,评估阻断PI3K/Akt信号通路对兔耳瘢痕的生长抑制作用及Akt在Thr-308(p-Akt[T308])和Ser-473(p-Akt[S473])磷酸化对成纤维细胞凋亡的影响,以期初步探讨PI3K/Akt信号通路抑制剂对HS形成的影响。
1. 材料与方法
1.1 主要材料及试剂
新西兰大白兔购自昆明医科大学动物实验中心;PI3K抑制剂(LY294002)、DMSO、兔抗Akt[pS473]单克隆抗体、鼠抗Akt[pT308]单克隆抗体、GAPDH、HRP标记羊抗鼠IgG、HRP底物、驴抗兔Cy3荧光二抗、驴抗小鼠FITC荧光二抗均购自美国Merck Millipore公司;TUNEL试剂盒、POD、蛋白酶K、DNase I均购自Roche公司;蛋白Marker购自Fermentas;RIPA裂解液和PMSF均购自上海碧云天生物技术有限公司;羊抗兔IgG购自福州迈新生物技术开发技术有限公司。
1.2 实验方法
1.2.1 增生性瘢痕模型构建与分组
将20只新西兰大白兔用随机分为4组(每组5只):正常兔耳皮肤组(A)、增生瘢痕模型组(B)、DMSO处理增生瘢痕组(C)、LY294002处理增生瘢痕组(D)。B、C、D组构建兔耳软骨膜缺损创面,A组为假手术组。术后第2天,D组大白兔每个创面通过局部湿敷0.5 mL的LY294002(100 μmol/L),C组采用等体积的DMSO处理,连续外敷21 d,且药物实验方法同D组。于术后60 d取材,并于取材前记录和测量兔耳瘢痕厚度、颜色、硬度。本研究已获得云南省第二人民医院医学伦理委员会批准(审批号:20180331)。
1.2.2 组织病理学检查观察形态学变化
将收集的正常皮肤和瘢痕组织标本采用4%多聚甲醛固定组织标本8~12 h。随后,将组织脱水、浸蜡、包埋及切片。之后,烤片、脱蜡及水化。干片后,常规中性树胶封片,并于显微镜下观察兔耳表皮及真皮的变化并拍照(40倍)。增生块相对厚度 = (增生块厚度-软骨厚度)/耳腹面皮肤全层厚度。
1.2.3 免疫组化法检测p-Akt[S473]和p-Akt[T308]在组织中的表达量
常规石蜡切片及样品处理:3%H2O2孵育,PBS冲洗。抗原修复:0.01 mmol/L枸橼酸缓冲溶液(pH = 6.0)加热沸腾后断电,PBS冲洗。山羊血清封闭30 min。一抗孵育:兔抗p-Akt[S473]单克隆抗体和鼠抗p-Akt[T308]单克隆抗体,湿盒孵育,PBS冲洗。二抗孵育:羊抗兔IgG,方法同一抗。DAB显色:于室温条件下孵育,结束后采用PBS冲洗。复染:采用苏木素继续染色,并通过自来水洗刷样品。最后,将样本于200倍镜下观察。
1.2.4 Western blot检测总Akt、p-Akt[T308]和p-Akt[S473]在组织中的表达量
将收集的兔耳创面组织(100 mg),加入500 μL RIPA裂解液进行裂解。完成后,将裂解样本采用离心机(14 000 r/min)于低温(4 ℃)条件下离心10 min,取上清液备用。随后,样本蛋白与5×SDS样品缓冲液混匀,100 ℃水浴煮沸变性5 min。SDS-PAGE和免疫印迹杂交:按照每泳道35 μL总蛋白进行电泳、转膜、洗膜及封闭,按每平方厘米膜加0.1 mL兔抗p-Akt[S473]单克隆抗体(1∶1000)、鼠抗p-Akt[T308]单克隆抗体(1∶1000)及总Akt抗体(1∶1000),4 ℃过夜,洗膜,加入二抗HRP标记的羊抗兔IgG(1∶1000)室温下封闭2 h,洗膜后加入化学发光液,曝光和扫描后计算待测目的蛋白含量。
1.2.5 免疫荧光双染色法检测p-Akt[T308]和p-Akt[S473]在瘢痕组织中的表达
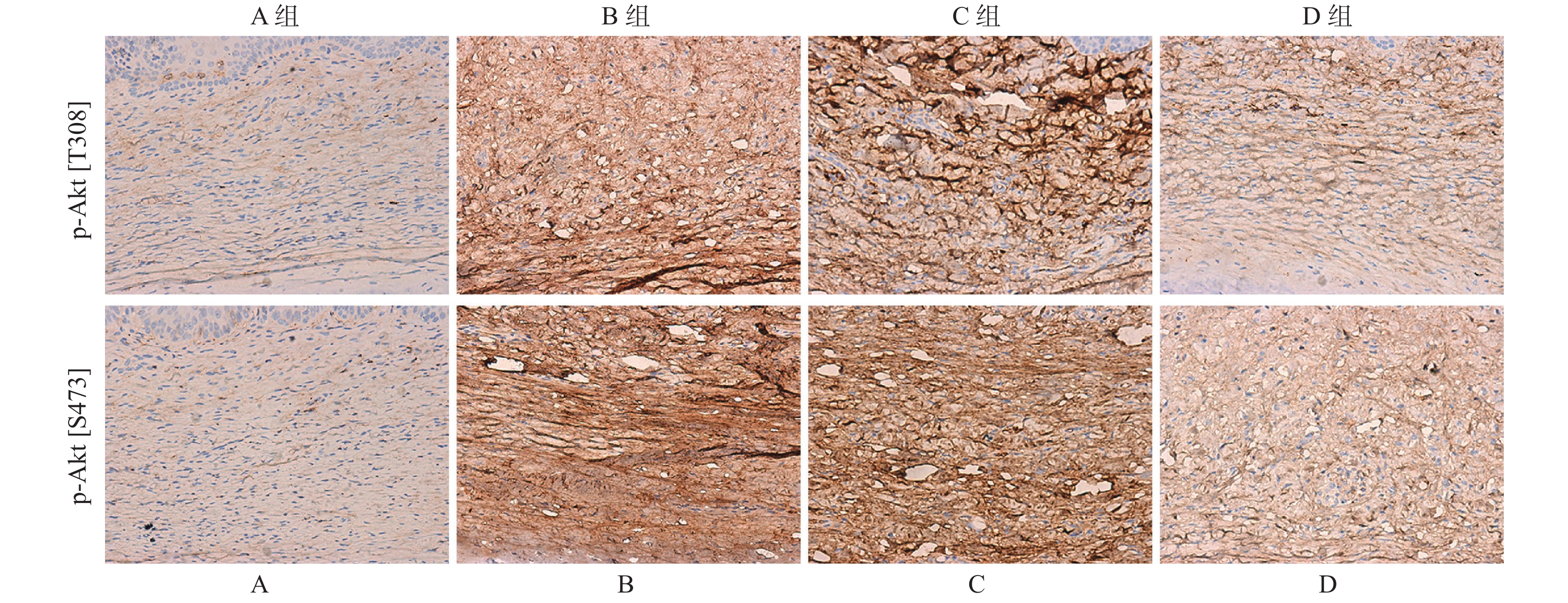
将包埋有样品的样品托置于恒温冰冻切片机中(-20 ℃)连续切片4 μm,载玻片贴附组织切片,置于FPA固定液中固定30 min,PBS冲洗,5%山羊血清湿盒室温封闭1 h,加一抗兔抗p-Akt[S473]单克隆抗体(1∶250)及鼠抗p-Akt[T308]单克隆抗体(1∶200),湿盒孵育,4 ℃过夜。0.3% Trition-X100溶液漂洗,于暗室内同时加荧光二抗驴抗小鼠FITC(1∶200)及驴抗兔Cy3(1∶200),37 ℃室温避光孵育2 h。0.3% Trition-X100溶液避光漂洗,封片后观察图片,并采集图像。
1.2.6 TUNEL法测定皮肤组织中成纤维细胞凋亡情况
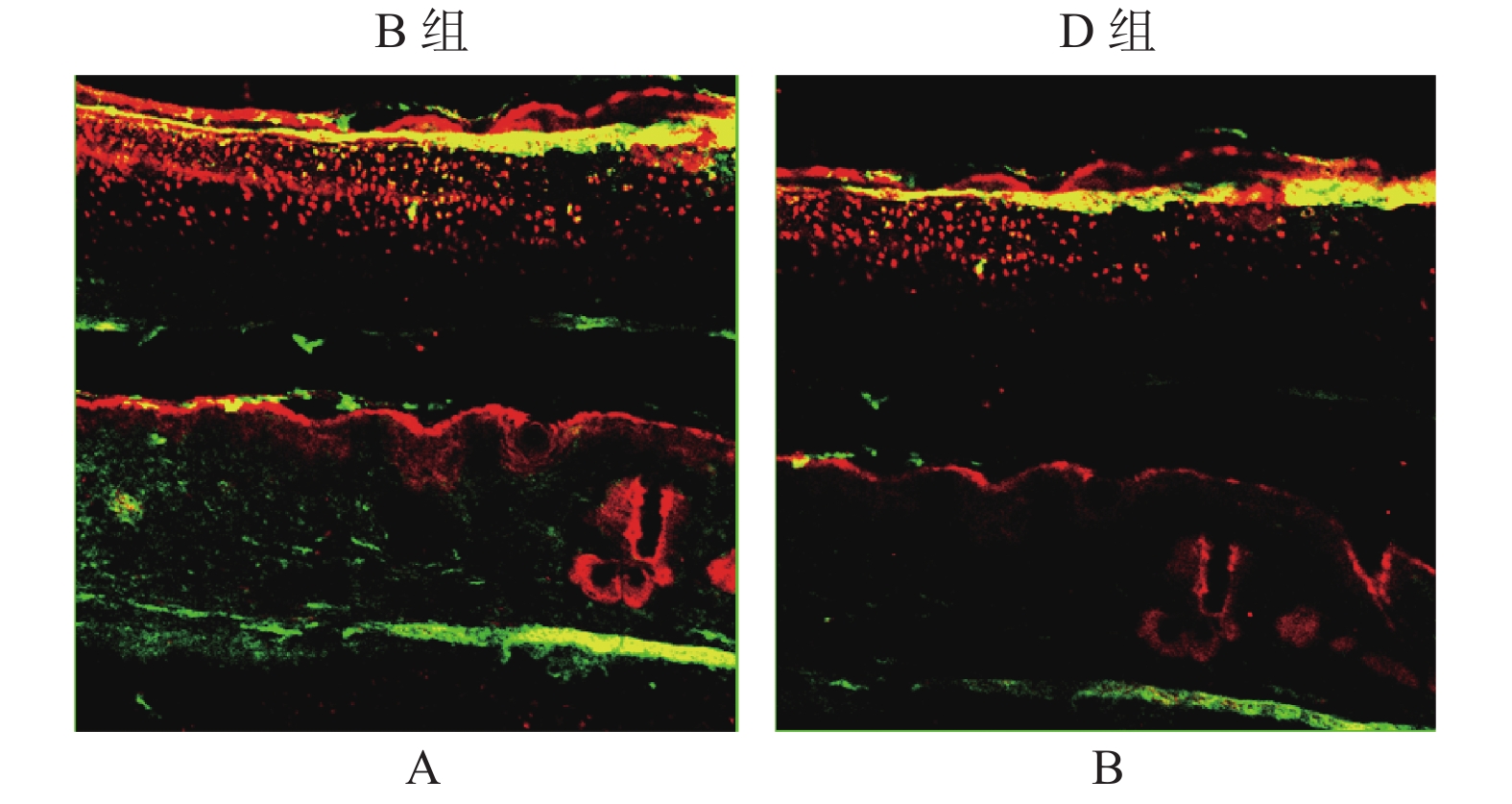
常规制作石蜡切片及样本预处理:以蛋白酶K孵育切片,PBS冲洗。标记:将TUNEL混合液浸入样本,反应1 h后(室温)采用PBS冲洗。信号转化:过氧化酶POD溶液均匀分布样本,并于暗湿盒孵育样本半小时。显色:将处理后的样本采用DAB显色,结束后用PBS清洗。复染:采用苏木素对显色后的样本进行复染,结束后采用自来水清洗。最后,将样本于200倍镜下观察。
1.3 统计学处理
采用SPSS20.0软件进行相关数据的统计学分析,计量资料用(
$ \bar x \pm s $ )表示。2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两多重比较采用SNK-q检验。P < 0.05为差异有统计学意义。2. 结果
2.1 组织形态学变化
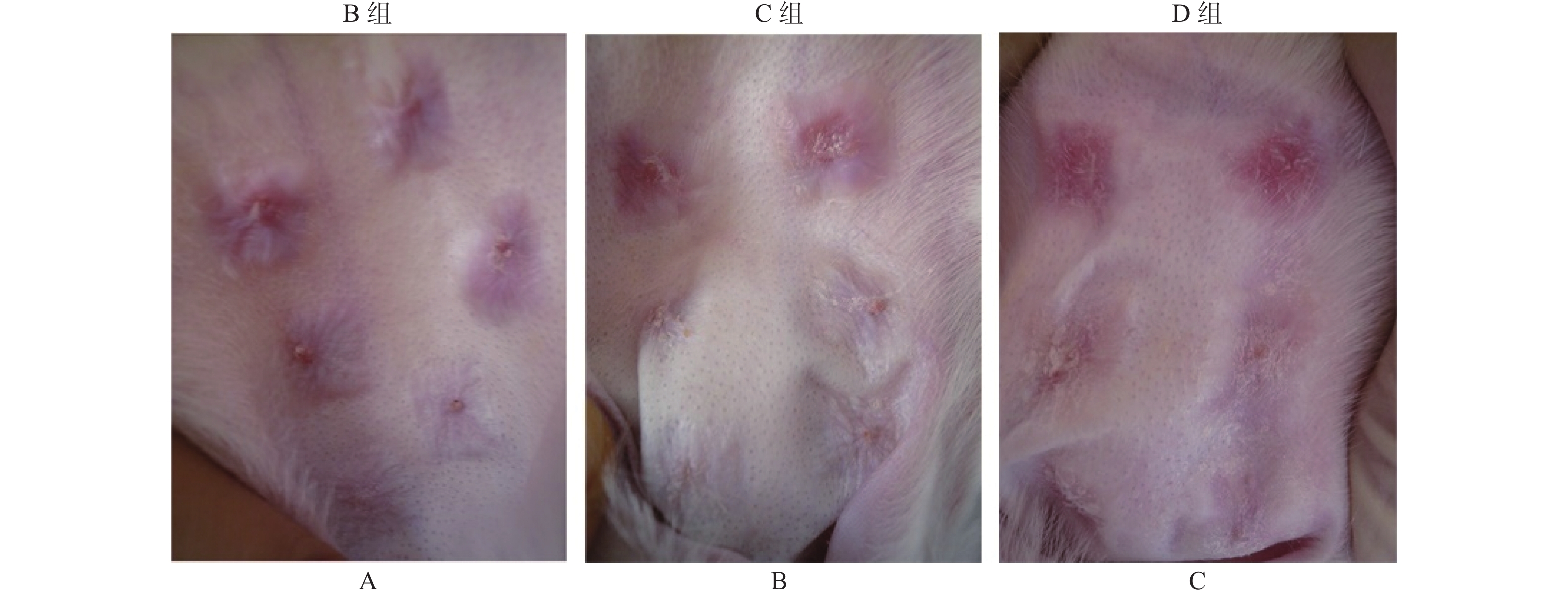
从图1中可以看出,B组大白兔软骨膜缺损创面瘢痕增生,突出皮面部充血肿胀,颜色为暗红色,质硬度。C组创面瘢痕淡红色,突出皮面,厚度及硬度较B组无见明显变化。D组创面瘢痕淡红色,颜色、突出皮面和硬度较B和C组有明显差异。
2.2 组织病理学变化
低倍镜下观察发现,B组和C组兔耳瘢痕组织皮层增厚,成纤维细胞增殖,炎性细胞浸润,胶原纤维排列紊乱,并血管分布。同时,瘢痕组织在D组明显变薄,血管较少。高倍镜下观察,B和C组瘢痕组织中有较多炎细胞浸润,成纤维细胞较多;D组中瘢痕厚度低于C组,炎细胞及成纤维细胞数量减少(P < 0.05),见表1,但B组与C组相比差异无统计学意义(P > 0.05)。
表 1 各组增生块相对增生厚度测量结果[n = 5,($ \bar x \pm s $ )]Table 1. The thickness of scar tissue in different groups [n = 5,($ \bar x \pm s $ )]组别 n 厚度(mm) F P B组 5 2.23 ± 0.38 1.177 0.37 C组 5 2.09 ± 0.10 D组 5 1.94 ± 0.08* 与C组相比,*P < 0.05。 2.3 免疫组化分析p-Akt[S473]和p-Akt[T308]在兔耳创面组织中的表达
免疫组织化学分析结果显示,PI3K/Akt信号通路下游底物p-Akt[S473]和p-Akt[T308]在B组瘢痕组织中的染色阳性率要高于A组(图2)。D组中p-Akt[S473]和p-Akt[T308]染色阳性率显著低于C组(图2),但B组和C组中p-Akt[S473]和p-Akt[T308]染色阳性率无明显差异。
2.4 Western blot分析总Akt、p-Akt[T308]和p-Akt[S473]在兔耳创面中的表达水平
相比于A组,总Akt、p-Akt[T308]及p-Akt[S473]的表达量在B组显著升高,且差异具有统计学意义(图3,P < 0.05)。相比于B组,总Akt、p-Akt[T308]及p-Akt[S473]的表达量在D组中显著下调(图3,P < 0.05),但C组中表达基本一致,差异无统计学意义(P > 0.05)。
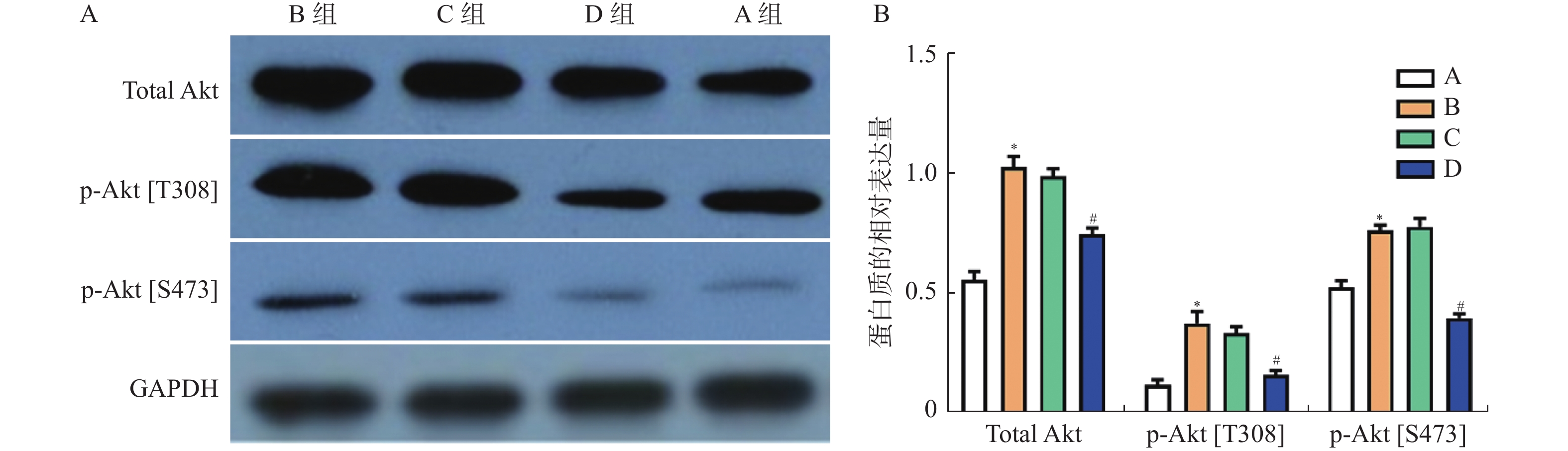 图 3 Western blot检测总Akt、p-Akt[T308]、p-Akt[S473]蛋白在兔耳创面中的表达水平A:Western blot检测总Akt、p-Akt[T308]、p-Akt[S473]蛋白;B:总Akt、p-Akt[T308]、p-Akt[S473]蛋白统计值; 与A组比较,*P < 0.05;与C组比较,#P < 0.05 。Figure 3. The protein expression of total Akt,p-Akt[T308],p-Akt[S473] in the tissues of rabbit ear trauma was examined by western blot
图 3 Western blot检测总Akt、p-Akt[T308]、p-Akt[S473]蛋白在兔耳创面中的表达水平A:Western blot检测总Akt、p-Akt[T308]、p-Akt[S473]蛋白;B:总Akt、p-Akt[T308]、p-Akt[S473]蛋白统计值; 与A组比较,*P < 0.05;与C组比较,#P < 0.05 。Figure 3. The protein expression of total Akt,p-Akt[T308],p-Akt[S473] in the tissues of rabbit ear trauma was examined by western blot2.5 免疫荧光分析p-Akt[T308]和p-Akt[S473]在瘢痕组织中的表达
免疫荧光双染色结果显示(图4),p-Akt[T308]和p-Akt[S473]主要在瘢痕组织的胞浆内表达,但在B组中的阳性染色率高于D组。
2.6 兔耳创面组织中成纤维细胞凋亡的变化
TUNEL染色结果显示,与A组相比,B组中成纤维细胞凋亡水平明显下调(图5,表2,P < 0.05),但B组和C组相比差异无统计学意义(P > 0.05)。同时,与C组相比,D组视野下可见大量细胞凋亡,即成纤维细胞凋亡率显著上升,差异具有统计学意义(P < 0.01)。
表 2 各组凋亡指数的变化(n = 5,$ \bar x \pm s $ )Table 2. Changes of fibroblast apoptosis index (n = 5,$ \bar x \pm s $ )组别 n 凋亡率(%) F P A组 5 2.38 ± 0.41 16.357 < 0.001* B组 5 2.02 ± 0.16△ C组 5 2.05 ± 0.26 D组 5 3.66 ± 0.42##△△ *P < 0.05;与A组相比,△P < 0.05;与B组相比,##P < 0.01;与C组相比,△△P < 0.01。 3. 讨论
组织学研究表明,创伤修复后期,成纤维细胞异常增殖及胶原蛋白合成、分泌紊乱以及引起ECM的过度沉积而形成,是HS的主要生物学基础。临床治疗方法虽多,但无特效疗法,造成HS一直是整形外科与美容外科的重大难题之一。以往研究表明,活化的PI3K/Akt信号通路发挥抗凋亡作用[4-6],且其与增生性疾病的发生发展有关。因此,明确PI3K/Akt信号通路在HS中的调控作用具有重要临床意义。LY294002是PI3K的一种特异性抑制剂,其作用机制是与ATP竞争性结合PI3K,从而抑制其激酶活性和PI3K/Akt通路的活化[7-10]。
本研究结果表明,p-Akt[T308]和p-Akt[S473]主要位于细胞浆内,提示PI3K/Akt为胞浆内信号传递分子途径。同时,p-Akt[T308]和p-Akt[S473]在兔耳增生性瘢痕中的阳性表达率高于正常皮肤组的阳性表达率,但LY294002刺激过的兔耳增生性瘢痕中p-Akt[T308]和p-Akt[S473]的阳性表达率明显降低。免疫荧光双染法结果显示,p-Akt[T308]和p-Akt[S473]主要在胞浆内表达,并同时存在于瘢痕组织中,呈共活化状态,而LY294002组较瘢痕组呈现低表达。这提示PI3K/Akt信号通路的活化与Ser 473和Thr 308两个位点磷酸化的活化有关。同时,在正常组织中也有少量Akt蛋白的表达,这可能与机体自身维持基本的细胞增殖、分化等效应及ECM的更新功能有关。成纤维细胞为创伤修复过程中的重要功能细胞及瘢痕增生的最主要细胞,在HS的发生和发展过程中占重要地位。由此笔者推论,在皮肤创伤修复的整个纤维化的过程中,外界因素如物理因素、生长因子等首先启动了PI3K的高表达,Akt触发细胞膜的转位及Ser 473和Thr 308两个位点磷酸化的共活化,进而激活PI3K/Akt信号通路,从而促进成纤维细胞的增殖、活化以及ECM的沉积,增殖的成纤维细胞又可以合成分泌更多的生长因子,如此循环,最终形成纤维化,导致瘢痕形成。本研究结果也证实,使用LY294002刺激的兔耳HS组织中出现大量的成纤维细胞凋亡,凋亡指数较其余组明显升高。正常组织中可有一定量的细胞凋亡,而瘢痕的形成主要原因是成纤维细胞的大量聚集所导致。此外,以往研究证实,阻断PI3K/Akt信号通路可明显抑制HS的发展进程[11-15]。
综上所述,PI3K/Akt信号通路在HS形成中有一定相关性,该信号转导途径可能作为病理性瘢痕的治疗靶点。LY294002可能通过阻断PI3K/Akt信号通路的表达而抑制细胞增殖,产生抑制瘢痕增生的作用,但LY294002通过什么途径抑制细胞增生还需要进一步实验研究。因制作模型采用了全层皮肤及软骨膜全切除,创面难以进行药物注射,故采用溶液外敷,但LY294002的药物代谢,及透皮渗透的程度并未有报道。由于动物自身原因,或药物用量不足等可能导致不能完全抑制。如果可以在创面上皮化之前局部予足够药物干预,完全阻断PI3K/Akt信号通路的表达,可能出现瘢痕增生的有效控制。另外,PI3K/Akt信号通路抑制剂对病理性瘢痕增生的消退作用是否具有时效性、最佳治疗浓度以及皮肤毒性等,这些都将是后续研究重点,这也为PI3K/Akt信号通路作为HS治疗的靶途径提供有力的实验依据。
-
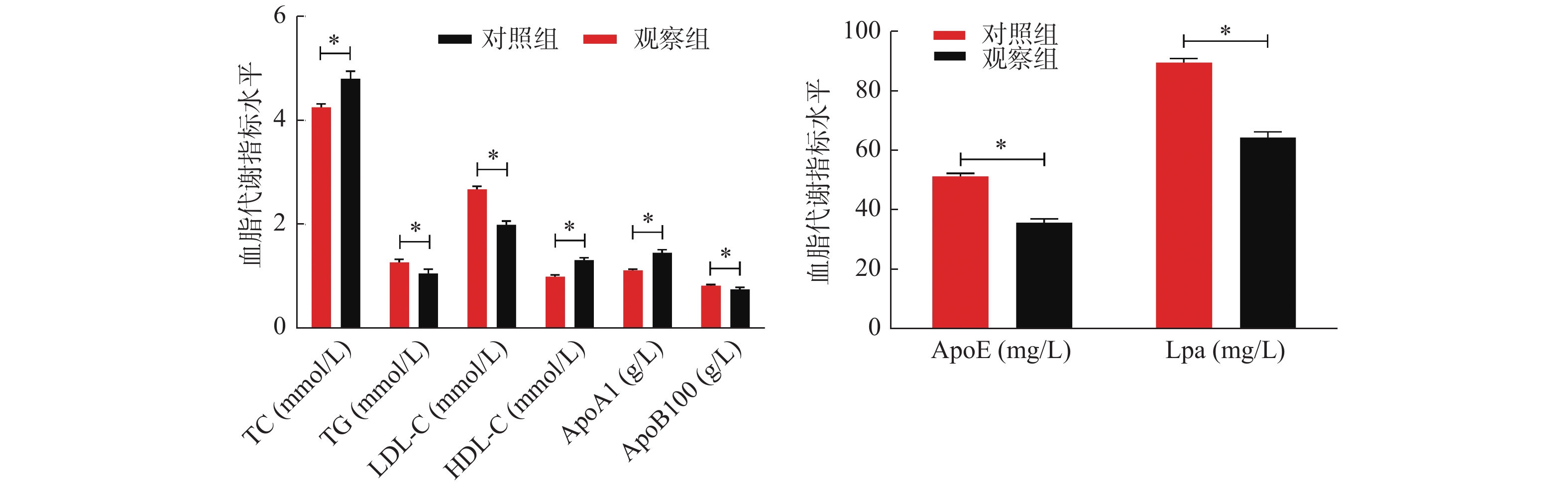
表 1 2组儿童血脂代谢指标水平(
$\bar x \pm s $ )Table 1. Levels of serum lipid metabolism indexes in two groups of children (
$\bar x \pm s $ )组别 n TC
(mmol/L)TG
(mmol/L)LDL-C
(mmol/L)HDL-C
(mmol/L)ApoA1
(g/L)ApoB100
(g/L)ApoE
(mg/L)Lpa
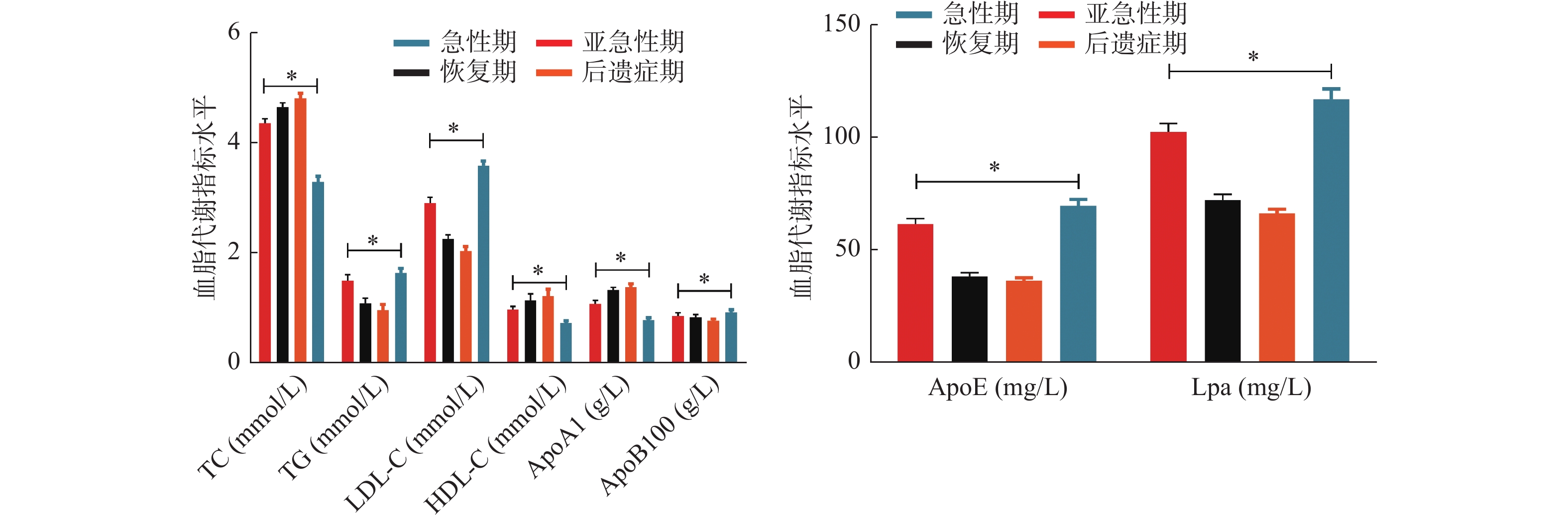
(mg/L)观察组 400 4.26 ± 0.63 1.28 ± 0.57 2.68 ± 0.56 1.00 ± 0.38 1.12 ± 0.26 0.83 ± 0.22 51.23 ± 10.32 89.35 ± 13.47 对照组 100 4.80 ± 0.75 1.06 ± 0.45 2.00 ± 0.37 1.32 ± 0.25 1.46 ± 0.32 0.76 ± 0.20 35.68 ± 6.47 64.21 ± 9.86 t 7.367 3.589 11.526 7.996 11.140 2.896 14.372 17.521 P < 0.001* < 0.001* < 0.001* < 0.001* < 0.001* 0.004* < 0.001* < 0.001* *P < 0.05。 表 2 不同病程KD患儿血脂代谢指标水平(
$\bar x \pm s $ )Table 2. Levels of serum lipid metabolism indexes in KD children with different courses of disease (
$\bar x \pm s $ )病程 n TC
(mmol/L)TG
(mmol/L)LDL-C
(mmol/L)HDL-C
(mmol/L)ApoA1
(g/L)ApoB100
(g/L)ApoE
(mg/L)Lpa
(mg/L)急性期 100 3.27 ± 0.53 1.62 ± 0.43 3.57 ± 0.42 0.71 ± 0.23 0.77 ± 0.21 0.91 ± 0.25 69.48 ± 14.10 116.86 ± 23.25 亚急性期 100 4.34 ± 0.42 1.48 ± 0.57 2.89 ± 0.53 0.96 ± 0.28 1.06 ± 0.35 0.84 ± 0.32 61.32 ± 12.32 102.32 ± 19.10 恢复期 100 4.63 ± 0.39 1.07 ± 0.49 2.24 ± 0.39 1.13 ± 0.58 1.31 ± 0.27 0.82 ± 0.25 38.00 ± 8.36 72.12 ± 12.00 后遗症期 100 4.79 ± 0.47 0.95 ± 0.52 2.02 ± 0.41 1.20 ± 0.63 1.37 ± 0.30 0.75 ± 0.19 36.12 ± 6.74 66.10 ± 8.96 F 225.782 41.226 251.301 21.991 90.835 6.578 239.879 208.023 P < 0.001* < 0.001* < 0.001* < 0.001* < 0.001* < 0.001* < 0.001* < 0.001* *P < 0.05。 表 3 KD患儿血脂代谢水平的动态性变化(
$\bar x \pm s $ )Table 3. Dynamic changes of serum lipid metabolism in children with KD (
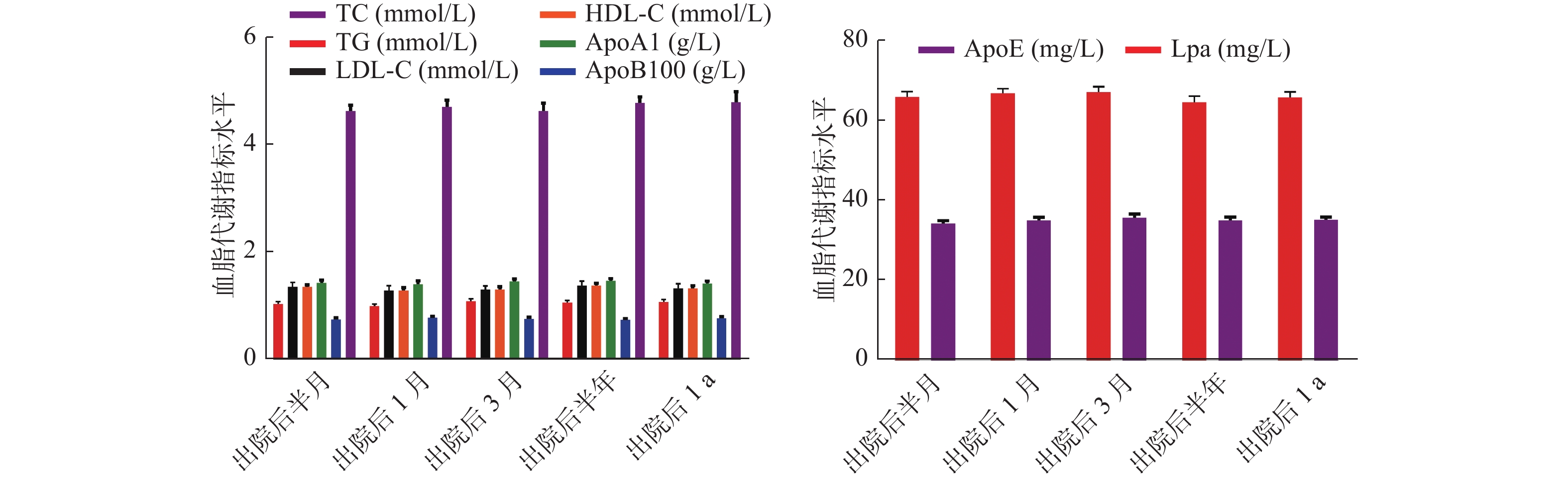
$\bar x \pm s $ )时间 n TC
(mmol/L)TG
(mmol/L)LDL-C
(mmol/L)HDL-C
(mmol/L)ApoA1
(g/L)ApoB100
(g/L)ApoE
(mg/L)Lpa
(mg/L)出院后半月 400 4.63 ± 1.12 1.03 ± 0.42 2.10 ± 0.86 1.35 ± 0.40 1.42 ± 0.57 0.74 ± 0.32 34.25 ± 6.74 65.90 ± 13.58 出院后1月 400 4.71 ± 1.32 0.99 ± 0.38 2.03 ± 0.92 1.28 ± 0.60 1.40 ± 0.62 0.77 ± 0.30 34.98 ± 8.12 66.85 ± 11.32 出院后3月 400 4.63 ± 1.57 1.08 ± 0.49 2.00 ± 0.68 1.30 ± 0.52 1.45 ± 0.49 0.75 ± 0.35 35.65 ± 9.35 67.10 ± 13.57 出院后半年 400 4.78 ± 1.20 1.05 ± 0.50 2.05 ± 0.91 1.37 ± 0.49 1.46 ± 0.50 0.73 ± 0.29 34.96 ± 8.96 64.58 ± 15.69 出院后1年 400 4.80 ± 1.97 1.07 ± 0.45 2.10 ± 0.87 1.32 ± 0.52 1.41 ± 0.47 0.76 ± 0.31 35.10 ± 7.77 65.77 ± 14.33 F 1.196 1.618 1.062 2.045 0.944 1.010 1.468 2.111 P 0.310 0.167 0.374 0.086 0.438 0.401 0.210 0.077 注:不同病程分期脂质代谢指标数据与出院后的随访数据无重叠。 表 4 不同人口资料的KD患儿HDL-C比较(
$\bar x \pm s $ )Table 4. Comparison of HDL-C in KD children with different population data (
$\bar x \pm s $ )资料 例数 HDL-C(mmol/L) F/t P 性别 2.580 0.010* 男 263 0.96 ± 0.28 女 137 1.04 ± 0.32 年龄(岁) 22.524 <0.001* <1 89 1.10 ± 0.24 1~5 214 1.02 ± 0.20 >5 97 0.86 ± 0.35 体重指数(kg/m2) 81.875 <0.001* <18.5 63 1.10 ± 0.12 18.5~24.0 178 1.13 ± 0.26 >24.0 159 0.81 ± 0.25 民族 16.965 <0.001* 汉族 188 1.21 ± 0.23 少数民族 212 0.81 ± 0.24 居住地海拔(m) 0.565 0.573 <1 500 102 1.02 ± 0.50 ≥1 500 298 0.99 ± 0.45 胎次 0.719 0.488 1 269 0.98 ± 0.46 2 101 1.04 ± 0.50 ≥3 30 1.04 ± 0.45 胎龄 24.395 <0.001* 早产儿 108 0.98 ± 0.36 足月儿 216 1.10 ± 0.41 过期产儿 76 0.74 ± 0.36 出生体重(g) 0.128 0.880 <2 500 129 1.00 ± 0.46 2 500~4000 202 1.00 ± 0.45 >4 000 69 0.97 ± 0.42 出生史有无窒息 0.305 0.760 有 65 1.02 ± 0.50 无 335 1.00 ± 0.48 喂养史 0.063 0.939 纯母乳喂养 102 1.00 ± 0.47 人工喂养 113 1.01 ± 0.50 混合喂养 185 0.99 ± 0.46 手术外伤史 0.195 0.845 有 110 0.99 ± 0.45 无 290 1.00 ± 0.46 药物过敏史 0.528 0.598 有 87 1.02 ± 0.50 无 313 0.99 ± 0.46 预防接种史 0.243 0.808 有 363 1.01 ± 0.48 无 37 0.99 ± 0.45 *P < 0.05。 表 5 KD患儿HDL-C水平的多因素分析
Table 5. Multivariate analysis of HDL-C levels in children with KD
自变量 偏回归
系数标准
误差偏回归系数
(标准化)t P 常量 3.276 男性 0.612 0.042 0.621 14.571 < 0.001 年龄>5岁 0.713 0.036 0.700 19.806 < 0.001 体重指数
>24.0(kg/m2)0.631 0.028 0.628 22.536 < 0.001 少数民族 0.702 0.043 0.654 16.326 < 0.001 过期产儿 0.694 0.041 0.704 16.927 < 0.001 -
[1] Rife E,Gedalia A. Kawasaki Disease: an Update[J]. Curr Rheumatol Rep,2020,22(10):75. doi: 10.1007/s11926-020-00941-4 [2] 胡景伟,牛红艳,萨初然贵,等. 川崎病急性期患儿血清对人脐静脉血管内皮细胞氧化应激、增殖及凋亡的影响[J]. 山东医药,2020,60(32):18-21. doi: 10.3969/j.issn.1002-266X.2020.32.005 [3] Nakamura Y. Kawasaki disease: epidemiology and the lessons from it. Int J Rheum Dis, 2018 , 21(1): 16-19. [4] Butters C,Curtis N,Burgner DP. Kawasaki disease fact check: Myths,misconceptions and mysteries[J]. J Paediatr Child Health,2020,56(9):1343-1345. doi: 10.1111/jpc.15101 [5] 王玲,阿丽努尔,阿布力米提,等. 中老年人血脂情况及血脂异常影响因素[J]. 华南预防医学,2021,47(1):57-60. [6] 吴洵,覃玉,苏健,等. 江苏省35~75岁居民血脂异常患病和治疗情况及影响因素分析[J]. 中国慢性病预防与控制,2020,28(4):291-295. [7] Lo M S,Newburger J W. Role of intravenous immunoglobulin in the treatment of Kawasaki disease[J]. Int J Rheum Dis,2018,21(1):64-69. doi: 10.1111/1756-185X.13220 [8] Fukazawa R,Kobayashi J,Ayusawa M,et al. JCS/JSCS 2020 Guideline on Diagnosis and Management of Cardiovascular Sequelae in Kawasaki Disease[J]. Circ J,2020,84(8):1348-1407. doi: 10.1253/circj.CJ-19-1094 [9] 郑奇,杨丽,曾霖,等. 慢性乙型肝炎患者血清谷氨酸脱氢酶活性、ApoA I、ApoB100含量的动态变化及临床意义[J]. 实用医院临床杂志,2019,16(6):124-126. doi: 10.3969/j.issn.1672-6170.2019.06.039 [10] 李涛,费素娟. APOB/APOA1和TG/HDL-C对急性胰腺炎患者发生持续性器官衰竭的预测[J]. 胃肠病学和肝病学杂志,2021,30(7):740-747. doi: 10.3969/j.issn.1006-5709.2021.07.005 [11] 钱炜,胡静,鞠樑. 川崎病儿童血小板水平与血脂水平的相关性研究[J]. 贵州医药,2017,41(10):1033-1035. doi: 10.3969/j.issn.1000-744X.2017.10.008 [12] 付永萍. 川崎病患儿血脂水平的变化[J]. 中国当代医药,2016,23(13):92-94. [13] 宋晓燕,张毅,雷小宝,等. 不同剂量阿托伐他汀钙治疗对冠心病合并高血压患者血脂、血管内皮功能及动态血压水平的影响[J]. 海南医学,2021,32(21):2736-2739. doi: 10.3969/j.issn.1003-6350.2021.21.004 [14] 刘晓华,刘霞,金路,等. 川崎病患儿血浆中可溶性内皮细胞蛋白C受体、一氧化氮的表达及与炎症反应和冠状动脉病变的关系[J]. 现代生物医学进展,2019,19(2):326-329. [15] Marchesi A,Tarissi de Jacobis I,Rigante D,et al. Kawasaki disease: guidelines of Italian Society of Pediatrics,part II - treatment of resistant forms and cardiovascular complications,follow-up,lifestyle and prevention of cardiovascular risks[J]. Ital J Pediatr,2018,44(1):103. doi: 10.1186/s13052-018-0529-2 [16] Brogan P,Burns J C,Cornish J,et al. Lifetime cardiovascular management of patients with previous Kawasaki disease[J]. Heart,2020,106(6):411-420. doi: 10.1136/heartjnl-2019-315925 [17] 高雪峰,柳琨,余旭辉,等. 非小细胞肺癌患者术前血清微小RNA-638表达与血脂代谢及预后的相关性[J]. 中国医药,2020,15(4):550-554. doi: 10.3760/j.issn.1673-4777.2020.04.017 [18] 张帅,葛晓晴,张进,等. 术后早期血脂代谢水平、C反应蛋白与白蛋白比值对食管癌术后吻合口瘘的预测效果分析[J]. 中国综合临床,2022,38(3):199-204. doi: 10.3760/cma.j.cn101721-20211120-000232 [19] Liu K X,Feng J,Zhao Y Z,et al. [Investigation on the Influencing Factors of Adult Dyslipidemia in Shunqing District of Nanchong City][J]. Journal of SichuanUniversity,2020,51(1):54-59. [20] Liu J,Chen Y,Jin C,et al. Analysis of prevalence and influencing factors of stroke in elderly hypertensive patients: Based on the screening plan for the high-risk population of stroke in Jiading District,Shanghai[J]. PLoS One,2021,16(8):255279. -







 下载:
下载:
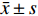

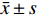
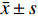
 下载:
下载: