A Comparative Study of Rat Models of Intrauterine Adhesions Constructed in Different Ways
-
摘要:
目的 通过采取不同的处理方式构建宫腔粘连大鼠模型,以筛选出更稳定的宫腔粘连大鼠模型,为进一步研究宫腔粘连的发生机制以及为新的治疗方式提供理论依据。 方法 将48只雌性发情期的SD大鼠随机分为4组,即对照组、脂多糖棉线组(带线组)、脂多糖注射组(注射组)、脂多糖明胶组(明胶组),每组12只。分别于建模7 d、14 d、28 d每组各处死4只大鼠并取子宫内膜组织检测,使用HE染色观察大鼠子宫内膜腺体数量变化情况,使用Masson染色观察大鼠子宫内膜纤维化面积变化情况,使用免疫组织化法检测纤维化蛋白TGF-β1的表达情况。使用Western Blot检测纤维化蛋白Collagen-Ⅰ、Collagen-Ⅲ、α-SMA、TGF-β1的蛋白表达情况。 结果 (1)HE染色结果显示,建模7 d、14 d、28 d,各组腺体数量均较对照组减少(P < 0.05)。其中建模14 d、28 d,注射组的腺体数量比带线组及明胶组均减少更明显(P < 0.05),且建模28 d时,注射组腺体数量几乎为0。(2)Masson染色结果显示,带线组、注射组、明胶组在建模7 d、14 d、28 d大鼠的子宫内膜纤维化程度均明显较对照组高(P < 0.05),经过不同组之间的比较发现,注射组大鼠的子宫内膜纤维化程度较带线组、明胶组高(P < 0.05),且造模28d注射组最严重。(3)免疫组化染色结果显示,在建模7 d、14 d、28 d时,带线组、注射组、明胶组等各组大鼠TGF-β1的表达均较对照组显著增加,除造模7 d的带线组、明胶组外,其余各组结果之间均具有统计学意义(P < 0.05)。建模7 d、28 d时,注射组TGF-β1的表达量较明胶组升高(P < 0.05)。(4)Western blot结果表明,机械损伤后不同的感染细菌脂多糖处理方式都会上调纤维化相关蛋白的表达,经过不同组之间的比较发现,造模7 d、14 d、28 d,注射组较明胶组Collagen-Ⅰ、Collagen-Ⅲ、α-SMA及TGF-β1表达升高(P < 0.05),但明胶组与带线组相比,组间结果无统计学意义(P > 0.05);造模7 d,注射组较带线组Collagen-Ⅰ、Collagen-Ⅲ、α-SMA蛋白表达升高(P < 0.05),造模14 d,注射组较带线组Collagen-Ⅲ、α-SMA蛋白表达升高(P < 0.05),造模28 d,注射组较带线组Collagen-Ⅰ、Collagen-Ⅲ、α-SMA及TGF-β1蛋白表达升高(P < 0.05)。且对照组相、带线组、注射组和明胶组4组中,注射组中的Collagen-Ⅰ、Collagen-Ⅲ、α-SMA及TGF-β1蛋白的表达都是最高的,经过机械损伤后,注射脂多糖损伤大鼠子宫的效果最为显著。 结论 采用刮宫后宫腔内注射脂多糖的方式所获得的大鼠宫腔粘连模型较宫腔内放置脂多糖棉线或脂多糖明胶的损伤更严重,建模效果更好,且建模28 d时的大鼠宫腔粘连模型损伤最严重。刮宫后宫腔内放置脂多糖明胶作为一种新的方法,也能造成宫腔粘连。 Abstract:Objective To find out the more stable rat models of intrauterine adhesions, so as to provide the basis for further investigation into the mechanism of intrauterine adhesions occurrence and exploration of novel treatments by constructing rat models of intrauterine adhesions with different measures. Methods Forty-eight female SD rats in estrus were randomly assigned to one of the four groups: control group, lipopolysaccharide cotton thread group (with line group), lipopolysaccharide injection group (injection group), lipopolysaccharide gelatin group (gelatin group), each group consisted of 12 rats. Rats in the gelatin group placed a gelatin sponge strip soaked in lipopolysaccharides in the uterine cavity after curettage. In each group, 4 rats were sacrificed 7 days, 14 days, and 28 days later, respectively, and endometrial tissue was detected, the number of endometrial glands and the area of fibrosis of the rats were observed by HE staining and Masson staining and the expression of the fibrotic protein TGF-β1 was detected by immunohistochemistry. Western Blot was used to detect the protein expression of fibrotic proteins Collagen-I, Collagen-III, α-SMA, and TGF-β1. Result (1) The results of HE staining showed that the number of glands in each group decreased compared with the control group after 7 days, 14 days, and 28 days of modeling (P < 0.05). Of these, after 14 days and 28 days of modeling, the number of glands in the injection group decreased more significantly than those in the line and gelatin e group (P < 0.05), and when modeling for 28 days the number of glands in the injection group was close to zero. (2) Masson staining showed that the degree of fibrosis of the endometrium in the lineage-based group, injection group, and gelatin group was significantly higher than that of the control group at 7 days, 14 days, and 28 days (P < 0.05), and after comparison between different groups, it was found that the degree of endometrial fibrosis of rats in the injection group was higher than that in the line-and-line group and gelatin group (P < 0.05), and the injection group after 28 days of molding was the most severe group. (3) Immunohistochemical staining showed that TGF-β1 expression in the lineage group, there was a significant increase in the injection group and gelatin group compared to the control group at 7 days, 14 days, and 28 days of modeling, and the differences in the other groups were statistically significant with the exception of the line and gelatin group for 7 days of molding (P < 0.05). Furthermore, at 7 days and 28 days after modeling, TGF-β1 expression in the injection group was greater than that in the gelatin group (P < 0.05). (4) Western blot analysis showed that the expression of fibrosis related proteins was up-regulated by different methods of infective bacterial lipopolysaccharide treatment after mechanical injury, and upon a comparison between different groups, it was found that the expression of Collagen-I, Collagen-III, α-SMA, and TGF-β1 in the injection group was increased in comparison to that in the gel-treated group (P < 0.05), but the difference between the gelatin e group and the strip group did not reach statistical significance (P > 0.05). After 7 days of molding, the expression Collagen-I, Collagen-III And α-SMA in the injection group was higher (P < 0.05), 14 days after molding, the expression of Collagen-III andα-SMA (P < 0.05) in the injection group was higher than that in the line group, and the expression of Collagen-I, Collagen-III, α-SMA, and TGF-β1 in the injection group was greater (P < 0.05). The expression of Collagen-I, Collagen-III, α-SMA and TGF-β1 protein in the control group, the line group, the injection group, and the gelatin group was the highest, and after mechanical injury, the effect of lipopolysaccharide injection to damage the uteri of rats was the most significant. Conclusions The rat model of intrauterine adhesions obtained by intrauterine injection of lipopolysaccharide after curettage is more severe than that obtained by intrauterine placement of a cotton string of lipopolysaccharide or lipopolysaccharide gelatin and the rat model of intrauterine adhesions has the most severe damage 28 days after modeling. The placement of lipopolysaccharide gelatin in the uterine cavity following curettage is a novel method that may also result in intrauterine adhesions. -
Key words:
- Intrauterine adhesions /
- Rats /
- Animal model /
- Modeling
-
宫腔粘连(intrauterine adhesions,IUA)是临床上一种常见的子宫内膜修复障碍类妇科疾病,致病原因是受损的子宫内膜引起宫腔前后壁部分或全部粘连,其伴随月经不调、异常出血、继发性不孕、复发性流产、胎盘粘连和胎盘发育异常等临床病症,临床上也有无症状的宫腔粘连[1-3]。我国由于人工流产的数量逐年上升,宫腔粘连的发病率居高不下,极大地影响了育龄期女性的生殖和身心健康[4]。
宫腔粘连发病机制迄今尚未完全阐明,动物模型的成功构建将有助于深入研究其发生机制和探索治疗新途径。因此构建准确的IUA动物模型对IUA的发病机制研究及治疗具有重要意义。目前,IUA的建模方法主要有机械损伤、电烧伤和化学损伤等[5]。建模方式多种多样,建模动物主要包括大鼠、小鼠和兔子[6]。目前,大鼠IUA模型因其造模方法与临床子宫内膜损伤和IUA病理状况相似而受到广泛研究应用[7]。付振琳等[8]通过机械损伤后乙醇灌注的方法成功构建了此模型,江梅等[9]利用机械损伤联合脂多糖感染法也成功建立了此模型。故本实验在手术器械造成大鼠子宫内膜病理性损伤后,通过不同的感染方式使大鼠宫腔内感染脂多糖(双重病理损伤),其目的是通过筛选出脂多糖最佳感染方式建立IUA大鼠模型并对IUA发病机制研究提供有效动物模型借鉴,为探索IUA治疗方法提供一定理论依据。
1. 材料与方法
1.1 材料
1.1.1 实验动物
48只雌性SD大鼠(10周,300 g)购自昆明医科大学动物实验中心,证书编号:SCXK(滇)K2020-0004。SPF动物房22~26 ℃,相对湿度52%~58%,自由饮食、进水;实验过程中严格遵守伦理标准进行操作,伦理审批号:kmmu20220879。
1.1.2 试剂
多聚甲醛溶液(北京索莱宝科技有限公司)、HE染色试剂盒(上海碧云天生物技术有限公司)、Masson切片染色试剂盒(北京索莱宝科技有限公司)、大鼠免疫组化试剂盒(中国迈新生物科技有限公司)、Skim Milk(北京索莱宝科技有限公司)、蛋白上样缓冲液(北京索莱宝科技有限公司)、Collagen-Ⅰ antibody(Abcam,ab138492)、Collagen-Ⅲ antibody(Abcam,ab184993)、α-SMAantibody(Abcam,ab5694)、TGF-β1(Abcam,ab229856)、CD31 antibody(Abcam,ab9498);辣根过氧化物酶标记山羊抗兔IgG(H+L)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 造模方法
将发情期的48只SD大鼠随机分为4组,即对照组、脂多糖棉线组(带线组)、脂多糖注射组(注射组)、脂多糖明胶组(明胶组),每组12只。针对不同模型构建方式对大鼠进行不同的处理。对照组:仅打开关腹部,不做任何处理。细菌脂多糖棉线感染组:麻醉发情时雌性SD大鼠,在大鼠双侧子宫内进行刮宫,刮宫结束后将细菌脂多糖棉线(10 mg/L浸润)置入损伤段子宫,留约0.4 cm长度于腹部后缝合子宫切口。48 h后,再次剖开切口取出棉线。细菌脂多糖注射感染组:刮宫后,将两侧子宫的近、远端分别使用无创血管钳夹紧,然后找到子宫动脉和卵巢动脉-子宫动脉交通支,使用无菌手术线扎紧。使用注射器将大约0.2 mL浓度为10 mg /L的脂多糖溶液从子宫近端慢慢地注射到宫腔内直至其充满,松开血管夹、剪除无菌手术线。冲洗并缝合腹部。细菌脂多糖明胶海绵感染组:配制好浓度为10 mg/L的细菌脂多糖溶液浸泡明胶海绵条,刮宫后,将浸泡过脂多糖的明胶海绵条放入损伤后的子宫,缝合子宫并关腹。造模成功后,分别于建模7 d、14 d、28 d每组各处死4只大鼠并取子宫内膜组织检测。每个时间点分别从各组抽取2只动物收集子宫组织。所有动物研究(包括安乐死程序)都是根据昆明医科大学机构动物护理条例和指南开展的。选择一部分组织进行切片,其余部分作为其他相关指标进行检测。
1.2.2 HE染色
HE染色观察大鼠子宫内膜病理变化,对子宫组织石蜡切片进行以下操作:烤片-脱蜡-二甲苯浸透-梯度乙醇复水- H&E染色-梯度乙醇脱水-甲苯透明-中性树脂封片。选取4个高倍视野在每张HE染色切片中,并计算每个视野下腺体数量,计算其平均值。由Image-Pro PLUS(IPP)图像分析软件自动计算完成。
1.2.3 Masson染色
Masson染色观察子宫内膜纤维化面积,对子宫组织石蜡切片进行Masson染色检查,选取4个高倍镜视野在每张Masson染色切片中随机,并计算纤维化面积比例(蓝染区域)。由Image-Pro PLUS(IPP)图像分析软件自动计算完成。
1.2.4 免疫组织化学(IHC)
采用免疫组化二步进行TGF-β1(1/500稀释)染色。利用光学显微镜观察、拍照;利用mage-Pro PLUS(IPP)图像分析软件测定蛋白含量,即平均光密度。
1.2.5 Western blot实验
称取100 mg的子大鼠宫组织快速研磨匀浆,后加入使用RIPA缓冲液(Beyotime,上海,中国)提取组织和细胞中的总蛋白,用BCA蛋白质分析试剂盒(Beyotime,上海,中国)测定蛋白质浓度。随后,将蛋白质装载到10%SDS-聚丙烯酰胺凝胶上分离蛋白质。分离的蛋白质转移到PVDF膜上,并在室温下用5%脱脂奶粉封闭1 h后,将膜与一抗α-SMA、Collagen-Ⅰ、Collagen-Ⅲ、TGF-β1稀释液(1/1000),4 ℃孵育过夜,次日用TBST洗涤后,与相应的二抗培养1 h。使用增强化学发光试剂盒(Millipore,Burlington,MA,USA)显色。使用Image J软件对蛋白质条带进行半定量分析。
1.3 统计学处理
使用GraphPad Prism 7进行统计学分析,在数据符合正态分布的情况下,3组或多组之间采用单因素方差分析。在数据未呈正态分布或无法应用正态性检验的情况下,比较2组的均值采用非参数检验的Mann-Whitnev检验,比较3组或更多组的均值采用非参数检验的Kruskal-Wallis检验 。P < 0.05为差异有统计学意义。
2. 结果
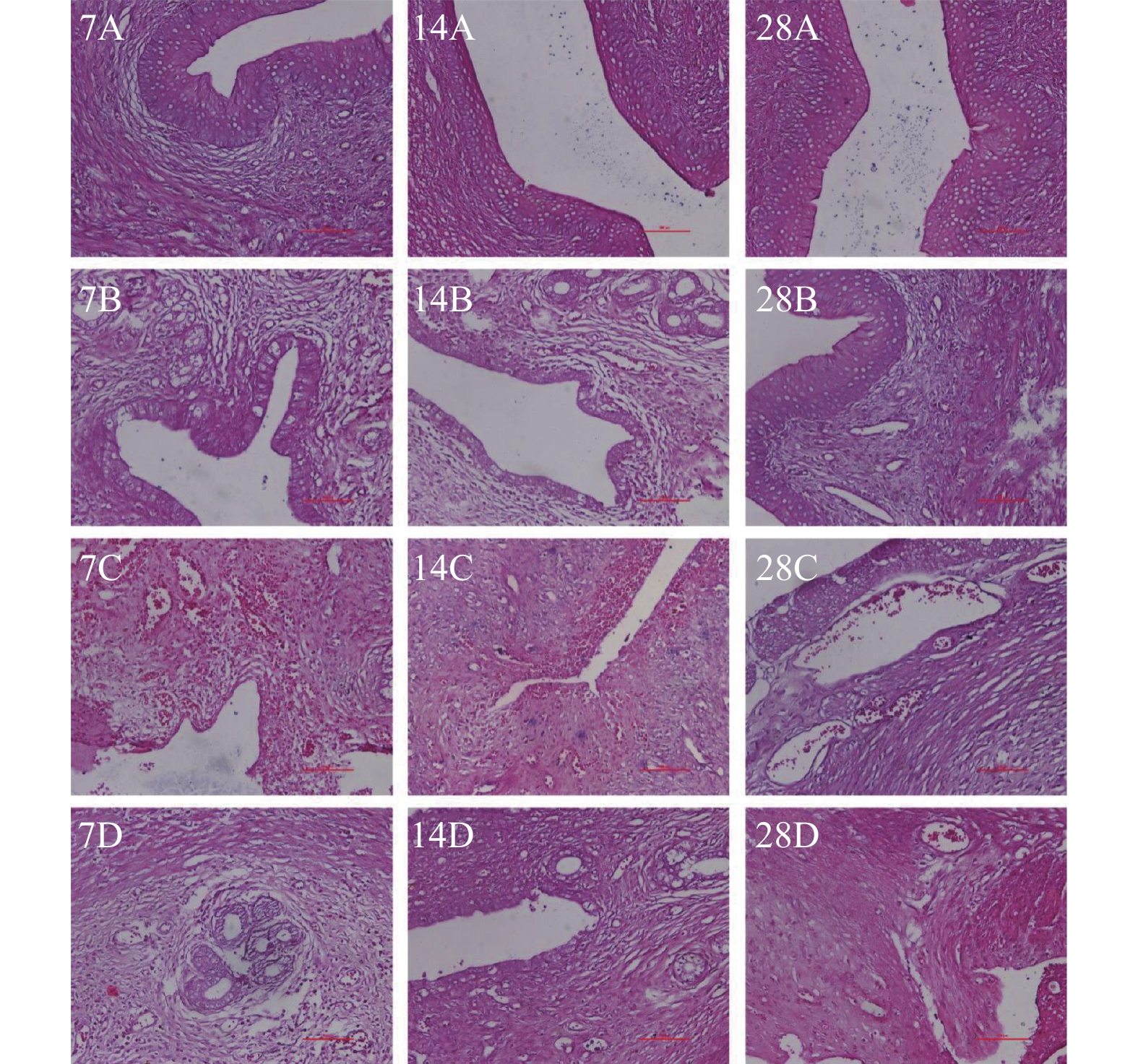
2.1 HE染色观察宫腔粘连大鼠模型子宫病理变化情况
利用HE染色观察大鼠子宫内膜组织的病理形态变化,对照组大鼠子宫腔壁组织完整,腺体明显可见;造模7 d、14 d、28 d,各组腺体数量均比对照组少(P < 0.05);但各处理组的腺体数量并没有随着造模时间的增加出现显著的差异(P > 0.05)。造模7 d、14 d、28 d时,与带线组相比,注射组腺体数量明显减少(P < 0.05),明胶组无显著差异; 造模14 d、28 d时,与注射组相比,注射组腺体数量明显少于明胶组(P < 0.05),且造模28 d注射组腺体数量最少,几乎为0,见表1、图1。
表 1 大鼠子宫腺体数量统计Table 1. Number of uterine glands in rats组别 7 d腺体
数量(个)14 d腺体
数量(个)28 d腺体
数量(个)对照组 11.00 10.00 9.50 带线组 6.25△△△ 6.00△ 5.75△ 注射组 2.00△△△ ## 1.00△△△## 0.50△△△### 明胶组 5.25△△ 5.00△△△&& 4.50△△& F 11.98 33.11 20.81 P 0.0006* < 0.001* < 0.001* *P < 0.05;与对照组比较,△P < 0.05,△△P < 0.01,△△△P < 0.001;与带线组比较,#P < 0.05,##P < 0.01;与注射组比较,&P < 0.05,&& P < 0.01。 2.2 Masson染色宫腔粘连大鼠模型子宫内膜纤维化情况
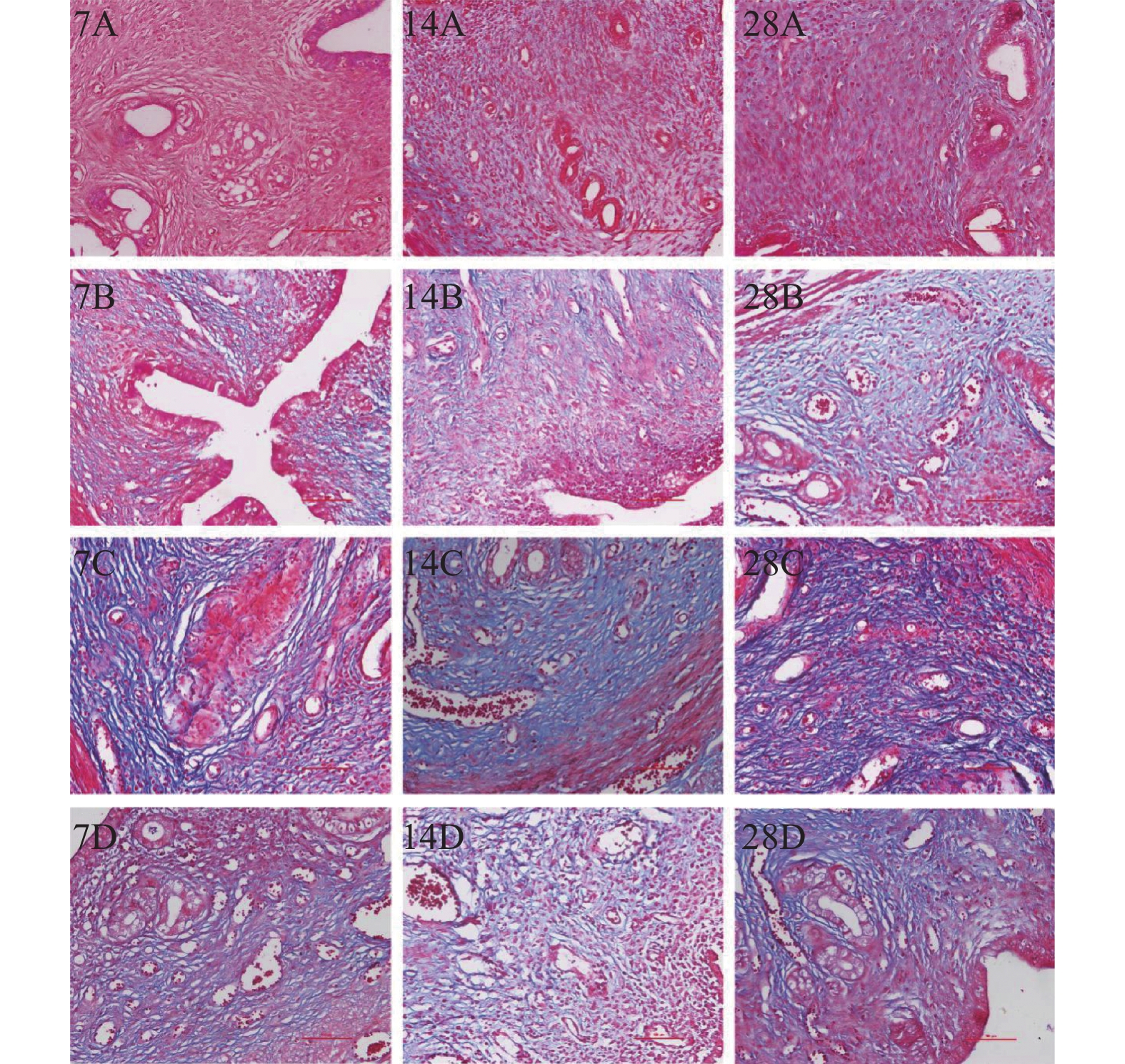
通过Masson染色观察大鼠模型子宫内膜纤维化情况,子宫内膜间质胶原纤维(蓝色)呈梭形排列。带线组、注射组、明胶组在造模7 d、14 d、28 d大鼠的子宫内膜纤维化程度均明显较对照组高(P < 0.05);造模7 d、14 d、28 d注射组大鼠的子宫内膜纤维化程度较带线组、明胶组高(P < 0.05),且造模28 d注射组最严重。明胶组与带线组比,造模7 d,明胶组较带线组纤维化面积高(P < 0.05),造模14 d、28 d,2组间差异无统计学意义(P > 0.05),见表2、图2。
表 2 大鼠子宫内膜纤维化程度(%)Table 2. Area of endometrial fibrosis in rats (%)组别 7 d纤维化程度 14 d纤维化程度 28 d纤维化程度 对照组 21.04 8.76 18.92 带线组 61.83△△ 83.89△△△ 142.99aaabbb 注射组 202.51△△△## 253.58△△△### aaa bbb 310.23△△△### aaabbb 明胶组 96.22△△△#&&& 109.54△△△&&& aaabbb 171.12△△△&&& aaabbb F 127.3 194 207.9 P < 0.001* < 0.001* < 0.001* *P < 0.05;与对照组比较,△P < 0.05,△△P < 0.01,△△△P < 0.001;与带线组比较,#P < 0.05,##P < 0.01;与注射组比较,&&& P < 0.001;与7 d比较, aaaP < 0.001;与14 d比较,bbbP < 0.001。 2.3 免疫组织化学(IHC)染色观察TGF-β1在子宫内膜上的表达情况
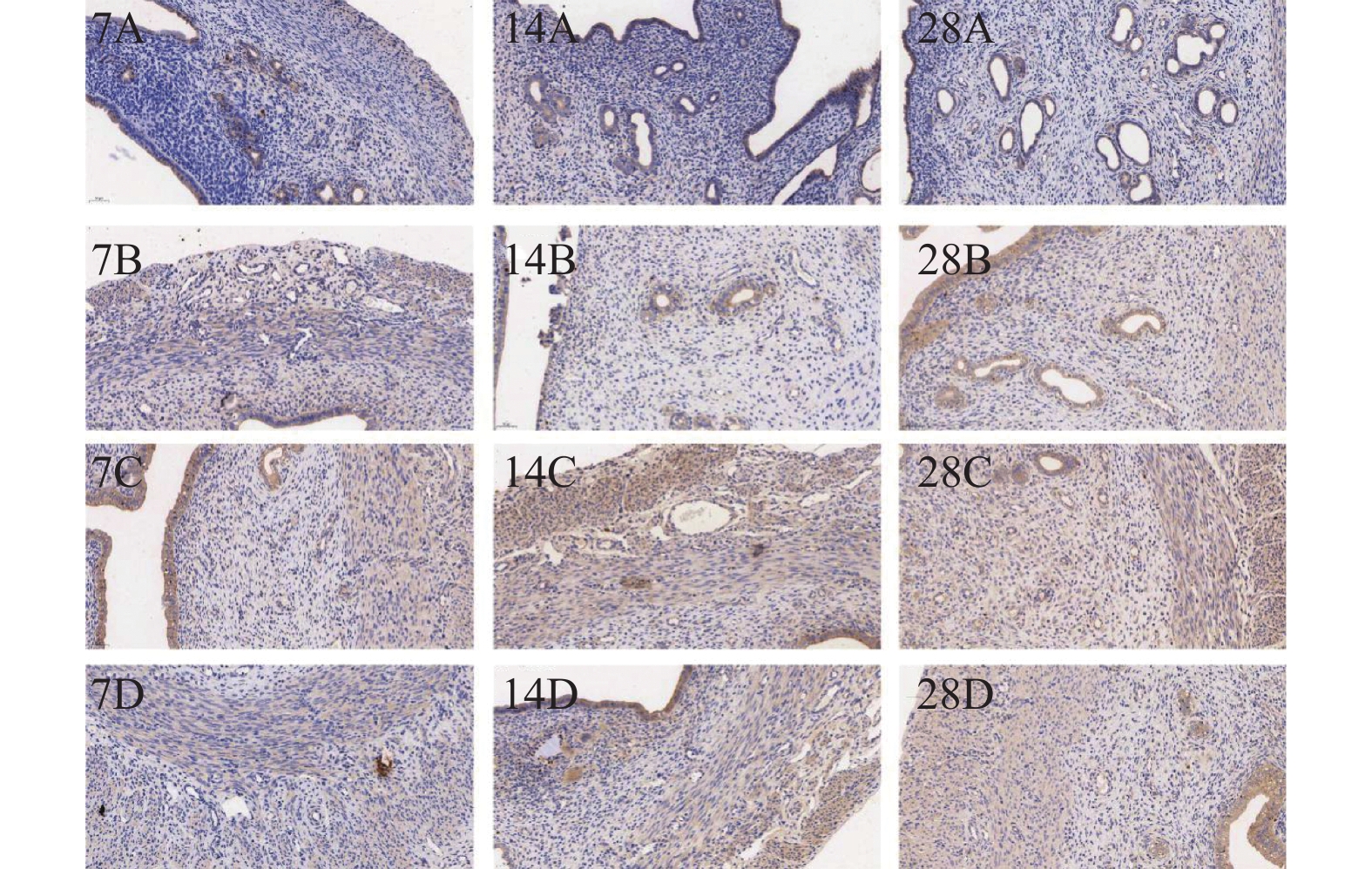
对大鼠子宫内膜组织切片进行IHC染色观察TGF-β1的表达结果显示,TGF-β1被染成棕色,造模7 d、14 d、28 d,与对照组相比,带线组、注射组、明胶组大鼠TGF-β1的表达显著增多,除造模7 d的带线组、明胶组外,其余各组差异具有统计学意义(P < 0.05),各组间比,注射组较带线组、明胶组TGF-β1的表达量升高,除与明胶组造模7 d、28 d比,差异有统计学意义(P < 0.05),其余各组间比差异无统计学意义(P > 0.05)。且造模28 d时TGF-β1的表达增加,见表3、图3。
表 3 大鼠子宫内膜TGF-β1的蛋白阳性率比较(%)Table 3. Comparison of protein positivity rate of endometrial TGF-β1 on the endometrium in rats (%)组别 7 d阳性率 14 d阳性率 28 d阳性率 对照组 54.41 42.54 45.41 带线组 67.58 86.66△△△ 117.31△△△aaabb 注射组 106.45△△△ 111.15△△△ 139.87△△△aab 明胶组 80.68& 102.24△△△a 109.77△△△&& F 13.37 17.58 41.69 P 0.0018* 0.007* < 0.001* *P < 0.05;与对照组比较,△P < 0.05,△△P < 0.01,△△△P < 0.001;与带线组比较,#P < 0.05,##P < 0.01;与注射组比较,&&& P < 0.001;与7 d比较,aP < 0.01, aaaP < 0.001;与14 d比较,bP < 0.005,bbP < 0.01。 2.4 Western Blot实验检测IUA组织内纤维化相关蛋白的表达情况
通过结果分析显示,与对照组比,造模7 d、14 d、28 d,各组纤维化指标均升高,组间差异具有统计学意义(P < 0.05)。各组间比较,造模7 d,注射组较带线组Collagen-Ⅰ、Collagen-Ⅲ及α-SMA表达升高(P < 0.05);注射组较明胶组Collagen-Ⅰ、Collagen-Ⅲ、α-SMA及TGF-β1表达升高(P < 0.05);明胶组较带线组各纤维化蛋白表达升高,但差异无统计学意义(P > 0.05);造模14 d,注射组较带线组Collagen-Ⅲ及α-SMA表达升高(P < 0.05);注射组较明胶组Collagen-Ⅰ、Collagen-Ⅲ、α-SMA及TGF-β1表达升高(P < 0.05);明胶组较带线组各纤维化蛋白表达升高,但差异无统计学意义(P > 0.05);造模28 d,注射组较带线组Collagen-Ⅰ、Collagen-Ⅲ、α-SMA及TGF-β1表达升高(P < 0.05);注射组较明胶组Collagen-Ⅰ、Collagen-Ⅲ、α-SMA及TGF-β1表达升高(P < 0.05);明胶组较带线组各纤维化蛋白表达升高,但差异无统计学意义(P > 0.05);在4个组中,注射组中的Collagen-Ⅰ、Collagen-Ⅲ、α-SMA及TGF-β1蛋白的表达是最高的,经过机械损伤后,注射脂多糖损伤大鼠子宫内膜的效果最为显著,且以造模28 d效果最佳,见图4。
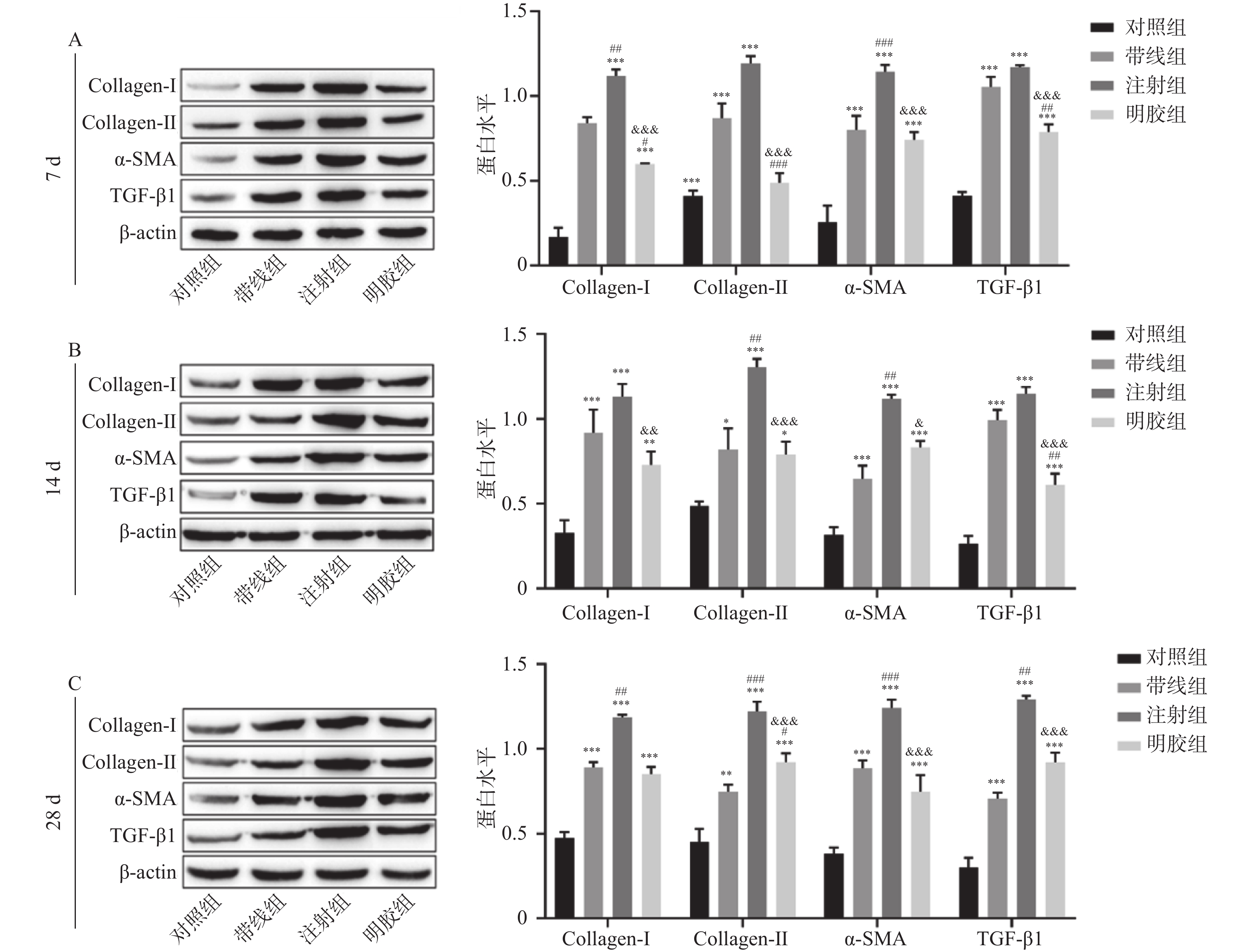 图 4 western blot检测纤维化有关蛋白的表达情况(
图 4 western blot检测纤维化有关蛋白的表达情况($\bar x \pm s $ )与对照组相比,*P < 0.05,**P < 0.01,***P < 0.001;与带线组相比,#P < 0.05,##P < 0.01,###P < 0.001;与注射组相比,& P < 0.05,&& P < 0.01,&&& P < 0.001。A:7 d大鼠子宫组织纤维化有关蛋白检测情况;B:14 d大鼠子宫组织纤维化有关蛋白检测情况;C:21 d大鼠子宫组织纤维化有关蛋白检测。Figure 4. The expression of fibrosis-related proteins detected by Western blot ($\bar x \pm s $ )3. 讨论
IUA组织病理学特点是子宫内膜纤维化程度增加,宫腔纤维组织黏稠,内膜组织萎缩,腺体减少且大多无活性,大量血管堵塞造成粘连部位低氧缺血等[10-11]。合适的人类疾病动物模型的构建是基础研究以及治疗策略评价的重要依据。目前,国内外对 IUA 模型动物的选择、造模方法等尚无统一的标准:以啮齿动物为代表的大鼠、小鼠以及兔等,在啮齿动物中,大鼠子宫相对于小鼠子宫大,且因其具有价格低廉、实验操作方便、遗传背景清晰、繁殖速度快等优点,常作为IUA较为理想的动物模型[12-13];尽管非人灵长类动物如恒河猴、狒狒等,虽然与人类相似的月经周期、生殖解剖生理等特征,但是在获取方面需要消耗大量的人力、物力以及财力,限制了推广[14]。本着节约成本、方便探究的特点,实验通常通过物理、化学或联合损伤的方法损伤啮齿动物子宫[15-17],以探究IUA的损伤机制。本研究拟就机械损伤中不同感染方式下双重损伤造模方法进行比较,建立于临床病理接近的IUA 大鼠模型,并对其治疗手段进一步探讨。目前一般认为创伤和感染为 IUA 发生的主要高危因素[18]。本研究针对IUA出现的两个高危因素-创伤和感染,并参照刘芳等[15]的实验方法,构建细菌脂多糖棉线感染建立大鼠宫腔粘连模型;构建IUA动物模型并比较不同感染方式联合损伤法的有效性。参照张永裕等[17]的研究,构建细菌脂多糖注射感染大鼠宫腔粘连模型;明胶海绵放置入体内后,可液化形成凝胶薄膜,在被生物体降解、吸收之前可起到屏障作用,研究证明透明质酸钠凝胶联合明胶海绵预防宫腔粘连[19]。结合刘芳、张永裕等造模方法[15, 17]为建模研究基础,在实验过程中对实验操作进行改进,构建细菌脂多糖明胶海绵大鼠宫腔粘连模型。在本研究中,对大鼠宫腔粘连模型的构建方法进行探索,均建立在以往研究的基础之上,旨在筛选出最有效的脂多糖感染方式,建立一个最佳且稳定的IUA大鼠模型。
上皮细胞和间充质细胞再生、新生血管形成、成纤维细胞增殖和细胞外基质过量积累等都会对其再生能力产生不利的影响[20]。尽管不同的造模手段都能对子宫内膜造成不同的损伤,成功构建IUA动物模型,但动物IUA的病理症状与发病机制与临床IUA仍存在一定的差距。因此,选取合适的方法并确定其发病原因与临床病理变化一致一直是值得探讨的问题。采用物理或化学损伤构建的IUA动物模型,在宫腔中留下的材料,可能会对影响后续的实验观察和指标检测。研究发现,单纯的机械损伤后,子宫内膜很容易再生[21],在14 d后子宫内膜上皮和腺体可完全再生[15],所以,将两种或多种损伤方法结合在一起也许更容易构建IUA动物模型。
脂多糖(lipopolysaccharide ,LPS)在发病机制中经常起关键作用,它可以进入血流并引发全身炎症反应,同时增加促炎介质(如IL-6)的产生[22]。有文献报道[23],LPS 可用于诱导急性子宫损伤(acute uterine injury,AUI)和IUA的细胞和动物模型,在LPS注射后6~12 h观察到子宫内膜损伤,其特征是肉眼可见水肿;LPS注射后6 h子宫内膜上皮和基质中的中性粒细胞和中性粒细胞;LPS注射后24 h,子宫内膜损伤得到明显修复。LPS注射后6 h中性粒细胞显著增加,并在注射后24 h恢复到注射前的正常水平。
在使用机械造成子宫内膜损伤的基础上,联合脂多糖感染的方法,能进一步干扰炎症反应,达到加重子宫内膜损伤的程度[24]。本研究显示,与对照组大鼠比较,造模组大鼠的子宫内膜腺体数量减少,子宫内膜变薄,纤维化程度加重(P < 0.05);并且随着造模时间的延长,造模组大鼠的子宫内膜腺体数量减少、子宫内膜厚度变薄以及纤维化程度均加重。这提示大鼠宫腔粘连模型构建成功,该建模方法操作简单,对内膜损伤明显,模型相对稳定。此外,脂多糖棉线、脂多糖明胶及脂多糖注射的感染方式均能构建大鼠IUA双重损伤模型,其中注射脂多糖的感染方式效果最佳,建模成功率和模型稳定性最高,操作方便,更符合动物实验伦理要求,且选择注射脂多糖的感染方式造模的动物模型与临床IUA病理症状更为相似,这为进一步探讨IUA发生的机制和探索更好的治疗手段奠定了理论依据。脂多糖明胶组为本实验探讨研究的新方法,本研究的思路为将明胶海绵作为细菌脂多糖的传递的媒介,将明胶海绵浸泡于细菌脂多糖中,避免刮宫后注射细菌脂多糖后,细菌脂多糖液从阴道流出。脂多糖明胶组与感染脂多糖棉线相比,避免二次从腹腔将棉线取出的操作,且造成宫腔粘连的结果优于感染脂多糖棉线组。尽管造成宫腔粘连模型的稳定性不如脂多糖明胶组,但为宫腔粘连模型提供新思路。
病理学研究表明,细胞外基质纤维蛋白原聚集可导致子宫内膜组织出现纤维化[25],而TGF-β1是目前引起器官纤维化最重要的细胞因子之一,其在子宫内膜中呈现高表达[26]。Collagen-Ⅰ、Collagen-Ⅲ、α-SMA作为纤维标志蛋白[27],在本研究中,与对照组相比,机械损伤后不同的处理方式都会上调TGF-β1、Collagen-Ⅰ、Collagen-Ⅲ和α-SMA的表达,造模7 d、14 d和28 d,对照组相、带线组、注射组和明胶组4组中,注射组中的Collagen-Ⅰ、Collagen-Ⅲ、α-SMA及TGF-β1蛋白的表达都是最高的,经过机械损伤后,注射脂多糖损伤大鼠子宫的效果最为显著。
综上所述,刮宫联合注射LPS大鼠的子宫内膜纤维化程度最严重,注射LPS能够构建稳定的宫腔粘连大鼠模型,为后续进行相关机制研究提供了稳定动物模型。
-
图 4 western blot检测纤维化有关蛋白的表达情况(
$\bar x \pm s $ )与对照组相比,*P < 0.05,**P < 0.01,***P < 0.001;与带线组相比,#P < 0.05,##P < 0.01,###P < 0.001;与注射组相比,& P < 0.05,&& P < 0.01,&&& P < 0.001。A:7 d大鼠子宫组织纤维化有关蛋白检测情况;B:14 d大鼠子宫组织纤维化有关蛋白检测情况;C:21 d大鼠子宫组织纤维化有关蛋白检测。
Figure 4. The expression of fibrosis-related proteins detected by Western blot (
$\bar x \pm s $ )表 1 大鼠子宫腺体数量统计
Table 1. Number of uterine glands in rats
组别 7 d腺体
数量(个)14 d腺体
数量(个)28 d腺体
数量(个)对照组 11.00 10.00 9.50 带线组 6.25△△△ 6.00△ 5.75△ 注射组 2.00△△△ ## 1.00△△△## 0.50△△△### 明胶组 5.25△△ 5.00△△△&& 4.50△△& F 11.98 33.11 20.81 P 0.0006* < 0.001* < 0.001* *P < 0.05;与对照组比较,△P < 0.05,△△P < 0.01,△△△P < 0.001;与带线组比较,#P < 0.05,##P < 0.01;与注射组比较,&P < 0.05,&& P < 0.01。 表 2 大鼠子宫内膜纤维化程度(%)
Table 2. Area of endometrial fibrosis in rats (%)
组别 7 d纤维化程度 14 d纤维化程度 28 d纤维化程度 对照组 21.04 8.76 18.92 带线组 61.83△△ 83.89△△△ 142.99aaabbb 注射组 202.51△△△## 253.58△△△### aaa bbb 310.23△△△### aaabbb 明胶组 96.22△△△#&&& 109.54△△△&&& aaabbb 171.12△△△&&& aaabbb F 127.3 194 207.9 P < 0.001* < 0.001* < 0.001* *P < 0.05;与对照组比较,△P < 0.05,△△P < 0.01,△△△P < 0.001;与带线组比较,#P < 0.05,##P < 0.01;与注射组比较,&&& P < 0.001;与7 d比较, aaaP < 0.001;与14 d比较,bbbP < 0.001。 表 3 大鼠子宫内膜TGF-β1的蛋白阳性率比较(%)
Table 3. Comparison of protein positivity rate of endometrial TGF-β1 on the endometrium in rats (%)
组别 7 d阳性率 14 d阳性率 28 d阳性率 对照组 54.41 42.54 45.41 带线组 67.58 86.66△△△ 117.31△△△aaabb 注射组 106.45△△△ 111.15△△△ 139.87△△△aab 明胶组 80.68& 102.24△△△a 109.77△△△&& F 13.37 17.58 41.69 P 0.0018* 0.007* < 0.001* *P < 0.05;与对照组比较,△P < 0.05,△△P < 0.01,△△△P < 0.001;与带线组比较,#P < 0.05,##P < 0.01;与注射组比较,&&& P < 0.001;与7 d比较,aP < 0.01, aaaP < 0.001;与14 d比较,bP < 0.005,bbP < 0.01。 -
[1] Dreisler E,Kjer J J. Asherman's syndrome: current perspectives on diagnosis and management[J]. International journal of women's health,2019,11:191-198. doi: 10.2147/IJWH.S165474 [2] 王素敏,花向东. 不同方法对子宫内膜损伤修复的治疗结局探讨[J]. 中国实用妇科与产科杂志,2022,38(9):885-891. [3] 许阡,王祎祎,臧春逸. 宫腔粘连临床病因学及诊疗研究进展[J]. 国际妇产科学杂志,2021,48(2):224-229,240. doi: 10.12280/gjfckx.20200820 [4] 中华医学会妇产科学分会. 宫腔粘连临床诊疗中国专家共识[J]. 中华妇产科杂志,2015,50(12):881-887. doi: 10.3760/cma.j.issn.0529-567x.2015.12.001 [5] Sun L,Zhang S,Chang Q,et al. Establishment and comparison of different intrauterine adhesion modelling procedures in rats[J]. Reprod Fertil Dev,2019,38(14):149-156. [6] 梁姗姗,植枝福,黄滟岚. 宫腔粘连动物模型建立的研究进展[J]. 中华生殖与避孕杂志,2022,42(8):874-877. [7] 陈艳玲,孙冬岩. 大鼠宫腔粘连模型的研究进展[J]. 中国计划生育和妇产科,2022,14(1):49-51. [8] 付振琳,陈欣,杨菁. 藏药韦色尼阿丸预防宫腔粘连形成的实验研究[J]. 生殖医学杂志,2021,30(4):524-529. doi: 10.3969/j.issn.1004-3845.2021.04.018 [9] 江梅,姜经航,邵帅,等. 宫腔粘连大鼠模型的构建以及二甲双胍对模型大鼠生育能力的改善作用[J]. 广西医学,2021,43(1):62-66. [10] Chen Y,Chang Y,Yao S. Role of angiogenesis in endometrial repair of patients with severe intrauterine adhesion[J]. Int J Clin Exp Pathol,2013,6(7):1343-1350. [11] Kou L,Jiang X,Xiao S,et al. Therapeutic options and drug delivery strategies for the prevention of intrauterine adhesions[J]. Journal of controlled release:official journal of the Controlled Release Society,2020,318:25-37. doi: 10.1016/j.jconrel.2019.12.007 [12] 王改,贺斌,徐祥波,等. 子宫内膜损伤与宫腔粘连动物模型的研究进展[J]. 生殖医学杂志,2014,23(10):856-859. doi: 10.3969/j.issn.1004-3845.2014.10.017 [13] 黄璞,张诚,李春艳,等. 子宫内膜异位症动物模型的研究进展[J]. 现代妇产科进展,2020,29(8):634-637. doi: 10.13283/j.cnki.xdfckjz.2020.08.033 [14] 张春斌,谈西满,罗佳滨,等. 子宫内膜异位症动物模型的研究现状及进展[J]. 黑龙江医药科学,2008,31(3):80-81. doi: 10.3969/j.issn.1008-0104.2008.03.090 [15] 刘芳,何援利. 机械和感染双重损伤法建立新西兰大白兔宫腔粘连模型[J]. 重庆医学,2013,42(7):765-767. [16] 阳媛,毛艳华,王佳,等. 机械和感染双重法建立中华田园犬宫腔粘连模型[J]. 重庆医科大学学报,2017,42(4):401-405. doi: 10.13406/j.cnki.cyxb.001225 [17] 张永裕,谭国胜,罗灿桥,等. 多重损伤法建立大鼠宫腔粘连模型及其对子宫内膜LIF及整合素αvβ3的影响[J]. 中山大学学报:医学科学版,2016,37(1):15-22. [18] 施佳艳. 宫腔粘连发生的高危因素分析[J]. 蚌埠医学院学报,2021,46(3):376-377. doi: 10.13898/j.cnki.issn.1000-2200.2021.03.026 [19] 吴言英,王敏. 透明质酸钠凝胶联合明胶海绵预防宫腔粘连的研究[J]. 黑龙江医药,2017,30(6):1214-1216. doi: 10.14035/j.cnki.hljyy.2017.06.013 [20] Prianishnikov V A. On the concept of stem cell and a model of functional-morphological structure of the endometrium[J]. Contraception,1978,18(3):213-223. doi: 10.1016/S0010-7824(78)80015-8 [21] 郭意欣,关婷. 机械损伤联合不同感染方法建立大鼠宫腔粘连模型的对比研究[J]. 现代妇产科进展,2018,27(9):693-695. doi: 10.13283/j.cnki.xdfckjz.2018.09.014 [22] 曹承华,贺雅静,高荧苒,等. LPS介导的炎症反应过程及作用机制[J]. 河南大学学报:医学版,2017,36(1):70-76. [23] Xiao L,Song Y,Huang W,et al. Expression of SOX2,NANOG and OCT4 in a mouse model of lipopolysaccharide-induced acute uterine injury and intrauterine adhesions[J]. Reproductive Biology and Endocrinology,2017,15(1):14-20. doi: 10.1186/s12958-017-0234-9 [24] Dd B,Se G. Direct effects of endotoxinon the endothelium: barrier function and injury[J]. Lab Invest,1999,79(10):1181-1199. [25] Bai X,Liu J,Cao S,et al. Mechanisms of endometrial fibrosis and the potential application of stem cell therapy[J]. Discovery medicine,2019,27(150):267-279. [26] 谢小惠. 宫腔粘连患者子宫内膜TGF-β1、β-catenin的表达及雌激素与生长激素治疗的比较 [D]. 长沙: 中南大学, 2014. [27] 周柳. TGF-β1诱导的Postn、α-SMA和CollagenⅠ在宫腔粘连内膜组织中表达上调且与粘连程度相关 [D]. 重庆: 重庆医科大学, 2018. -






 下载:
下载:


 下载:
下载:

