Role of HK2 and VDAC1 in Diacetylmorphine-induced Cardiomyocyte Apoptosis
-
摘要:
目的 探讨HK2和VDAC1在二乙酰吗啡致心肌细胞凋亡中的作用。 方法 采用剂量递增方法,建立二乙酰吗啡成瘾大鼠模型。将40只SD大鼠随机分为3组,正常组(Control,n=10)皮下注射等量生理盐水;模型组(Model,n=15)首次皮下注射二乙酰吗啡剂量为 5 mg/kg,以后逐日递增剂量 2.5 mg/(kg·d),连续注射20 d;模型+10 D组(Model+10D,n=15)在模型组基础上继续递增剂量至第10天。采用ELISA法检测乳酸脱氢酶(lactate dehydrogenase,LDH)、谷草转氨酶(glutamic oxaloacetic transaminase,GOT)含量;采用 HE 染色观察各组心肌组织病理变化;采用TUNEL染色检测各组心肌组织细胞凋亡;采用免疫组化、RT-qPCR和Western blot检测HK2、VDAC1及凋亡相关因子的mRNA和蛋白的表达变化。 结果 HE染色发现随着二乙酰吗啡干预时间的延长,心肌组织表现出不同程度的损伤。与正常组相比,模型组中血清LDH、GOT含量及心肌凋亡率升高,HK2和抗凋亡因子Bcl-2的mRNA和蛋白水平下降,VDAC1和促凋亡因子Bax、Caspase-3的mRNA和蛋白水平升高,Clevead Caspase-3蛋白水平升高;与正常组相比,模型+10 D组中以上指标,差异有统计学意义(P < 0.05)。 结论 二乙酰吗啡可导致心肌细胞凋亡,HK2和VDAC1可能参与了二乙酰吗啡致心肌细胞凋亡的过程。 -
关键词:
- 二乙酰吗啡 /
- 心肌凋亡 /
- 己糖激酶2 /
- 电压依赖性阴离子通道1 /
- 裂解半胱氨酸天冬氨酸蛋白酶-3
Abstract:Objective To investigate the role of HK2 and VDAC1 in diacetylmorphine-induced cardiomyocyte apoptosis. Methods A dose-escalation method was used to establish a rat model of diacetylmorphine addiction. Forty SD rats were randomly divided into three groups, the normal group (n=10) was injected with an equal amount of saline subcutaneously, the model group (n=15) was injected with 5 mg/kg of diacetylmorphine for the first time, and then the dose was increased by 2.5 mg/ (kg·d) day by day for 20 days, and the group of model + 10 D (n=15) continued to increase the dose based on the model group up to the 10th day. Lactate dehydrogenase (LDH) and glutamic oxaloacetic transaminase (GOT) were detected by ELISA; HE staining was used to observe the pathological changes of myocardial tissues in each group; TUNEL staining was used to detect apoptosis in myocardial tissues in each group; and immunohistochemistry, RT-q-analysis, and immunochemistry were used to detect apoptosis in myocardial tissues in each group. Immunohistochemistry, RT-qPCR and Western blot were used to detect the mRNA and protein expression of HK2, VDAC1 and apoptosis-related factors. Results HE staining revealed that myocardial tissues exhibited different degrees of damage with the prolongation of diacetylmorphine intervention. Compared with the normal group, serum LDH, GOT content and myocardial apoptosis rate increased in the model group, mRNA and protein levels of HK2 and anti-apoptotic factor Bcl-2 decreased, mRNA and protein levels of VDAC1 and pro-apoptotic factors Bax and Caspase-3 increased, and the protein level of Clevead Caspase-3 increased; in the model + 10 D group the above indexes, there was a statistically significant difference (P < 0.05). Conclusion Diacetylmorphine can cause cardiomyocyte apoptosis, and VDAC1 may be involved in the process of cardiomyocyte apoptosis caused by diacetylmorphine. -
Key words:
- Diacetylmorphine /
- Cardiac apoptosis /
- HK2 /
- VDAC1 /
- Clevead Caspase-3
-
目前,药物滥用仍然是一个全球性的问题。二乙酰吗啡是一种阿片类激动剂,因其止痛效果和欣快感而经常被滥用[1]。研究表明,凋亡过度可引起心肌细胞结构紊乱及功能障碍[2]。吸食或注射二乙酰吗啡会损伤心血管系统,使心脏正常生理功能发生障碍,其机制可能与心肌凋亡有关[3]。
己糖激酶(hexokinase,HKs)是一种进化上保守的酶,可以磷酸化六碳糖。己糖激酶2(hexokinase 2,HK2)是HKs之一,主要存在于脂肪、骨骼肌和心肌等胰岛素敏感组织中[4],其功能之一是直接调节细胞凋亡,被认为是防止细胞器损伤和维持细胞凋亡后活力的潜在靶点[5]。电压依赖性阴离子通道1(voltage-dependent anion channel 1,VDAC1)是已鉴定的三种哺乳动物亚型中最丰富的,它不仅调节细胞的氧化还原状态,还介导Ca2+和ROS等离子在线粒体和细胞质之间的转移[6],并可释放凋亡相关因子进入胞浆,从而导致细胞凋亡[7]。Fan等[8]学者发现,线粒体通透性转换孔(mPTP)的重要成员HK2可以通过与VDAC1结合并保持其开放构象来交换ATP/ADP,从而维持mPTP的完整性,防止细胞凋亡,提示HK2和VDAC1存在相互作用关系。目前HK2和VDAC1在肿瘤中得到广泛研究,而在二乙酰吗啡致心肌细胞凋亡中的作用仍不清楚。本研究初步探讨HK2和VDACl在二乙酰吗啡致大鼠心肌细胞凋亡中的作用,为进一步探索二乙酰吗啡导致的心脏损伤提供新的防治靶标。
1. 材料与方法
1.1 研究材料
1.1.1 实验动物
40只SPF级SD大鼠,雌雄不限,体质量(220±30)g,由新疆医科大学实验动物中心提供,动物生产许可证号:SYXK(新)2018-0002,实验已通过新疆医科大学第一附属医院动物实验医学伦理委员会审批(20200320-145)。
1.1.2 药品与试剂
二乙酰吗啡粉剂,纯度:90%以上,由新疆维吾尔自治区禁毒总队提供。HK2、VDAC1、Bcl-2相关X蛋白基因(Bcl-2 associated X protein,Bax)、β-肌动蛋白(Beta-actin,β-actin)抗体,均由英国Abcam公司生产。B细胞淋巴瘤/白血病-2基因(B-cellymphoma-2,Bcl-2)、半胱氨酸天冬氨酸特异性蛋白酶-3(Cysteinylaspartate specific proteinase-3,Caspase-3)抗体,均购自中国Abclonal公司。Total RNA Kit I试剂盒,中国北京诺博莱德科技有限公司生产。TUNEL试剂盒,美国Roche公司生产。LDH和GOT试剂均购自中国索莱宝生物科技有限公司。
1.1.3 主要仪器
CFX96 实时荧光定量PCR仪,美国伯乐公司产品;BX43 荧光显微镜,日本 Olymplus 公司产品。
1.2 研究方法
1.2.1 实验分组、二乙酰吗啡成瘾模型构建
SD大鼠随机分为3组,分别为正常组(Control)、模型组(Model)、模型+10 D组(Model+10 D)。参照 Min Ji[9]的方法,首次皮下注射二乙酰吗啡剂量为 5 mg/kg,以后逐日剂量递增法[递增剂量 2.5 mg/(kg·d)]建立二乙酰吗啡成瘾大鼠模型。模型建立成功后,在此基础上继续递增剂量至第10天,进一步建立二乙酰吗啡成瘾+10 D模型。
1.2.2 ELISA检测LDH、GOT含量
给药结束后,腹主动脉采血,采用ELISA检测各组大鼠血清GOT、LDH含量,该实验重复6次。
1.2.3 HE染色观察心肌组织病理变化
将心脏组织固定后,切片等步骤结束后,进行HE染色,并在光学显微镜下观察心脏组织的形态。
1.2.4 TUNEL染色检测心肌凋亡
随机抽取6张心肌组织石蜡切片,烤片脱蜡等步骤结束后,PBS洗2次,配置蛋白酶K∶PBS=1∶200覆盖于组织(常温,15~30 min),PBS洗2次,蛋白酶K覆盖期间可配置TUNEL反应液,反应液1∶反应液2=1∶9,每张切片50 μL反应液覆盖即可(37 ℃,1 h),PBS洗3次进行DAPI染色(常温,10 min),最后滴1滴PBS在片子上以防干片,荧光显微镜下观察。每张切片在200×视野下随机选取3~5个视野获取图像进行计数,细胞凋亡率为细胞凋亡数(红色)/总细胞数(蓝色)×100%。
1.2.5 免疫组化检测相关蛋白表达
切片标本随机抽取6张,EDTA修复后,滴加HK2、VDAC1、Bax、Bcl-2、Caspase-3一抗(37 ℃ ,60 min),随后滴加通用型二抗(37 ℃ ,15 min)。每张切片在200×视野下随机选取3~5个视野获取图像,Image J软件对图像进行定量测量,在细胞中观察到棕色反应颗粒显示为阳性结果,阳性信号的平均光密度值(AOD=累积光密度值/视野面积)。
1.2.6 RT-qPCR检测心肌组织中相关基因表达
将小块心肌组织剪至平底研磨管,放入研磨仪中研磨(3次,45 s)。提取组织总RNA后,上机测260/280>1.8时合成cDNA。后续按PCR试剂盒说明书进行操作,以β-actin作为内参,用2-△△Ct法计算HK2、VDAC1、Bax、Bcl-2、Caspase-3 mRNA的相对表达,该实验重复6次。
1.2.7 Western blot检测心肌组织中相关蛋白表达
按照心肌组织:RIPA裂解液=1 mg∶10 μL比例进行匀浆,离心(4 ℃,20 min,12000 r/min),离心后取上清液,通过BCA蛋白定量法(定2 μg/μL)测定蛋白含量后,每组取蛋白3 μL进行10% SDS-PAGE电泳,之后将分离的蛋白湿转至PVDF膜,用5×脱脂奶粉在摇床中进行封闭(37 ℃,2 h),一抗4 ℃孵育过夜,二抗常温孵育1 h,通过显色成像并用Image J软件分析灰度值做量化分析,该实验重复6次。
1.3 统计学处理
所有计量数据以均数±标准差($ \bar x \pm s $)表示。采用SPSS 24.0软件分析,GraphPad Prim 8.0软件作图。组间比较采用 t 检验,多组间比较采用单因素方差分析,单因素方差分析有意义后各组两两比较采用 q 检验。P < 0.05表示差异具有统计学意义。
2. 结果
2.1 二乙酰吗啡对大鼠心功能的影响
给药完毕后,与正常组相比,模型组、模型+10 D组大鼠血清中的LDH、GOT表达水平升高(P < 0.05),说明损伤随二乙酰吗啡干预时间延长而呈递增趋势,见图1。
2.2 二乙酰吗啡对大鼠心肌组织形态的影响
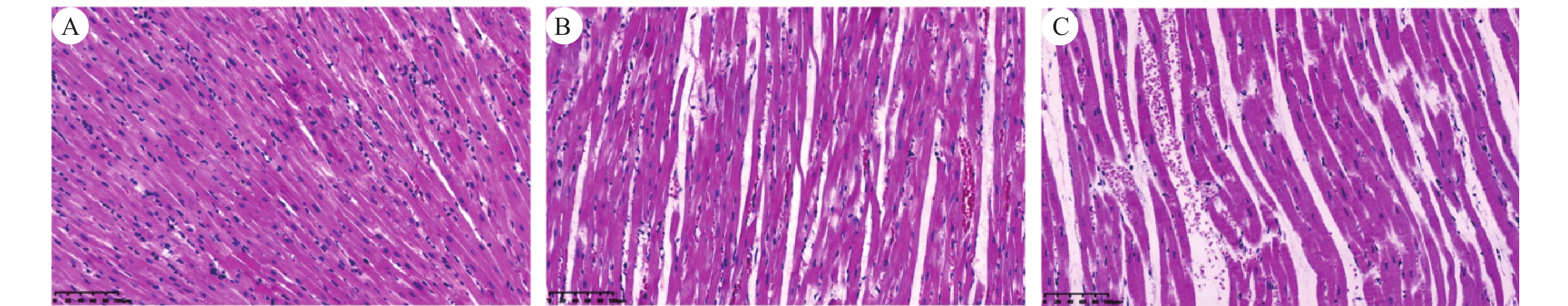
正常组心肌细胞排列整齐,心肌间质轻微水肿但未见炎性细胞,心肌组织形态学正常;模型组出现大量的心肌细胞坏死、细胞核散落在细胞外现象或细胞核固缩、溶解现象明显,炎症浸润,肌原纤维丝局部出现断裂;随着加药时间的延长,模型+10 D组的形态变化比模型组更加明显,心肌细胞出现明显损伤,细胞破碎严重,肌原纤维丝排列紊乱并且断裂增多,见图2。
2.3 TUNEL染色检测二乙酰吗啡对大鼠心肌细胞凋亡的影响
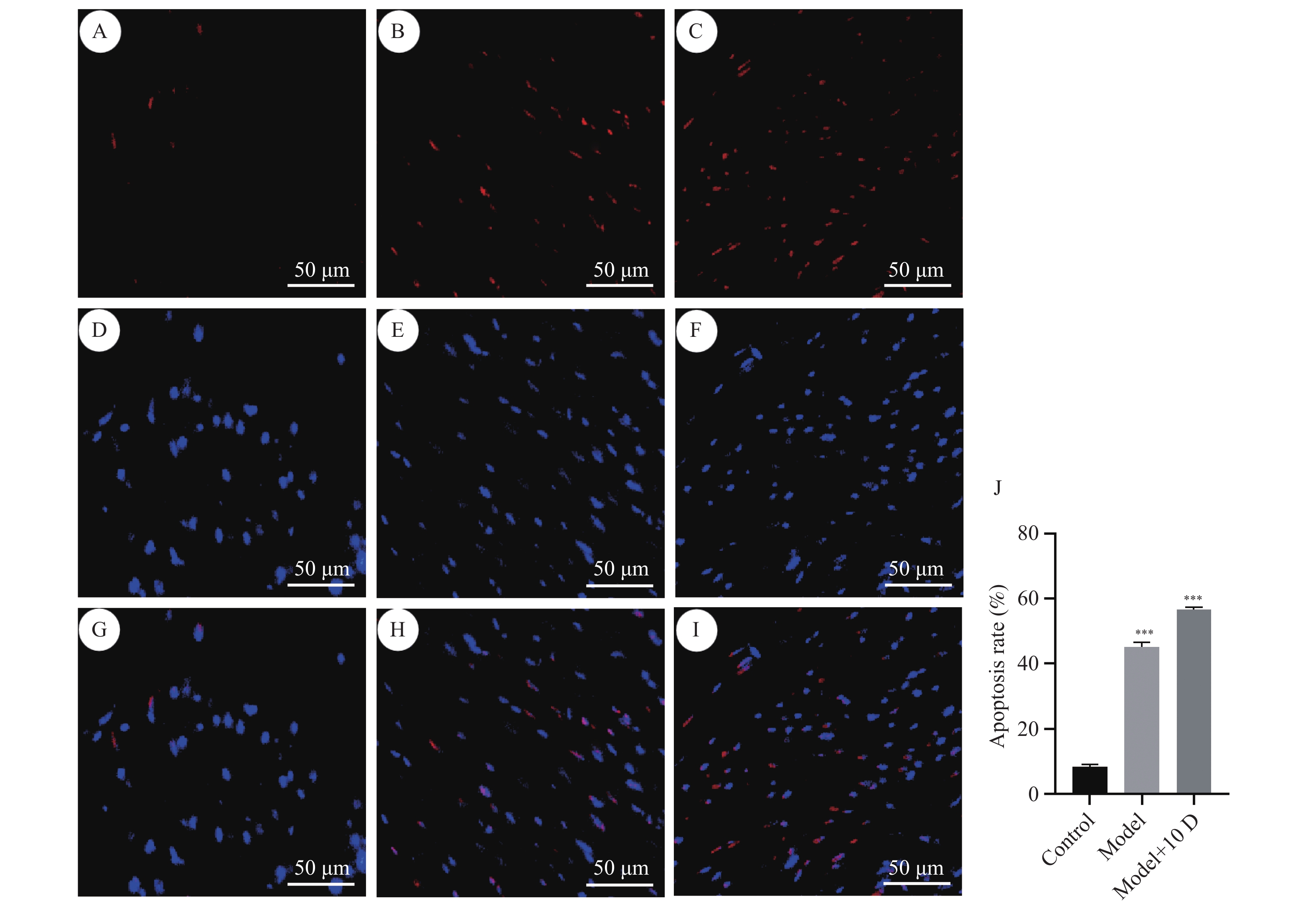
与正常组相比,模型组和模型+10 D组阳性细胞比例明显升高(P < 0.05),见图3。
2.4 二乙酰吗啡对心肌组织中HK2、VDAC1及相关凋亡蛋白的影响
与正常组比较,模型组和模型+10 D组的心肌组织中HK2和Bcl-2蛋白AOD降低(P < 0.05),VDAC1、Bax和Caspase-3蛋白AOD升高(P < 0.05),见图4。
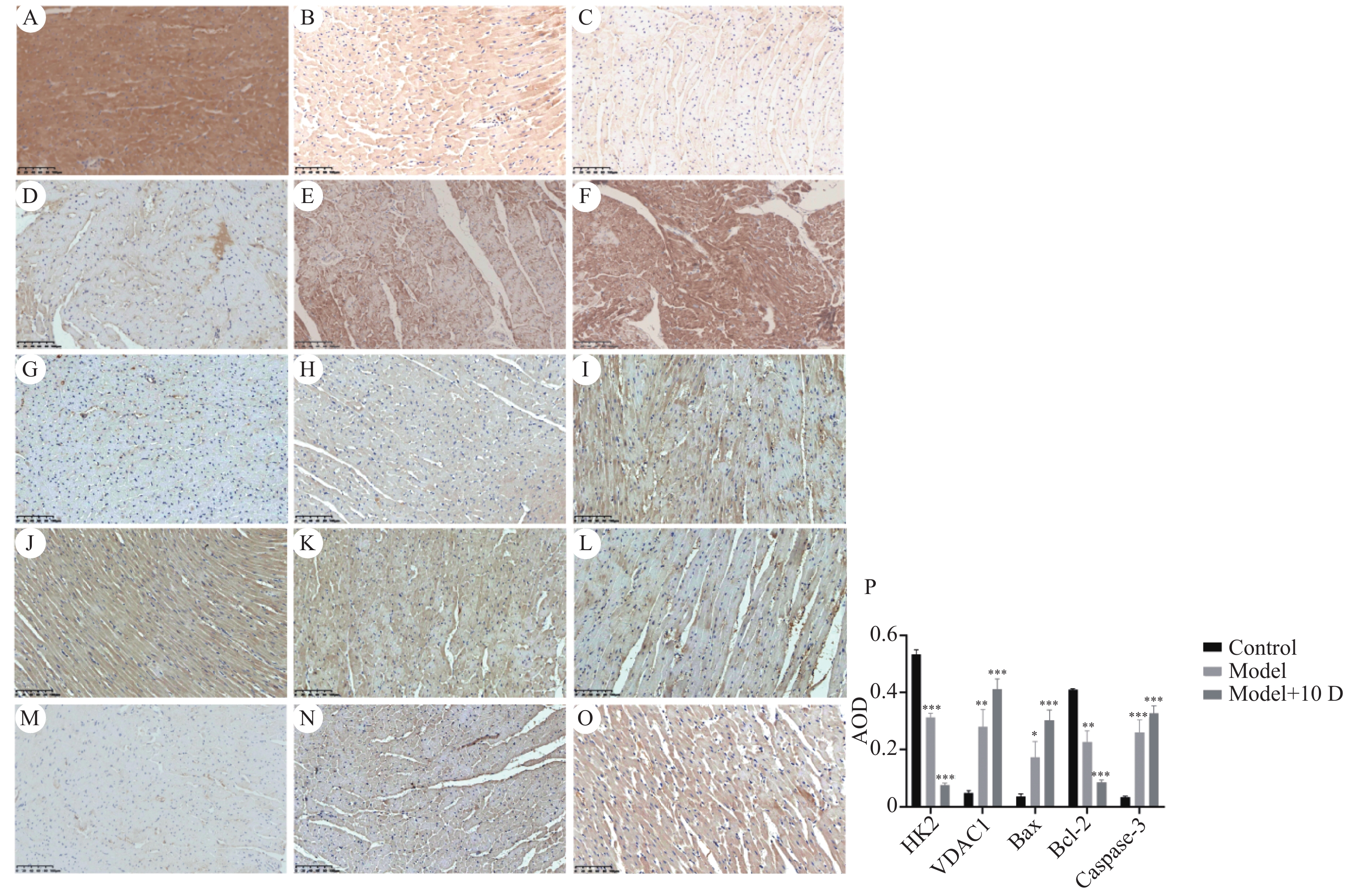 图 4 大鼠心肌组织HK2、VDAC1、Bax、Bcl-2、Caspase-3蛋白表达(×200)A:正常组HK2表达;B:模型组HK2表达;C:模型+10 D组HK2表达;D:正常组VDAC1表达;E:模型组VDAC1表达;F:模型+10 D组VDAC1表达;G:正常组Bax表达;H:模型组Bax表达;I:模型+10 D组Bax表达;J:正常组Bcl-2表达;K:模型组Bcl-2表达;L:模型+10 D组Bcl-2表达;M:正常组Caspase-3表达;N:模型组Caspase-3表达;O:模型+10 D组Caspase-3表达;P:大鼠心肌组织HK2、VDAC1、Bax、Bcl-2、Caspase-3蛋白AOD表达情况(
图 4 大鼠心肌组织HK2、VDAC1、Bax、Bcl-2、Caspase-3蛋白表达(×200)A:正常组HK2表达;B:模型组HK2表达;C:模型+10 D组HK2表达;D:正常组VDAC1表达;E:模型组VDAC1表达;F:模型+10 D组VDAC1表达;G:正常组Bax表达;H:模型组Bax表达;I:模型+10 D组Bax表达;J:正常组Bcl-2表达;K:模型组Bcl-2表达;L:模型+10 D组Bcl-2表达;M:正常组Caspase-3表达;N:模型组Caspase-3表达;O:模型+10 D组Caspase-3表达;P:大鼠心肌组织HK2、VDAC1、Bax、Bcl-2、Caspase-3蛋白AOD表达情况($ \bar x \pm s $ Figure 4. Expression of HK2,VDAC1,Bax,Bcl-2 and Caspase-3 protein in rat myocardial tissue (×200)2.5 二乙酰吗啡对心肌组织中HK2、VDAC1及相关凋亡基因的影响
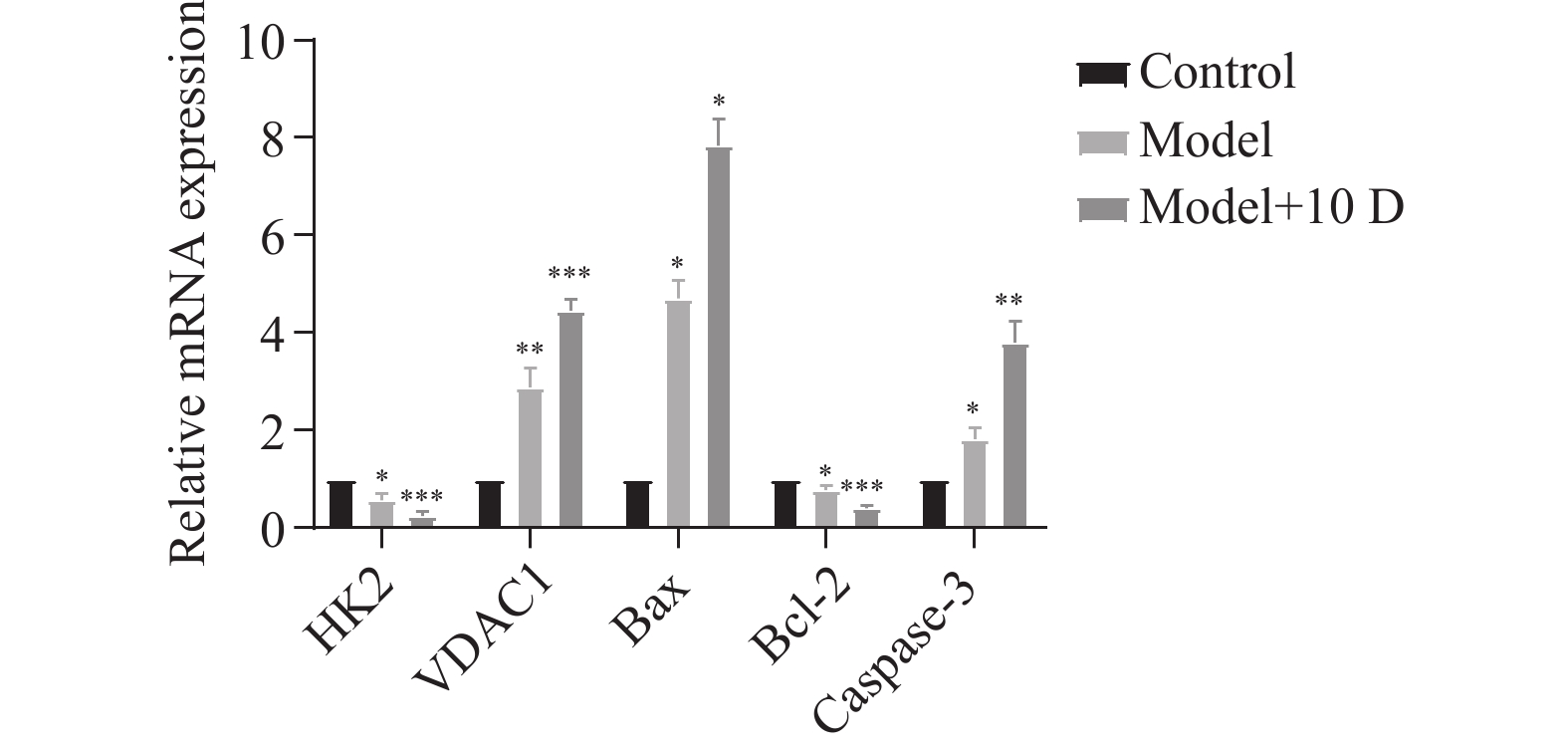
与正常组相比,模型组、模型+10 D组心肌组织中HK2、Bcl-2 mRNA表达下调(P < 0.05);VDAC1、Bax、Caspase-3 mRNA表达上调(P < 0.05),见表1和图5。
表 1 二乙酰吗啡对心肌组织中HK2、VDAC1、Bax、Bcl-2、Caspase-3 mRNA表达的影响($ \bar x \pm s $,n=6)Table 1. Effects of diamorphine on the mRNA expression of HK2,VDAC1,Bax,Bcl-2 and Caspase-3 in myocardium($ \bar x \pm s $,n=6)基因 正常组 模型组 模型+10 D组 F P HK2 1.00±0.00 0.57±0.14* 0.24±0.09*** 48.77 0.009# VDAC1 1.00±0.00 3.00±0.61** 4.46±0.25*** 32.62 0.027# Bax 1.00±0.00 4.88±0.17* 7.64±0.44* 50.32 0.001# Bcl-2 1.00±0.00 0.75±0.10* 0.39±0.05*** 34.86 0.020# Caspase-3 1.00±0.00 1.91±0.11* 3.78±0.38** 45.67 0.020# 与正常组比较,*P < 0.05,**P < 0.01,***P < 0.001。组间比较,#P < 0.05。 2.6 二乙酰吗啡对心肌组织HK2、VDAC1及相关凋亡蛋白的影响
Western blot结果显示,与正常组相比,模型组HK2和Bcl-2蛋白表达水平下降,VDAC1、Bax、Caspase-3和Cleaved Caspase-3蛋白表达水平上升。随着二乙酰吗啡干预时间延长,趋势愈加明显。上述指标,正常组与模型组或与模型+10 D组相比,差异均有统计学意义(P < 0.05),见图6。
3. 讨论
近年来,阿片类药物使用率逐年上升,海洛因化学名为二乙酰吗啡,作为阿片类药物具有高度成瘾性[1]。尽管公众意识逐渐加强且出现大量新的合成药物,但二乙酰吗啡的吸引力并没有减弱。研究表明二乙酰吗啡对心血管系统危害极为严重[10],但目前对其具体机制尚不明确,有待进一步深入研究。
杜磊等[11]发现吗啡治疗急性心肌缺血再灌注大鼠后,大鼠的心脏功能有所恢复。本研究结果发现二乙酰吗啡干预后心肌损伤标志物LDH、GOT表达水平升高,且心肌组织结构排列紊乱,肌原纤维丝发生断裂,这与本研究结论不一致,考虑可能原因与药物给药剂量与给药时间长短不同所致。细胞凋亡存在于各种细胞生物中,是一种受促凋亡因子和抗凋亡信号调控的程序性细胞死亡,其生物学特征是半胱天冬酶的激活[12]。国内学者研究发现二乙酰吗啡会降低视网膜组织抗氧化能力,诱导视网膜细胞凋亡[13];二乙酰吗啡对大脑产生各种神经毒性作用,例如灰质丧失、神经元凋亡等[14];以上研究提示二乙酰吗啡可使组织器官受损并参与细胞凋亡。本研究通过建立二乙酰吗啡成瘾模型,发现大鼠心肌组织在二乙酰吗啡干预下有不同程度地损伤,且凋亡率显著升高,这与刘小山等[15]的研究结果相一致,进一步证实二乙酰吗啡干预后造成心肌组织损害并发生凋亡。HK2作为己糖激酶同工酶之一,主要存在于胰岛素敏感组织如脂肪、骨骼肌和心肌[16]。有研究表明,HK2在某些疾病模型上能够调控细胞凋亡。Song G等[17]发现类风湿关节炎滑膜中HK2的表达及其活性增加,沉默HK2可降低促炎因子的产生和细胞活力,并且诱导细胞凋亡;Kim等[18]研究表明过氧化氢可诱导心肌细胞凋亡,而预防HK2下调可能挽救心肌细胞免于凋亡。在哺乳动物中,VDAC有3种亚型,其中VDAC1最丰富,它不仅可以控制能量来源和代谢,还可以调节表观基因组元件和细胞凋亡[19],这证明了该蛋白质可作为多种病理中的药物靶点的潜力。Shoshan-BarmatzV等[20]学者证明在阿尔茨海默氏病患者的大脑中,表现出高水平的VDAC1,通过靶向干预VDAC1以防止这种促凋亡活性。宋阿北[21]等表明在结核病中,卡介苗感染能够引起巨噬细胞发生凋亡并导致VDAC1表达上调,敲低VDAC1后能够降低细胞凋亡相关基因和蛋白的表达。凋亡是癌细胞克服化学抗性的主要机制之一,HK2可通过在线粒体上表达并与VDAC1结合来抵抗癌细胞的凋亡[22]。Yuan S等[23]发现内皮抑素可刺激内皮细胞凋亡,诱导HK2减少,促进VDAC1积累。既往研究发现通过与VDACl相结合,HK2能够抑制凋亡,提高其对化疗的抗性[24]。本研究通过免疫组化结果发现,HK2和Bcl-2蛋白AOD显著下降,VDAC1、Bax、Caspase-3蛋白AOD显著上升。此外,RT-qPCR 和Western blot结果显示在二乙酰吗啡成瘾模型中HK2 mRNA和蛋白表达下降,VDAC1 mRNA和蛋白表达升高,随着干预时间延长,心肌组织损伤加重且凋亡率增加,蛋白表达差异更加显著,这与国内外学者研究结果相一致,同时,本研究发现抗凋亡因子Bcl-2表达水平下降,促凋亡因子Bax、Clevead Caspase-3表达水平升高,进一步提示HK2和VDAC1参与了二乙酰吗啡所致的心肌凋亡。
综上所述,本研究表明HK2和VDAC1都有不同程度地改变,其机制可能与二乙酰吗啡造成心肌损伤且引起心肌凋亡有关,这些研究结果将为二乙酰吗啡吸入和注射引起的心肌损伤患者的治疗和预防提供了理论依据。但本研究结果是在动物实验中得到的验证,并没有探讨HK2和VDAC1之间的作用关系,其对凋亡过程的调控机制尚不完善,后续将进一步研究,更好的为之后临床诊断、治疗以及预后提供新思路。
-
图 4 大鼠心肌组织HK2、VDAC1、Bax、Bcl-2、Caspase-3蛋白表达(×200)
A:正常组HK2表达;B:模型组HK2表达;C:模型+10 D组HK2表达;D:正常组VDAC1表达;E:模型组VDAC1表达;F:模型+10 D组VDAC1表达;G:正常组Bax表达;H:模型组Bax表达;I:模型+10 D组Bax表达;J:正常组Bcl-2表达;K:模型组Bcl-2表达;L:模型+10 D组Bcl-2表达;M:正常组Caspase-3表达;N:模型组Caspase-3表达;O:模型+10 D组Caspase-3表达;P:大鼠心肌组织HK2、VDAC1、Bax、Bcl-2、Caspase-3蛋白AOD表达情况($ \bar x \pm s $,n=6)。与正常组比较,*P<0.05,**P<0.01,***P<0.001。
Figure 4. Expression of HK2,VDAC1,Bax,Bcl-2 and Caspase-3 protein in rat myocardial tissue (×200)
表 1 二乙酰吗啡对心肌组织中HK2、VDAC1、Bax、Bcl-2、Caspase-3 mRNA表达的影响($ \bar x \pm s $,n=6)
Table 1. Effects of diamorphine on the mRNA expression of HK2,VDAC1,Bax,Bcl-2 and Caspase-3 in myocardium($ \bar x \pm s $,n=6)
基因 正常组 模型组 模型+10 D组 F P HK2 1.00±0.00 0.57±0.14* 0.24±0.09*** 48.77 0.009# VDAC1 1.00±0.00 3.00±0.61** 4.46±0.25*** 32.62 0.027# Bax 1.00±0.00 4.88±0.17* 7.64±0.44* 50.32 0.001# Bcl-2 1.00±0.00 0.75±0.10* 0.39±0.05*** 34.86 0.020# Caspase-3 1.00±0.00 1.91±0.11* 3.78±0.38** 45.67 0.020# 与正常组比较,*P < 0.05,**P < 0.01,***P < 0.001。组间比较,#P < 0.05。 -
[1] Milella M S,D'Ottavio G,De Pirro S,et al. Heroin and its metabolites: relevance to heroin use disorder[J]. Transl Psychiatry,2023,13(1):120. doi: 10.1038/s41398-023-02406-5 [2] 王珺,李光伟,汪娜,等. Kelch样ECH相关蛋白1/核因子E2相关因子2对2型糖尿病心肌细胞凋亡的影响[J]. 中国临床药理学杂志,2023,39(5):635-638. [3] 刘小山,陈玉川,李朝晖,等. 海洛因成瘾大鼠心电图及心肌超微结构改变的研究[J]. 法医学杂志,2004,20(3):129-132,135. [4] Ciscato F,Ferrone L,Masgras I,et al. Hexokinase 2 in cancer: A prima donna playing multiple characters[J]. Int J Mol Sci,2021,22(9):4716. doi: 10.3390/ijms22094716 [5] Bao C,Zhu S,Song K,et al. HK2: A potential regulator of osteoarthritis via glycolytic and non-glycolytic pathways[J]. Cell Commun Signal.,2022,20(1):132. doi: 10.1186/s12964-022-00943-y [6] Shoshan-Barmatz V,Maldonado E N,Krelin Y. VDAC1 at the crossroads of cell metabolism,apoptosis and cell stress[J]. Cell Stress,2017,1(1):11-36. doi: 10.15698/cst2017.10.104 [7] 周晓昕,张玉静,肖芳,等. 六价铬诱导的肝细胞线粒体依赖性凋亡中VDAC1的作用[J]. 生态毒理学报,2017,12(6):91-98. [8] Fan K,Fan Z,Cheng H,et al. Hexokinase 2 dimerization and interaction with voltage-dependent anion channel promoted resistance to cell apoptosis induced by gemcitabine in pancreatic cancer[J]. Cancer Med,2019,8(13):5903-5915. doi: 10.1002/cam4.2463 [9] Ji M,Su L,Liu L,et al. CaMKII regulates the proteins TPM1 and MYOM2 and promotes diacetylmorphine-induced abnormal cardiac rhythms[J]. Sci Rep,2023,13(1):5827. doi: 10.1038/s41598-023-32941-6 [10] Rosen D,Smith M L,Reynolds C F 3rd. The prevalence of mental and physical health disorders among older methadone patients[J]. Am J Geriatr Psychiatry,2008,16(6):488-497. doi: 10.1097/JGP.0b013e31816ff35a [11] 杜磊,夏海发,吴映辉,等. 吗啡对急性心肌缺血大鼠的作用及机制研究[J]. 中国临床药理学杂志,2021,37(18):2451-2455. [12] Xi H,Wang S,Wang B,et al. The role of interaction between autophagy and apoptosis in tumorigenesis (Review)[J]. Oncol Rep,2022,48(6):208. [13] 苟陶然,李重阳,欧锐,等. 海洛因对小鼠视网膜结构和抗氧化物酶的影响[J]. 解剖学报,2017,48(6):663-668. [14] Bernstein H G,Trübner K,Krebs P,et al. Increased densities of nitric oxide synthase expressing neurons in the temporal cortex and the hypothalamic paraventricular nucleus of polytoxicomanic heroin overdose victims: possible implications for heroin neurotoxicity[J]. Acta Histochem,2014,116(1):182-190. doi: 10.1016/j.acthis.2013.07.006 [15] 刘小山,刘水平,李朝晖,等. 海洛因成瘾大鼠心肌超微结构改变及凋亡检测[J]. 中山大学学报(医学科学版),2005,26(1):61-64,83. [16] Roberts D J,Miyamoto S. Hexokinase II integrates energy metabolism and cellular protection: Akting on mitochondria and TORCing to autophagy [published correction appears in cell death differ. 2015 Feb;22(2): 364][J]. Cell Death Differ,2015,22(2):248-257. doi: 10.1038/cdd.2014.173 [17] Song G,Lu Q,Fan H,et al. Inhibition of hexokinases holds potential as treatment strategy for rheumatoid arthritis[J]. Arthritis Res Ther,2019,21(1):87. doi: 10.1186/s13075-019-1865-3 [18] Kim K W,Kim S W,Lim S,et al. Neutralization of hexokinase 2-targeting miRNA attenuates the oxidative stress-induced cardiomyocyte apoptosis[J]. Clin Hemorheol Microcirc,2021,78(1):57-68. doi: 10.3233/CH-200924 [19] Shoshan-Barmatz V,Shteinfer-Kuzmine A,Verma A. VDAC1 at the intersection of cell metabolism,apoptosis,and diseases[J]. Biomolecules,2020,10(11):1485. doi: 10.3390/biom10111485 [20] Shoshan-Barmatz V,Nahon-Crystal E,Shteinfer-Kuzmine A,Gupta R. VDAC1,mitochondrial dysfunction,and Alzheimer’s disease[J]. Pharmacol Res,2018,131:87-101. doi: 10.1016/j.phrs.2018.03.010 [21] 宋阿北. VDAC1参与调控BCG感染的巨噬细胞凋亡的机制研究[D]. 银川: 宁夏大学, 2021. [22] Li Y,Kang J,Fu J,et al. PGC1α Promotes cisplatin resistance in ovarian cancer by regulating the HSP70/HK2/VDAC1 signaling pathway[J]. Int J Mol Sci,2021,22(5):2537. doi: 10.3390/ijms22052537 [23] Yuan S,Fu Y,Wang X,et al. Voltage-dependent anion channel 1 is involved in endostatin-induced endothelial cell apoptosis[J]. FASEB J,2008,22(8):2809-2820. doi: 10.1096/fj.08-107417 [24] Shoshan-Barmatz V,Ben-Hail D,Admoni L,et al. The mitochondrial voltage-dependent anion channel 1 in tumor cells[J]. Biochim Biophys Acta,2015,1848(10 Pt B):2547-2575. 期刊类型引用(1)
1. 文丹,黄丹丹,孙梁,孙雨婷,李叶丽,王羽,杨丹莉. 心梗后心衰大鼠模型中SIRT1/PGC-1α信号通路及葡萄糖代谢酶表达变化. 遵义医科大学学报. 2025(01): 1-8 .  百度学术
百度学术其他类型引用(0)
-







 下载:
下载:

 下载:
下载:

