The Analysis of the Therapeutic Effect of Intervertebral Foramen Endoscopy on Single Segment Non-specific Lumbar Intervertebral Space Infection
-
摘要:
目的 通过观察后外侧入路椎间孔镜技术与后路腰椎病灶清除植骨融合内固定术治疗单节段非特异性腰椎间隙感染的临床结果,评估后外侧入路椎间孔镜治疗单节段非特异性腰椎间隙感染的疗效和优势。 方法 对昆明医科大学第一附属医院骨科2016年6月至2023年6月收治的42例非特异性腰椎间隙感染患者的临床资料进行回顾性分析。男24例,女18例,平均54岁,分为A、B 2组,每组21例,A组患者均行后外侧经皮椎间孔镜下清创术,联合软组织浸泡法提高病原学检出率。B组患者均行后路腰椎病灶清除植骨融合内固定术,对比分析手术前后腰痛视觉模拟量表评分(VAS)、日本骨科协会腰椎评分(JOA)、腰椎ODI量表评估患者临床症状缓解情况,白细胞、超敏C反应蛋白、血沉等感染指标,病原耐药菌的治疗效果、细菌培养率和术后并发症。 结果 采用后外侧经皮椎间孔镜下清创术联合软组织浸泡法,获取病原菌培养阳性率为90%。A/B组的VAS、JOA、ODI,术后1周、末次随访与术前相比均有改善。术后7 d的JOA评分A组分数高于B组,且差异有统计学意义(P < 0.05);术后7 d的ODI评分A组低于B组,且差异有统计学意义(P < 0.05)。感染指标中,CRP、ESR在术后3 d、术后7 d、A组远小于B组,且逐渐下降,差异有统计学意义(P < 0.05)。 结论 后外侧入路椎间孔镜技术治疗腰椎间隙感染结合软组织浸泡法细菌培养率高、可有效减轻患者疼痛,提高生活质量;明显降低感染指标;对于高龄基础疾病多、细菌毒力强、高热、炎症指标较高、预估置入内固定物感染风险较高、不能耐受全麻手术的的高危患者人群安全有效。 Abstract:Objective To evaluate the efficiency of posterolateral approach in the treatment of single-segment nonspecific lumbar spondylodiscitis by observation of the clinical results of posterior lateral percutaneous transforaminal endoscopic debridement (PTED) approach and posterior single segmental lumbar debridement, bone graft and internal fixation in the treatment of single segment nonspecific lumbar spondylodiscitis. Methods In this study, 42 patients ( males 24 and females 18 with an average age of 54 years) with nonspecific lumbar spondylodiscitis treated in the Department of Orthopaedics of the 1st Affiliated Hospital of Kunming Medical University from June 2016 to June 2023 were analyzed retrospectively. They were divided into group A (n = 21) and group B (n = 21). All the patients in group A were treated with posterolateral percutaneous transforaminal endoscopic debridement combined with soft tissue immersion to improve the detection rate of etiology. All the patients in group B were treated with posterior single-segment lumbar focus debridement, bone graft and internal fixation. The visual analogue scale score of low back pain (VAS), Japanese Orthopaedic Association Lumbar vertebra score (JOA) and lumbar vertebra ODI scale were compared before and after the operation to evaluate the remission of clinical symptoms, infection indexes such as white blood cells, hypersensitive C-reactive protein, ESR, the therapeutic effect of pathogenic drug-resistant bacteria, bacterial culture rate and postoperative complications. Results The positive rate of pathogen culture obtained through posterior lateral percutaneous foramen debridement combined with soft tissue soaking method was 90%. The score of ODI in group A was lower than that in group B on the 7th day after operation. Among the infection indexes, CRP and ESR in group A were much lower than those in group B at 3 and 7 days after the operation, and the difference was statistically significant (P < 0.05). Conclusion Percutaneous transforaminal endoscopic debridement (PTED)in the treatment of lumbar spondylodiscitis combined with soft tissue immersion has a high bacterial culture rate, which can effectively reduce the pain of patients, improve the quality of life, and significantly reduce the index of infection. it is safe and effective for high-risk patients with multiple underlying diseases, strong bacterial virulence, high fever, high inflammation index, high risk of infection with internal fixation and inability to tolerate general anesthesia surgery. -
表 1 组内临床指标比较(分)
Table 1. Comparison of clinical indicators within groups (points)
指标 术前 术后7 d 末次随访 F P A组 VAS 6.05±2.31 2.43±1.78a 0.52±0.51ab 132.27 <0.001* JOA 12.34±3.32 18.57±3.99a 24.95±2.78ab 285.36 <0.001* ODI 49±16.63 33.81±13.58a 9.62±3.12ab 109.58 <0.001* B组 VAS 5.19±1.54 2.43±1.03a 0.38±0.50ab 135.93 <0.001* JOA 14.38±5.08 15.62±3.32 25.29±1.71ab 69.20 <0.001* ODI 58.14±15.07 55.43±18.26 13.86±3.31ab 87.04 <0.001* 与同组术前比较,aP < 0.05;与同组术后7 d比较,bP < 0.05;*P < 0.05。 表 2 组间临床指标比较(分)
Table 2. Comparison of clinical indicators between groups (points)
指标 A B t P VAS 术前 6.05±2.31 5.19±1.54 1.4150 0.164 术后7 d 2.43±1.78 2.43±1.03 0.9 0.373 末次随访 0.52±0.51 0.38±0.50 0.917 0.364 JOA 术前 12.34±3.32 14.38±5.08 −1.545 0.130 术后7 d 18.57±3.99 15.62±3.32 2.604 0.013* 末次随访 24.95±2.78 25.29±1.71 −0.468 0.642 ODI 术前 49±16.63 58.14±15.07 −1.867 0.069 术后7 d 33.81±13.58 55.43±18.26 −4.271 <0.001* 末次随访 12.62±3.12 13.86±3.31 −1.249 0.219 *P < 0.05。 表 3 组内感染指标比较[M(P25,P75)]
Table 3. Comparison of infection indicators within groups [M(P25,P75)]
指标 术前 术后3 d 术后7 d 术后1月 H P A组 CRP 43.6(8.9,51.85) 26.3(9.99,35.95) 14.4(4.65,31.28)a 2.6(1.25,17.75)a 15.347 0.002* ESR 69(15.5,83) 40(11.5,69.5) 23(9,66.5)a 12(4,25)a 14.893 0.002* WBC 5.6(4.65,7.25) 5.7(4.85,7.8) 6(5.45,8.2) 6(5,7.25) 1.180 0.758 B组 CRP 30(4.3,53.55) 71.7(36.75,104)a 41.8(27.6,54.45) 7(3.6,1.25)a 32.725 <0.001* ESR 53(29,84.5) 61(34,79.5) 56(47.5,77.5) 14(11,41.5)a 16.691 <0.001* WBC 5.8(5.2,8.45) 8.1(5.85,9.9) 7.3(5.15,8.25) 5.6(5,6.9) 6.708 0.082 与同组术前比较,aP < 0.05;*P < 0.05。 表 4 组间感染指标比较[M(P25,P75)]
Table 4. Comparison of infection indicators between groups [M(P25,P75)]
指标 A组 B组 Z P CRP 术前 43.6(8.9,51.85) 30(4.3,53.55) −0.692 0.489 术后3 d 26.3(9.99,35.95) 71.7(36.75,104) −3.685 <0.001* 术后7 d 14.4(4.65,31.28) 41.8(27.6,54.45) −3.535 <0.001* 术后1月 2.6(1.25,17.75) 7(3.6,1.25) −1.485 0.138 ESR 术前 69(15.5,83) 53(29,84.5) −0.503 0.615 术后3 d 40(11.5,69.5) 61(34,79.5) −2.063 0.039* 术后7 d 23(9,66.5) 56(47.5,77.5) −2.416 0.016* 术后1月 12(4,25) 14(11,41.5) −1.652 0.099 WBC 术前 5.6(4.65,7.25) 5.8(5.2,8.45) −0.931 0.352 术后3 d 5.7(4.85,7.8) 8.1(5.85,9.9) −2.240 0.025* 术后7 d 6(5.45,8.2) 7.3(5.15,8.25) −0.617 0.537 术后1月 6(5,7.25) 5.6(5,6.9) −0.581 0.561 *P < 0.05。 表 5 42例化脓性脊柱炎细菌型频数分布
Table 5. Frequency distribution of bacterial types in 42 cases of suppurative spondylitis
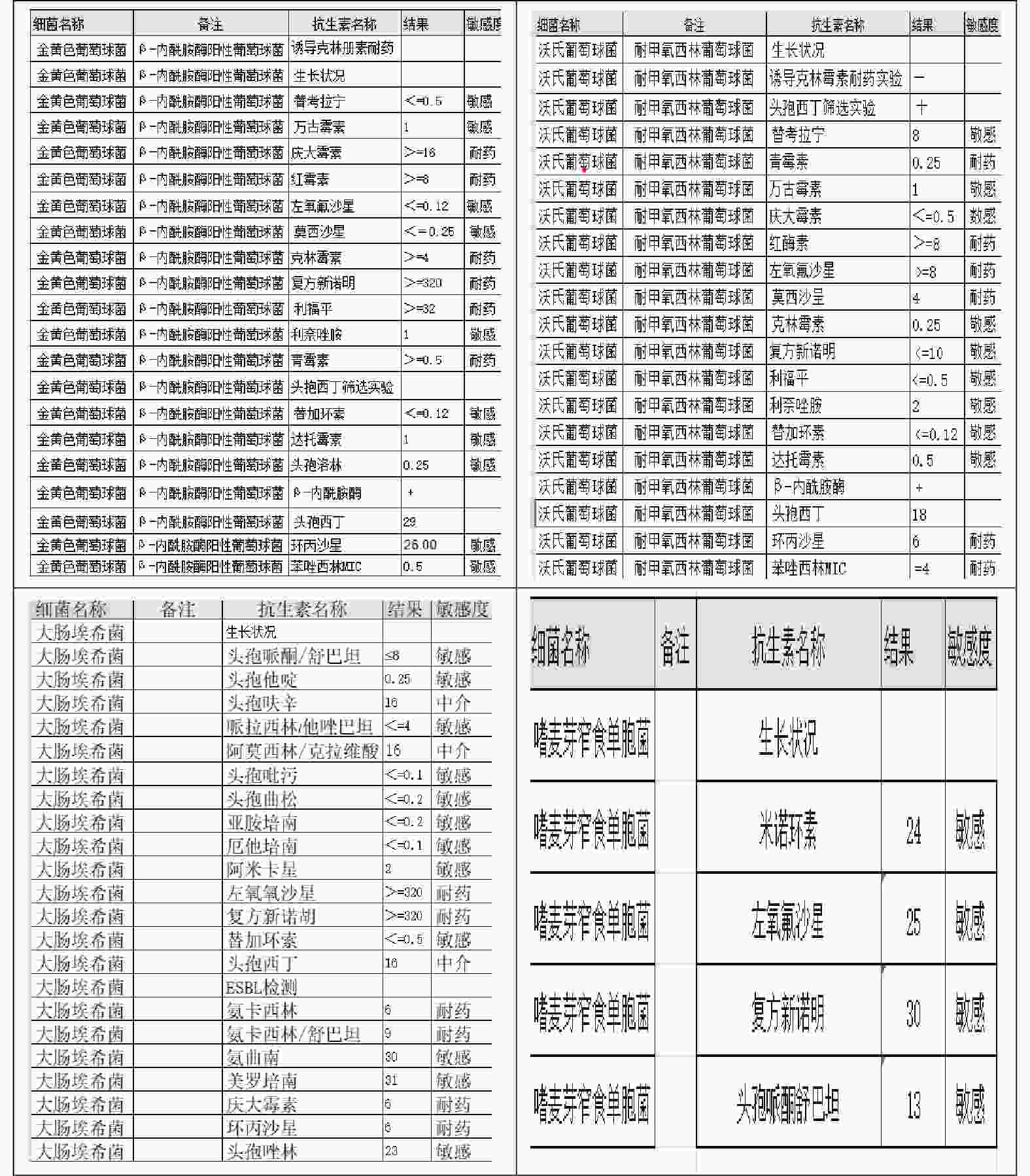
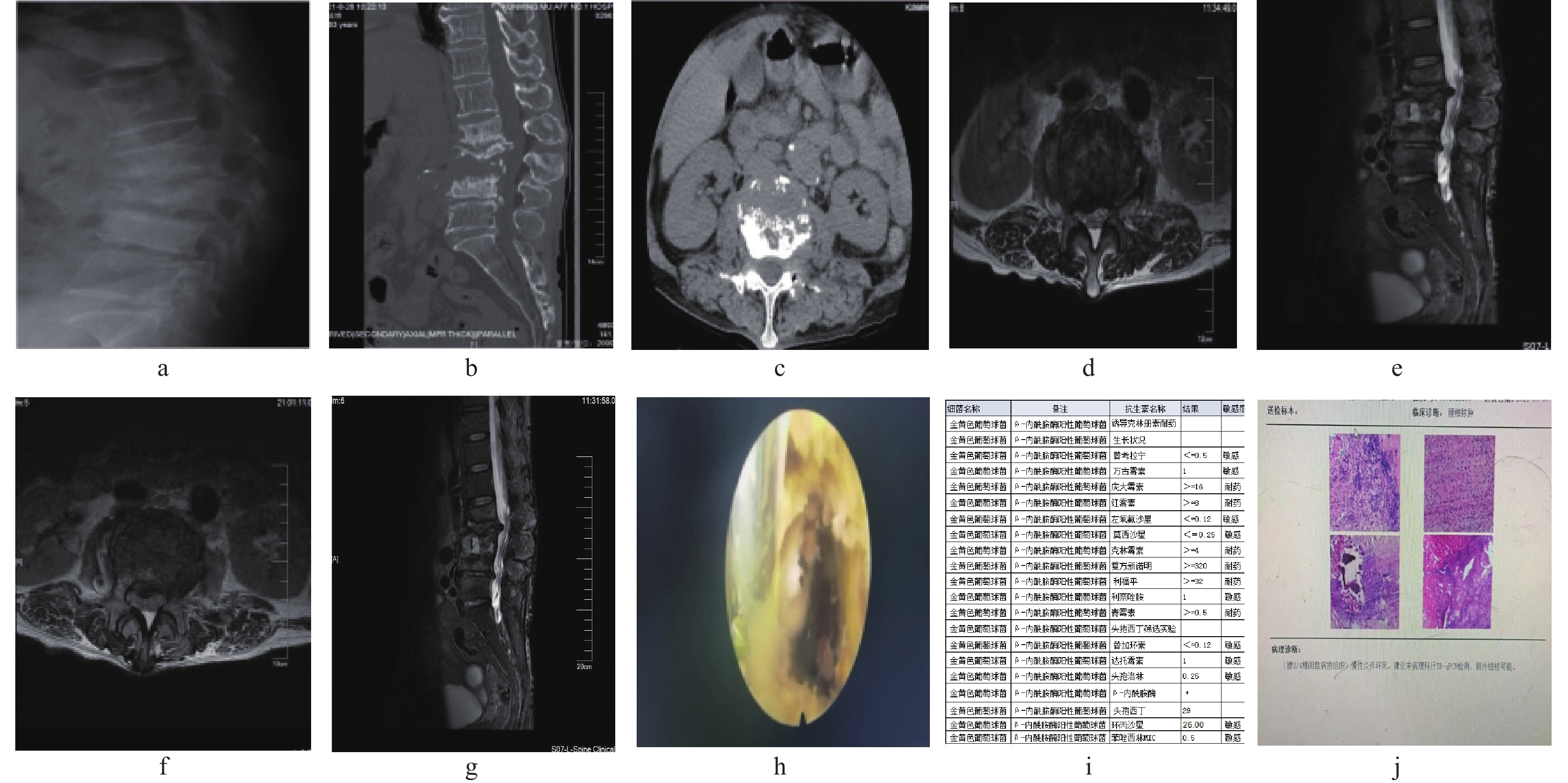
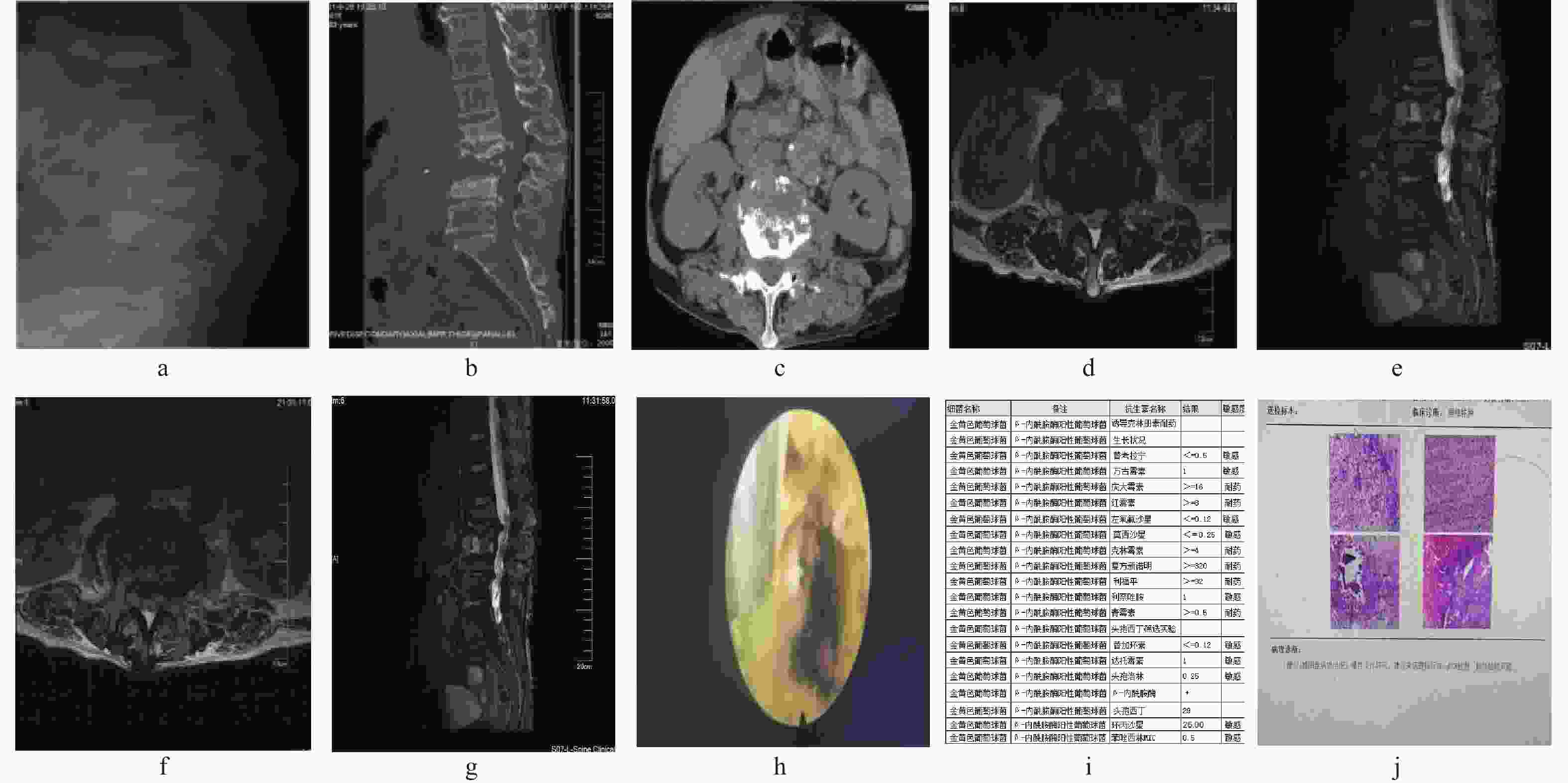
细菌类型 n 耐药菌数 耐药抗生素 革兰阳性菌和杆菌 21 金黄色葡萄球菌 5 2 青霉素、头孢类、红霉素、克林霉素* 沃氏葡萄球菌 3 2 青霉素、左氧氟沙星、莫西沙星* 粪肠球菌 1 表皮葡萄球菌 7 1 青霉素、红霉素、四环素、苯唑西林 人葡萄球菌 2 戈登链球菌 1 革兰阴性菌杆菌 16 大肠埃希菌 8 4 左氧氟沙星、复方新诺明、环丙沙星、头孢曲松* 嗜麦芽单胞菌 1 1 头孢哌酮舒巴坦* 伤寒杆菌 3 大田苍白杆菌 1 未知类型细菌 5 共计 42 *表示见图1药敏菌谱。 -
[1] Kourbeti I S,Tsiodras S,Boumpas D T. Spinal infections: Evolving concepts[J]. Curr Opin Rheumatol,2008,20(4):471-479. doi: 10.1097/BOR.0b013e3282ff5e66 [2] Skaf G S,Domloj N T,Fehlings M G,et al. Pyogenic spondylodiscitis: An overview[J]. J Infect Public Health,2010,3(1):5-16. doi: 10.1016/j.jiph.2010.01.001 [3] Cheung W Y,Luk K D. Pyogenic spondylitis[J]. Int Orthop,2012,36(2):397-404. doi: 10.1007/s00264-011-1384-6 [4] Akiyama T,Chikuda H,Yasunaga H,et al. Incidence and risk factors for mortality of vertebral osteomyelitis: A retrospective analysis using the Japanese diagnosis procedure combination database[J]. BMJ Open,2013,3(3):e002412. doi: 10.1136/bmjopen-2012-002412 [5] Milosevic B,Cevik M,Urosevic A,et al. Risk factors associated with poor clinical outcome in pyogenic spinal infections: 5-years' intensive care experience[J]. J Infect Dev Ctries,2020,14(1):36-41. doi: 10.3855/jidc.12260 [6] Duarte R M,Vaccaro A R. Spinal infection: State of the art and management algorithm[J]. Eur Spine J,2013,22(12):2787-2799. doi: 10.1007/s00586-013-2850-1 [7] D'Agostino C,Scorzolini L,Massetti A P,et al. A seven-year prospective study on spondylodiscitis: Epidemiological and microbiological features[J]. Infection,2010,38(2):102-107. doi: 10.1007/s15010-009-9340-8 [8] Aljawadi A,Jahangir N,Jeelani A,et al. Management of pyogenic spinal infection,review of literature[J]. J Orthop,2019,16(6):508-512. doi: 10.1016/j.jor.2019.08.014 [9] Chelsom J,Solberg C O. Vertebral osteomyelitis at a Norwegian university hospital 1987-97: Clinical features,laboratory findings and outcome[J]. Scand J Infect Dis,1998,30(2):147-151. doi: 10.1080/003655498750003537 [10] Gasbarrini A L,Bertoldi E,Mazzetti M,et al. Clinical features,diagnostic and therapeutic approaches to haematogenous vertebral osteomyelitis[J]. Eur Rev Med Pharmacol Sci,2005,9(1):53-66. [11] Zarghooni K,Röllinghoff M,Sobottke R,et al. Treatment of spondylodiscitis[J]. Int Orthop,2012,36(2):405-411. doi: 10.1007/s00264-011-1425-1 [12] Berbari E F,Kanj S S,Kowalski T J,et al. 2015 infectious diseases society of america (IDSA) clinical practice guidelines for the diagnosis and treatment of native vertebral osteomyelitis in adults[J]. Clin Infect Dis,2015,61(6):e26-46. doi: 10.1093/cid/civ482 [13] Chew F S,Kline M J. Diagnostic yield of CT-guided percutaneous aspiration procedures in suspected spontaneous infectious diskitis[J]. Radiology,2001,218(1):211-214. doi: 10.1148/radiology.218.1.r01ja06211 [14] Sehn J K,Gilula L A. Percutaneous needle biopsy in diagnosis and identification of causative organisms in cases of suspected vertebral osteomyelitis[J]. Eur J Radiol,2012,81(5):940-946. doi: 10.1016/j.ejrad.2011.01.125 [15] Fouquet B,Goupille P,Gobert F,et al. Infectious discitis diagnostic contribution of laboratory tests and percutaneous discovertebral biopsy[J]. Rev Rhum Engl Ed,1996,63(1):24-29. [16] Lu M L,Niu C C,Tsai T T,et al. Transforaminal lumbar interbody debridement and fusion for the treatment of infective spondylodiscitis in the lumbar spine[J]. Eur Spine J,2015,24(3):555-560. doi: 10.1007/s00586-014-3585-3 [17] Rutges J P,Kempen D H,van Dijk M,et al. Outcome of conservative and surgical treatment of pyogenic spondylodiscitis: A systematic literature review[J]. Eur Spine J,2016,25(4):983-999. doi: 10.1007/s00586-015-4318-y [18] Price D D,Mcgrath P A,Rafii A,et al. The validation of visual analogue scales as ratio scale measures for chronic and experimental pain[J]. Pain,1983,17(1):45-56. doi: 10.1016/0304-3959(83)90126-4 [19] Kawakami M,Takeshita K,Inoue G,et al. Japanese Orthopaedic Association (JOA) clinical practice guidelines on the management of lumbar spinal stenosis,2021 - Secondary publication[J]. J Orthop Sci,2023,28(1):46-91. doi: 10.1016/j.jos.2022.03.013 [20] Fairbank J. Revised oswestry disability questionnaire[J]. Spine (Phila Pa 1976),2000,25(19): 2552. [21] Abreu P G P,Lourenço J A,Romero C,et al. Endoscopic treatment of spondylodiscitis: Systematic review[J]. Eur Spine J,2022,31(7):1765-1774. doi: 10.1007/s00586-022-07142-w [22] Mao Y,Li Y,Cui X. Percutaneous endoscopic debridement and drainage for spinal infection: Systemic review and Meta-analysis[J]. Pain Physician,2019,22(4):323-330. [23] Yee D K,Samartzis D,Wong Y W,et al. Infective spondylitis in Southern Chinese: A descriptive and comparative study of ninety-one cases[J]. Spine (Phila Pa 1976),2010,35(6): 635-641. [24] Hadjipavlou A G,Mader J T,Necessary J T,et al. Hematogenous pyogenic spinal infections and their surgical management[J]. Spine (Phila Pa 1976),2000,25(13): 1668-1679. [25] Berbari E F,Kanj S S,Kowalski T J,et al. Executive summary: 2015 Infectious Diseases Society of America (IDSA) clinical practice guidelines for the diagnosis and treatment of native vertebral osteomyelitis in adults[J]. Clin Infect Dis,2015,61(6):859-863. doi: 10.1093/cid/civ633 [26] Guo W,Wang M,Chen G,et al. Early surgery with antibiotic medication was effective and efficient in treating pyogenic spondylodiscitis[J]. BMC Musculoskelet Disord,2021,22(1):288. doi: 10.1186/s12891-021-04155-2 [27] Li Y D,Wong C B,Tsai T T,et al. Appropriate duration of post-surgical intravenous antibiotic therapy for pyogenic spondylodiscitis[J]. BMC Infect Dis,2018,18(1):468. doi: 10.1186/s12879-018-3377-1 [28] Rezai A R,Woo H H,Errico T J,et al. Contemporary management of spinal osteomyelitis[J]. Neurosurgery,1999,44(5):1018-1025. doi: 10.1097/00006123-199905000-00047 [29] Menon V K,Kumar K M,Al Ghafri K. One-stage biopsy,debridement,reconstruction,and stabilization of pyogenic vertebral osteomyelitis[J]. Global Spine J,2014,4(2):93-100. doi: 10.1055/s-0034-1370789 [30] Haaker R G,Senkal M,Kielich T,et al. Percutaneous lumbar discectomy in the treatment of lumbar discitis[J]. Eur Spine J,1997,6(2):98-101. doi: 10.1007/BF01358740 [31] Iwata A,Ito M,Abumi K,et al. Fungal spinal infection treated with percutaneous posterolateral endoscopic surgery[J]. J Neurol Surg A Cent Eur Neurosurg,2014,75(3):170-176. [32] Yang S C,Fu T S,Chen H S,et al. Minimally invasive endoscopic treatment for lumbar infectious spondylitis: A retrospective study in a tertiary referral center[J]. BMC Musculoskelet Disord,2014,27(15):105. -





 下载:
下载: