Exploring the Effect of TRPC1 and BK-α expression on Diabetic Nephropathy
-
摘要:
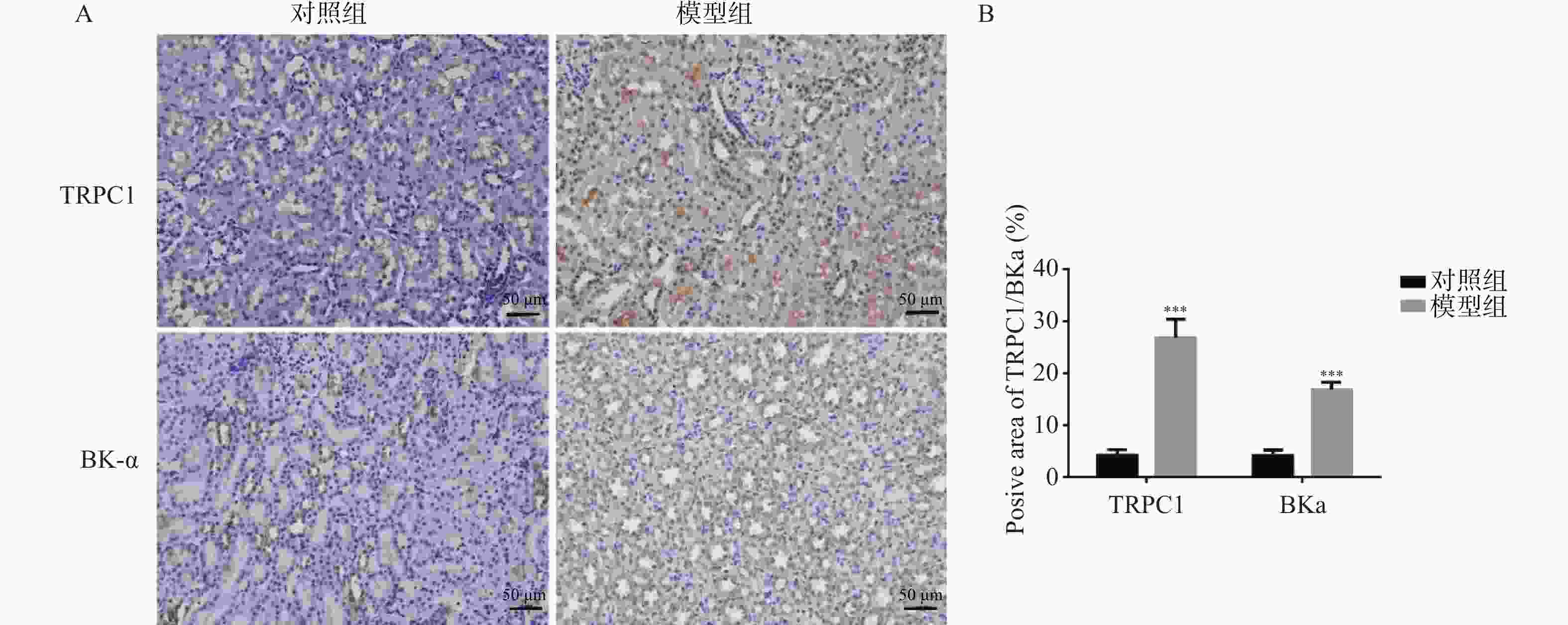
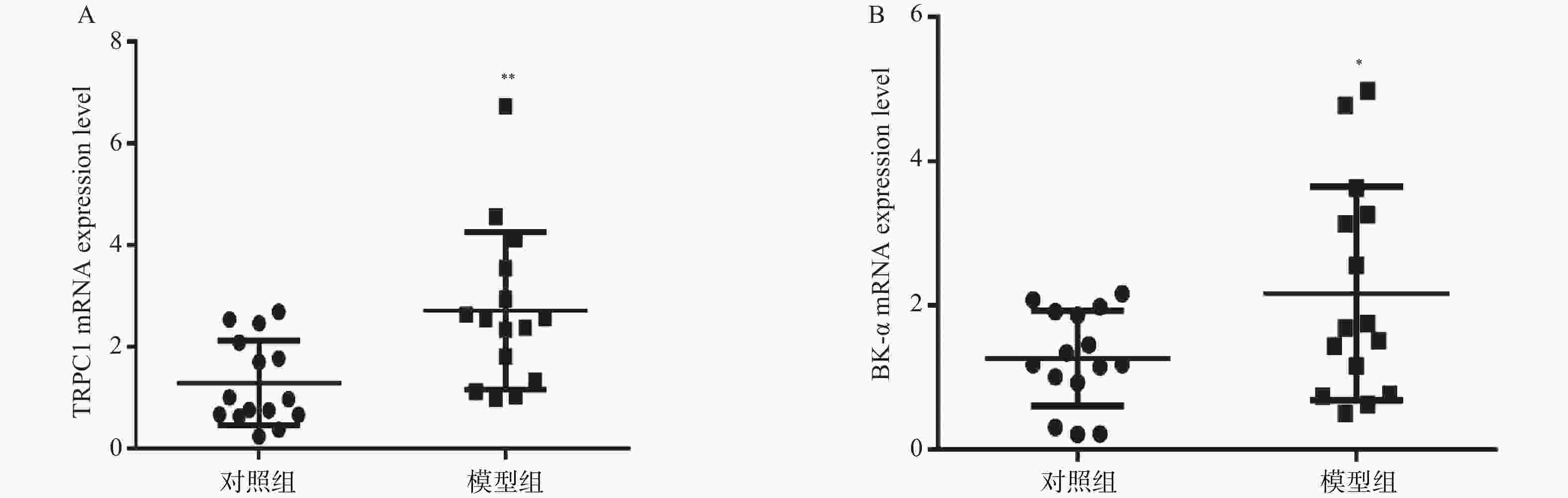
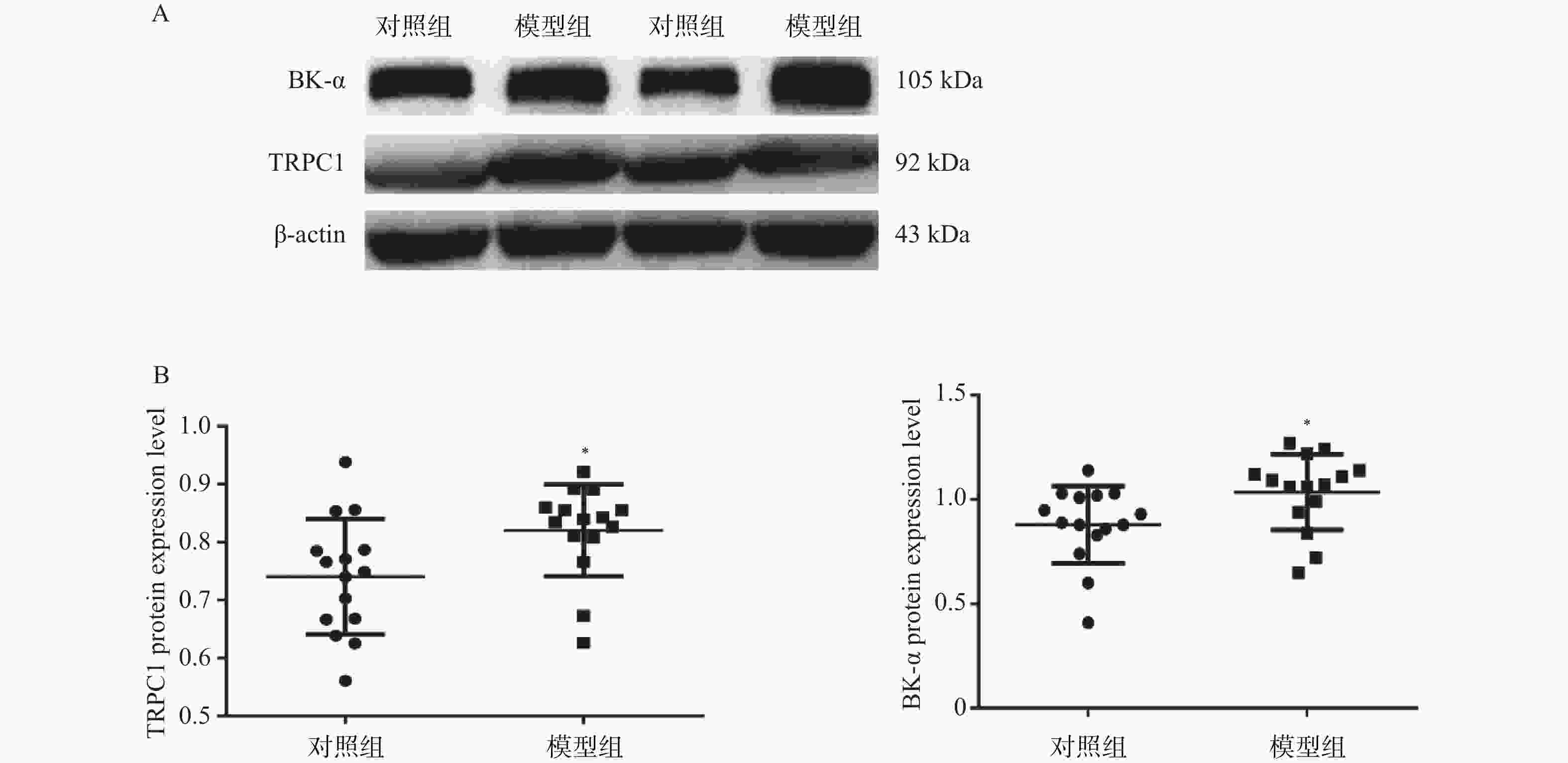
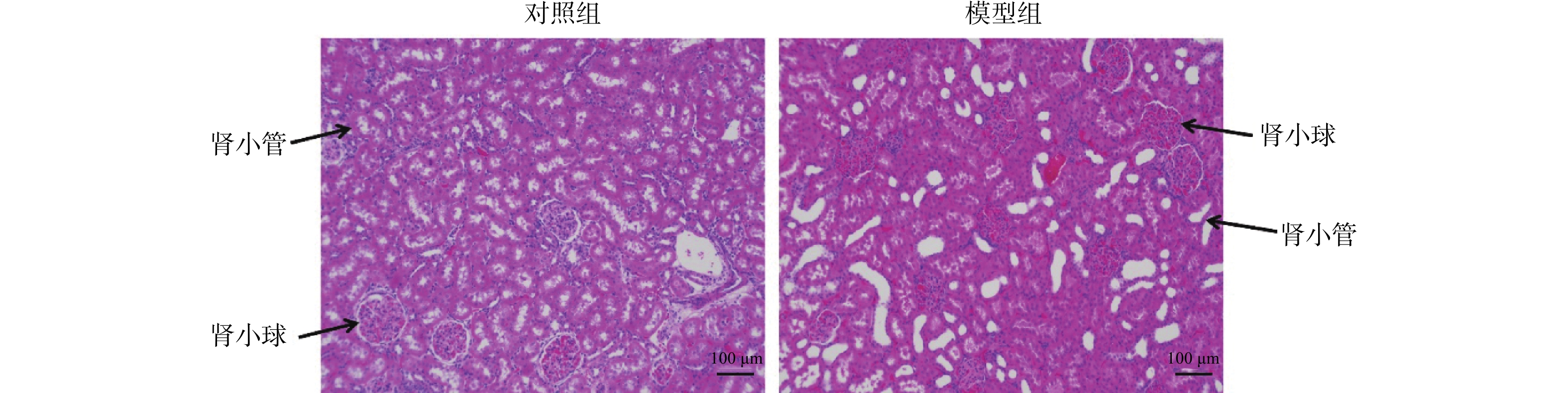
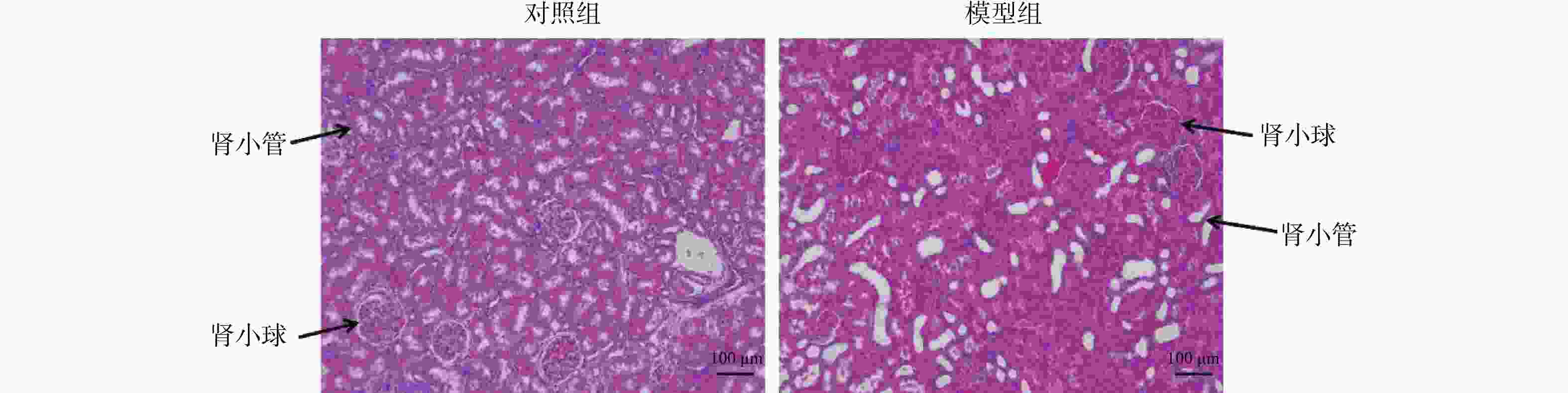
目的 探究瞬时受体电位C1(transient receptor potential channel 1,TRPC1)蛋白和大电导钙离子激活钾通道α亚单位(large conductance Ca2+-activated K+channel α subunit,BK-α)蛋白对大鼠糖尿病肾病(diabetic kidney disease,DKD)的影响。 方法 将SD大鼠随机分为对照组(n=15)和模型组(n=15)。利用高脂饲料和链脲佐菌素(streptozocin,STZ)构建DKD模型。采用血糖分析仪检测大鼠血糖变化;采用全自动生化分析仪检测大鼠肾功能水平;HE染色检测肾组织的病理变化以确定造模成功。实时荧光定量PCR(RT-qPCR)和蛋白免疫印迹分别检测肾组织TRPC1和BK-α的mRNA和蛋白表达水平;免疫组化检测TRPC1和BK-α的分布和表达情况。 结果 模型组大鼠空腹血糖(fasting plasma glucose,FPG)、尿白蛋白排泄率(urinary albumin excretion rates,UAER)、血尿素氮(blood urea nitrogen,BUN)和肌酐(creatinine,Cr)均显著高于对照组(P < 0.01);模型组大鼠肾小管内壁细胞出现膨胀现象,部分细胞脱离;可见肾小管发生病变或死亡;此外,在许多肾小管及肾间质区域发现有中性白细胞及其残骸;以上HE染色结果提示,DKD模型复制成功。TRPC1和BK-α在肾小球部位最为丰富,且模型组大鼠肾组织中TRPC1和BK-α的mRNA和蛋白水平都显著高于对照组(P < 0.05)。 结论 大鼠糖尿病肾病影响TRPC1和BK-α在肾组织中的分布和表达。 -
关键词:
- 大鼠糖尿病肾病 /
- 瞬时受体电位C1蛋白 /
- 大电导钙离子激活钾通道α亚单位蛋白
Abstract:Objective To explore the effect of transient receptor potential channel 1 (TRPC1) protein and large conductivity Ca2+ activated K+ channel α subunit (BK-α) protein on diabetic nephropathy (DKD). Methods SD rats were randomly divided into a control group (n=15) and a model group (n=15). Construct a DKD model using high-fat feed and streptozocin (STZ). Using a blood glucose analyzer to detect changes in blood glucose levels in rats; Using a fully automatic biochemical analyzer to detect the renal function level of rats; HE staining was used to detect pathological changes in renal tissue to confirm successful modeling. Real time fluorescence quantitative PCR (RT-qPCR) and Western blotting were used to detect the mRNA and protein expression levels of TRPC1 and BK-α in renal tissue, respectively; Immunohistochemical detection of the distribution and expression of TRPC1 and BK-α. Results The fasting plasma glucose (FPG), urinary albumin excretion rate (UAER), blood urea nitrogen (BUN), and creatinine (Cr) in the model group were significantly higher than those in the control group (P < 0.01); the inner wall cells of the renal tubules in the model group showed swelling, with some cells detached; visible renal tubular lesions or death. In addition, neutrophils and their debris were found in many renal tubules and interstitial regions; the above HE staining results indicate that the DKD model has been successfully replicated. TRPC1 and BK-α were most abundant in the glomerulus, and the mRNA and protein levels of TRPC1 and BK-α in the renal tissue of the model group rats were significantly higher than those in the control group (P < 0.05). Conclusion Diabetic nephropathy affects the distribution and expression of TRPC1 and BK-α in renal tissue. -
表 1 高糖高脂饲料配料表(%)
Table 1. Ingredients of High Sugar and High Fat Feed (%)
成分 添加比例 猪油 10.0 胆固醇 2.5 蔗糖 20.0 胆酸盐 1.0 常规饲料 66.5 表 2 TRPC1和BK-α引物序列信息
Table 2. TRPC1 and BK-α primer sequence information
Gene Sequence(5′→3′) Length(bp) BK-α TTGAAGATGAGCAACCGCCA 20 TCATGCCTCATCAGCTTCGG 20 TRPC1 CGTTCTGAGTTACCTTCGGCT 21 AGCTGTGTCAGTCCAATCGT 20 GAPDH GTGGAGTCTACTGGCGTCTT 20 TGCTGACAATCTTGAGGGA 19 表 3 不同组大鼠的理化指标比较[($ \bar x \pm s $),n=15]
Table 3. Comparison of physical and chemical indicators of different groups of rats [($ \bar x \pm s $),n=15]
组别 空腹血糖
(FPG,mmol/L)尿白蛋白排泄率
(UAER,mg/24 h)血尿素氮
(BUN,mmol/L)肌酐
(Cr,μmol/L)对照组 5.968 ± 1.36 11.09 ± 0.91 6.403 ± 0.63 4.028 ± 1.29 模型组 21.61 ± 2.52 33.01 ± 1.62 26.36 ± 1.38 19.85 ± 1.61 t 3.261 2.485 4.069 3.012 P 0.003** 0.012** <0.001** 0.009** 与对照组比较,**P < 0.01。 -
[1] Guan Z,Li H,Liu R,et al. Artificial intelligence in diabetes management: Advancements,opportunities,and challenges[J]. Cell Rep Med,2023,4(10):101213. doi: 10.1016/j.xcrm.2023.101213 [2] Sun H,Saeedi P,Karuranga S,et al. IDF diamonds atlas: Global,regional and country-level diabetes prevalence estimates for 2021 and projects for 2045[J]. Diabetes Res Clin Pract,2021,183:109119. [3] Reutens A T. Epidemiology of diabetic kidney disease[J]. Med Clin North Am,2013,97(1):1-18. doi: 10.1016/j.mcna.2012.10.001 [4] Nathan D M. Diabetes: advantages in diagnosis and treatment[J]. JAMA,2015,314(10):1052-1062. doi: 10.1001/jama.2015.9536 [5] Moraes R D A,Webb R C,Silva D F. Vascular dysfunction in diabetes and obesity: Focus on TRP channels[J]. Front Physiol,2021,12(5):1-23. [6] Qian L L,Liu X Y,Yu Z M,et al. BK channel dysfunction in diabetic coronary artery: Role of the E3 ubiquitin ligases[J]. Front Physiol,2020,11(5):1-7. [7] Ma R,Pluznick J L,Sansom S C. Ion channels in mesangial cells: Functio,malfunction,or fiction[J]. Physiology,2005,20(4):102-111. [8] Dopico A M,Bukiya A N,Jaggar J H. Calcium and voltagegated BK channels in vascular smooth muscle[J]. Pflugers Arch,2018,470(9):1271-1289. doi: 10.1007/s00424-018-2151-y [9] Toth P,Csiszar A,Tucsek Z,et al. Role of 20-HETE,TRPC channels,and BKCa in dysregulation of pressure-induced Ca2+ signaling and myogenic constriction of cerebral arteries in aged hypertensive mice [J]. Am J Physiol Heart Circ Physiol,2013,305(12): 698-708. [10] Saskia P,JÖRG F,Michaei F. Mice with disrupted BK channel β1 subunit gene feature abnormal Ca2+ spark/STOC coupling and elevated blood pressure [J]. Circ Res,2000,87(11): E53-60. [11] Dryer S E,Reise J. TRPC6 channels and their binding partners in podocytes: role inglomerular filtration and pathophysiology[J]. Am J Physiol Renal Physiol,2010,299(4):F689-70134. doi: 10.1152/ajprenal.00298.2010 [12] Kim B Y,Choi K J,Dryer S E. Nephrin binds to the COOH terminus of a large-conductance Cat-activated K+ channel isoform and regulates its expression on thecell surface[J]. Am J Physiol Renal Physiol,2008,295(1):F235-246. doi: 10.1152/ajprenal.00140.2008 [13] Qian L,Liu X,Wang R,et al. Role of BK(Ca) channels in diabetic vascular complications[J]. Chin Med J,2014,127(9):1775-1781. doi: 10.3760/cma.j.issn.0366-6999.20132503 [14] Mysiewicz S C,Hawks S M,Bukiya A N,et al. Differential functional contribution of BK channel subunits to aldosterone-induced channel activation in vascular smooth muscle and eventual cerebral artery dilation[J]. International Journal of Molecular Sciences,2023,24(10):8704. doi: 10.3390/ijms24108704 [15] 宋阿会,刘英莉. BK通道在肾脏钾离子代谢中的作用[J]. 国际泌尿系统杂志,2018,38(4):692-695. doi: 10.3760/cma.j.issn.1673-4416.2018.04.048 [16] Wang R X,Shi H F,Chai Q,et al. Molecular mechanisms of diabetic coronary dysfunction due to large conductance Ca2+-activated K+ channel impairment[J]. Chin Med J,2012,125(4):2548-2555. [17] Wen J,Cheng J,LI P Y,et al. Changes of large conductance Ca2+-activated K+ channel impairment of mesenteric artery smooth muscle cells in disbetic patient[J]. Chongqing Med,2014,43(18):2312-2315. -





 下载:
下载: