The Molecular Mechanism of miR-205-5p Targeting ERBB3 to Regulate PI3K/AKT/mTOR Pathway and Inhibit Angiogenesis in Hemorrhoids
-
摘要:
目的 探讨miR-205-5p靶向ERBB3调控PI3K/AKT/mTOR通路抑制血管生成在痔疮中的分子机制。 方法 收集2021年07月至2022年06月临床12例患者的痔核和正常肛周组织,通过qRT-PCR检测临床病理样本中miR-205-5p和ERBB3的表达情况,双荧光素酶报告基因实验验证miR-205-5p与ERBB3的靶向关系。将miR-205-5p mimic、pcDNA-ERBB3、miR-205-5p inhibitor、sh-ERBB3、oe-ERBB3及阴性对照质粒分别或共同转染至痔疮模型大鼠和HUVEC细胞。HE、TUNEL染色观察组织病理和细胞凋亡情况,免疫组化检测ERBB3、VEGFR2蛋白定位及表达水平,Western blot检测ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax、Bcl-2和PI3K/AKT/mTOR通路相关蛋白的表达水平。MTT、划痕愈合、Transwell实验、流式细胞术、血管形成实验检测各组HUVEC细胞增殖、迁移、侵袭能力、凋亡率和血管生成量。 结果 痔疮临床样本中miR-205-5p呈低表达,ERBB3呈高表达(P < 0.001),miR-205-5p与ERBB3(WT)的3'UTR靶向结合(P < 0.001)。miR-205-5p mimic组痔疮大鼠和HUVEC细胞中ERBB3表达量显著降低(P < 0.01,P < 0.001),VEGFR2(P < 0.001)、Cyclin D1(P < 0.01)、Bcl-2(P < 0.001)、p-PI3K/PI3K、p-AKT/AKT和p-mTOR/mTOR(P < 0.001)水平显著下调,Cleaved-caspase 3和Bax水平显著上调(P < 0.01),大鼠肛周组织病理状况改善,HUVEC细胞增殖、迁移和侵袭力均降低(P < 0.001),凋亡率升高(P < 0.001),血管生成数量及分支减少(P < 0.001),pcDNA-ERBB3逆转了这一效应(P < 0.001)。 结论 miR-205-5p能通过靶向抑制ERBB3表达,下调PI3K/AKT/mTOR通路活性,抑制细胞增殖、迁移和侵袭,促进细胞凋亡,减少血管生成,从而缓解痔疮进展。 -
关键词:
- 痔疮 /
- miR-205-5p /
- ERBB3 /
- PI3K/AKT/mTOR通路 /
- 血管生成
Abstract:Objective To explore the molecular mechanism of miR-205-5p targeting ERBB3 to regulate PI3K/AKT/mTOR pathway and inhibit angiogenesis in hemorrhoids. Methods The hemorrhoidal nucleus and normal perianal tissues of 12 patients from July 2021 to June 2022 were collected, the expression of miR-205-5p and ERBB3 in the samples was detected by qRT-PCR, and the targeting relationship was verified by dual-luciferase. miR-205-5p mimic, pcDNA-ERBB3, miR-205-5p inhibitor, sh-ERBB3, oe-ERBB3 and negative control plasmids were respectively or co-transfected into hemorrhoidal model rats and HUVEC cells. The pathological changes and apoptosis of perianal tissue in each group were observed by HE and TUNEL staining, and the localization of expression of ERBB3 and VEGFR2 proteins were detected by immunohistochemistry, and the expression levels of ERBB3, VEGFR2, Cyclin D1, cleaved-caspase 3, Bax, Bcl-2 and PI3K/AKT/mTOR pathway related proteins were detected by Western blot. The proliferation, migration, invasion, apoptosis and angiogenesis of HUVEC were detected by MTT, wound healing, transwell, flow cytometry and angiogenesis assay. Results MiR-205-5p was lowly expressed and ERBB3 was highly expressed in clinical samples of hemorrhoids (P < 0.001), and miR-205-5p targeted the 3'UTR of ERBB3 (WT) (P < 0.001). The expression of ERBB3 in hemorrhoidal rats and HUVEC cells in miR-205-5p mimic group was significantly decreased (P < 0.01, P < 0.001), and the levels of VEGFR2 (P < 0.001), Cyclin D1 (P < 0.01),Bcl-2 (P < 0.001), p-PI3K/PI3K, p-AKT/AKT, p-mTOR/mTOR (P < 0.001) were significantly down-regulated, the levels of Cleaved-caspase 3 and Bax were significantly up-regulated (P < 0.01), the perianal histopathology of rats was improved, the proliferation, migration and invasion activities of HUVEC cells were reduced (P < 0.001), the apoptosis rate was increased (P < 0.001), and the number and branches of angiogenesis were reduced (P < 0.001), and these effects were eventually reversed by pcDNA-ERBB3 (P < 0.001). Conclusion MiR-205-5p can reduce angiogenesis and relieve hemorrhoids by targeting the inhibition of ERBB3 expression, down-regulating the activity of PI3K/AKT/mTOR pathway, inhibiting cell proliferation, migration and invasion, and promoting apoptosis. -
Key words:
- Hemorrhoids /
- miR-205-5p /
- ERBB3 /
- PI3K/AKT/mTOR pathway /
- Angiogenesis
-
痔疮(Hemorrhoids)是正常解剖学肛垫向下移位所导致一系列症状的一种常见的肛门直肠良性疾病。在国际公认的痔疮发病机制研究中,静脉曲张学说和血管增生学说的认可度最高[1-2],尽管血管增生正在被更多的研究证实,但细胞异常增殖、迁移和血管新生与基因表达调控的关系仍是研究的难点,其表观遗传机制还有待进一步研究。微小RNA(microRNAs,miRNAs)作为表观遗传调节因子,在痔疮发病中参与相关蛋白和多种通路的调控[3-4]。研究发现,miR-412-5p可以靶向xpo1调控痔核组织的血管增生[5]。此外,METTL14表达受miR-4729调控,影响痔疮血管内皮细胞的增殖,从而调节血管生成[6]。因此,研究miRNAs在痔疮血管生成中的应用极为重要。miR-205-5p是miRNAs的1种亚型,目前已被证实参与多种疾病的血管生成[7-8]。比如miR-205-5p通过靶向负调控VEGFA和磷脂酰肌醇3-激酶(phosphoinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target protein of rapamycin,mTOR)信号通路在肾细胞癌中抑制细胞增殖、迁移、侵袭和血管生成[9]。miR-205-5p过表达能直接靶向VEGF抑制PI3K/AKT通路,降低细胞活力,诱导细胞凋亡进而拮抗瘢痕疙瘩[10]。miRNAs种类众多,探究多种miRNAs在痔疮形成中的作用机制,可能为治疗痔病提供更多的理论基础。然而,miR-205-5p在痔疮中的表达和转录后调控痔病发生发展的机制尚未明确。因此,本研究将分析miR-205-5p在痔疮中的作用机制。
ERBB2受体酪氨酸激酶3 (erb-b2 receptor tyrosine kinase 3,ERBB3)是位于细胞表面的酪氨酸激酶受体ERBB家族成员之一,具有促进肿瘤细胞增殖、分化、迁移的能力[11]。ERBB3可参与鼻咽癌内皮细胞增殖和血管生成的调控[12]。ERBB3/4配体刺激人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)可诱导钙离子快速流动、受体酪氨酸磷酸化和细胞增殖,促进血管形成[13]。PI3K/AKT/mTOR通路广泛参与细胞增殖、粘附、迁移、侵袭、代谢等多种信号传导和生物学过程,在调节血管生成中发挥重要作用[14]。然而miR-205-5p能否通过ERBB3调控PI3K/AKT/mTOR通路影响痔病发生发展目前尚不清楚。鉴于此,本研究选取临床病理样本检测miR-205-5p和ERBB3的表达量,预测并验证两者的靶向关系,通过动物和细胞实验,进一步探讨miR-205-5p是否通过靶向ERBB3调控PI3K/AKT/mTOR通路,影响血管内皮细胞增殖和血管生成,进而缓解痔疮。这项研究可能为阐明痔疮发病机制和寻找新的治疗靶点提供理论依据。
1. 材料与方法
1.1 研究材料
1.1.1 临床样本
选取2021年07月至2022年06月期间昆明市中医医院肛肠科12例痔疮手术患者的痔核组织、痔核3 cm外正常肛周组织,分别标记为疾病组和正常组。所有患者年龄在28 ~ 50岁之间,纳入标准:患者以痔疮脱出肛门外、瘙痒、便血为主要临床表现。排除标准[15]:严重肾、肝、心脑血管疾病、造血系统疾病患者;感染性疾病患者,包括性传播疾病、乙型肝炎、肺结核;药物过敏的患者;思维异常、精神疾病且依从性差的患者。所有患者均签署知情同意书,本研究已获得昆明市中医医院伦理委员会批准(2021伦备字21号)。
1.1.2 实验动物
60只8~10周龄的SPF级SD大鼠购自于昆明医科大学实验动物学部,体质量180 ~ 220 g,饲养在可控的环境中(温度22 ± 2 ℃,湿度45%,光照12 h/d)1周,本实验经昆明医科大学动物实验伦理审查委员会批准(KMMU20211591)。
1.1.3 主要试剂和仪器
HUVEC、HEK-293T细胞(中国科学院上海细胞库);DMEM培养基、FBS(美国Gibco);Trizol试剂、PrimeScript RT Reagent Kit逆转录试剂盒、SYBR Green PCR Master Mix试剂盒、LipofectamineTM 2000转染试剂盒(美国Invitrogen);MTT溶液、RIPA裂解液(美国sigma-Aldrich);BCA试剂盒(美国Thermo Scientific);PVDF膜、ECL显影剂(美国Millipore);双荧光素酶报告基因检测试剂盒(美国Promega);TUNEL试剂盒、蛋白酶抑制剂(中国Beyotime);Matrigel基质胶、Transwell小室(美国Becton Dickinson);Annexin V-FITC/PI试剂盒(加拿大BD Biosciences);抗ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax、Bcl-2、p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、IgG和β-catenin抗体购自美国Abcam;PCR引物、NC mimic、miR-205-5p mimic、NC inhibitor、miR-205-5p inhibitor、sh-NC、sh-ERBB3、oe-ERBB3、pcDNA、pcDNA-ERBB3由上海Genepharma合成并提供;细胞培养箱、qRT-PCR仪(美国Invitrogen);Thermo酶标仪、FACS流式细胞仪(美国Becton Dickinson);荧光显微镜(日本NiKon)。
1.2 研究方法
1.2.1 建模及转染
根据文献[16]制备大鼠痔疮模型:在大鼠肛门外周皮下注射75% 冰醋酸0.05 mL,24 h后大鼠肛周出现白色溃疡面、肿胀伴炎症渗出,即痔病模型建立成功。将阴性对照模拟物(NC mimic)、miR-205-5p模拟物(miR-205-5p mimic)、ERBB3敲低质粒载体(sh-ERBB3)和阴性对照(sh-NC)、阴性对照抑制剂(NC inhibitor)、miR-205-5p抑制剂(miR-205-5p inhibitor)载体质粒经尾静脉注射至模型大鼠;注射miR-205-5p mimic载体的同时,分别注射ERBB3过表达载体(pcDNA-ERBB3)及阴性对照(pcDNA),各组连续注射3周,2次/周;空白组和模型组经尾静脉注射10 mL/kg生理盐水,分别记为Control组、Model组、Model + NC mimic组、Model + miR-205-5p mimic组、Model + sh-NC组、Model + sh-ERBB3组、Model + sh-ERBB3 + NC inhibitor组、Model + sh-ERBB3 + miR-205-5p inhibitor组、Model + miR-205-5p mimic + pcDNA组、Model + miR-205-5p mimic + pcDNA-ERBB 3组。
1.2.2 细胞培养与转染
将HUVEC添加至含有10% FBS、1%青霉素和链霉素的DMEM培养基中,在37 ℃、5% CO2培养箱中培养。待细胞密度约60 ~ 70%时,分为NC组、oe-ERBB3组、sh-ERBB3组、NC mimic组、miR-205-5p mimic组、miR-205-5p mimic + pcDNA-ERBB3组、miR-205-5p mimic + pcDNA组。严格按照LipofectamineTM 2000转染试剂说明书操作,将ERBB3过表达(oe-ERBB3)和ERBB3敲低(sh-ERBB3)质粒分别转染至oe-ERBB3组和sh-ERBB3组HUVEC细胞中;miR-205-5p mimic + pcDNA-ERBB3组及miR-205-5p mimic + pcDNA组在miR-205-5p mimic组基础上分别转染pcDNA-ERBB3及pcDNA质粒,在37 ℃、5% CO2培养箱中培养48 h后用于后续实验。
1.2.3 qRT-PCR
Trizol试剂分别从组织和细胞中提取总RNA,使用PrimeScript RT Reagent Kit将总RNA逆转录成cDNA,使用SYBR Green PCR Master Mix进行PCR反应,引物序列,见表1,以U6和β-actin为内源性参照,用2-ΔΔCt 法计算基因相对表达量。
表 1 引物序列Table 1. Primer sequence基因 引物序列(5′-3′) miR-205–5p Forward CGTCCTTCATTCCACCGG Reverse AGTGCAGGGTCCGAGGTATT ERBB3 Forward CAAGATTCCAGTCTGCATTAAAGTC Reverse CAGCATATGATCTGTCACAGCTTG U6 Forward CTCGCTTCGGCAGCACATA Reverse AACGCTTCACGAATTTGCGT β-actin Forward TGACGTGGACATCCGCAAAG Reverse CTGGAAGGTGGACAGCGAGG 1.2.4 Western blot
使用含有1% 蛋白酶抑制剂的RIPA缓冲液提取细胞或组织的总蛋白,使用BCA检测试剂盒测定蛋白浓度。SDS-PAGE凝胶电泳分离总蛋白质,并将分离的蛋白转移到PVDF膜上,用5% 脱脂奶粉封膜2 h。加入一抗ERBB3、VEGFR2、p-PI3K、PI3K、p-AKT、AKT、p-mTOR、mTOR、Cyclin D1、Caspase-3、Bax、Bcl-2 (1∶1000)4 ℃孵育过夜,加入二抗(1∶20000)室温孵育2 h,避光加入ECL显影剂,以β-actin作为内参蛋白,采用Image J软件分析蛋白灰度值。
1.2.5 免疫荧光染色
4% 多聚甲醛固定组织,0.1% TritonX-100室温透化20 min,5% BSA封闭1 h,加入一抗VEGFR2 (1∶1000),4 ℃ 孵育过夜,加入FITC荧光标记的二抗(1∶200)避光孵育1 h,PBS漂洗,DAPI复染细胞核20 min,PBS清洗3次,滴加抗荧光淬灭剂,中性树胶封片,置于荧光显微镜下观察VEGFR2蛋白的表达情况。
1.2.6 HE染色
将大鼠痔疮组织制成切片脱蜡,苏木精染色5 min,5% 乙酸分化30 s,置于水中返蓝1 ~ 2 min,用伊红染色液染色1 min,梯度乙醇脱水,二甲苯溶液浸泡2遍,用中性树胶密封观察。
1.2.7 TUNEL染色
用PBS洗涤各组织标本2次,各组滴加50 µL TUNEL检测液(2 µL TdT酶+ 48 µL荧光素标记的dUTP溶液),加盖玻片37 ℃ 避光孵育1 h,PBS漂洗组织样品3次,甘油密封。随机选取5个不同视野,在激光共聚焦显微镜下观察并拍照。
1.2.8 免疫组织化学染色
组织切片经二甲苯2次脱蜡和梯度乙醇脱水后置于PBS缓冲溶液中5 min,加入枸橼酸钠缓冲液(0.1 mol/L,pH = 6.0)修复抗原,滴加一抗ERBB3 (1∶1000)和VEGFR2(1∶1000) 4 ℃ 孵育过夜。PDS冲洗3次,滴加HRP标记的羊抗鼠/兔二抗在37 ℃ 下孵育30 min,滴加二氨基联苯胺(DAB)显色剂,苏木素复染、脱水透明、封片,置于显微镜下观察染色情况并拍照。
1.2.9 免疫共沉淀(Co-IP)
收集细胞后加入适量RIPA裂解液(含蛋白酶抑制剂混合物),冰上裂解15 min,12000 r/min离心10 min后吸取上清液,取少量裂解液以备Western blot分析。剩余裂解液加入1 µg相应的抗体和10 µL Protrin A/G琼脂糖珠,在4 ℃ 下缓慢摇晃孵育4 h,非特异性IgG作为对照。免疫沉淀物在裂解缓冲液中洗涤3 ~ 4次,加入15 µL的2×SDS缓冲液后,沸水煮5 min。
1.2.10 双荧光素酶报告基因检测
采用TargetScan数据库预测miR-205-5p和ERBB3的靶向结合位点,将含有ERBB3 3'-UTR的miR-205-5p结合位点克隆到pGL3载体中,分别构建ERBB3野生型质粒(WT)和突变型质粒(MUT)。将2种质粒分别与miR-205-5p mimic、NC mimic共转染到HEK-293T细胞中,培养24 h后,通过双荧光素酶报告基因检测试剂盒检测各组细胞的荧光素酶活性。
1.2.11 MTT
用胰蛋白酶消化HUVEC细胞,单层接种至96孔板中(1 × 104个/孔),每孔加入20 μL MTT孵育4 h后,加入150 μL二甲基亚砜,震荡10 min,在酶标仪490 nm处测量OD值,计算0 ~ 48 h每组细胞增殖活性。
1.2.12 划痕愈合和Transwell
划痕愈合:将各组细胞接种至6孔板中(1 × 103个/孔),待细胞汇合度为90% 时,用200 μL枪尖垂直划痕,PBS清洗3次,加入划痕用培养基,37 ℃、5% CO2恒温箱培养24 h,在倒置显微镜下观察拍照。Transwell:将细胞消化并转移到涂有Matrigel基质胶的Transwell上室,下室加入含20% 胎牛血清的培养基,在37 ℃、5% CO2恒温箱中培养24 h,弃培养基,上室用4% 多聚甲醛固定。0.1% 结晶紫染色,洗涤风干,在显微镜下对细胞进行观察和计数。
1.2.13 流式细胞术
严格按照FACS流式细胞仪和Annexin V-FITC/PI试剂盒操作,随机选取5个不同视野,计算每个视野细胞凋亡率。
1.2.14 体外血管形成实验
胰酶消化,将各组细胞按每孔2 × 104个的密度接种到涂有Matrigel凝胶的96孔板上,37 ℃、5% CO2恒温培养箱中培养12 h,最后在显微镜下观察血管生成情况并拍照。
1.3 统计学处理
所有数据至少重复3次独立实验,采用GraphPad Prism 8.1进行数据统计分析。数据以均值 ± 标准差(SD)表示,多组间比较采用单因素方差分析,进一步两两比较的方法用Fishers LSD方法。P < 0.05为差异有统计学意义。
2. 结果
2.1 miR-205-5p和ERBB3在痔疮中的表达情况
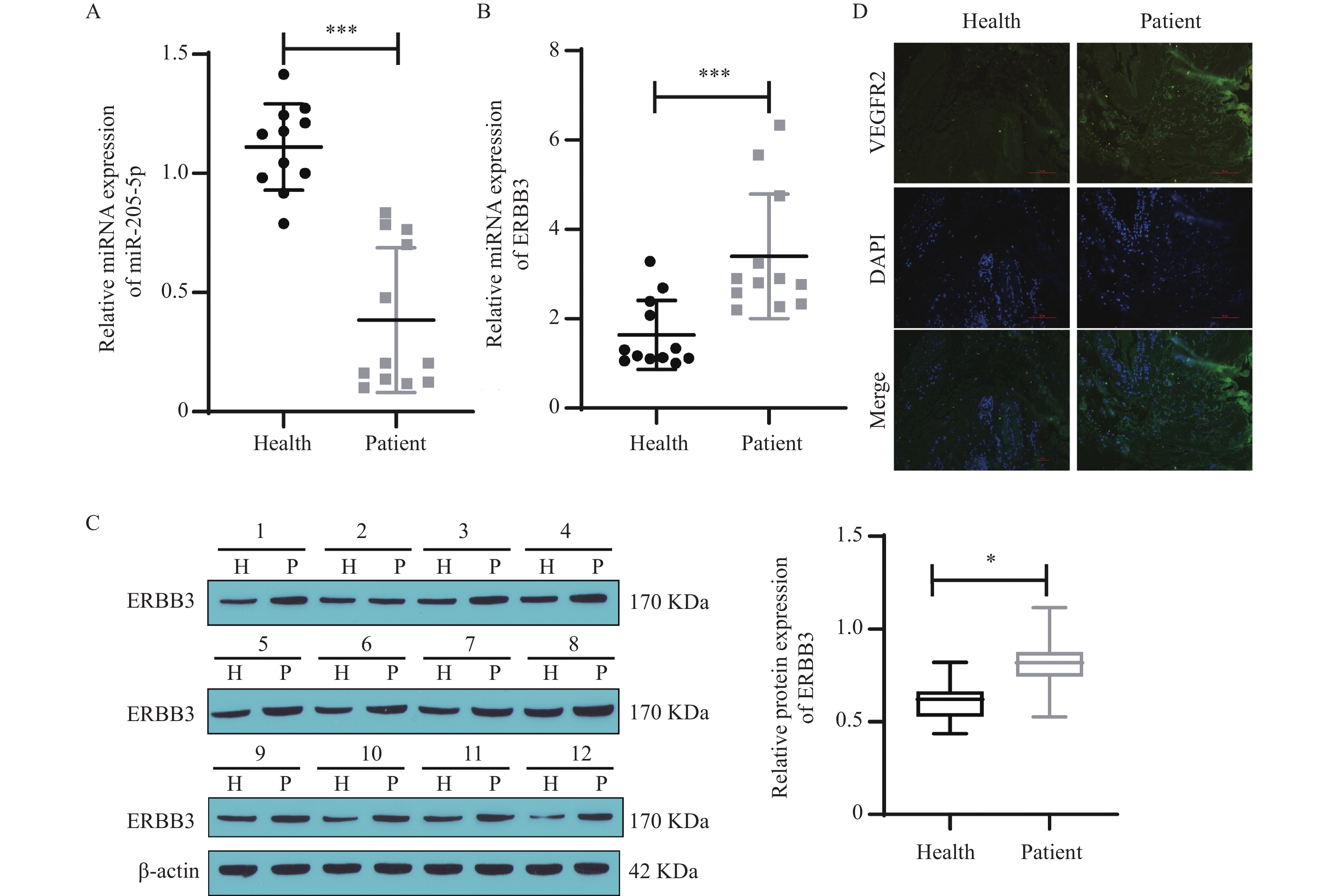
采用qRT-PCR检测临床病理组织样本中miR-205-5p和ERBB3的表达情况,结果显示,与正常组样本相比,疾病组样本中miR-205-5p表达量降低(P < 0.001),ERBB3 mRNA表达量升高(P < 0.001),见图1A~B;Western blot结果显示,疾病组样本中ERBB3蛋白表达量高于健康组(P < 0.05),见图1C。此外,对临床样本进行免疫荧光染色检测VEGFR2蛋白定位及表达水平,结果发现VEGFR2主要定位于细胞质中,相比正常组,疾病组样本中VEGFR2蛋白荧光强度增加,见图1D。
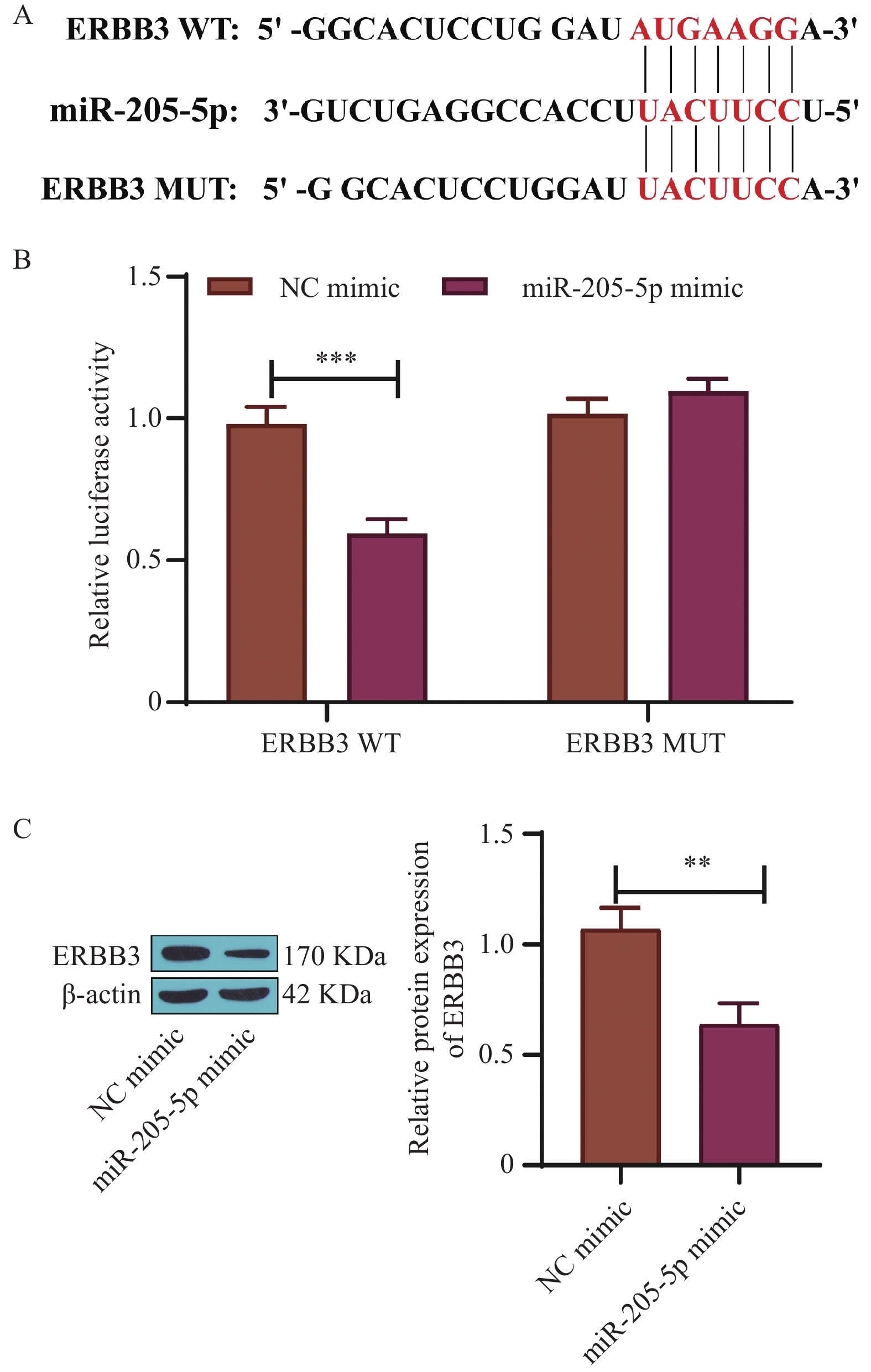
2.2 miR-205-5p靶向结合ERBB3
TargetScan数据库预测结果显示,miR-205-5p与ERBB3存在靶向关系,见图2A。双荧光素酶实验结果显示,与NC mimic组比较,miR-205-5p mimic组中ERBB3-WT的荧光素酶活性显著降低(P < 0.001),而ERBB3-MUT的荧光素酶活性无明显变化,见图2B。Western blot结果显示,miR-205-5p mimic组ERBB3蛋白水平较NC mimic组显著降低(P < 0.01),见图2C。可见,miR-205-5p能直接靶向结合ERBB3,并且负调控ERBB3的表达。
2.3 miR-205-5p对痔疮的影响
qRT-PCR检测各组大鼠肛周组织中miR-205-5p的相对表达量,模型组大鼠中miR-205-5p表达量降低(P < 0.001),转染miR-205-5p mimic后表达量升高(P < 0.001),见图3A。HE染色显示模型组大鼠肛周组织血管明显增生,血管内皮细胞核增大,大量炎性细胞浸润,血管周围间质层连接不紧密,转染NC mimic后无明显变化,转染miR-205-5p mimic后大鼠肛周组织病理情况得到改善,见图3B。TUNEL染色结果显示,模型组大鼠细胞凋亡率降低(P < 0.001),转染miR-205-5p mimic后细胞凋亡率升高(P < 0.05),见图3C。免疫组化结果显示,模型组大鼠肛周组织中ERBB3、VEGFR2表达量升高,转染miR-205-5p mimic后ERBB3、VEGFR2表达量均明显降低,见图3D。此外,Western blot结果显示,模型组中ERBB3、VEGFR2、Cyclin D1、Bcl-2蛋白表达量升高,cleaved-caspase 3、Bax蛋白表达量降低;而转染miR-205-5p mimic后,逆转了模型组大鼠肛周组织的蛋白表达情况(P < 0.05,P < 0.01,P < 0.001),见图3E。由此推测,miR-205-5p能抑制肛周组织血管生成,改善痔疮的组织病理状况,可能与抑制ERBB3、VEGFR2表达,抑制细胞周期、促进凋亡相关。
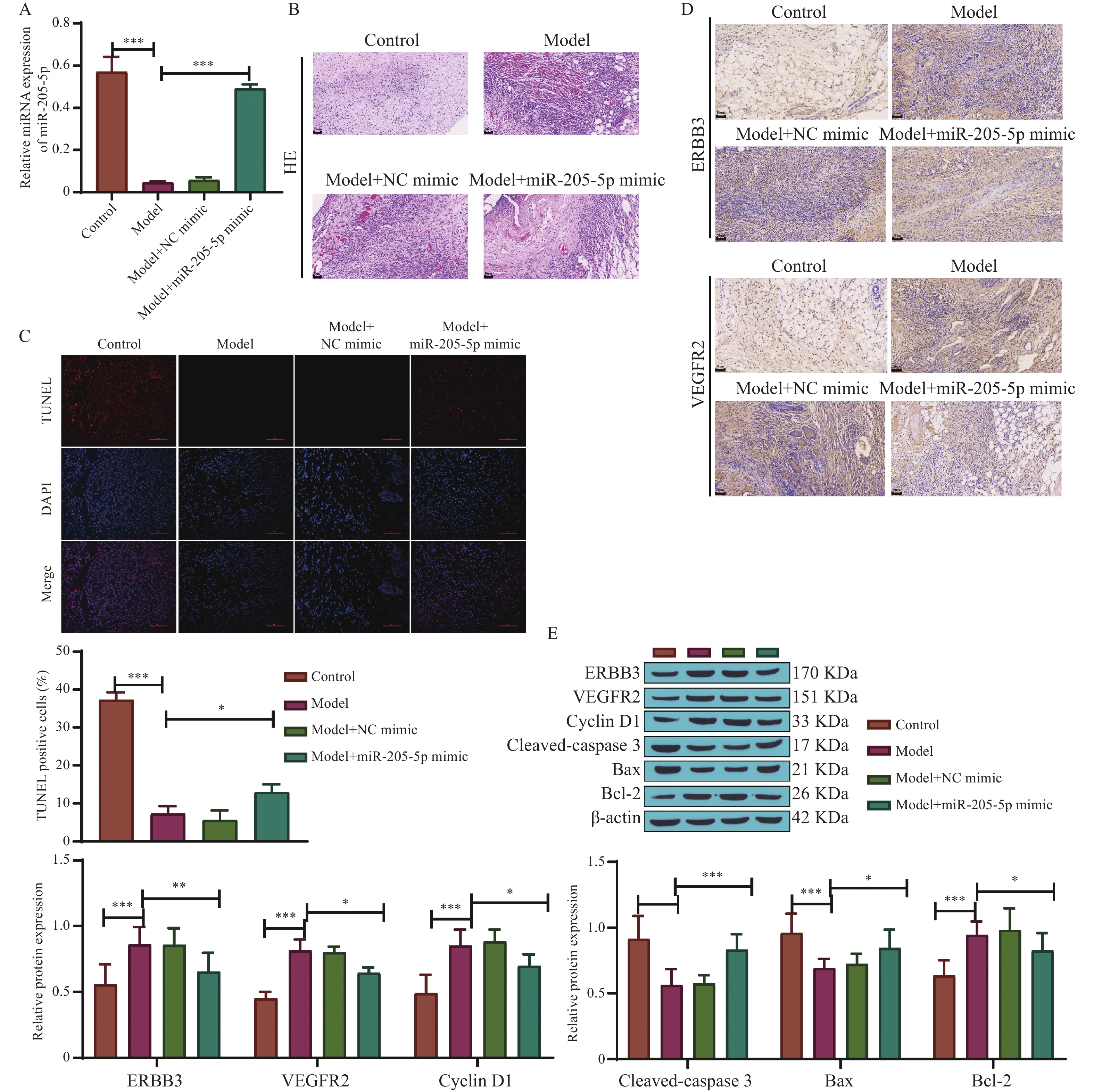 图 3 过表达miR-205-5p对痔疮大鼠的影响A:qRT-PCR检测各组大鼠肛周组织中miR-205-5p的相对表达量;B:HE染色观察各组大鼠肛周组织病理变化(200 ×,标尺50 μm),n=5;C:TUNEL染色检测各组大鼠肛周组织细胞凋亡率和凋亡阳性细胞定量;D:免疫组化检测ERBB3和VEGFR2蛋白表达情况(200 ×,标尺50 μm),n=5;E:Western blot检测ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax和Bcl-2蛋白水平,n=5;*P < 0.05,**P < 0.01,***P < 0.001。Figure 3. The effect of overexpression of miR-205-5p on hemorrhoidal rats
图 3 过表达miR-205-5p对痔疮大鼠的影响A:qRT-PCR检测各组大鼠肛周组织中miR-205-5p的相对表达量;B:HE染色观察各组大鼠肛周组织病理变化(200 ×,标尺50 μm),n=5;C:TUNEL染色检测各组大鼠肛周组织细胞凋亡率和凋亡阳性细胞定量;D:免疫组化检测ERBB3和VEGFR2蛋白表达情况(200 ×,标尺50 μm),n=5;E:Western blot检测ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax和Bcl-2蛋白水平,n=5;*P < 0.05,**P < 0.01,***P < 0.001。Figure 3. The effect of overexpression of miR-205-5p on hemorrhoidal rats2.4 miR-205-5p通过ERBB3影响痔疮进展
qRT-PCR结果显示,sh-ERBB3成功转染至模型大鼠后,与模型组相比,miR-205-5p表达量无明显变化,而转染miR-205-5p inhibitor后表达量降低(P < 0.001),见图4A。HE染色发现,将sh-ERBB3转染至模型大鼠后,肛周组织中增生血管及炎性细胞明显减少;而转染miR-205-5p inhibitor后,组织中炎性细胞增多,伴微小脓腔形成,见图4B。TUNEL染色结果显示,转染sh-ERBB3后模型大鼠细胞凋亡率升高,转染miR-205-5p inhibitor后,sh-ERBB3对细胞凋亡率的影响被逆转(P < 0.01,P < 0.001),见图4C。免疫组化染色显示,转染sh-ERBB3后模型大鼠ERBB3、VEGFR2表达降低,转染miR-205-5p inhibitor后明显升高,见图4D。Western blot结果显示,转染sh-ERBB3后,ERBB3、VEGFR2、Cyclin D1、Bcl-2蛋白表达量降低,cleaved-caspase 3、Bax表达量升高(P < 0.001),而转染miR-205-5p inhibitor后,sh-ERBB3对蛋白表达的影响被不同程度逆转(P < 0.05,P < 0.01,P < 0.001),见图4E。可见,抑制miR-205-5p表达可以促进ERBB3在肛周组织中表达,下调凋亡相关蛋白水平,促进血管新生,进而导致肛周组织病理恶化和痔疮的发生发展。
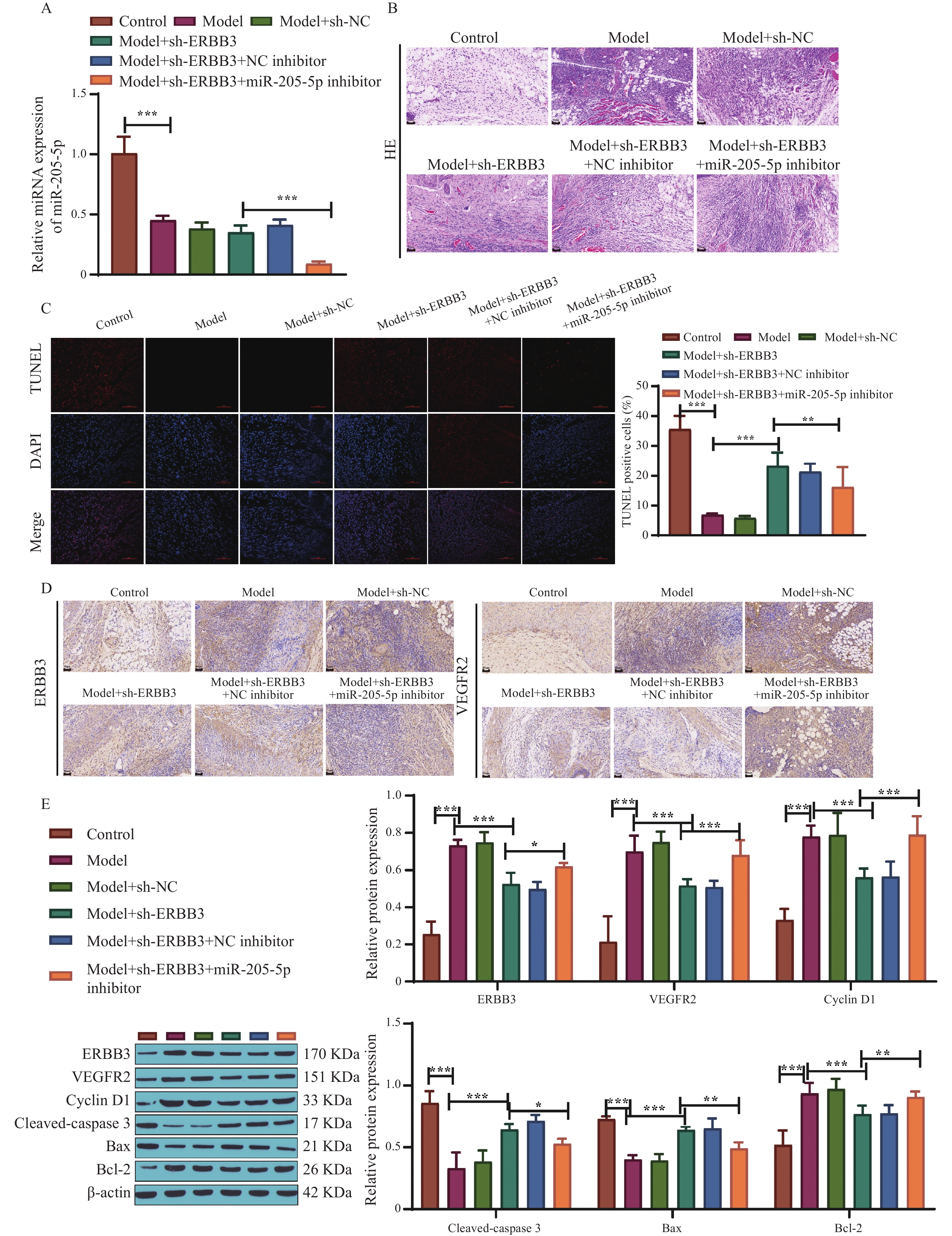 图 4 ERBB3受miR-205-5p调控影响痔疮的进展A:qRT-PCR检测各组大鼠肛周组织中miR-205-5p的相对表达量;B:HE染色观察肛周组织病理变化(200 ×,标尺50 μm),n=5;C:TUNEL染色检测细胞凋亡率和阳性细胞定量;D:免疫组化检测ERBB3和VEGFR2蛋白表达情况(200 ×,标尺50 μm),n=5;E:Western blot检测ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax和Bcl-2蛋白水平,n=5;*P < 0.05,**P < 0.01,***P < 0.001。Figure 4. ERBB3 is regulated by miR-205-5p to affect the progression of hemorrhoids
图 4 ERBB3受miR-205-5p调控影响痔疮的进展A:qRT-PCR检测各组大鼠肛周组织中miR-205-5p的相对表达量;B:HE染色观察肛周组织病理变化(200 ×,标尺50 μm),n=5;C:TUNEL染色检测细胞凋亡率和阳性细胞定量;D:免疫组化检测ERBB3和VEGFR2蛋白表达情况(200 ×,标尺50 μm),n=5;E:Western blot检测ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax和Bcl-2蛋白水平,n=5;*P < 0.05,**P < 0.01,***P < 0.001。Figure 4. ERBB3 is regulated by miR-205-5p to affect the progression of hemorrhoids2.5 过表达ERBB3逆转miR-205-5p过表达对痔疮的影响
将pcDNA、pcDNA-ERBB3分别转染至miR-205-5p mimic组大鼠后,qRT-PCR结果显示,miR-205-5p表达量并无明显差异,见图5A。HE、TUNEL和免疫组化染色结果发现,转染pcDNA-ERBB3后逆转了miR-205-5p mimic可以改善大鼠肛周组织病理情况、促进细胞凋亡、抑制ERBB3、VEGFR2表达的作用,见图5B~5D。Western blot结果显示,转染pcDNA-ERBB3后,大鼠ERBB3、VEGFR2、Cyclin D1、Bcl-2、p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白表达量升高,cleaved-caspase 3、Bax表达量降低(P < 0.05,P < 0.01,P < 0.001),pcDNA-ERBB3逆转了miR-205-5p mimic对痔疮大鼠相关蛋白的影响,见图5E。这些结果提示,过表达ERBB3能逆转miR-205-5p过表达诱导细胞凋亡、抑制血管生成、改善肛周组织病理的作用,可能与PI3K/AKT/mTOR信号通路异常激活相关。
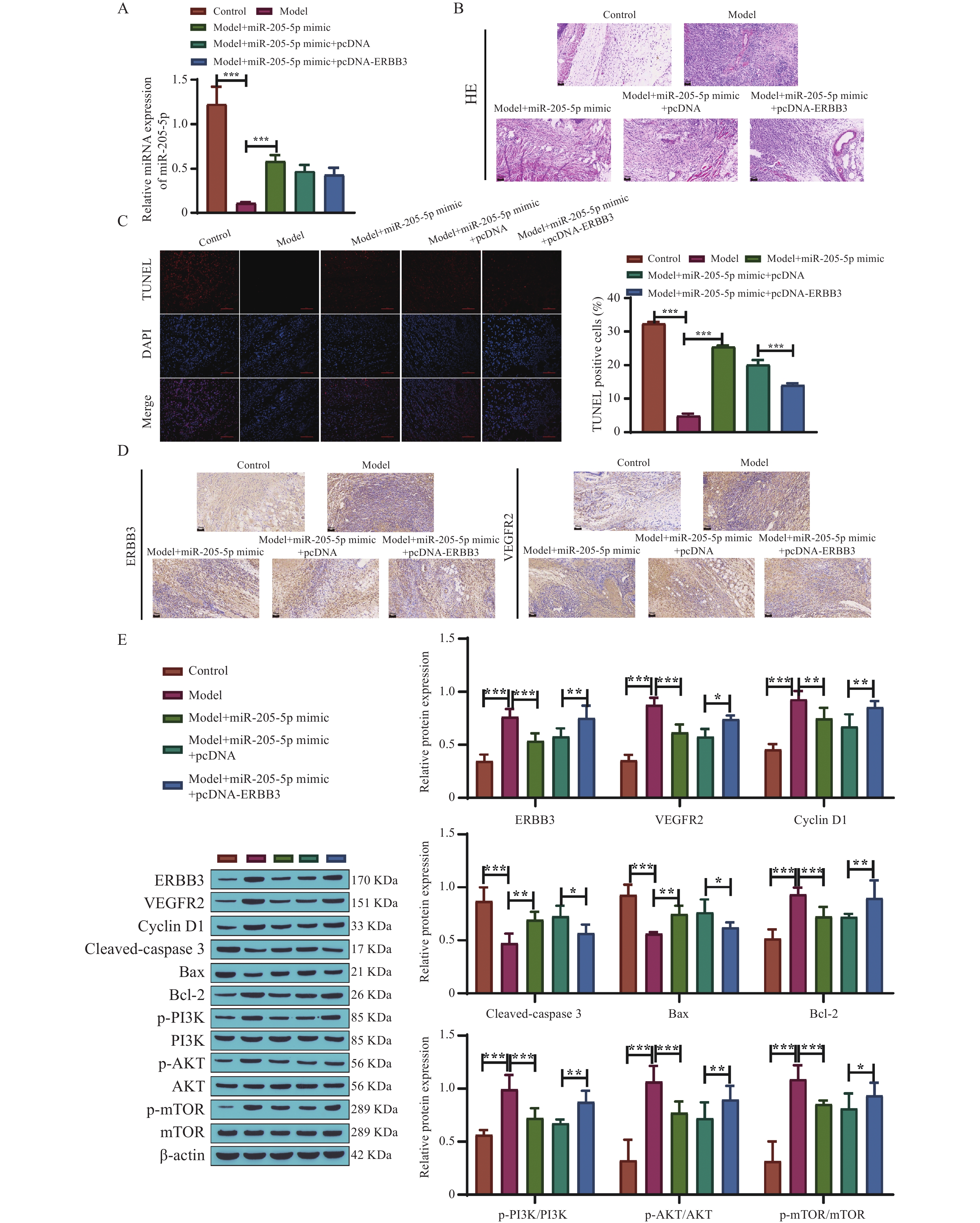 图 5 过表达ERBB3对痔疮大鼠的影响A:qRT-PCR检测各组大鼠肛周组织中miR-205-5p的相对表达量;B:HE染色观察肛周组织病理变化(200 ×,标尺50 μm),n=5;C:TUNEL染色检测细胞凋亡率和阳性细胞定量;D:免疫组化检测ERBB3和VEGFR2蛋白表达情况(200 ×,标尺50 μm),n=5;E:Western blot检测ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax、Bcl-2、p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白水平,n=5;*P < 0.05,**P < 0.01,***P < 0.001。Figure 5. The effect of overexpression of ERBB3 on hemorrhoidal rats
图 5 过表达ERBB3对痔疮大鼠的影响A:qRT-PCR检测各组大鼠肛周组织中miR-205-5p的相对表达量;B:HE染色观察肛周组织病理变化(200 ×,标尺50 μm),n=5;C:TUNEL染色检测细胞凋亡率和阳性细胞定量;D:免疫组化检测ERBB3和VEGFR2蛋白表达情况(200 ×,标尺50 μm),n=5;E:Western blot检测ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax、Bcl-2、p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白水平,n=5;*P < 0.05,**P < 0.01,***P < 0.001。Figure 5. The effect of overexpression of ERBB3 on hemorrhoidal rats2.6 过表达ERBB3促进血管生成与PI3K/AKT/mTOR通路相关
免疫共沉淀检测结果显示,ERBB3与PI3K发生结合,提示ERBB3可能通过PI3K发挥下游作用,见图6A。qRT-PCR检测ERBB3的转染效率,结果显示,与NC组相比,oe-ERBB3组的ERBB3表达量显著升高,而sh-ERBB3组表达量显著降低(P < 0.01,P < 0.001),见图6B。血管生成实验结果显示,与NC组相比,oe-ERBB3组血管生成量显著增加,而sh-ERBB3组显著减少(P < 0.001),见图6C。Western blot结果显示,与NC组相比,oe-ERBB3组ERBB3、VEGFR2、Cyclin D1、Bcl-2、p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR表达量升高,Cleaved-caspase 3、Bax表达量降低,sh-ERBB3组则相反(P < 0.01,P < 0.001),见图6D。此外,通过分析HUVEC细胞生物学行为发现,与NC组相比,oe-ERBB3组HUVEC细胞的增殖、迁移、侵袭能力显著升高,sh-ERBB3组则显著降低(P < 0.01,P < 0.001),见图6E~6H。流式细胞仪术结果显示,与NC组相比,oe-ERBB3组细胞凋亡率显著降低,HUVEC细胞G0/G1期、S期比例显著升高,G2/M期细胞比例显著降低,sh-ERBB3组细胞凋亡率显著升高(P < 0.001),见图6I~6J。由此推测,过表达ERBB3可能激活PI3K/AKT/mTOR通路,促进HUVEC细胞增殖迁移及侵袭,抑制凋亡,促使血管生成。
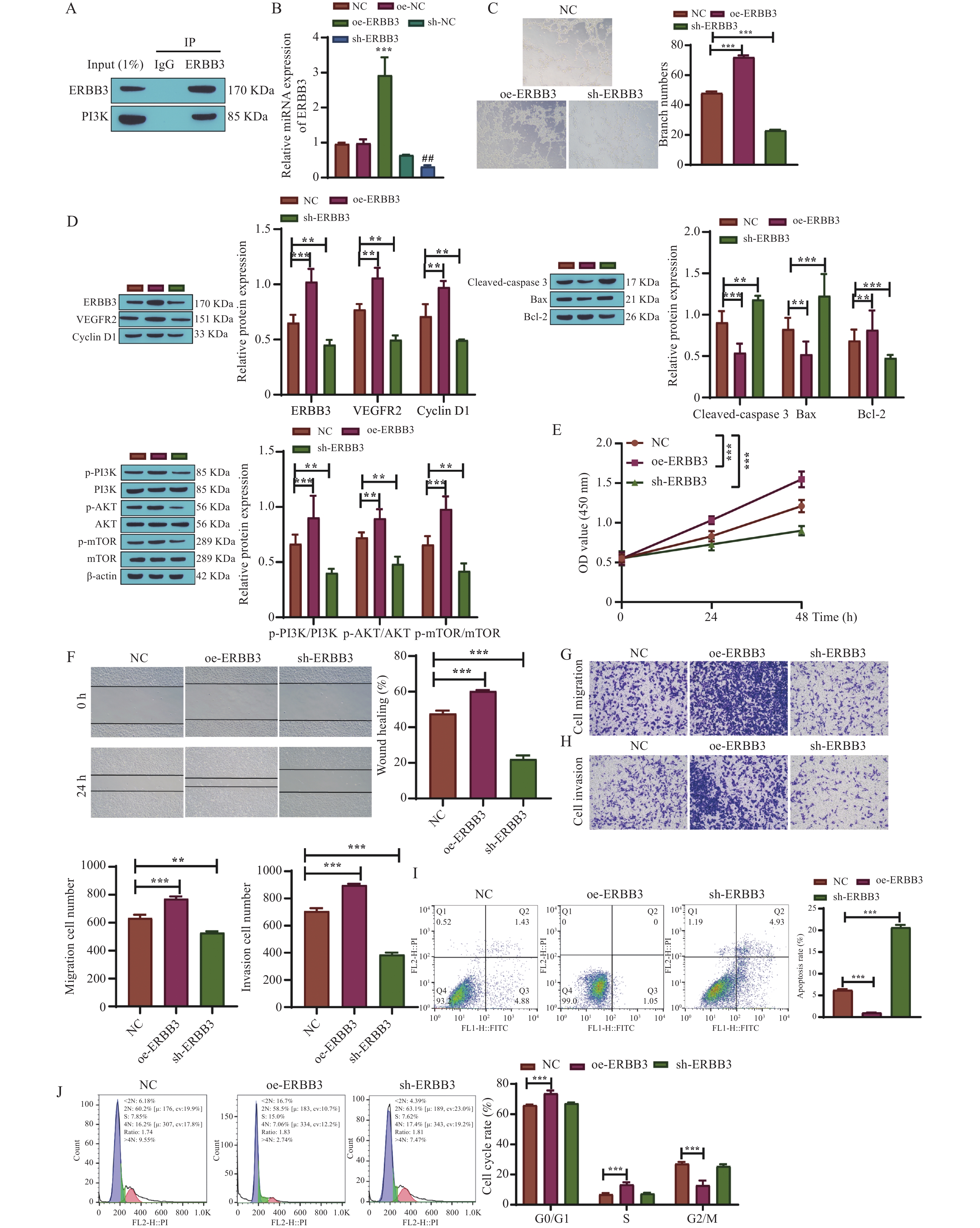 图 6 过表达ERBB3促进血管生成与PI3K/AKT/mTOR通路相关A:免疫共沉淀法验证ERBB3与PI3K的相互作用,n = 3;B:qRT-PCR检测转染效率;C:血管生成实验;D:Western blot检测相关蛋白水平,n = 3;E:MTT法检测细胞增殖能力;F:划痕愈合实验检测细胞迁移能力;G-H:Transwell实验检测细胞迁移侵袭能力;I: AnnexinV-FITC/PI检测细胞凋亡率;J:流式细胞仪检测细胞周期;*P < 0.05,**P < 0.01,***P < 0.001,与NC组相比,##P < 0.01。Figure 6. Overexpression of ERBB3 promotes angiogenesis through PI3K/AKT/mTOR pathway
图 6 过表达ERBB3促进血管生成与PI3K/AKT/mTOR通路相关A:免疫共沉淀法验证ERBB3与PI3K的相互作用,n = 3;B:qRT-PCR检测转染效率;C:血管生成实验;D:Western blot检测相关蛋白水平,n = 3;E:MTT法检测细胞增殖能力;F:划痕愈合实验检测细胞迁移能力;G-H:Transwell实验检测细胞迁移侵袭能力;I: AnnexinV-FITC/PI检测细胞凋亡率;J:流式细胞仪检测细胞周期;*P < 0.05,**P < 0.01,***P < 0.001,与NC组相比,##P < 0.01。Figure 6. Overexpression of ERBB3 promotes angiogenesis through PI3K/AKT/mTOR pathway2.7 miR-205-5p靶向ERBB3调控PI3K/AKT/mTOR通路抑制HUVEC细胞增殖、迁移和血管生成
qRT-PCR检测各组细胞miR-205-5p的表达量,结果显示,miR-205-5p mimic组表达量相比NC mimic组显著升高(P < 0.001),而转染pcDNA-ERBB3及pcDNA后,miR-205-5p表达量无明显变化,见图7A。Western blot结果显示,与NC mimic组相比,miR-205-5p mimic组ERBB3、VEGFR2、Cyclin D1、Bcl-2、p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR表达量降低,Cleaved-caspase 3、Bax表达量升高(P < 0.01,P < 0.001),而转染pcDNA-ERBB3后则削弱了miR-205-5p mimic的作用(P < 0.05,P < 0.01,P < 0.001),见图7B。MTT法、划痕愈合、Transwell实验和流式细胞术结果显示,转染pcDNA-ERBB3后HUVEC细胞增殖、迁移、侵袭能力以及血管生成量均显著升高,凋亡率显著降低(P < 0.001),HUVEC细胞S期和G2/M期比例升高(P < 0.05),见图7C~7I。可见,过表达ERBB3逆转了miR-205-5p过表达对HUVEC细胞的影响。证实了miR-205-5p能够靶向ERBB3抑制PI3K/AKT/mTOR通路,进而抑制HUVEC细胞增殖、迁移、侵袭及血管生成。
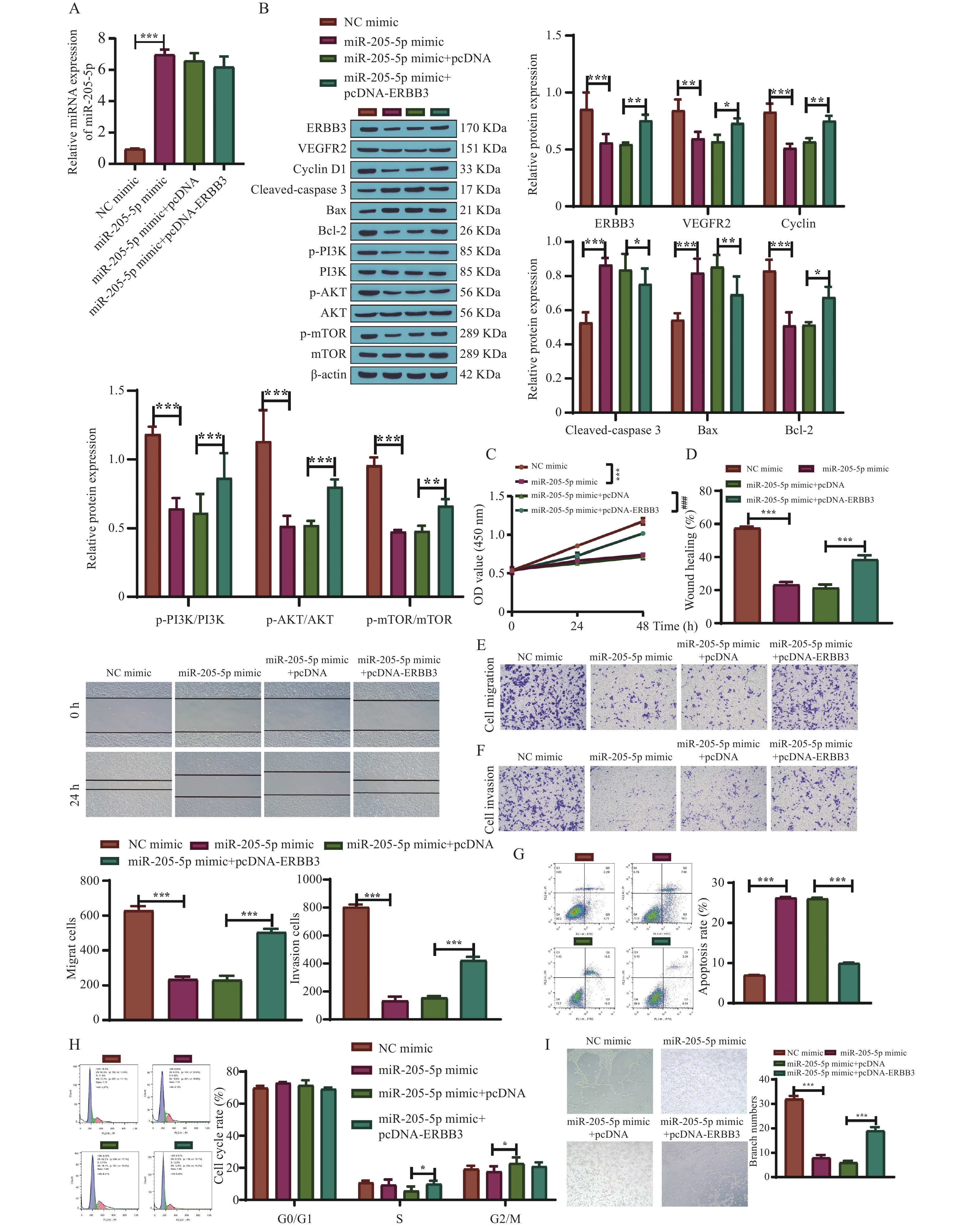 图 7 miR-205-5p靶向ERBB3调控PI3K/AKT/mTOR通路对HUVEC细胞的影响A:qRT-PCR检测各组miR-205-5p表达量;B:Western blot检测相关蛋白表达水平,n=3;C:MTT法检测HUVEC细胞增殖能力;D:划痕愈合实验检测HUVEC细胞迁移能力;E~F:Transwell实验检测HUVEC细胞迁移侵袭能力;G: AnnexinV-FITC/PI检测HUVEC细胞凋亡率;H:流式细胞仪检测HUVEC细胞周期;I:血管生成实验;*P < 0.05,**P < 0.01,***P < 0.001。Figure 7. The effect of miR-205-5p targeting ERBB3 to regulate PI3K/AKT/mTOR pathway on HUVEC cells
图 7 miR-205-5p靶向ERBB3调控PI3K/AKT/mTOR通路对HUVEC细胞的影响A:qRT-PCR检测各组miR-205-5p表达量;B:Western blot检测相关蛋白表达水平,n=3;C:MTT法检测HUVEC细胞增殖能力;D:划痕愈合实验检测HUVEC细胞迁移能力;E~F:Transwell实验检测HUVEC细胞迁移侵袭能力;G: AnnexinV-FITC/PI检测HUVEC细胞凋亡率;H:流式细胞仪检测HUVEC细胞周期;I:血管生成实验;*P < 0.05,**P < 0.01,***P < 0.001。Figure 7. The effect of miR-205-5p targeting ERBB3 to regulate PI3K/AKT/mTOR pathway on HUVEC cells3. 讨论
3.1 miR-205-5p在痔疮血管生成中的作用
miRNAs是一类非编码小RNA分子,其通过抑制mRNAs翻译或促进mRNAs降解,转录后调控靶基因的表达,在细胞增殖、迁移、凋亡和血管生成等生物过程中发挥重要作用[17-18]。其中miR-205-5p作为miRNA205家族成员,广泛参与多种肿瘤的增殖、侵袭转移和血管生成等生物学行为。miR-205-5p 通过降低VEGFA和FGF1表达抑制胃癌中的血管生成[19]。此外,miR-205-5p 可以调节PTK7的表达限制结直肠癌细胞的增殖、迁移[20]。Huang等[21]研究表明,miR-205-5p可抑制ox-LDL诱导的HAVSMC细胞增殖和迁移。Oltra等[22]发现miR-205-5p受氧化应激调节,靶向VEGRA调控血管生成。然而,miR-205-5p在痔疮中的调节机制鲜有报道。笔者通过检测临床组织样本发现,miR-205-5p在痔核组织中呈低表达,ERBB3呈高表达,并通过生物信息数据库预测了miR-205-5p与ERBB3的3'UTR靶向结合位点。同时,双荧光素酶实验证实了miR-205-5p能直接靶向结合ERBB3。体内外实验结果显示,转染miR-205-5p mimics后,HUVEC细胞增殖、迁移、侵袭能力均明显降低,细胞凋亡率升高,血管生成量明显减少,痔疮大鼠的肛周组织病理情况也明显改善,而转染miR-205-5p inhibitor后则相反。因此,过表达miR-205-5p可抑制HUVEC细胞增殖和成管能力,诱导细胞凋亡,减缓痔疮进展,可作为痔疮治疗的候选靶点。
3.2 miR-205-5p调控ERBB3的表达
ERBB3作为ERBB家族重要成员之一,在多种良恶性疾病中呈高表达。有研究发现抑制ERBB3表达,可以缓解肝细胞癌进展[23]。ERBB3在非小细胞肺癌(non-small cell lung cancer,NSCLC)组织中高表达,并且促进NSCLC细胞增殖迁移及血管生成[24]。此外,EGFR/ERBB2和ERBB2/ERBB3异源二聚体是血管内皮生长因子VEGF mRNA表达的最有效诱导因子,具有强大的血管生成活性[25]。通过免疫荧光染色和免疫组化检测我们发现,临床病理组织和大鼠组织血管内皮生长因子受体2(VEGFR2)在细胞质中呈黄褐色,其表达量显著升高,提示痔疮发生发展与血管生成密切相关。Tu等[26]研究发现,miR-497过表达分别靶向VEGFR2/PI3K/AKT和VEGFR2/Raf/MEK/ERK信号通路诱导HUVEC凋亡和抑制细胞增殖,发挥抗血管生成作用。有研究[27]表明ERBB3受miR-205-5p直接靶向负调控,siERBB3诱导前列腺癌PCa细胞G0/G1期阻滞和凋亡。在本研究中,过表达ERBB3后,HUVEC细胞中VEGFR2表达量显著升高,细胞周期蛋白Cyclin D1和抗凋亡蛋白Bcl-2相对表达量显著升高,凋亡分子cleaved Caspase-3和促凋亡蛋白Bax相对表达量显著降低,细胞增殖、迁移、侵袭活性显著提高,管腔数量及分支增多,细胞凋亡率显著降低。过表达miR-205-5p可能通过抑制VEGFR2表达,降低Cyclin D1、Bcl-2蛋白水平,提高cleaved Caspase-3、Bax蛋白水平,阻断HUVEC细胞从G0/G1期到S期的转换,从而抑制细胞增殖并诱导凋亡;而过表达ERBB3能逆转miR-205-5p对HUVEC细胞的作用。体内外实验结果均表明,miR-205-5p靶向抑制ERBB3表达在痔疮中调控细胞增殖、迁移、凋亡、血管生成等生物学行为,且这一过程可能与ERBB3激活下游信号分子有关。笔者的研究证明了miR-205-5p可以靶向抑制ERBB3的表达,进而缓解痔疮的形成。
3.3 PI3K/AKT/mTOR通路在痔疮血管生成中的作用
有研究发现miR-205转录后沉默驱动ERBB3过表达并与FGF特异结合,过度激活PI3K/AKT/mTOR通路维持胶质母细胞瘤恶性表型[28]。ERBB2/ERBB3异源二聚体通过其C端的6个磷酸化激活位点,与PI3K-p85亚基结合,激活PI3K/AKT信号级联[29]。mTOR作为PI3K/AKT最主要的下游分子,受p-AKT诱导磷酸化而激活,从而参与调控细胞周期和细胞自噬等过程[30]。笔者通过免疫共沉淀证明了ERBB3和PI3K的相互作用。oe-ERBB3组HUVEC细胞ERBB3表达显著升高,PI3K、AKT、mTOR的磷酸化水平均升高,管腔数量增多,HUVEC细胞增殖迁移、侵袭力升高,细胞凋亡率降低;sh-ERBB3组则相反。miR-205-5p mimic组大鼠肛周组织和HUVEC细胞的ERBB3表达显著降低,PI3K、AKT、mTOR的磷酸化水平降低,PI3K/AKT/mTOR信号通路活性被抑制,而过表达ERBB3逆转了miR-205-5p mimic诱导PI3K/AKT/mTOR通路活性降低的作用。说明miR-205-5p调控 PI3K/AKT/mTOR通路能有效抑制HUVEC细胞增殖、迁移、侵袭和血管生成,促进细胞凋亡。因此,抑制PI3K/AKT/mTOR通路激活可以抑制血管内皮细胞的生理活性和痔疮的形成。
综上所述,miR-205-5p能够通过靶向抑制ERBB3表达,下调PI3K/AKT/mTOR通路活性,在体外阻滞HUVEC细胞周期,诱导细胞凋亡,抑制HUVEC细胞增殖、迁移、侵袭和血管生成;在体内可以有效抑制肛周组织血管新生,改善肛周组织病理状况,减缓痔疮发生发展。本研究为miRNAs在痔病中的临床相关性提供了新见解,也为miR-205-5p作为痔疮的治疗靶点提供了新的理论基础。但本研究仅对HUVEC细胞株进行研究,在其他细胞中,miR-205-5p是否具有相似的调控机制,还有待进一步研究。
-
图 3 过表达miR-205-5p对痔疮大鼠的影响
A:qRT-PCR检测各组大鼠肛周组织中miR-205-5p的相对表达量;B:HE染色观察各组大鼠肛周组织病理变化(200 ×,标尺50 μm),n=5;C:TUNEL染色检测各组大鼠肛周组织细胞凋亡率和凋亡阳性细胞定量;D:免疫组化检测ERBB3和VEGFR2蛋白表达情况(200 ×,标尺50 μm),n=5;E:Western blot检测ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax和Bcl-2蛋白水平,n=5;*P < 0.05,**P < 0.01,***P < 0.001。
Figure 3. The effect of overexpression of miR-205-5p on hemorrhoidal rats
图 4 ERBB3受miR-205-5p调控影响痔疮的进展
A:qRT-PCR检测各组大鼠肛周组织中miR-205-5p的相对表达量;B:HE染色观察肛周组织病理变化(200 ×,标尺50 μm),n=5;C:TUNEL染色检测细胞凋亡率和阳性细胞定量;D:免疫组化检测ERBB3和VEGFR2蛋白表达情况(200 ×,标尺50 μm),n=5;E:Western blot检测ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax和Bcl-2蛋白水平,n=5;*P < 0.05,**P < 0.01,***P < 0.001。
Figure 4. ERBB3 is regulated by miR-205-5p to affect the progression of hemorrhoids
图 5 过表达ERBB3对痔疮大鼠的影响
A:qRT-PCR检测各组大鼠肛周组织中miR-205-5p的相对表达量;B:HE染色观察肛周组织病理变化(200 ×,标尺50 μm),n=5;C:TUNEL染色检测细胞凋亡率和阳性细胞定量;D:免疫组化检测ERBB3和VEGFR2蛋白表达情况(200 ×,标尺50 μm),n=5;E:Western blot检测ERBB3、VEGFR2、Cyclin D1、Cleaved-caspase 3、Bax、Bcl-2、p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白水平,n=5;*P < 0.05,**P < 0.01,***P < 0.001。
Figure 5. The effect of overexpression of ERBB3 on hemorrhoidal rats
图 6 过表达ERBB3促进血管生成与PI3K/AKT/mTOR通路相关
A:免疫共沉淀法验证ERBB3与PI3K的相互作用,n = 3;B:qRT-PCR检测转染效率;C:血管生成实验;D:Western blot检测相关蛋白水平,n = 3;E:MTT法检测细胞增殖能力;F:划痕愈合实验检测细胞迁移能力;G-H:Transwell实验检测细胞迁移侵袭能力;I: AnnexinV-FITC/PI检测细胞凋亡率;J:流式细胞仪检测细胞周期;*P < 0.05,**P < 0.01,***P < 0.001,与NC组相比,##P < 0.01。
Figure 6. Overexpression of ERBB3 promotes angiogenesis through PI3K/AKT/mTOR pathway
图 7 miR-205-5p靶向ERBB3调控PI3K/AKT/mTOR通路对HUVEC细胞的影响
A:qRT-PCR检测各组miR-205-5p表达量;B:Western blot检测相关蛋白表达水平,n=3;C:MTT法检测HUVEC细胞增殖能力;D:划痕愈合实验检测HUVEC细胞迁移能力;E~F:Transwell实验检测HUVEC细胞迁移侵袭能力;G: AnnexinV-FITC/PI检测HUVEC细胞凋亡率;H:流式细胞仪检测HUVEC细胞周期;I:血管生成实验;*P < 0.05,**P < 0.01,***P < 0.001。
Figure 7. The effect of miR-205-5p targeting ERBB3 to regulate PI3K/AKT/mTOR pathway on HUVEC cells
表 1 引物序列
Table 1. Primer sequence
基因 引物序列(5′-3′) miR-205–5p Forward CGTCCTTCATTCCACCGG Reverse AGTGCAGGGTCCGAGGTATT ERBB3 Forward CAAGATTCCAGTCTGCATTAAAGTC Reverse CAGCATATGATCTGTCACAGCTTG U6 Forward CTCGCTTCGGCAGCACATA Reverse AACGCTTCACGAATTTGCGT β-actin Forward TGACGTGGACATCCGCAAAG Reverse CTGGAAGGTGGACAGCGAGG -
[1] Wang C,Lu H,Luo C,et al. miR-412-5p targets Xpo1 to regulate angiogenesis in hemorrhoid tissue[J]. Gene,2019,705(26):167-176. doi: 10.1016/j.gene.2019.04.058 [2] Qureshi W A. Office management of hemorrhoids[J]. Am J Gastroenterol,2018,113(6):795-798. doi: 10.1038/s41395-018-0020-0 [3] Wang K,Zhang Y,Ma X,et al. Identification of the microRNA alterations in extracellular vesicles derived from human haemorrhoids[J]. Exp Physiol,2023,108(5):752-761. doi: 10.1113/EP090549 [4] Song C,Zhou H,Lu H,et al. Aberrant expression for microRNA is potential crucial factors of haemorrhoid[J]. Hereditas,2020,157(1):25. doi: 10.1186/s41065-020-00139-9 [5] 王辰. miR-412-5p靶向xpo1调控痔核组织血管增生以及痔血宁合剂干预的机制研究 [D]. 上海: 上海中医药大学, 2019. [6] Liu T,Zhou H,Lu H,et al. MiR-4729 regulates TIE1 mRNA m6A modification and angiogenesis in hemorrhoids by targeting METTL14[J]. Ann Transl Med,2021,9(3):232. doi: 10.21037/atm-20-3399 [7] Wang S,Aurora A B,Johnson B A,et al. The endothelial-specific microRNA miR-126 governs vascular integrity and angiogenesis[J]. Dev Cell,2008,15(2):261-271. doi: 10.1016/j.devcel.2008.07.002 [8] Fish J E,Santoro M M,Morton S U,et al. miR-126 regulates angiogenic signaling and vascular integrity[J]. Dev Cell,2008,15(2):272-284. doi: 10.1016/j.devcel.2008.07.008 [9] Huang J,Wang X,Wen G,et al. miRNA-205-5p functions as a tumor suppressor by negatively regulating VEGFA and PI3K/Akt/mTOR signaling in renal carcinoma cells[J]. Oncol Rep,2019,42(5):1677-1688. [10] An G,Liang S,Sheng C,et al. Upregulation of microRNA-205 suppresses vascular endothelial growth factor expression-mediated PI3K/Akt signaling transduction in human keloid fibroblasts[J]. Exp Biol Med (Maywood),2017,242(3):275-285. doi: 10.1177/1535370216669839 [11] Yang X,Chen Y,Li M,et al. ERBB3 methylation and immune infiltration in tumor microenvironment of cervical cancer[J]. Sci Rep,2022,12(1):8112. doi: 10.1038/s41598-022-11415-1 [12] Duan B,Zhu Z,You B,et al. Overexpression of ERBB3 promotes proliferation,migration,and angiogenesis in nasopharyngeal carcinoma[J]. Int J Clin Exp Pathol,2019,12(8):2931-2940. [13] Russell K S,Stern D F,Polverini P J,et al. Neuregulin activation of ErbB receptors in vascular endothelium leads to angiogenesis[J]. Am J Physiol,1999,277(6):H2205-2211. [14] Shi J,Lv H,Tang C,et al. Mangiferin inhibits cell migration and angiogenesis via PI3K/AKT/mTOR signaling in high glucose-and hypoxia-induced RRCECs [J]. Mol Med Rep,2021,23(6),473. [15] Aigner F, Bodner G, Gruber H, et al. The vascular nature of hemorrhoids[J]. J Gastrointest Surg,2006,10(7):1044-1050. [16] 谢逸轩,王赛,朱飞鹏,等. 基于中西医临床病症特点的痔疮动物模型分析[J]. 中药新药与临床药理,2022,33(7):939-943. [17] Han S,Lin F,Ruan Y,et al. miR-132-3p promotes the cisplatin-induced apoptosis and inflammatory response of renal tubular epithelial cells by targeting SIRT1 via the NF-κB pathway[J]. Int Immunopharmacol,2021,99(10):108022. doi: 10.1016/j.intimp.2021.108022 [18] Kir D,Schnettler E,Modi S,et al. Regulation of angiogenesis by microRNAs in cardiovascular diseases[J]. Angiogenesis,2018,21(4):699-710. doi: 10.1007/s10456-018-9632-7 [19] Zhang J,Zhang J,Pang X,et al. MiR-205-5p suppresses angiogenesis in gastric cancer by downregulating the expression of VEGFA and FGF1[J]. Exp Cell Res,2021,404(2):112579. doi: 10.1016/j.yexcr.2021.112579 [20] Chen S,Wang Y,Su Y,et al. miR-205-5p/PTK7 axis is involved in the proliferation,migration and invasion of colorectal cancer cells[J]. Mol Med Rep,2018,17(5):6253-6260. [21] Huang P,Zhang Y,Wang F,et al. MiRNA-205-5p regulates the ERBB4/AKT signaling pathway to inhibit the proliferation and migration of HAVSMCs induced by ox-LDL[J]. Pathol Res Pract,2022,233(5):153858. doi: 10.1016/j.prp.2022.153858 [22] Oltra M,Vidal-Gil L,Maisto R,et al. Oxidative stress-induced angiogenesis is mediated by miR-205-5p[J]. J Cell Mol Med,2020,24(2):1428-1436. doi: 10.1111/jcmm.14822 [23] Sun J,Wu K,Chen S,et al. UHRF2 promotes Hepatocellular Carcinoma Progression by Upregulating ErbB3/Ras/Raf Signaling Pathway[J]. Int J Med Sci,2021,18(14):3097-3105. doi: 10.7150/ijms.60030 [24] Wu J,Liu C,Yu G. Downregulation of circ_PLXND1 inhibits tumorigenesis of non-small cell lung carcinoma via miR-1287-5p/ERBB3 axis[J]. Thorac Cancer,2023,14(17):1543-1555. doi: 10.1111/1759-7714.14897 [25] Yen L,Benlimame N,Nie Z R,et al. Differential regulation of tumor angiogenesis by distinct ErbB homo- and heterodimers[J]. Mol Biol Cell,2002,13(11):4029-4044. doi: 10.1091/mbc.e02-02-0084 [26] Tu Y,Liu L,Zhao D,et al. Corrigendum: Overexpression of miRNA-497 inhibits tumor angiogenesis by targeting VEGFR2[J]. Sci Rep,2016,6(1):21221. doi: 10.1038/srep21221 [27] Li J,Cao X,Chu T,et al. The circHMGCS1-miR-205-5p-ErBB3 axis mediated the Sanggenon C-induced anti-proliferation effects on human prostate cancer[J]. Pharmacol Res,2023,187(1):106584. doi: 10.1016/j.phrs.2022.106584 [28] De Bacco F,Orzan F,Erriquez J,et al. ERBB3 overexpression due to miR-205 inactivation confers sensitivity to FGF,metabolic activation,and liability to ERBB3 targeting in glioblastoma[J]. Cell Rep,2021,36(4):109455. doi: 10.1016/j.celrep.2021.109455 [29] Wang X,Liang Z,Xu X,et al. miR-148a-3p represses proliferation and EMT by establishing regulatory circuits between ERBB3/AKT2/c-myc and DNMT1 in bladder cancer[J]. Cell Death Dis,2016,7(12):e2503. doi: 10.1038/cddis.2016.373 [30] 李娟,师若迪,陈雨婷,等. 枸杞多糖通过miRNA-21-5p靶向PTEN调控PI3K/Akt/mTOR通路抗人视网膜色素上皮细胞光损伤机制[J]. 中华中医药杂志,2023,38(8):3588-3593. -






 下载:
下载:
 下载:
下载:

