Changes of Genebody Methylation in Lingual Carcinogenesis
-
摘要:
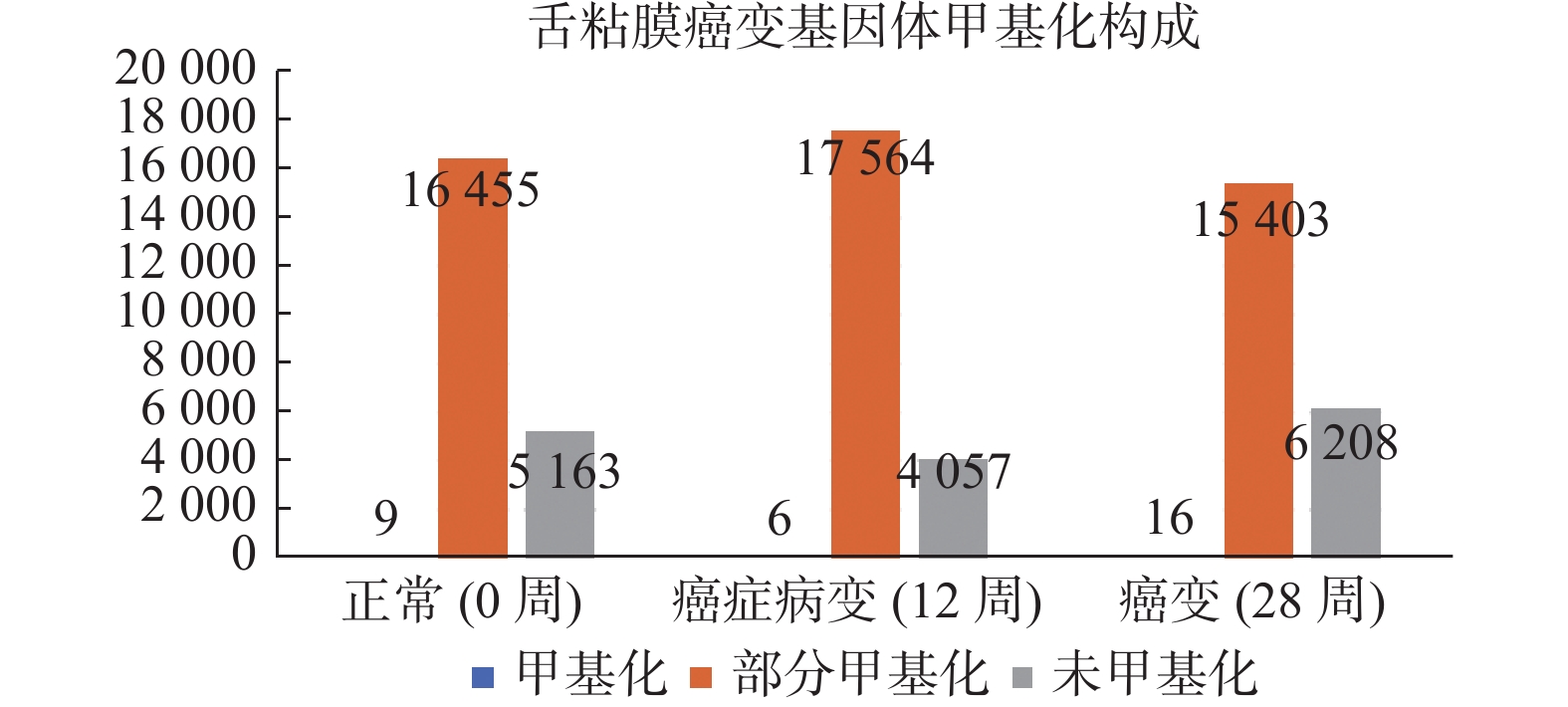
目的 了解舌粘膜癌变中基因体甲基化的差异表达基因。 方法 用浓度50 mg/L的4-硝基喹啉-1-氧化物(4NQO)诱导C57BL/6小鼠舌癌。基因芯片和甲基化DNA免疫沉淀测序(MeDIP-Seq)检测0周、12周、28周(代表正常、癌前、癌变)的舌粘膜的基因表达和基因组DNA甲基化。在人正常舌粘膜和癌前病变组织中用qRT-PCR和飞行质谱检测泛素羧基水解酶CYLD的mRNA表达和基因体甲基化。 结果 正常、癌前和舌癌3组间基因体MeDIP-score(mean±s)分别是(5.58±14.80)、(5.79±13.35)、(5.83±17.25),差异无统计学意义(H = 100.75,P > 0.05)。3组间145个差异表达基因伴基因体甲基化改变。CYLD在人癌前病变组织中表达降低伴有基因体甲基化降低(P < 0.05)。 结论 舌粘膜癌变有多个基因体甲基化异常的差异表达基因,CYLD在人癌前病变中低表达可能与基因体甲基化有关。 Abstract:Objective To evaluate differentially expressed genes with correlation of gene body methylation . Methods The lingual carcinogenesis was induced through the delivery of drinking water of 4-nitroquinoline-1-oxide(4NQO) with a density of 50 mg/L. The lingual mucosae specimens were harvested at 0, 12, 28 weeks, which represented normal, pre-cancer, and cancer individually. The microarray and methylated DNA immunoprecipitation sequencing (MeDIP-Seq) were used for the evaluation of gene expression and global DNA methylation in these specimens. The mRNA expression of Ubiquitin carboxyl-terminal hydrolase CYLD was tested with qRT-PCR in human normal and dysplasia mucosa. Results There were no statistical differences in gene body methylation among normal(C), pre-cancer(M), and cancer(E)(mean±sofMeDIP-score were 5.58±14.80, 5.79±13.35, 5.83±17.25 individually, H = 100.75, P > 0.05)There presented 145 differentially expressed genes with positive correlation to gene body methylation changes.The expression of CYLD mRNA was decreased in human dysplasia compared to normal mucosa with downregulation of gene body methylation. Conclusions There are many differentially expressed genes with a positive correlation to gene body methylations. The expression of CYLD is downregulated with the downregulation of gene body methylation in earlier stage during tongue carcinogenesis. -
Key words:
- Tongue cancer /
- Animal model /
- Methylation /
- Gene body /
- Differentially expressed gene
-
中耳炎是临床常见、多发病,咽鼓管结构异常和功能障碍是中耳炎发病机制中最常见的因素[1-2]。临床咽鼓管功能检测虽多,但目前评估困难,仍没有一种客观有效的方法精确判断咽鼓管功能,为寻求一种客观、有效并且具有动态直观效果的检查方法[3]。2019年4月至2020年5月昆明医科大学第一附属医院耳鼻咽喉科对慢性化脓性中耳炎、中耳胆脂瘤及外伤性鼓膜穿孔的40例患者采用咽鼓管SPECT-CT核素显像检查观察咽鼓管阻塞的部位、程度,籍以探讨SPECT-CT核素显像对中耳炎咽鼓管功能的临床诊断价值。
1. 资料与方法
1.1 临床资料
选取2019年4月至2020年5月昆明医科大学第一附属医院耳鼻咽喉科慢性化脓性中耳炎、中耳胆脂瘤及外伤性鼓膜穿孔患者的临床资料40例,分为3组。所有患者均在治疗前接受纯音听阈、声导抗、颞骨薄层CT、耳内镜及Valsalva检查。排除存在鼻咽部良恶性肿瘤、腺样体肥大或颌面部有畸形患者。所有患者均自愿接受咽鼓管SPECT-CT核素显像,并签署书面检查知情同意书。结合术中所见及术后病理分为:A组为慢性化脓性中耳炎患者,B组为中耳胆脂瘤患者,C组为外伤性鼓膜穿孔患者,3组基线临床资料类似,具有可比性。A组14例,其中男6例,女8例,左耳5例,右耳9例,年龄21~60岁,平均(44.7±11.7)岁。B组21例,其中男11例,女10例,左耳9例,右耳12例,年龄29~67岁,平均(47.3±10.9)岁。C组5例,其中男3例,女2例,左耳3例,右耳2例,年龄24 ~47岁,平均(35.8±9.2)岁。病史6月~30 a不等。所有患者均自愿接受检查,并签署知情同意书,已行伦理审核。
1.2 检查方法
咽鼓管SPECT-CT核素显像(观察组):检查前告知患者行咽鼓管SPECT-CT核素显像检查的方法及注意事项。采用德国西门子双探头SPECT/CT Symbia T2及计算机处理系统。显像剂为高锝酸钠酸钠注射液(99 mTc)为37MBQ,能量141 kev,体积0.2~0.3 mL。显像的原理为示踪剂流经循环通路的原理,耳道无明显蠕动功能,因此显像剂依靠重力流动。动态显像时患者选择侧卧位,患耳向上,颈部向健侧倾斜30°,下颌内收,显像剂为高锝酸钠注射液(99 mTc),于患耳处外耳道口滴入,患者同时嚼口香糖,滴入后即刻显像,观察显像剂排空的时间和滞留的部位。采集参数为1 min一帧,采集30 min,探头选择双竖立位。断层融合显像时体位为仰卧位,外耳道口滴入显像剂(99 mTc)30 min后显像。采集参数为SPECT部分40 s一帧,每一帧图探头旋转11.25°;CT部分管电压130 KV,管电流为固定毫安秒,扫描层厚3 mm,重建层厚5 mm。
Valsalva检查(对照组):将听诊管两端的橄榄头分别置于患者和检查者外耳道口,当患者作捏鼻鼓气动作时,检查者可听到轻柔的“嘘嘘”声。耳内镜下可观察到鼓膜随捏鼻鼓气动作而运动。
1.3 统计学处理
统计学处理应用 SPSS19.0 统计学分析软件。计量资料服从正态分布用均数±标准差(
$\bar x \pm s $ )表示,计数资料以百分率(%) 表示,组间比较采用χ2 检验, P < 0.05 为差异有统计学意义。2. 结果
2.1 咽鼓管SPECT-CT核素显像检查结果
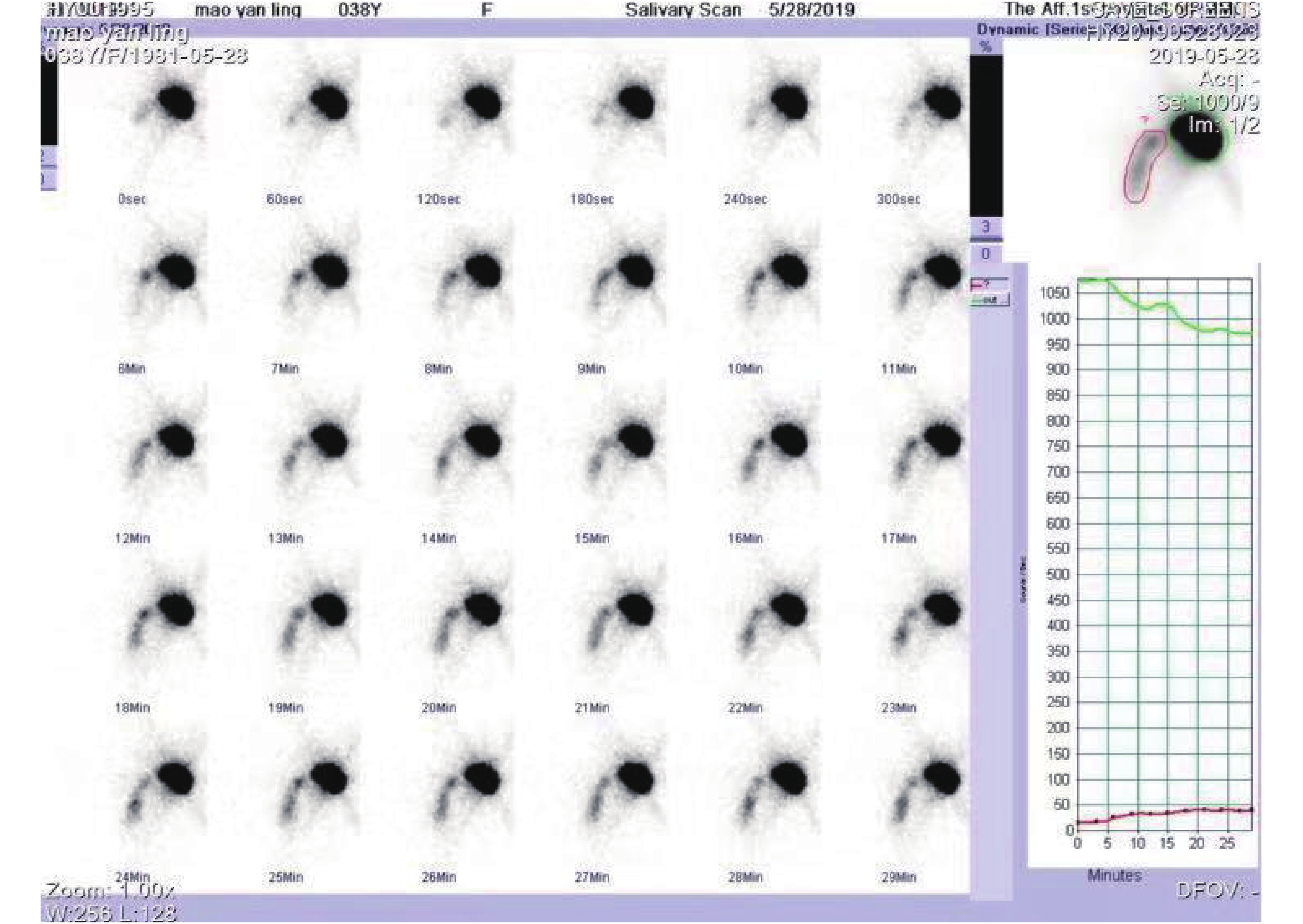
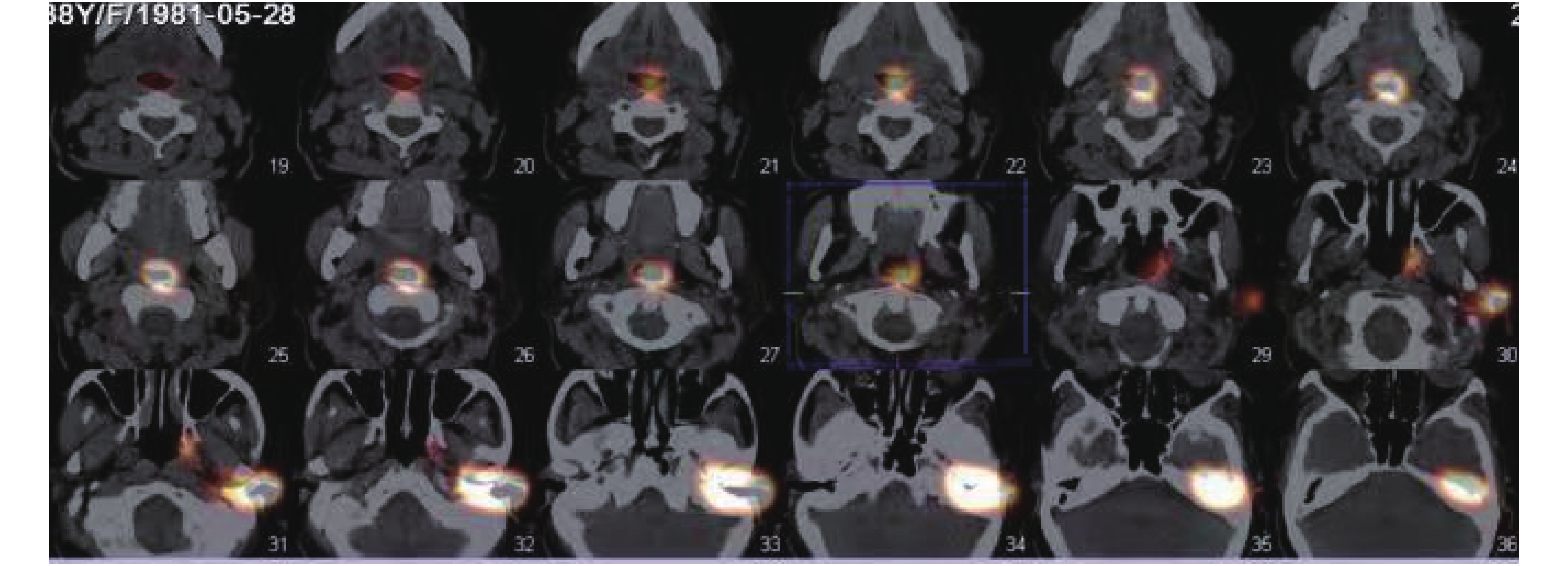
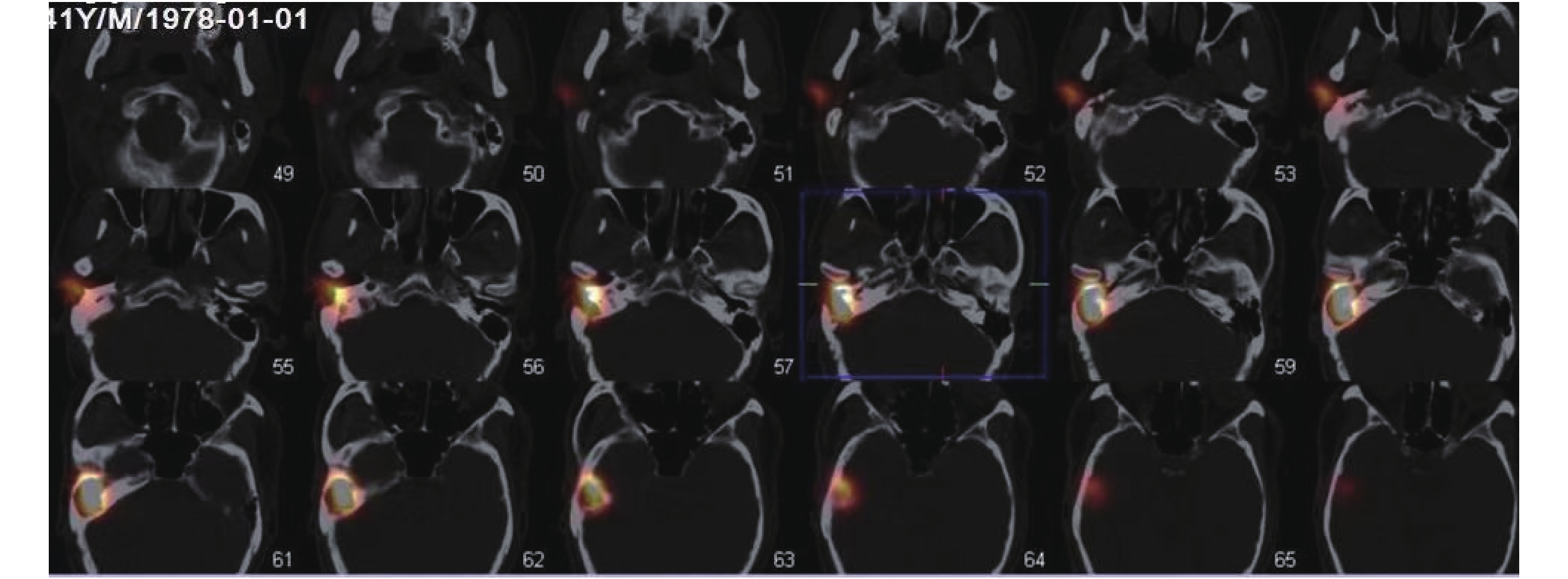
咽鼓管通畅显像:患者经外耳道给药后,同时做连续吞咽动作(嚼口香糖)后,显像剂高锝酸钠注射液(99 mTc)迅速沿着正常解剖途径,经患者的外耳道,进入中耳的鼓室,流入咽鼓管鼓口、峡部进入咽口,最终到达鼻咽部,咽鼓管的走行区可见放射性浓聚,即核素动态显像为蝌蚪状的显像,核素断层融合显像为哑铃状显像(图1-图2)。咽鼓管阻塞显像:只出现中耳部位的放射性团状显影,经多次吞咽后仍然不出现咽鼓管走行区全程影像(图3-图4)。
2.2 咽鼓管SPECT-CT核素显像研究比较结果
表1为慢性化脓性中耳炎鼓膜穿孔的患者(A组)、中耳胆脂瘤鼓膜穿孔的患者(B组)与外伤性鼓膜穿孔的患者(C组)行咽鼓管SPECT-CT核素显像咽鼓管阻塞的比较结果。采用χ2检验,χ2 = 7.924,P = 0.019,差异有统计学意义(P < 0.05),表明发病不同,阻塞程度不同。
表 1 3组行咽鼓管SPECT-CT核素显像检查咽鼓管阻塞的比较[n(%)]Table 1. Comparison of eustachian tube obstruction with SPECT-CT radionuclide imaging in groups A, B and C [n (%)]组别 阻塞 通畅 合计(n) 阻塞率(%) A组 11(78.6) 3(21.4) 14 78.6* B组 17(80.9) 4(19.1) 21 80.9* C组 1(20.0) 4(80.0) 5 20.0 与C组比较,*P < 0.05。 A组、B组与C组行咽鼓管SPECT-CT核素显像(观察组)与Valsalva检查(对照组)的比较结果。采用χ2检验,差异有统计学意义(P < 0.05),见表2。
表 2 观察组与对照组咽鼓管阻塞率的比较[n(%)]Table 2. Comparison of eustachian tube obstruction between observation group and control group [n(%)]组别 A组(n = 14) B组(n = 21) C组(n = 5) 观察组 11(78.6) 17(80.9) 1(20.0) 对照组 5(35.7) 10(47.6) 3(60.0) χ2 5.250 5.081 0.417 P 0.022* 0.024* 0.519 *P < 0.05。 2.3 术后换药及随访
术后抗生素治疗,术后3~5 d出院,2周后换药,检查术腔恢复情况及鼓膜生长情况,每周换药直至术腔干耳及上皮化。同时通过随访及复查,所有患者行咽鼓管SPECT-CT核素显像均未发生任何不良反应及并发症。
3. 讨论
咽鼓管结构和功能异常在中耳炎的发生、发展、预后起重要作用。对临床中鼓室成形术、鼓室置管术、腺样体切除术等有指导作用[4-6]。临床上检查方法较多,然而由于咽鼓管结构深在,且结构变异大,静态与动态差异大,因此,寻找一种客观有效、直观简便的检查方法很有必要[7]。
SPECT-CT核素显像是将放射性同位素标记药物注射到人体内,利用同位素在不同细胞及组织中的摄取、分布与代谢速率不同,得到血流、生化、生理及代谢功能变化的图像,是一种“功能性”影像:CT则是利用X射线穿透人体后射线不同程度衰减,信息数据经过计算机处理,得到精细的解剖结构及组织密度差异的影像,是一种“结构性”影像。SPECT-CT核素显像最大的优势是在一次检查中同时完成核医学SPECT显像检查和放射学CT检查,将两种影像进行图像融合,使功能显像和结构显像优势互补,“强强联合”,拓宽了诊断内容,为临床医生提供更加全面、准确早期诊断疾病的依据[8]。
咽鼓管SPECT-CT核素显像国内报道很少[9-11],本研究采用:患者侧卧位,于鼓膜穿孔的患耳滴入高锝酸钠显像剂(99 mTc),患者做连续吞咽动作(嚼口香糖)后,在咽鼓管通畅的情况下,核素注入鼓室后,呈潮涌式运动顺利通过,直达咽口后逐渐逸尽,即可在短时间内咽鼓管走行区显示放射性浓聚;而咽鼓管阻塞者,因解剖结构、纤毛的运动、压力等因素,核素通过的连续性较差,核素聚集于中耳不能排出,咽鼓管咽口不出现核素,只能获得鼓室团状显像。本组资料显示,与传统的碘-131显影剂相比,高锝酸钠酸钠注射液(99 mTc)属短半衰期核素,物理半衰期仅为6 h,且为生理盐水溶剂,无碘油的黏稠性,排除较快,给药后24 h即可衰变逸尽后只剩生理盐水,因而较碘-131显影剂接受辐射量小。对咽鼓管局部无任何刺激和影响,可用于全身各种器官的核医学检查。与Valsalva 检查相比,其原理:因患者捏鼻鼓气的动作首先会引起鼻咽部的气压发生快速的变化,随之中耳的气体压力通过咽鼓管的不断调节发生相应改变。Valsalva 检查广泛应用于临床,操作简单方便,可间接反映咽鼓管的开放程度,为主观检查,相关的参考资料表明大多数患者未正确完成Valsalva动作,闭嘴、捏鼻、鼓气不标准,从而导致准确性和敏感性也不高,然而它对于咽鼓管功能检查仍是必要而基础的检查。与CT、MRI等影像学方法比较,高分辨率CT能够清晰显示骨性咽鼓管结构。MRI软组织对比分辨率高,能显示咽鼓管的解剖学标志和周围的异常病变。影像学检查直观、痛苦少,可为临床确诊病变位置,但无法判定咽鼓管功能。与声导抗检查比较,声导抗检测快速、操作简单、无创,为实用性强的检测中耳压力的检查,能客观的反映咽鼓管是否通畅。但患者鼓膜穿孔,无法行声导抗检查。咽鼓管SPECT-CT核素显像不但能够显示咽鼓管的结构,还能获得连续的动态影像学资料,动态观察咽鼓管阻塞的程度,有助于咽鼓管阻塞部位的判断,为临床工作提供直观的影像图片[12-15]。
本研究中,行咽鼓管SPECT-CT核素显像检查中,慢性化脓性中耳炎鼓膜穿孔的患者(A组)咽鼓管阻塞率为78.6%,中耳胆脂瘤鼓膜穿孔的患者(B组)咽鼓管阻塞率为80.9%,外伤性鼓膜穿孔的患者(C组)咽鼓管阻塞率为20%。采用χ2检验,P < 0.05 ,差异有统计学意义。研究结果说明咽鼓管的阻塞是慢性化脓性中耳炎、中耳胆脂瘤的病因、诊断、治疗中的一个重要的因素,也是外伤性鼓膜穿孔不易自行愈合的一个原因。咽鼓管功能可影响中耳功能,致中耳炎形成,对中耳炎的转归有较大影响。同样咽鼓管功能是鼓室成形术、乳突根治术、听骨链成形术、鼓膜置管术等中耳手术成功的基础。为临床选择更为适合的手术方案,预测术后效果,提供有价值的参考资料。而咽鼓管阻塞多年前就公认为在中耳炎发病机制中是最常见的因素之一,Mandeie等[16]指出咽鼓管功能状态可预测中耳炎的发病概率;袁媛等[17]报道咽鼓管功能障碍是中耳炎的病因及发病机制之一;Danner[18]的研究表明中耳炎的鼓膜情况反映了中耳腔内的负压状态,认为与乳突气房的压力缓冲、中耳黏膜的气体弥散、及经咽鼓管的气体交换有关,其中咽鼓管功能障碍是导致中耳炎发生发展的主要原因。均与笔者的研究结果相符。通过随访及复查,所有患者均未发生任何不良反应及并发症。另外该检查必须具备核医学条件及核医学影像设备方可进行,有一定的局限性。目前,尚无一种方法能全面而准确地反映咽鼓管的功能状况。但做为一种影像学检查方法,有其独特的优越性,可做为一种较可靠的咽鼓管检查方法。我科将进一步加大样本量的比较,增加研究深度,并对咽鼓管SPECT-CT核素显像的影像学特点进一步探讨。
因此早期观察咽鼓管阻塞的程度,及时发现咽鼓管病变对掌握中耳炎的发生、发展是非常必要的[19-21],咽鼓管SPECT-CT核素显像成像清晰,简单易行,大大减少了操作难度或主观因素的干扰,是一项可以在进行中耳乳突影像学检查的同时,还能完成连续的动态核素显像检查的方法,且直观、痛苦少,可为临床确诊病变位置、选择治疗方法提供有价值的参考资料。
-
表 1 基因体甲基化异常的差异表达基因
Table 1. Differentially expressed genes with positive correlation to gene body methylation
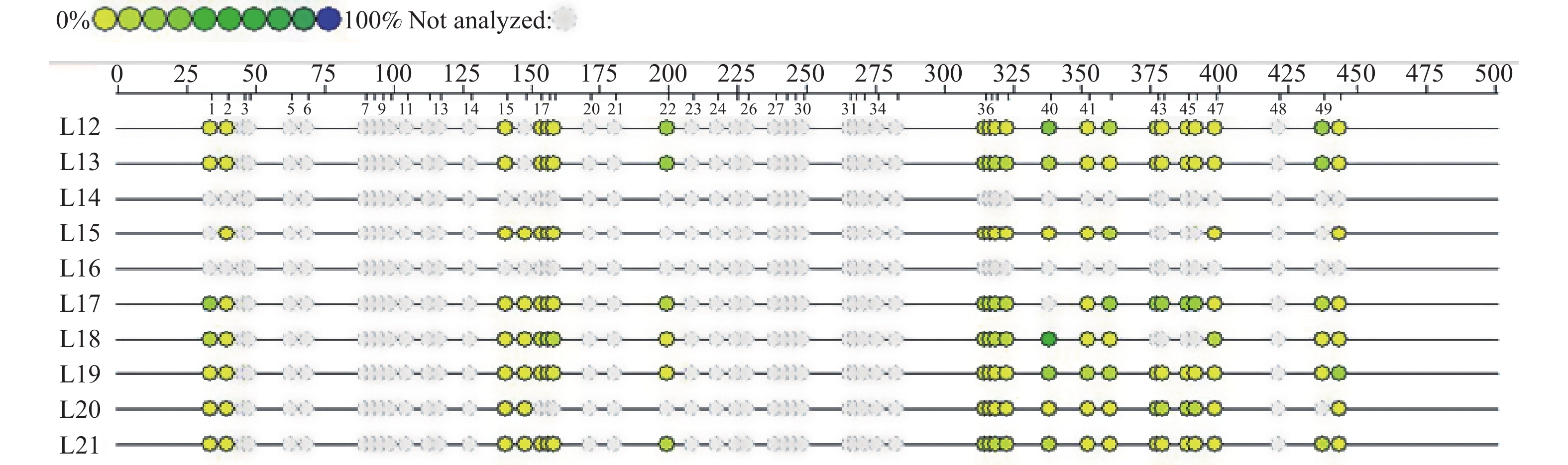
序号 癌前vs正常 癌变vs正常 癌变vs癌前 上调 下调 上调 下调 上调 下调 1 Gm12657 Ddx25 Hps3 Irf3 Odf2 Msln 2 Rnf14 Cyld Mreg Zfp939 Uba1 Slc35a5 3 Rsbn1l 2610507B11Rik Gm12657 Tesk1 2010012O05Rik Csprs 4 Celf2 5330434G04Rik Edaradd Gab3 Wdyhv1 Ywhaz 5 Mapk3 Dclk2 Gm7120 Ntng1 Cdca5 Ada 6 Rdh9 Ecsit Pemt Sema3b Fbxo24 Bpifb6 7 Ache Il20 Plekhb2 Ptges3l Tmem37 A730008H23Rik 8 Stard10 AI846148 Nop14 Bace2 Spp1 Stard10 9 Klhl7 Iars2 Hivep1 Gm3086 Plekhg4 Casc4 10 Mfsd1 Gm3086 Fam98b Kcnn4 Fam81a Igsf5 11 Arf4 Zfp763 Oas2 a Fubp1 12 Zbtb18 Pptc7 Tbx22 Ewsr1 Cdkl5 13 Kcnj2 Cdc42se2 Mfsd2a Fut2 14 Ap1s2 Slfn4 Shc4 H2-T9 15 Setd1b Npl Tspan32 16 Cyth3 Exoc6 Car4 17 Nek1 Son Mapkapk2 18 Cpn1 Rsbn1l Slc25a39 19 Aqr Nacad Eif5a 20 Abca5 Ddx20 Bace2 21 Pomgnt1 Atf1 Hira 22 Nfkb1 Vps37c Azgp1 23 Kalrn Nfkbiz Hmgcll1 24 Dsg1b Prkaa1 Cfl1 25 Sec62 Pik3c2a Mamstr 26 Camk2a Ankfn1 Celf2 27 Ube2q2 Mfsd1 Gfra4 28 Ppp4r2 Cdk1 Papss2 29 Lrrc58 Bcas2 Smurf2 30 Tnpo1 Rad21 Cat 31 Zfp763 Zfand1 Myoz3 32 Il2rg Mmgt1 Tmed3 33 Slc25a39 Trip13 Prb1 34 Nfe2l1 Dyrk1b 35 Tob1 Prrt2 36 H2-T10 37 Gyk 38 Tmem55b 39 Zfp386 40 Akr1b3 41 Tnfaip6 -
[1] Siegel R L,Giaquinto A N,Jemal A. Cancer statistics,2024[J]. CA Cancer J Clin,2024,74(1):12-49. doi: 10.3322/caac.21820 [2] 代晓明,刘华,左志斌,等. 4-硝基喹啉-1-氧化物诱导C57BL/6小鼠舌黏膜癌变的研究[J]. 华西口腔医学杂志,2015,33(4):357-360. doi: 10.7518/hxkq.2015.04.007 [3] Lai Z L,Tsou Y A,Fan S R,et al. Methylation-associated gene silencing of RARB in areca carcinogens induced mouse oral squamous cell carcinoma[J]. Biomed Res Int,2014,2014:378358. [4] Human D. Declaration of helsinki[J]. Lancet,2001,357(9251):236. [5] Kundaje A,Meuleman W,Ernst J,et al. Integrative analysis of 111 reference human epigenomes[J]. Nature,2015,518(7539):317-330. doi: 10.1038/nature14248 [6] Lorincz M C,Dickerson D R,Schmitt M,et al. Intragenic DNA methylation alters chromatin structure and elongation efficiency in mammalian cells[J]. Nat Struct Mol Biol,2004,11(11):1068-1075. doi: 10.1038/nsmb840 [7] Naftelberg S,Schor I E,Ast G,et al. Regulation of alternative splicing through coupling with transcription and chromatin structure[J]. Annu Rev Biochem,2015,84:165-198. doi: 10.1146/annurev-biochem-060614-034242 [8] Bell J S K,Vertino P M. Orphan CpG islands define a novel class of highly active enhancers[J]. Epigenetics,2017,12(6):449-464. doi: 10.1080/15592294.2017.1297910 [9] Huang K K,Ramnarayanan K,Zhu F,et al. Genomic and epigenomic profiling of high-risk intestinal metaplasia reveals molecular determinants of progression to gastric cancer[J]. Cancer Cell,2018,33(1):137-150e5. doi: 10.1016/j.ccell.2017.11.018 [10] Zhang F F,Zhang X,Zhang H K,et al. Pan-precancer and cancer DNA methylation profiles revealed significant tissue specificity of interrupted biological processes in tumorigenesis[J]. Epigenetics,2023,18(1):2231222. doi: 10.1080/15592294.2023.2231222 [11] Hernández H G,Aranzazu-Moya G C,Pinzón-Reyes E H. Aberrant AHRR,ADAMTS2 and FAM184 DNA methylation: Candidate biomarkers in the oral rinse of heavy smokers[J]. Biomedicines,2023,1(7):1797. [12] Li X,Li Z,Gao Q,et al. Correlation of DNA methylation of DNMT3A and TET2 with oral squamous cell carcinoma[J]. Discov Oncol,2024,15(1):15. doi: 10.1007/s12672-024-00866-9 [13] Gabusi A,Gissi D B,Grillini S,et al. Shared epigenetic alterations between oral cancer and periodontitis: A preliminary study[J]. Oral Dis,2023,9(5):2052-2060. [14] Aghiorghiesei O,Irimie AI,Braicu C,et al. Epigenetic methylation changes: Implication as biomarkers in oral and maxillofacial area cancers[J]. Med Pharm Rep,2023,96(3):310-317. [15] Okoturo E,Green D,Clarke K,et al. Whole genome DNA methylation and mutational profiles identify novel changes in proliferative verrucous leukoplakia[J]. Oral Surg Oral Med Oral Pathol Oral Radiol,2023,135(6):893-903. doi: 10.1016/j.oooo.2023.03.004 [16] Rivera-Peña B,Folawiyo O,Turaga N,et al. Promoter DNA methylation patterns in oral,laryngeal and oropharyngeal anatomical regions are associated with tumor differentiation,nodal involvement and survival[J]. Oncol Lett,2024,27(3):89. doi: 10.3892/ol.2024.14223 [17] Dean K A,von Ahsen O,Görlich D,et al. Signal recognition particle protein 19 is imported into the nucleus by importin 8 (RanBP8) and transportin[J]. J Cell Sci,2001,114(Pt 19): 3479-3485. [18] Giussani P,Maceyka M,Le Stunff H,et al. Sphingosine-1-phosphate phosphohydrolase regulates endoplasmic reticulum-to-golgi trafficking of ceramide[J]. Mol Cell Biol,2006,26(13):5055-5069. doi: 10.1128/MCB.02107-05 [19] Lv X,Yu X. Signatures and prognostic values of related immune targets in tongue cancer[J]. Front Surg,2023,9:952389. doi: 10.3389/fsurg.2022.952389 [20] Thakore V P,Patel K D,Vora H H,et al. Up-regulation of extracellular-matrix and inflammation related genes in oral squamous cell carcinoma[J]. Arch Oral Biol,2024,161:105925. doi: 10.1016/j.archoralbio.2024.105925 期刊类型引用(0)
其他类型引用(1)
-






 下载:
下载:

 下载:
下载: