Factors Influencing the Development of Extra-Pulmonary Tuberculosis in Patients with Viral Hepatitis Complicated by Pulmonary Tuberculosis
-
摘要:
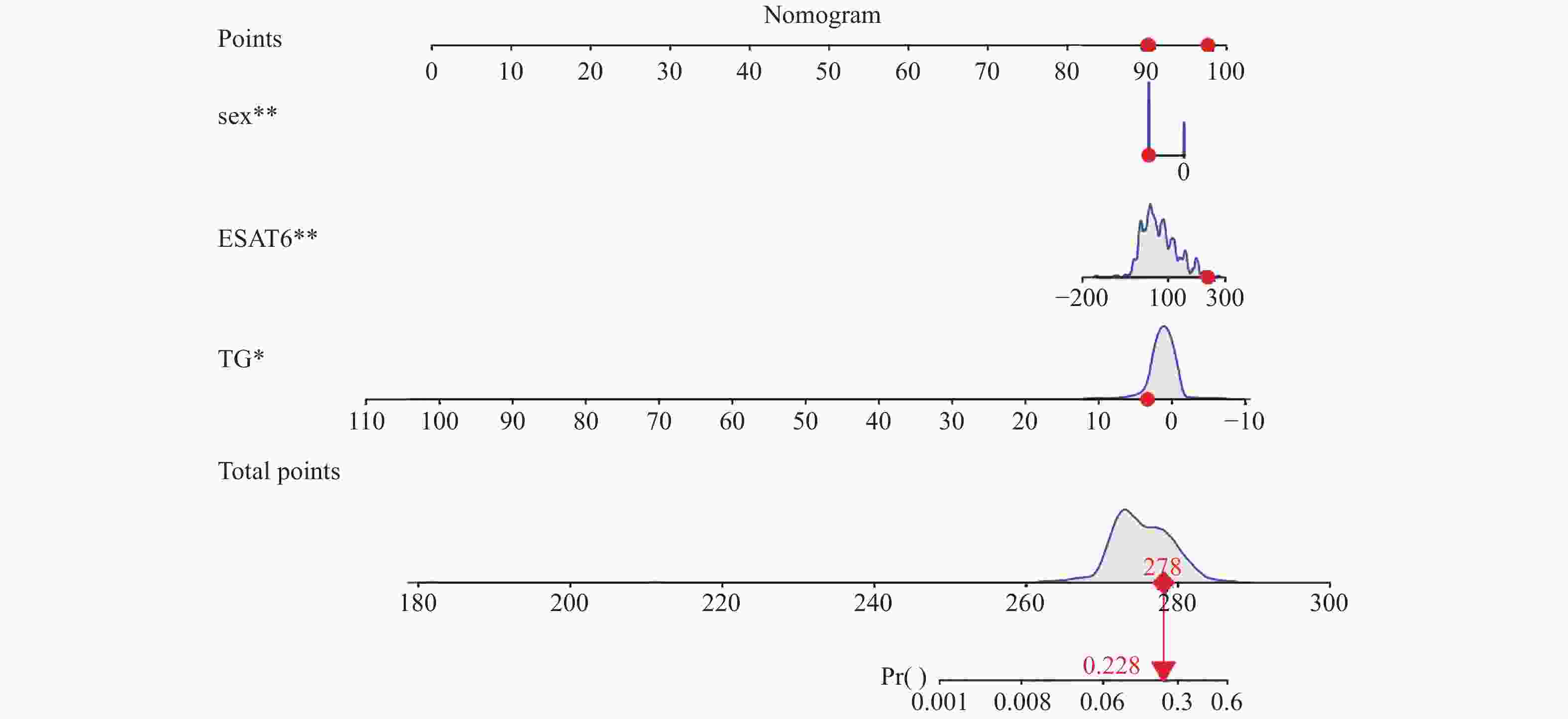
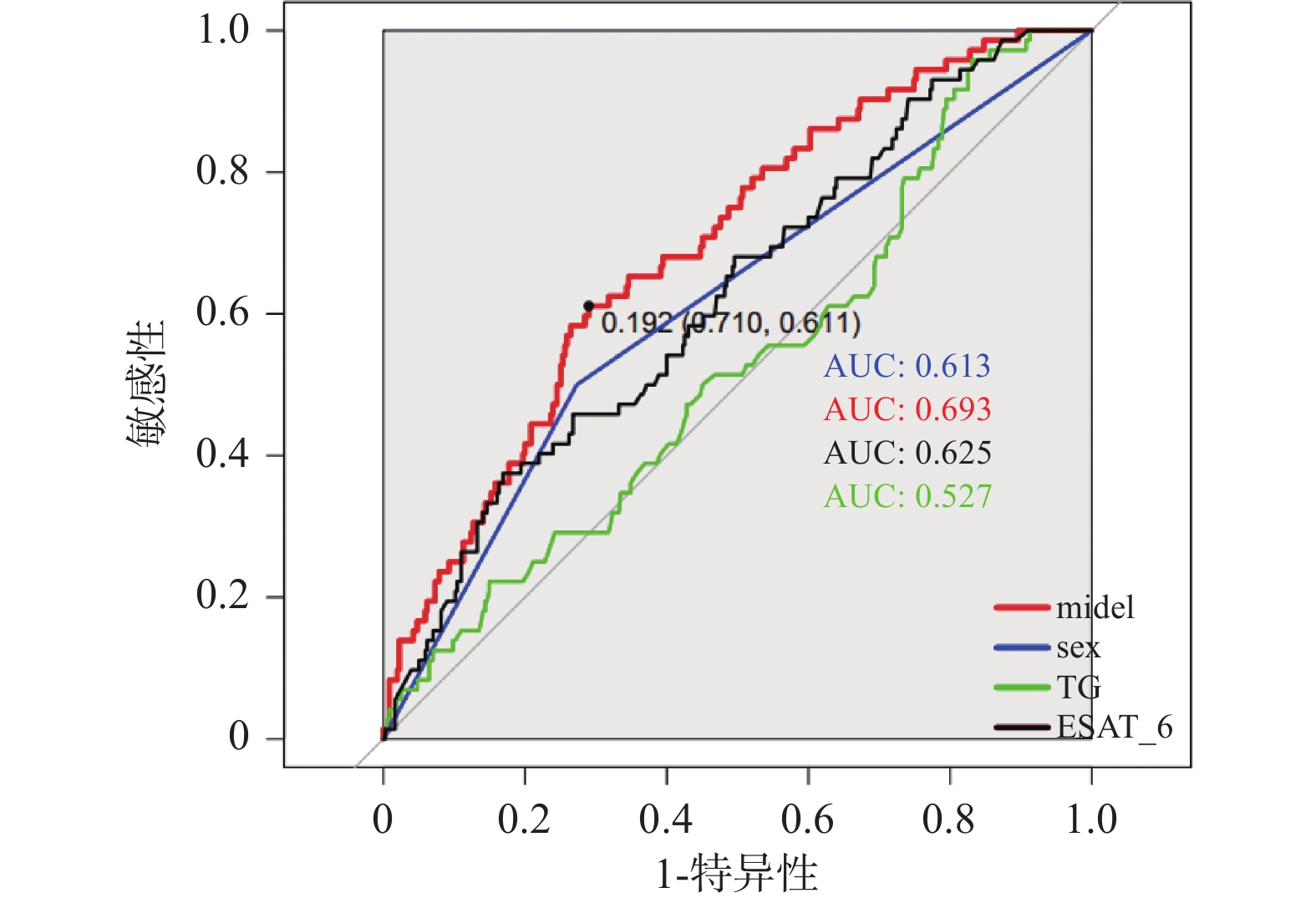
目的 探讨病毒性肝炎合并肺结核患者并发肺外结核(extra-pulmonary tuberculosis,EPTB)的影响因素。 方法 回顾分析昆明市第三人民医院2015年1月至2020年12月结核科收治的病毒性肝炎乙型(hepatitis B virus,HBV)和病毒性肝炎丙型(hepatitis C virus,HCV)合并肺结核(pulmonary tuberculosis,PTB)的患者427例,以是否并发EPTB分为并发EPTB组(n = 72)和未并发EPTB组(n = 355)。收集患者的临床资料,采用单因素、多因素Logistic回归筛选并发EPTB的独立危险因素作为预测因子,建立病毒性肝炎合并PTB患者并发EPTB的列线图预测模型,选用Hosmer-Lemeshow检验、ROC曲线评价。 结果 427名患者中男292例(68.3%),女135例(31.7%),并发EPTB72例,发生率16.86%。其中,EPTB中男34例(47.2%),女38例(52.8%),结核性胸膜炎21例(29%),结核性腹膜炎16例(22%),淋巴结结核13例(18%),结核性脑炎5例(6%),肠结核6例(8%),骨结核5例(6%),盆腔结核3例(4%)泌尿系统结核3例(4%)。多因素Logistic回归示,性别(OR = 0.425,95%CI:0.250~0.722,P = 0.02)、低水平甘油三脂(TG)(OR = 0.837,95%CI:0.717~0.978,P = 0.025)、结核特异性抗原A(ESAT-6)(OR = 1.007,95%CI:1.003~1.011是PTB合并HBV、HCV感染并发EPTB的独立影响因素。列线图模型的最佳截断值0.192,对应的灵敏度0.611、和特异度0.710、约登指数0.741、阳性似然比2.103、阴性似然比0.548。Hosmer-Lemeshow检验,χ2 = 2.631,P = 0.955。ROC曲线分析显示AUC:0.693,95%CI: 0.6291 ~0.7574 )。结论 基于性别、低水平TG、ESAT-6建立的预测模型能一定程度上预测是否并发EPTB,为临床治疗工作提供参考。 Abstract:Objective To investigate the factors influencing the development of extra-pulmonary tuberculosis (EPTB) in patients with viral hepatitis complicated by pulmonary tuberculosis(PTB). Methods A retrospective analysis was conducted on 427 patients with Hepatitis B Virus (HBV) and Hepatitis C Virus (HCV) infections complicated by PTB admitted to the tuberculosis department of Kunming Third People’ s Hospital from January 2015 to December 2020. Patients were divided into the EPTB complication group (n = 72) and the non-EPTB complication group (n = 355) based on the presence of EPTB.Clinical treatment data of patients were collected. Univariate and multivariate Logistic regression analyse were used to screen independent risk factors for EPTB as predictive factors. A nomogram prediction model was established for Extrapulmonary Tuberculosis (EPTB) complications in patients with viral hepatitis and Pulmonary Tuberculosis (PTB) , evaluated using the Hosmer-Lemeshow test and ROC curve analysis. Results Among the 427 patients, 292 (68.3%) were male and 135 (31.7%) were female, with 72 cases of EPTB, resulting in an incidence rate of 16.86%. In the EPTB group, there were 34 males (47.2%) and 38 females (52.8%). The types of EPTB included tuberculous pleuritis (21 cases, 29%), tuberculous peritonitis(16 cases, 22%), lymph node tuberculosis (13 cases, 18%), tuberculous encephalitis(5 cases, 6%), intestinal tuberculosis( 6 cases, 8%), bone tuberculosis(5 cases, 6%), pelvic tuberculosis(3 cases, 4%), and genitourinary tuberculosis(3 cases, 4%). Multivariate logistic regression analysis showed that gender (OR = 0.425, 95%CI: 0.250-0.722, P = 0.02), low triglyceride (TG) levels (OR = 0.837, 95%CI: 0.717-0.978, P = 0.025), the tuberculosis-specific antigen A (ESAT-6) (OR = 1.007, 95%CI: 1.003 ~ 1.011 were independent influencing factors for EPTB in patients with PTB complicated by HBV and HCV infections. The optimal cutoff value for the nomogram model is 0.192, with a sensitivity of 0.611, specificity of 0.710, Youden index of 0.741, positive likelihood ratio of 2.103, and negative likelihood ratio of 0.548. The Hosmer-Lemeshow test yielded χ2 = 2.631, P = 0.955. ROC curve analysis showed an AUC of 0.693, 95%CI: 0.6291 ~ 0.7574.Conclusion The prediction model based on gender, low TG levels and ESAT-6 can well predict the occurrence of EPTB to some extent, providing a reference for clinical treatment. -
表 1 并发与未并发肺外结核患者的临床特征比较[n(%)/M(P25,P75)]
Table 1. Comparison of clinical characteristics between patients with and without extrapulmonary tuberculosis. [n(%)/M(P25,P75)]
指标 并发EPTB(n = 72) 未并发EPTB组(n = 355) Z/χ2 P 性别(男) 34(47.2) 258(72.7) 17.938 < 0.001* 年龄 43(33.0~55.0) 43(30.0~55.0) −0.850 0.396 民族(汉) 59(81.9) 321(90.4) 4.392 0.036* 饮酒史 11(15.3) 66(18.6) 0.445 0.505 吸烟史 14(19.4) 81(22.8) 0.394 0.530 BMI (kg/m2) 体重过轻 16(22.2) 95(26.8) 正常 42(58.3) 216(60.8) −1.404 0.160 超重 14(14.5) 44(12.4) HCV 15(20.8) 70(19.7) 0.047 0.829 HBV 59(81.9) 299(84.2) 0.230 0.632 发热 12(16.7) 66(18.6) 0.149 0.700 WBC(109/L) 5.375(4.723~7.75) 5.74(4.5~7.1) −0.418 0.676 RBC(1012/L) 4.52(4.13~4.87) 4.58(4.15~5.07) −1.009 0.313 PLT(109/L) 226(169.00~304.75) 218(163.00~273.00) −1.690 0.091 HB(g/L) 133(115.00~141.00) 137(121.00~152.00) −2.269 0.023 TBIL(μmol/L) 11.05(7.33~18.38) 10.2(7.60~15.60) −0.897 0.370 Cr(μmol/L) 58.9(52~68.78) 64.1(55.3~75.6) −2.485 0.013* ALT(U/L) 22.5(11~36.45) 22(14.7~40) −0.748 0.455 AST(U/L) 23(17.25~39.5) 25(18~40) −0.892 0.372 ALB(g/L) 34.6(30.93~37.50) 36.1(32.2~39.41) −1.740 0.082 TG 0.945(0.655~1.482) 0.99(0.68~1.58) −0.729 0.466 ESAT-6 78.8(41~143) 55.2(22.16~103.4) −3.342 0.001* CFP-10 79.5(28.37~158.76) 56.54(13.5~126.96) −2.318 0.020* *P < 0.05。 表 2 病毒性肝炎合并肺结核患者并发肺外结核的单因素分析
Table 2. Univariate analysis of extrapulmonary tuberculosis in patients with viral hepatitis complicated by pulmonary tuberculosis
变量 单因素二元Logistic回归 OR(95%CI) P BMI(kg/m2) 1.256(0.880~1.793) 0.209 性别 0.376(0.224~0.631) < 0.001* 年龄 0.993(0.976~1.010) 0.399 民族 2.080(1.036~4.176) 0.039* 饮酒史 0.790(0.394~1.583) 0.506 吸烟史 0.801(0.448~1.435) 0.456 乙肝 0.681(0.392~1.183) 0.172 丙肝 1.689(0.974~2.927) 0.062 发热 0.906(0.406~1.782) 0.774 WBC(109/L) 0.993(0.980~1.109) 0.906 NEUT(%) 1.008(0.989~1.028) 0.405 PLT(109/L) 1.002(1.000~1.004) 0.030* HB(g/L) 0.942(0.982~1.001) 0.097 RBC(1012/L) 0.942(0.789~1.126) 0.513 TBIL(μmol/L) 1.071(0.989~1.026) 0.464 Cr (μmol/L) 0.993(0.980~1.006) 0.309 ALT(U/L) 0.998(0.994~1.003) 0.489 AST(U/L) 0.998(0.991~1.005) 0.568 ALB(g/L) 0.983(0.946~1.022) 0.396 TG 0.829(0.714~0.963) 0.014* ESAT-6 1.007(1.003~1.011) < 0.001* CFP-10 1.002(0.999~1.004) 0.161 *P < 0.05。 表 3 性别、TG、ESAT-6及model预测并发EPTB的ROC曲线分析
Table 3. ROC curve analysis for sex,TG,ESAT-6,and model for predicting concomitant extrapulmonary tuberculosis (EPTB)
检验变量 AUC(95%CI) 最佳截断值 灵敏度(%) 特异度(%) 约登指数 阳性似然比 阴性似然比 P 性别 0.613(0.551~0.676) - 50.0 72.7 0.227 1.831 0.678 0.002* TG 0.527(0.455~0.599) 2.025 95.8 16.9 0.127 1.153 0.248 0.466 ESAT-6 0.625(0.555~0.695) 119.278 37.5 83.1 0.206 2.217 0.752 0.001* 模型 0.693(0.629~0.757) 0.192 61.1 71.0 0.741 2.103 0.548 < 0.001* *P < 0.05。 -
[1] Pai M,Behr M A,Dowdy D,et al. Tuberculosis[J]. Nat Rev Dis Primers,2016,2:16076. doi: 10.1038/nrdp.2016.76 [2] Furin J,Cox H,Pai M. Tuberculosis[J]. Lancet,2019,393(10181):1642-1656. doi: 10.1016/S0140-6736(19)30308-3 [3] World Health Organization. Global tuberculosis report 2022[Z/OL]. Geneva: World Health Organization,2022 [2023-10-29]. https://iris.who.int/handle/10665/363752. [4] 盛吉芳. 肺外结核[C]//第十次全国感染病学术会议暨第二届全国感染科医师大会、第四届中美临床微生物研讨会论文集. 杭州: 中华医学会感染病学分会,2008: 24-29. [5] Lee J Y. Diagnosis and treatment of extrapulmonary tuberculosis[J]. Tuberc Respir Dis (seoul),2015,78:47-55. doi: 10.4046/trd.2015.78.2.47 [6] 中华医学会感染病学分会,中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 国际流行病学传染病学杂志,2019,46(6):423-446. [7] 中华医学会肝病学分会,中华医学会感染病学分会. 丙型肝炎防治指南(2022年版)[J]. 中华临床感染病杂志,2022,15(6):428-447. [8] 高亮,欧勤芳,赵新国. Gene Xpert在肺外结核病临床诊断中的价值探讨[J]. 热带医学杂志,2023,23(3):324-326+359. [9] 徐烨. T-SPOT. TB在肺外结核诊断中的应用价值研究[J]. 实验与检验医学,2019,37(3):528-530. doi: 10.3969/j.issn.1674-1129.2019.03.059 [10] 王黎霞, 成诗明, 周林, 等. 肺结核诊断WS288-2017[J]. 中国感染控制杂志,2018,17(7):642-652. [11] Pang Y ,An J,Shu W,et al (2019) Epidemiology of extrapulmonary tuberculosis among inpatients,China,2008–2017[J]. Emerg Infect Dis, 2019, 25(3): 457-464. [12] Wang X. Insight to the Epidemiology and Risk Factors of Extrapulmonary Tuberculosis in Tianjin,China during 2006-2011[J]. PLoS One.,2014,9(12):e112213. [13] 刘燕飞,李涛,夏愔愔,等. 2018-2020年9家结核病定点医院肺外结核病住院患者特征分析[J]. 疾病监测,2023,38(10):1223-1228. [14] Yang Z,Kong Y,Wilson F,et al. Identification of risk factors for extrapulmonary tuberculosis. Clin Infect Dis[J]. 2004, 38(2): 199-205. [15] Nisar M,Williams C S,Davies P D. Experience of tuberculosis in immigrants from South East Asia-implications for the imminent lease back of Hong Kong[J]. Respir Med.,1991,85(3):219-222. [16] Guler S A,Bozkus F,Inci M F,et al. Evaluation of pulmonaryand extrapulmomary tuberulosis in lmmunocompetentadults; a retrospective case series analysis[J]. Med PrincPract,2015,24(1):75-79. [17] Gunal S,Yang Z,Agarwal M, et al. Demographic and micro-bial characteristics of extrapultnonary tuberculosis cases diag-nosed in Malatya,Turkey,2001—2007[J]. BMC Public Health,2011,11;154. [18] Sreeramareddy C T,Panduru K V,Verma S C,et al. Compari-son of pulmonary and extrapulmonary tuberculosis in Nepal-ahospital-based retrospective study[J]. BMC Infect Dis,2008,8:8. doi: 10.1186/1471-2334-8-8 [19] Ruggieri A,Gagliardi M C,Anticoli S. Sex-dependent outcome of hepatitis B and C viruses infections: Synergy of sex hormones and immune responses? Front Immunol[J]. 2018, 9: 2302. [20] Chen J X,Han Y S,Zhang S Q,Li Z B,Chen J,Yi W J,et al. Novel therapeutic evaluation biomarkers of lipid metabolism targets in uncomplicated pulmonary tuberculosis patients[J]. Signal Transduction and Targeted Therapy,2021,6(1):22. doi: 10.1038/s41392-020-00427-w [21] 董娜,付玉荣,伊正君. 结核分枝杆菌感染致脂代谢异常及其机制研究进展[J]. 中华结核和呼吸杂志,2016,39(7):548-550. [22] Wipperman M F,Sampson N S,Thomas S T. Pathogen roid rage: cholesterol utilization by Mycobacterium tuberculosis[J]. Critical Reviews in Biochemistry and Molecular Biology,2014,49(4):269-293. [23] Alvarez H M. Triacylglycerol and wax ester-accumulating machinery inprokaryotes[J]. Biochimie,2016,120:28-39. doi: 10.1016/j.biochi.2015.08.016 [24] Belogorodtsev S N,Nemkova E K,Stavitskaya N V,et al. Pathogenic effects of M. tuberculosis-specific proteins ESAT-6 and CFP-10 in macrophage culture and in 3D-granulemogenesis model in vitro[J]. Bull Exp Biol Med,2021,171(5):656-660. [25] 李玉洁,余海燕,杨雨婷,等. 结核分枝杆菌分泌蛋白早期分泌性抗原6(ESAT-6)的免疫学性质及其在新型疫苗中作用的研究进展[J]. 细胞与分子免疫学杂志,2024,40(1):89-94. -






 下载:
下载: