A Preliminary Study of CASR/VDR/PTH1R Signaling Pathway in the Pathogenesis of Calcium-containing Kidney Stones
-
摘要:
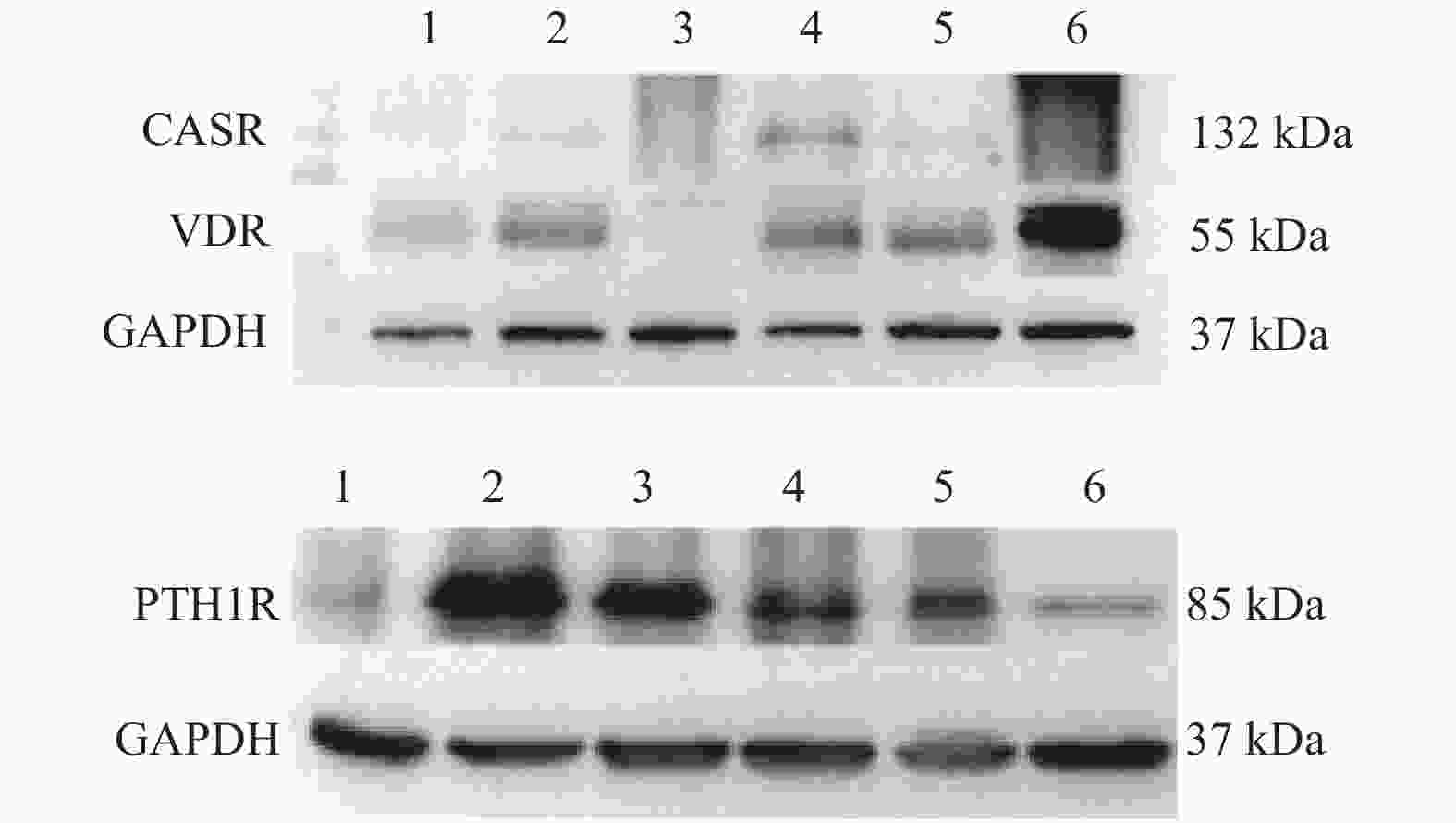
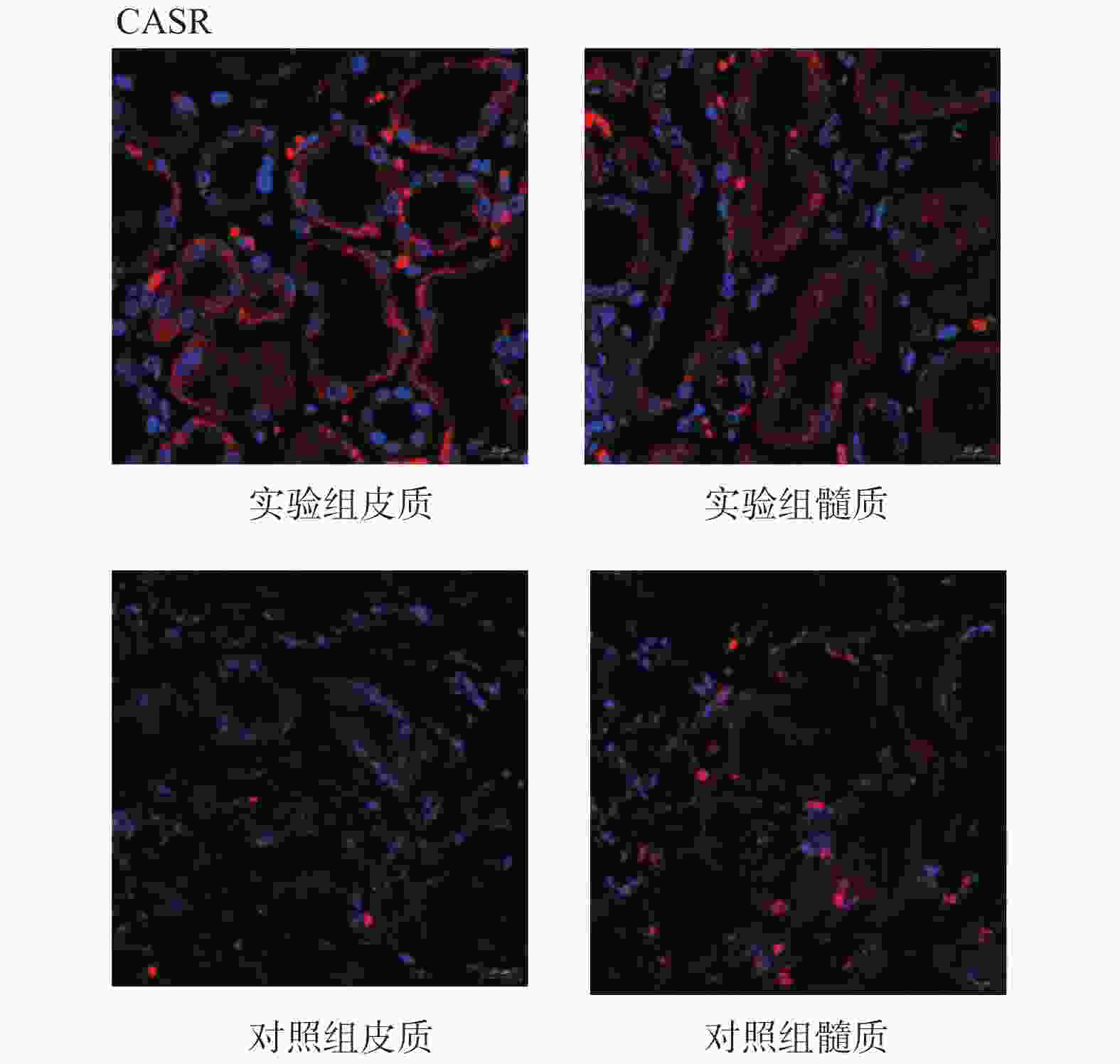
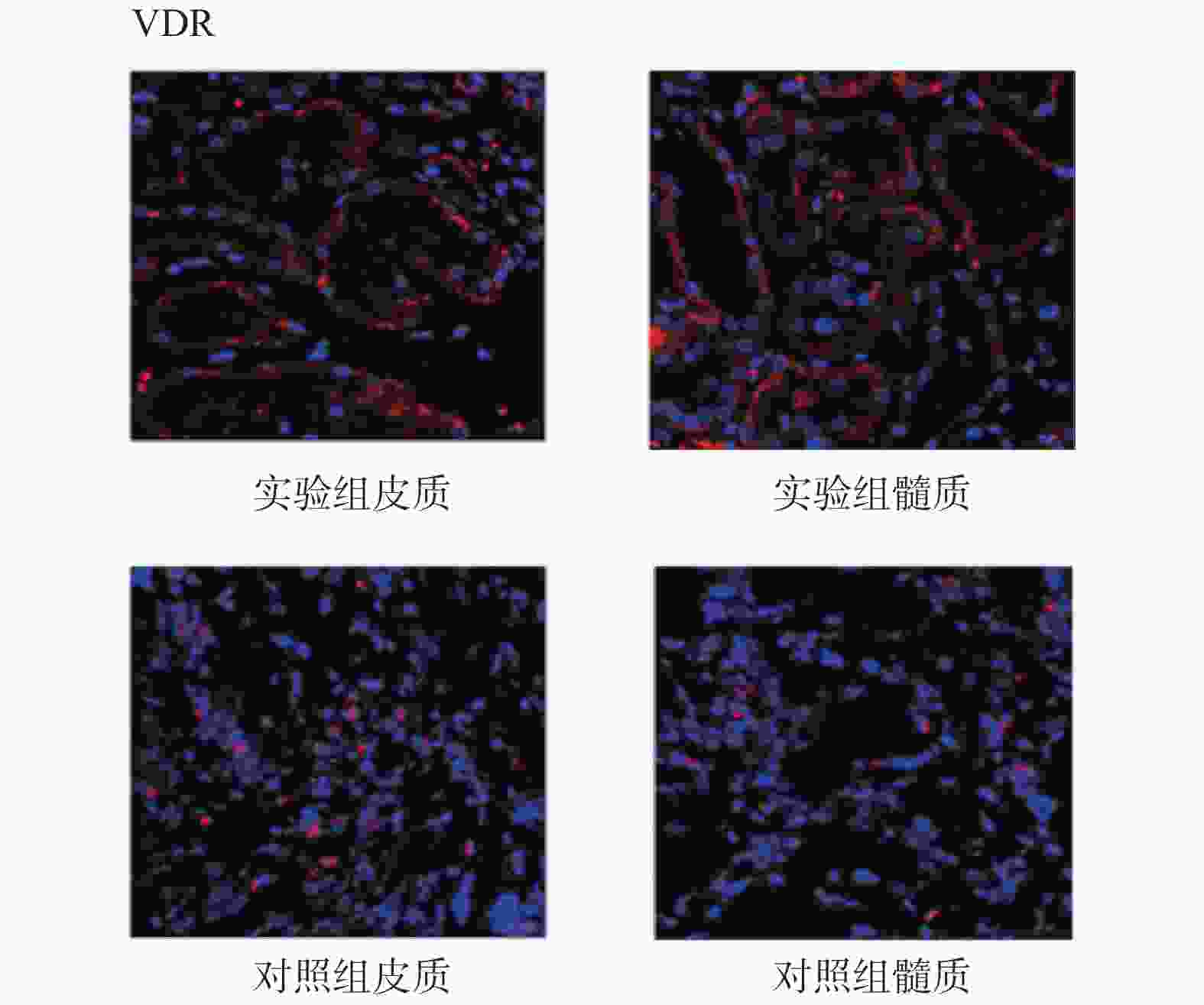
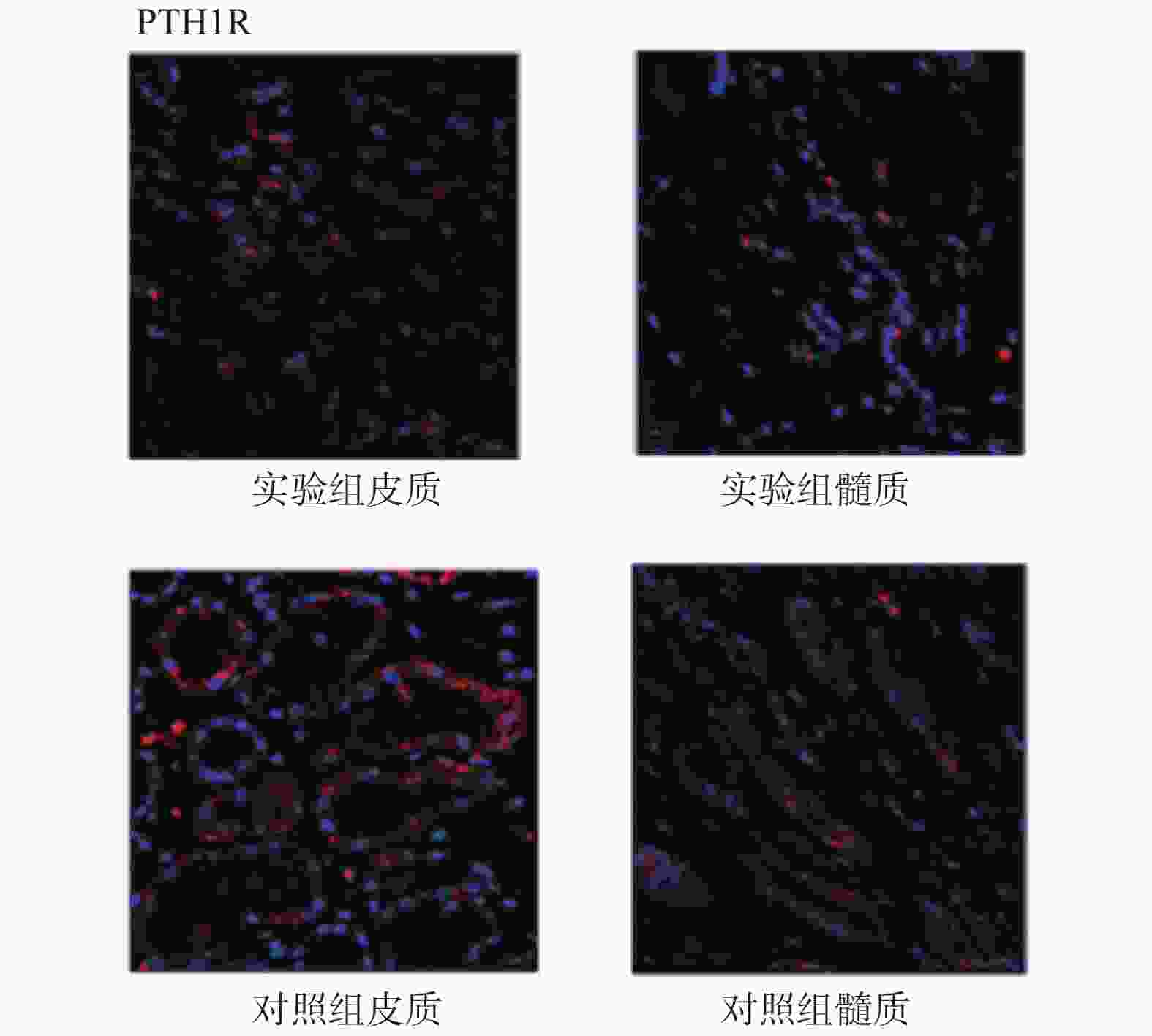
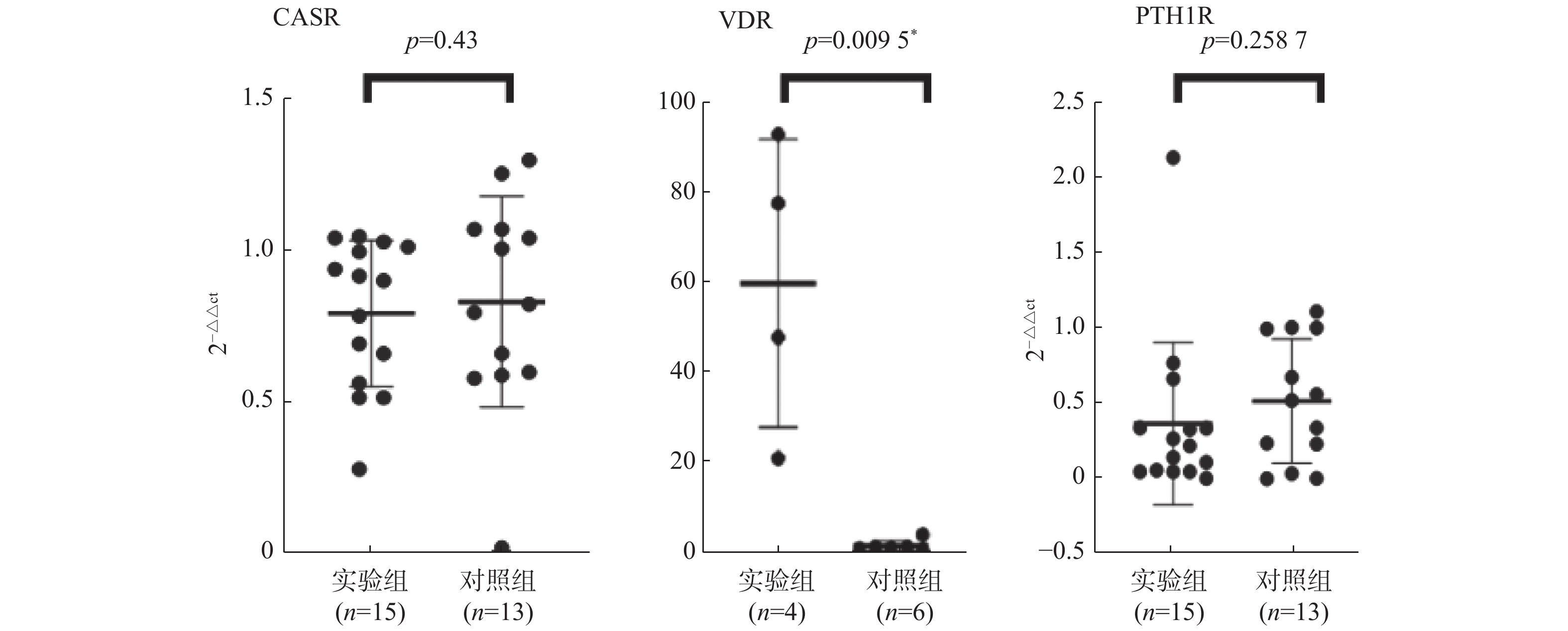
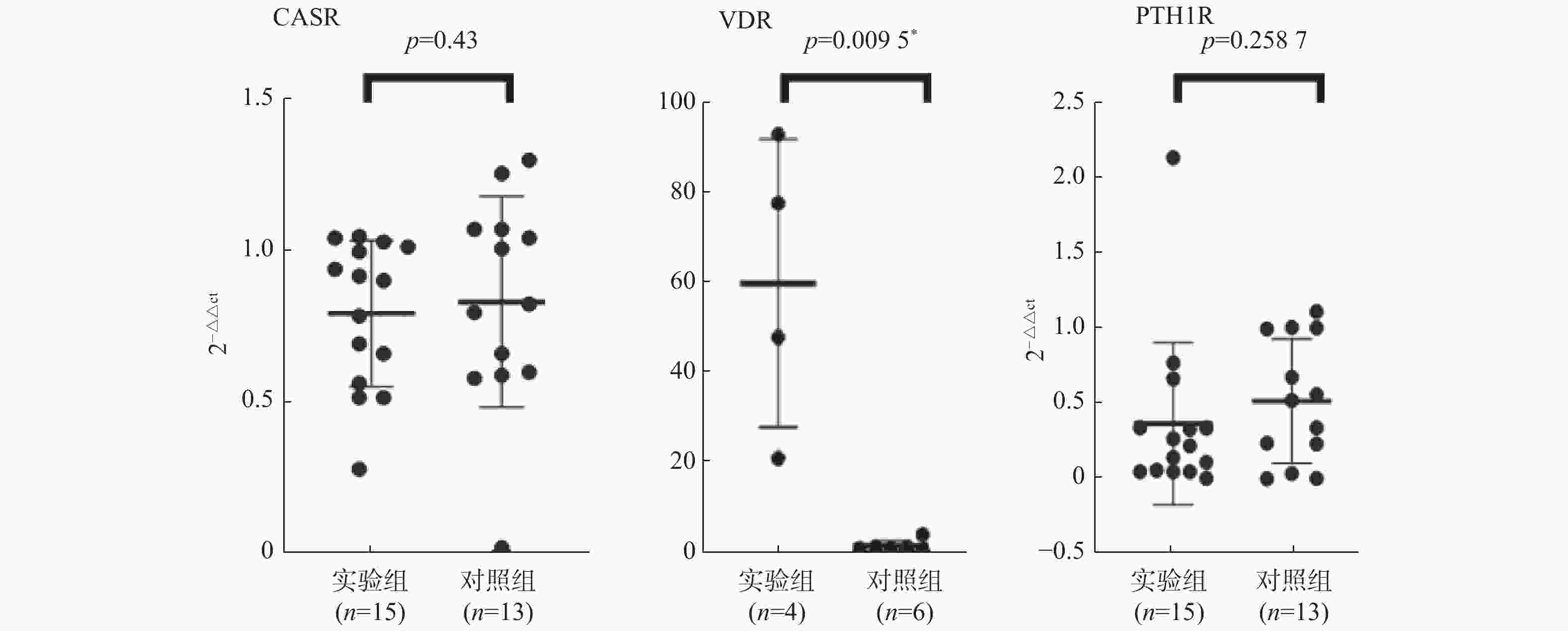
目的 研究CASR/VDR/PTH1R通路在含钙肾结石发生中的作用及机制。 方法 取肾结石患者肾脏髓质为实验组,肾脏肿瘤患者正常肾髓质为对照组,分别采用q-PCR、WB、免疫荧光法检测肾实体组织中CASR、VDR、PTH1R的mRNA表达和蛋白水平。 结果 CASR、PTH1R基因 mRNA在积水肾髓质及肾肿瘤正常髓质表达水平差异无统计学意义(P > 0.05)。VDR基因的mRNA在积水肾髓质及肾肿瘤正常髓质表达水平差异有统计学意义(P < 0.05)。 结论 CASR、VDR、PTH1R在肾结石患者肾脏髓质中表达,且有可能通过CASR/VDR/PTH1R信号通路途径参与含钙肾结石的发生机制。 -
关键词:
- 钙敏受体 /
- 维生素D受体 /
- 重组人甲状旁腺激素1受体 /
- 基因表达 /
- 肾结石
Abstract:Objective To study the role and mechanism of CASR, VDR, PTH1R and other genes in the occurrence of calcium-containing kidney stones. Methods The renal medulla of patients with renal calculi was selected as the experimental group, and the normal renal medulla of patients with renal tumors was selected as the control group. The mRNA expression and protein level of CASR, VDR and PTH1R in renal solid tissue were detected by q-PCR, WB and immunofluorescence, respectively. Results There was no significant difference in the expression levels of CASR and PTH1R gene mRNA in the hydronephrotic medulla and the normal medulla of renal tumor (P > 0.05). The difference of VDR gene mRNA expression in hydronephrotic medulla and normal medulla of renal tumor was statistically significant (P < 0.05). Conclusion CASR, VDR, and PTH1R are involved in the occurrence of calcium-containing kidney stones, and may participate in the mechanism of calcium-containing kidney stones through the CASR/VDR/PTH1R signaling pathway. -
Key words:
- CASR /
- VDR /
- PTH1R /
- Gene expression /
- Kidney stones
-
表 1 引物序列
Table 1. Primer sequence
序列 名称 长度(bp) TTGCCCTCAACGACCACTTT GAPDH(H)-F 120 TGGTCCAGGGGTCTTACTCC GAPDH(H)-R GTCTGGATCTCCTTCATTC CASR(H)-F 75 GATGGCAATCACCTCTAC CASR(H)-R TCACTGTATCACCTCTTC VDR (H)-F 80 GGTCATCTGAATCTTCTTC VDR (H)-R CAACTACTACTGGATTCTG PTH1R(H)-F 81 AGGTACTTCTTCTCTGAG PTH1R(H)-R 注:F代表上游引物forward;R代表下游引物reverse;使用LightCycle96进行定量实时聚合酶链式反应(qRTPCR),每个实验中都包括一个阴性对照,一式两份测定所有患者样品和非模板对照,GAPDH为内参。 表 2 抗体序列表
Table 2. Antibody sequence
抗体 公司 来源 稀释比 CaSR Santacrus 鼠 1∶1 000 VDR Proteintech 鼠 1∶5 000 PTH1R Santa SC-12722 鼠 1∶1 000 GAPDH abmart P30008M 兔 1∶2 000 一抗 CST 7074 1∶2 000 二抗 CST 7076 1∶2 000 -
[1] Coe F L,Worcester E M,Evan A P. Idiopathic hypercalciuria and formation of calcium renal stones[J]. Nat Rev Nephrol,2016,12(9):519-533. doi: 10.1038/nrneph.2016.101 [2] Li H,Zhang J,Long J,et al. Calcium-sensing receptor gene polymorphism (rs7652589) is associated with calcium nephrolithiasis in the population of Yi nationality in Southwestern China[J]. Ann Hum Genet,2018,82(5):265-271. doi: 10.1111/ahg.12249 [3] Li K,Luo Y,Mo Y,et al. Association between vitamin D receptor gene polymorphisms and idiopathic hypocitraturia in a Chinese Bai population[J]. Urolithiasis,2019,47(3):235-242. doi: 10.1007/s00240-018-1069-3 [4] Maiti A,Hait N C,Beckman M J. Extracellular calcium-sensing receptor activation induces vitamin D receptor levels in proximal kidney HK-2G cells by a mechanism that requires phosphorylation of p38alpha MAPK[J]. J Biol Chem,2008,283(1):175-183. doi: 10.1074/jbc.M707269200 [5] Skrajnowska D,Bobrowska-korczak B,Tokarz A. Disorders of Mechanisms of Calcium Metabolism Control as Potential Risk Factors of Prostate Cancer[J]. Curr Med Chem,2017,24(38):4229-4244. doi: 10.2174/0929867324666170913102834 [6] Gao X,Yamazaki Y,Tezuka Y,et al. The crosstalk between aldosterone and calcium metabolism in primary aldosteronism:A possible calcium metabolism-associated aberrant "neoplastic" steroidogenesis in adrenals[J]. J Steroid Biochem Mol Biol,2019,193:105434. doi: 10.1016/j.jsbmb.2019.105434 [7] Walker R W,Zhang S,Coleman-barnett J A,et al. Calcium receptor signaling and citrate transport[J]. Urolithiasis,2018,46(5):409-418. doi: 10.1007/s00240-018-1035-0 [8] Li X,Chen S,Feng D,et al. Calcium-sensing receptor promotes calcium oxalate crystal adhesion and renal injury in Wistar rats by promoting ROS production and subsequent regulation of PS ectropion,OPN,KIM-1,and ERK expression[J]. Ren Fail,2021,43(1):465-476. doi: 10.1080/0886022X.2021.1881554 [9] Saed H A R,Ibrahim H M M,El-khodery S A,et al. Relationship between expression pattern of vitamin D receptor,1 alpha-hydroxylase enzyme,and chemokine RANTES genes and selected serum parameters during transition period in Holstein dairy cows[J]. Vet Rec Open,2020,7(1):000339. [10] Bouksila M,Kaabachi W,Mrad M,et al. FGF 23,PTH and vitamin D status in end stage renal disease patients affected by VDR FokI and BsmI variants[J]. Clin Biochem,2018,54:42-50. doi: 10.1016/j.clinbiochem.2018.02.009 [11] Zhang Z L,Li Z R,Li J S,et al. Calcium-sensing receptor antagonist NPS-2143 suppresses proliferation and invasion of gastric cancer cells[J]. Cancer Gene Ther,2020,27(7-8):548-557. doi: 10.1038/s41417-019-0128-4 [12] Aslam A,Ahmad J,Baghdadi M A,et al. Chemopreventive effects of vitamin D(3) and its analogue,paricalcitol,in combination with 5-fluorouracil against colorectal cancer:The role of calcium signalling molecules[J]. Biochim Biophys Acta Mol Basis Dis,2021,1867(3):166040. doi: 10.1016/j.bbadis.2020.166040 [13] Peterlik M,Kállay E,Cross H S. Calcium nutrition and extracellular calcium sensing:relevance for the pathogenesis of osteoporosis,cancer and cardiovascular diseases[J]. Nutrients,2013,5(1):302-327. doi: 10.3390/nu5010302 [14] Varshney S,Bhadada S K,Saikia U N,et al. Simultaneous expression analysis of vitamin D receptor,calcium-sensing receptor,cyclin D1,and PTH in symptomatic primary hyperparathyroidism in Asian Indians[J]. Eur J Endocrinol,2013,169(1):109-116. doi: 10.1530/EJE-13-0085 [15] Egbuna O,Quinn S,Kantham L,et al. The full-length calcium-sensing receptor dampens the calcemic response to 1alpha,25(OH)2 vitamin D3 in vivo independently of parathyroid hormone[J]. Am J Physiol Renal Physiol,2009,297(3):F720-728. doi: 10.1152/ajprenal.00164.2009 [16] Schumacher S A,Kamr A M,Lakritz J,et al. Effects of intravenous magnesium sulfate on serum calcium-regulating hormones and plasma and urinary electrolytes in healthy horses[J]. PLoS One,2021,16(6):e0247542. doi: 10.1371/journal.pone.0247542 [17] Howles S A,Wiberg A,Goldsworthy M,et al. Genetic variants of calcium and vitamin D metabolism in kidney stone disease[J]. Nat Commun,2019,10(1):5175. doi: 10.1038/s41467-019-13145-x [18] Ho B B,Bergwitz C. FGF23 signalling and physiology[J]. J Mol Endocrinol,2021,66(2):R23-r32. doi: 10.1530/JME-20-0178 [19] Wu W,Fan H,Jiang Y,et al. Regulation of 25-hydroxyvitamin D-1-hydroxylase and 24-hydroxylase in keratinocytes by PTH and FGF23[J]. Exp Dermatol,2018,27(11):1201-1209. doi: 10.1111/exd.13760 [20] Jia R,Chai P,Wang S,et al. m(6)A modification suppresses ocular melanoma through modulating HINT2 mRNA translation[J]. Mol Cancer,2019,18(1):161. doi: 10.1186/s12943-019-1088-x [21] Pan J,Li Z,Wang Q,et al. Comparative proteomic investigation of drought responses in foxtail millet[J]. BMC Plant Biol,2018,18(1):315. doi: 10.1186/s12870-018-1533-9 [22] Maiti A,Beckman M J. Extracellular calcium is a direct effecter of VDR levels in proximal tubule epithelial cells that counter-balances effects of PTH on renal Vitamin D metabolism[J]. J Steroid Biochem Mol Biol,2007,103(3-5):504-508. doi: 10.1016/j.jsbmb.2006.11.012 [23] Lei M,Liu Z,Guo J. The Emerging Role of Vitamin D and Vitamin D Receptor in Diabetic Nephropathy[J]. Biomed Res Int,2020,2020:1-8. [24] Guo J,Song L,Liu M,et al. Fluorescent ligand-directed co-localization of the parathyroid hormone 1 receptor with the brush-border scaffold complex of the proximal tubule reveals hormone-dependent changes in ezrin immunoreactivity consistent with inactivation[J]. Biochi Bophys Acta,2012,1823(12):2243-2253. -





 下载:
下载: