Influence of Nutrition Intervention on Quality of Life and Survival Prognosis of Patients with Locally Advanced Pancreatic Cancer
-
摘要:
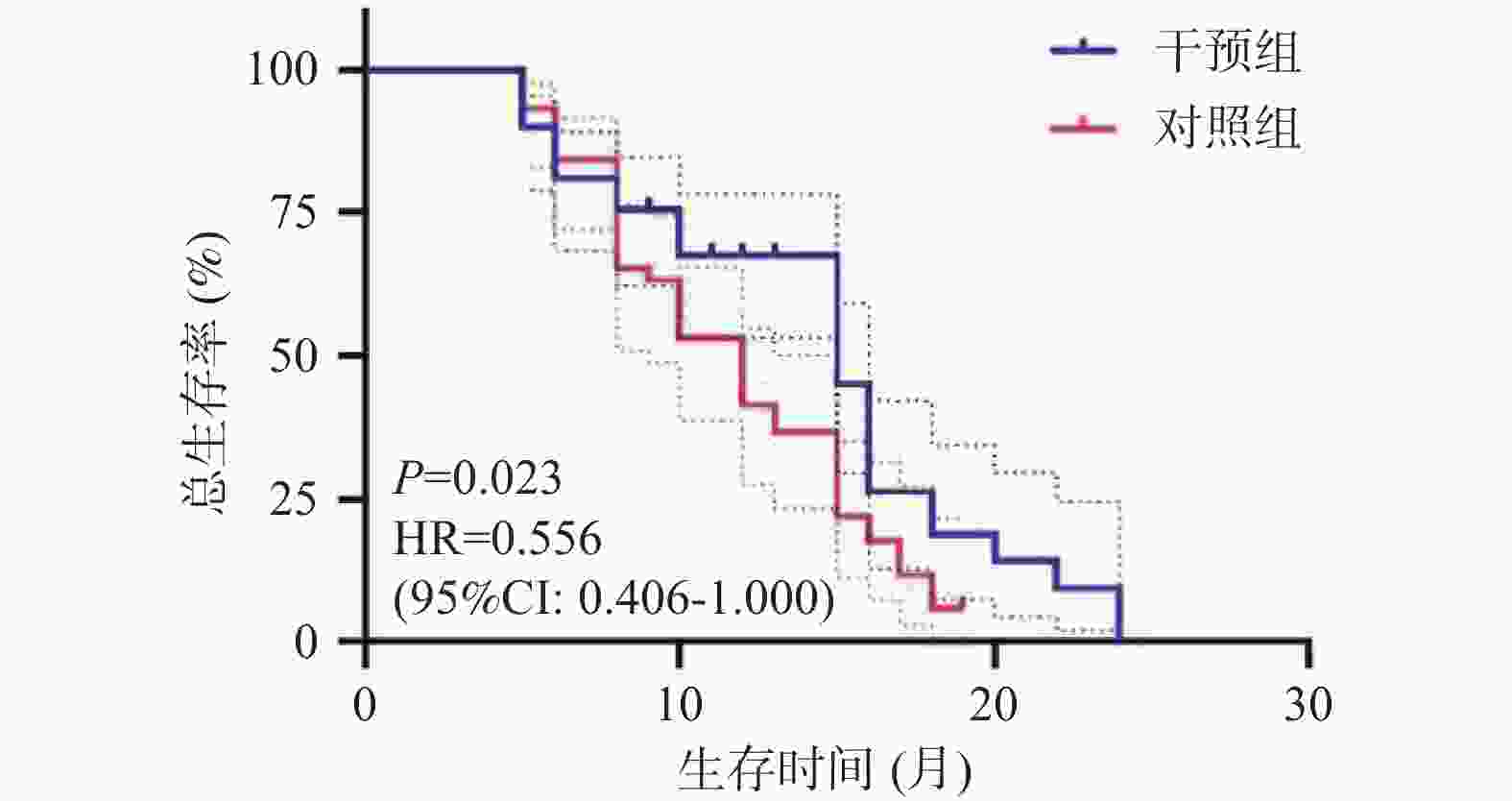
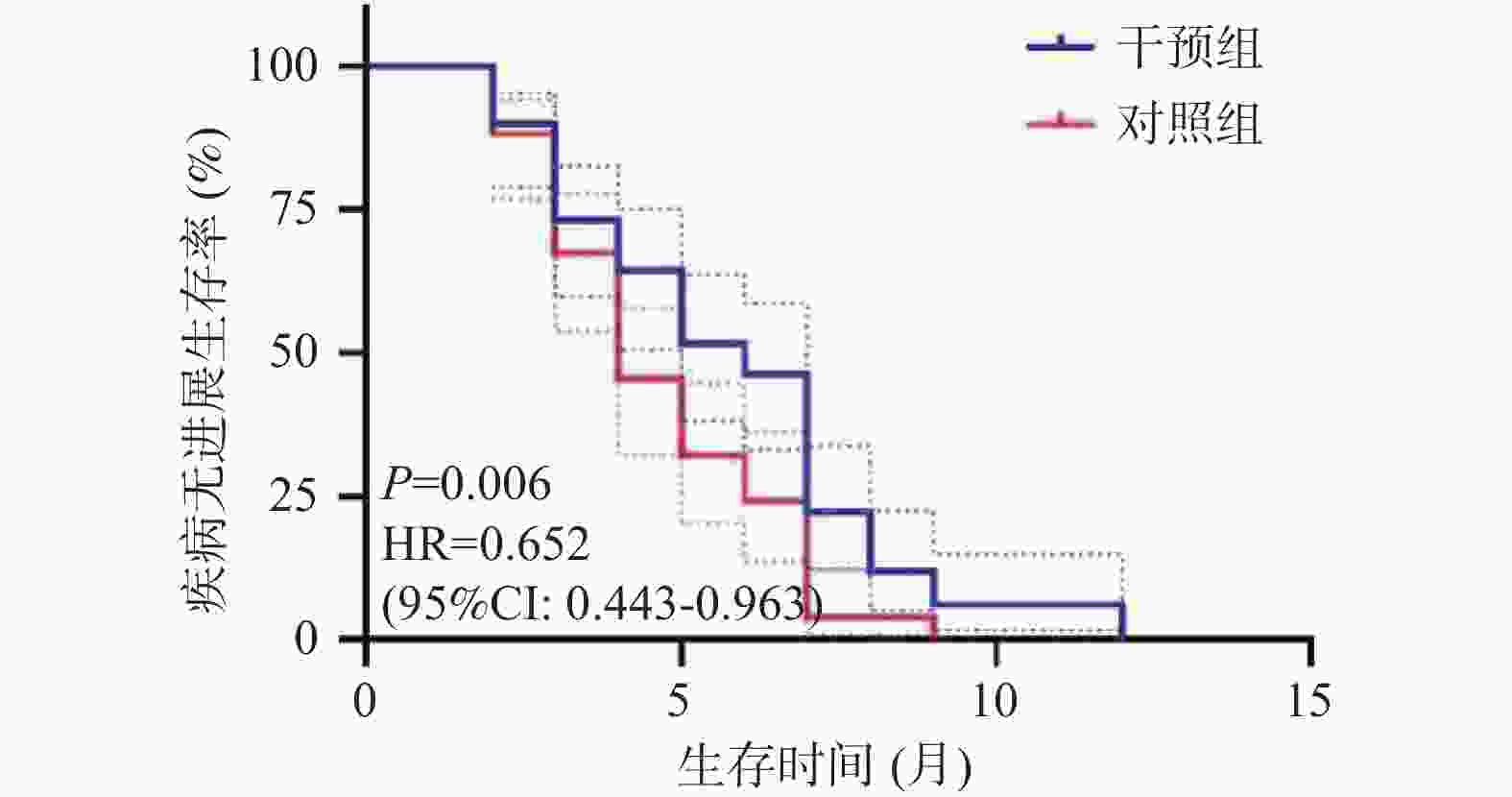
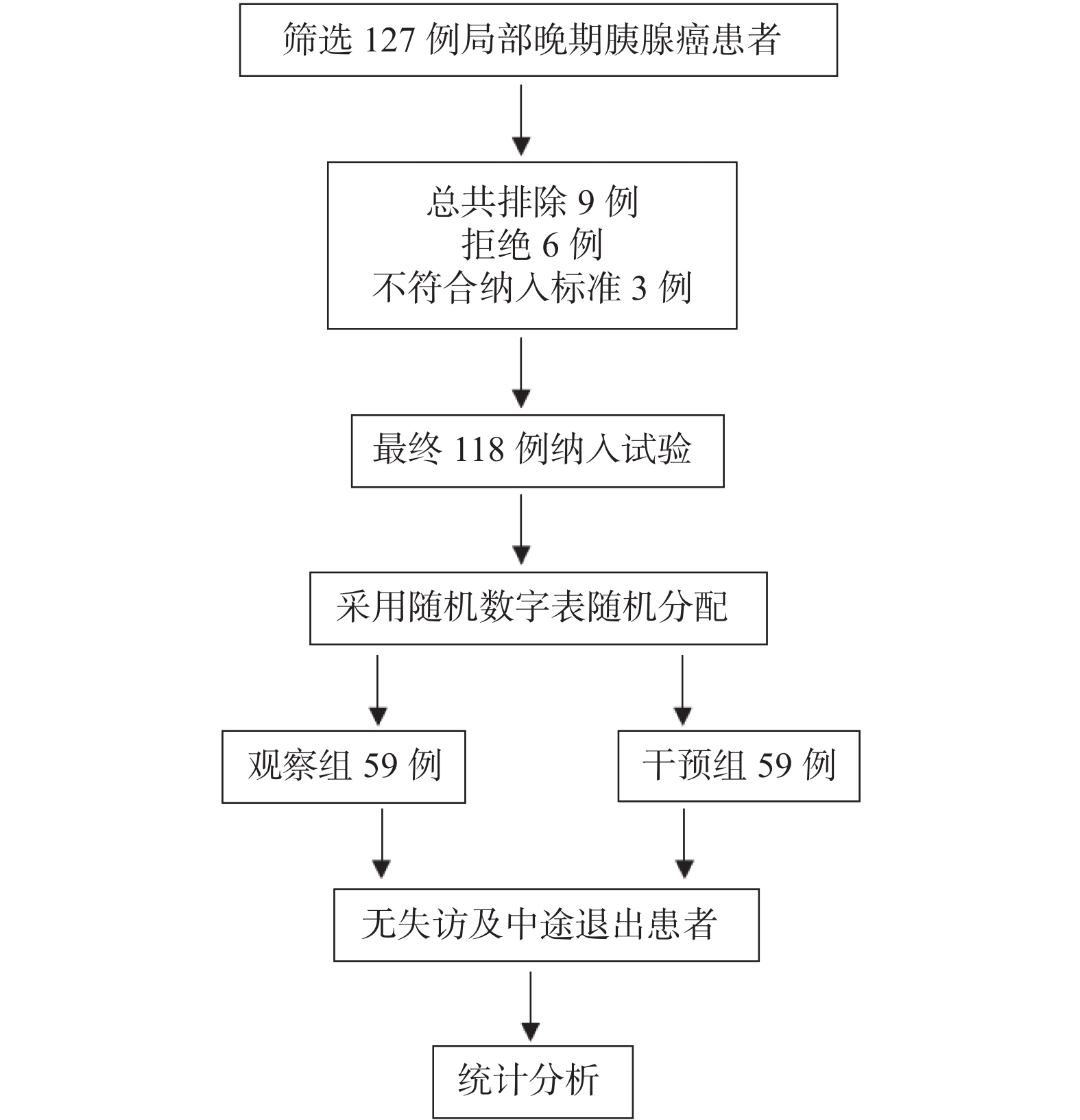
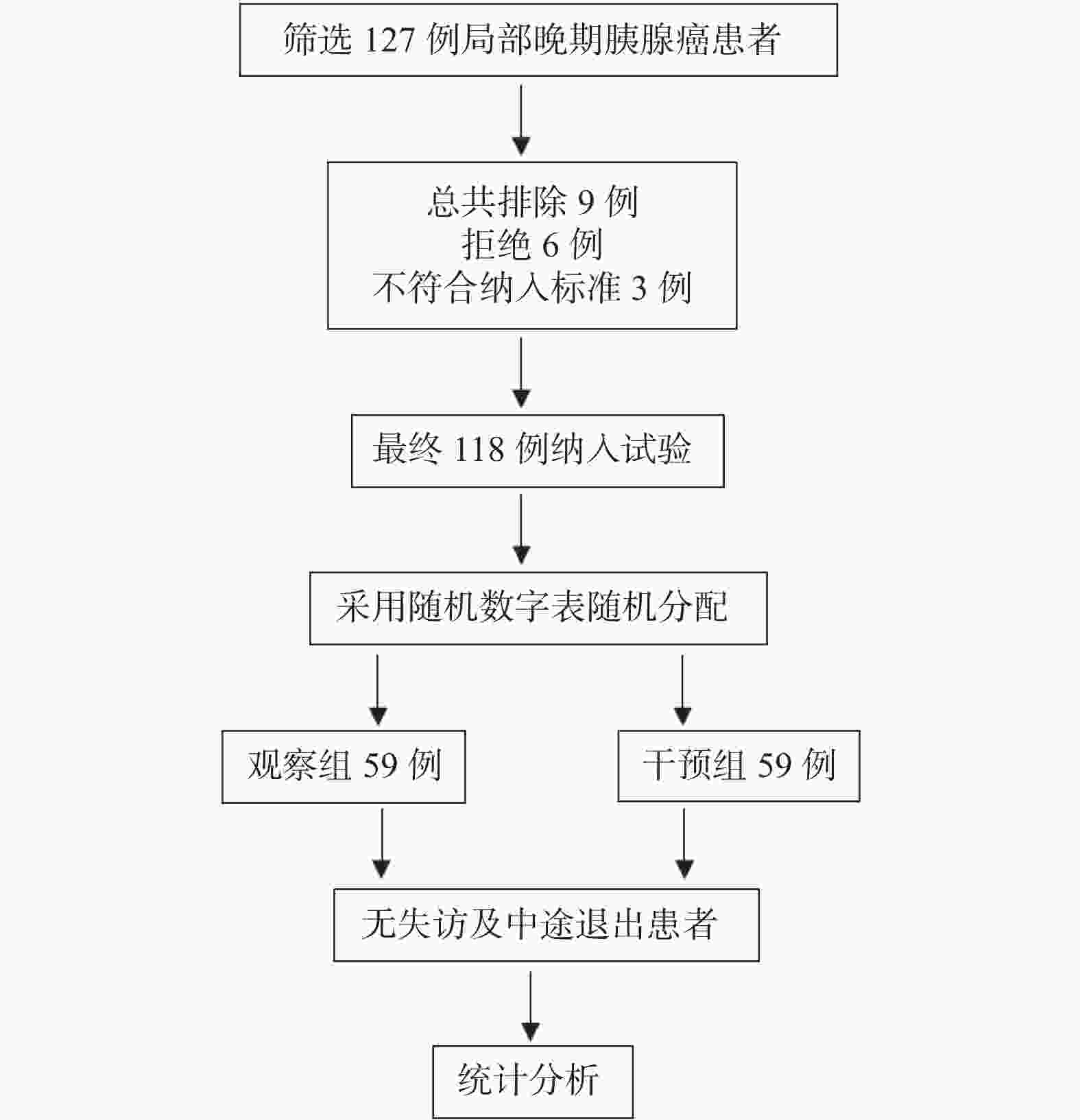
目的 探讨基于营养风险筛查的营养干预对局部晚期胰腺癌化疗患者的生活质量及生存预后的影响。 方法 选取2021年8月至2023年12月临沧市人民医院肝胆胰微创外科收治的胰腺癌患者118例,随机分成营养干预组及对照组,每组59例,所有患者均接受姑息性化疗,对照组予常规饮食指导,干预组基于营养风险评分给予的营养干预。比较两组患者的营养状况、生活质量评分及生存预后。 结果 第1次化疗至第6次化疗,干预组和对照组NRS2002评分(Nutritional risk screening 2002)水平逐渐升高,且干预组第4次化疗、第5次化疗、第6次化疗NRS2002评分低于对照组(P < 0.05)。干预组第1次化疗至第3次化疗,营养不良发生率分别为11.9%、30.9%、32.2%,均低于对照组20.3%、32.2%、40.7%,差异无统计学意义(P > 0.05);干预组第4次至第6次化疗,营养不良发生率分别为32.2%、45.8%、52.5%,显著低于对照组59.3%、69.5%、88.5%(P < 0.05);治疗后干预组的生活质量评分各个维度显著高于对照组(P < 0.05)。经营养干预治疗后显著改善患者的中位OS时间及中位PFS时间(P < 0.05)。 结论 营养的干预可以降低局部晚期胰腺癌化疗期间的营养风险,进而提高局部晚期胰腺癌患者的生活质量及改善其生存预后。 Abstract:Objective To investigate the impact of nutritional risk-based intervention on the quality of life and survival prognosis of patients with the locally advanced pancreatic cancer and undergoing the chemotherapy. Methods A total of 118 patients with the pancreatic cancer and admitted to the Department of Hepatobiliary and Minimally Invasive Surgery, Lincang People's Hospital from April 2021 to April 2024 were selected and randomly divided into the nutritional intervention group and the control group, with 59 patients in each group. All patients received the palliative chemotherapy, and the control group received the routine dietary guidance, while the intervention group received the nutritional intervention based on the nutritional risk score. The nutritional status, quality of life score, and survival prognosis of the two groups were compared. Results The NRS2002 score of the intervention group and the control group gradually increased from the first to the sixth chemotherapy, and the NRS2002 score of the intervention group was lower than that of the control group at the 4th, 5th, and 6th chemotherapy (P < 0.05). The incidence of malnutrition in the intervention group was lower than that of the control group at the 1st, 2nd, and 3rd chemotherapy (11.9%, 30.9%, and 32.2%, respectively), but there was no significant difference (P > 0.05); The incidence of malnutrition in the intervention group was significantly lower than that of the control group at the 4th, 5th, and 6th chemotherapy (32.2%, 45.8%, and 52.5%, respectively), while the incidence of malnutrition in the control group was 59.3%, 69.5%, and 88.5%, respectively (P < 0.05); The quality of life score of the intervention group in all dimensions was significantly higher than that of the control group after the treatment (P < 0.05). After the nutritional intervention, the median OS time and median PFS time of the patients were significantly improved (P < 0.05). Conclusion Nutritional intervention can reduce the nutritional risk during the chemotherapy for locally advanced pancreatic cancer patients and improve their quality of life. -
Key words:
- Pancreatic cancer /
- Nutritional intervention /
- Locally advanced /
- Quality of life
-
表 1 患者基线信息[n(%)/($\bar x \pm s $)]
Table 1. Patients' baseline information [n(%)/($\bar x \pm s $)]
项目 干预组(n = 59) 对照组(n = 59) t 或χ2 P 年龄(岁) 58.12 ± 9.90 59.05 ± 9.66 0.518 0.606 性别 男 40(67.8) 31(52.5) 2.864 0.091 女 19(32.2) 28(47.5) 肿瘤位置 胰头 52(88.1) 50(84.7) 0.289 0.591 胰体尾 7(11.9) 9(15.3) 病理学类型 胰腺导管腺癌 58(98.3) 57(96.6) 0.342 0.559 胰腺非导管腺癌 1(1.7) 2(3.4) 临床分期 III期 45(76.3) 47(79.7) 0.197 0.657 IV期 14(23.7) 12(20.3) 表 2 两组患者NRS2002评分比较[($\bar x \pm s $),分]
Table 2. Comparison of NRS2002 scores between the two groups of patients [($\bar x \pm s $),points]
项目 NRS2002评分 F时点 P F组间 P F交互 P 干预组(n = 59) 对照组(n = 59) t P 化疗前 1.85 ± 0.64 1.76 ± 0.60 0.791 0.430 23.041 0.001* 14.531 0.001* 11.041 0.001* 第1次化疗 1.97 ± 0.52 2.00 ± 0.64 −0.108 0.782 第2次化疗 1.98 ± 0.84 2.05 ± 0.86 −0.447 0.656 第3次化疗 2.19 ± 0.80 2.41 ± 0.81 −1.484 0.140 第4次化疗 2.24 ± 0.65 2.76 ± 0.94 −3.504 0.001 第5次化疗 2.32 ± 1.03 2.92 ± 0.79 −3.555 0.001 第6次化疗 2.64 ± 1.08 3.31 ± 0.70 −4.000 0.001 *P < 0.05。 表 3 两组患者营养不良率比较[n(%)]
Table 3. Comparison of malnutrition rates between the two groups of patients [n(%)]
项目 化疗前 第1次化疗 第2次化疗 第3次化疗 第4次化疗 第5次化疗 第6次化疗 干预组(n = 59) 8(13.6) 7(11.9) 18(30.9) 18(30.9) 19(32.2) 27(45.8) 31(52.5) 对照组(n = 59) 5(8.5) 12(20.3) 19(32.2) 19(32.2) 35(59.3) 41(69.5) 54(88.5) χ2 0.778 1.568 0.039 0.039 8.741 6.802 18.795 P 0.378 0.210 0.843 0.843 0.003* 0.009* 0.001* *P < 0.05。 表 4 两组患者化学治疗前后生活质量比较[($\bar x \pm s $),分]
Table 4. Comparison of quality of life in the two groups of patients before and after chemotherapy [($\bar x \pm s $),points]
项目 躯体功能 角色功能 认知功能 情绪功能 社会功能 化疗前 化疗后 化疗前 化疗后 化疗前 化疗后 化疗前 化疗后 化疗前 化疗后 干预组
(n = 59)62.61± 4.28 78.63± 5.36 58.97± 5.03 75.53± 5.67 60.51± 4.16 77.20± 5.60 59.47± 4.33 78.37± 5.15 60.49± 4.61 77.12± 4.55 对照组
(n = 59)63.49± 4.71 67.63± 5.11 59.08± 4.47 71.12± 5.27 61.59± 5.12 70.17± 5.50 60.76± 5.11 69.92± 5.08 62.00± 4.67 69.22± 4.35 t −0.990 10.548 −0.121 4.171 −1.345 6.020 −1.453 9.124 −1.670 9.260 P 0.33 <0.001* 0.904 <0.001* 0.184 <0.001* 0.152 <0.001* 0.1000 <0.001* *P < 0.05。 -
[1] 中国抗癌协会肿瘤营养专业委员会,中华医学会肠外肠内营养学分会. 胰腺癌患者的营养治疗专家共识[J]. 肿瘤代谢与营养电子杂志,2022,9(1):35-38. doi: 10.3969/j.issn.2095-7807.2022.1.zldxyyy202201007 [2] Poulia K A,Sarantis P,Antoniadou D,et al. Pancreatic cancer and cachexia-metabolic mechanisms and novel insights[J]. Nutrients,2020,12(6):1543. [3] McGuigan A,Kelly P,Turkington R C,et al. Pancreatic cancer: A review of clinical diagnosis,epidemiology,treatment and outcomes[J]. World Journal of Gastroenterology,2018,24(43):4846-4861. doi: 10.3748/wjg.v24.i43.4846 [4] Allen P J,Kuk D,Castillo C F,et al. Multi-institutional validation study of the American Joint Commission on Cancer (8th Edition) changes for T and N staging in patients with pancreatic adenocarcinoma[J]. Annals of Surgery,2017,265(1):185-191. doi: 10.1097/SLA.0000000000001763 [5] Park W,Chawla A,O'Reilly EM. Pancreatic cancer: A review[J]. JAMA,2021,326(9):851-862. doi: 10.1001/jama.2021.13027 [6] Kim S H,Lee S M,Jeung H C,et al. The effect of nutrition intervention with oral nutritional supplements on pancreatic and bile duct cancer patients undergoing chemotherapy[J]. Nutrients,2019,11(5):1145. doi: 10.3390/nu11051145 [7] Naumann P,Habermehl D,Welzel T,et al. Outcome after neoadjuvant chemoradiation and correlation with nutritional status in patients with locally advanced pancreatic cancer[J]. Strahlentherapie und Onkologie,2013,189(9):745-752. doi: 10.1007/s00066-013-0393-3 [8] Tempero M A, Malafa M P, Basturk O, et al. National comprehensive cancer network. NCCN clinical practice guidelines in oncology: Pancreatic adenocarcinoma. version 1.2025. (2024-12.20). https://www.nccn.org/patients [9] 李黎,唐雨欣,何伟,等. 常用临床试验设计的样本含量估计[J]. 系统医学,2018,3(9):191-193. [10] 石汉平,许红霞,李苏宜,等. 营养不良的五阶梯治疗[J]. 肿瘤代谢与营养电子杂志,2015,2(1):29-33. [11] Machado Dos Reis A,Marchetti J,Forte Dos Santos A,et al. NUTRIC score: Isolated and combined use with the NRS-2002 to predict hospital mortality in critically Ill patients[J]. JPEN J Parenter Enteral Nutr,2020,44(7):1250-1256. doi: 10.1002/jpen.1804 [12] Vachon H,Mierzynska J,Taye M,et al. Reference values for the EORTC QLQ-C30 in patients with advanced stage Hodgkin lymphoma and in Hodgkin lymphoma survivors[J]. European Journal of Haematology,2021,106(5):697-707. doi: 10.1111/ejh.13601 [13] Kahan B C,Hall S S,Beller E M,et al. Reporting of factorial randomized trials: Extension of the CONSORT 2010 statement[J]. JAMA,2023,330(21):2106-2114. doi: 10.1001/jama.2023.19793 [14] Cañamares-Orbís P,García-Rayado G,Alfaro-Almajano E. Nutritional support in pancreatic diseases[J]. Nutrients,2022,14(21):4570. doi: 10.3390/nu14214570 [15] Siegel R L,Giaquinto A N,Jemal A. Cancer statistics,2024[J]. CA: A Cancer Journal for Clinicians,2024,74(1):12-49. doi: 10.3322/caac.21820 [16] De Dosso S,Siebenhüner A R,Winder T,et al. Treatment landscape of metastatic pancreatic cancer[J]. Cancer Treatment Reviews,2021,96(2):102180. [17] Stoffel E M,Brand R E,Goggins M. Pancreatic cancer: Changing epidemiology and new approaches to risk assessment,early detection,and prevention[J]. Gastroenterology,2023,164(5):752-765. [18] 龚杨洋,张火俊. 营养干预对胰腺癌患者放化疗疗效及不良反应的影响[J]. 海军军医大学学报,2025,2(26):1-5. [19] Kordes M,Larsson L,Engstrand L,et al. Pancreatic cancer cachexia: Three dimensions of a complex syndrome[J]. British Journal of Cancer,2021,124(10):1623-1636. [20] Witvliet-van Nierop J E,Lochtenberg-Potjes C M,Wierdsma N J,et al. Assessment of nutritional status,digestion and absorption,and quality of life in patients with locally advanced pancreatic cancer[J]. Gastroenterology Research and Practice,2017,2017(8):6193765. [21] Carrato A,Cerezo L,Feliu J,et al. Clinical nutrition as part of the treatment pathway of pancreatic cancer patients: an expert consensus[J]. Clinical & Translational Oncology : Official Publication of the Federation of Spanish Oncology Societies and of the National Cancer Institute of Mexico,2022,24(1): 112-126. [22] Arends J,Bachmann P,Baracos V,et al. ESPEN guidelines on nutrition in cancer patients[J]. Clinical Nutrition (Edinburgh,Scotland),2017,36(1):11-48. doi: 10.1016/j.clnu.2016.07.015 [23] Kapoor N,Naufahu J,Tewfik S,et al. A prospective randomized controlled trial to study the impact of a nutrition-sensitive intervention on adult women with cancer cachexia undergoing palliative care in India[J]. Integrative Cancer Therapies,2017,16(1):74-84. doi: 10.1177/1534735416651968 [24] Yeh K Y,Wang H M,Chang J W,et al. Omega-3 fatty acid-,micronutrient-,and probiotic-enriched nutrition helps body weight stabilization in head and neck cancer cachexia[J]. Oral Surgery,Oral Medicine,Oral Pathology and Oral Radiology,2013,116(1):41-48. doi: 10.1016/j.oooo.2013.01.015 [25] Oliva E N,Nobile F,Alimena G,et al. Quality of life in elderly patients with acute myeloid leukemia: Patients may be more accurate than physicians[J]. Haematologica,2011,96(5):696-702. doi: 10.3324/haematol.2010.036715 [26] Nishikawa H,Goto M,Fukunishi S,et al. Cancer Cachexia: Its Mechanism and Clinical Significance[J]. International Journal of Molecular Sciences,2021,22(16):8491. [27] Cooper A B,Slack R,Fogelman D,et al. Characterization of anthropometric changes that occur during neoadjuvant therapy for potentially resectable pancreatic cancer[J]. Annals of Surgical Oncology,2015,22(7):2416-2423. doi: 10.1245/s10434-014-4285-2 [28] Santarpia L,Contaldo F,Pasanisi F. Nutritional screening and early treatment of malnutrition in cancer patients[J]. Journal of Cachexia,Sarcopenia and Muscle,2011,2(1):27-35. [29] Paccagnella A,Morello M,Da Mosto M C,et al. Early nutritional intervention improves treatment tolerance and outcomes in head and neck cancer patients undergoing concurrent chemoradiotherapy[J]. Supportive Care in Cancer : Official Journal of the Multinational Association of Supportive Care in Cancer,2010,18(7): 837-845. [30] 陈慧慧,桑秋菊,卢芳,等. 免疫营养在肿瘤治疗中的研究进展[J]. 现代肿瘤医学,2023,31(7):1370-1374. -





 下载:
下载: