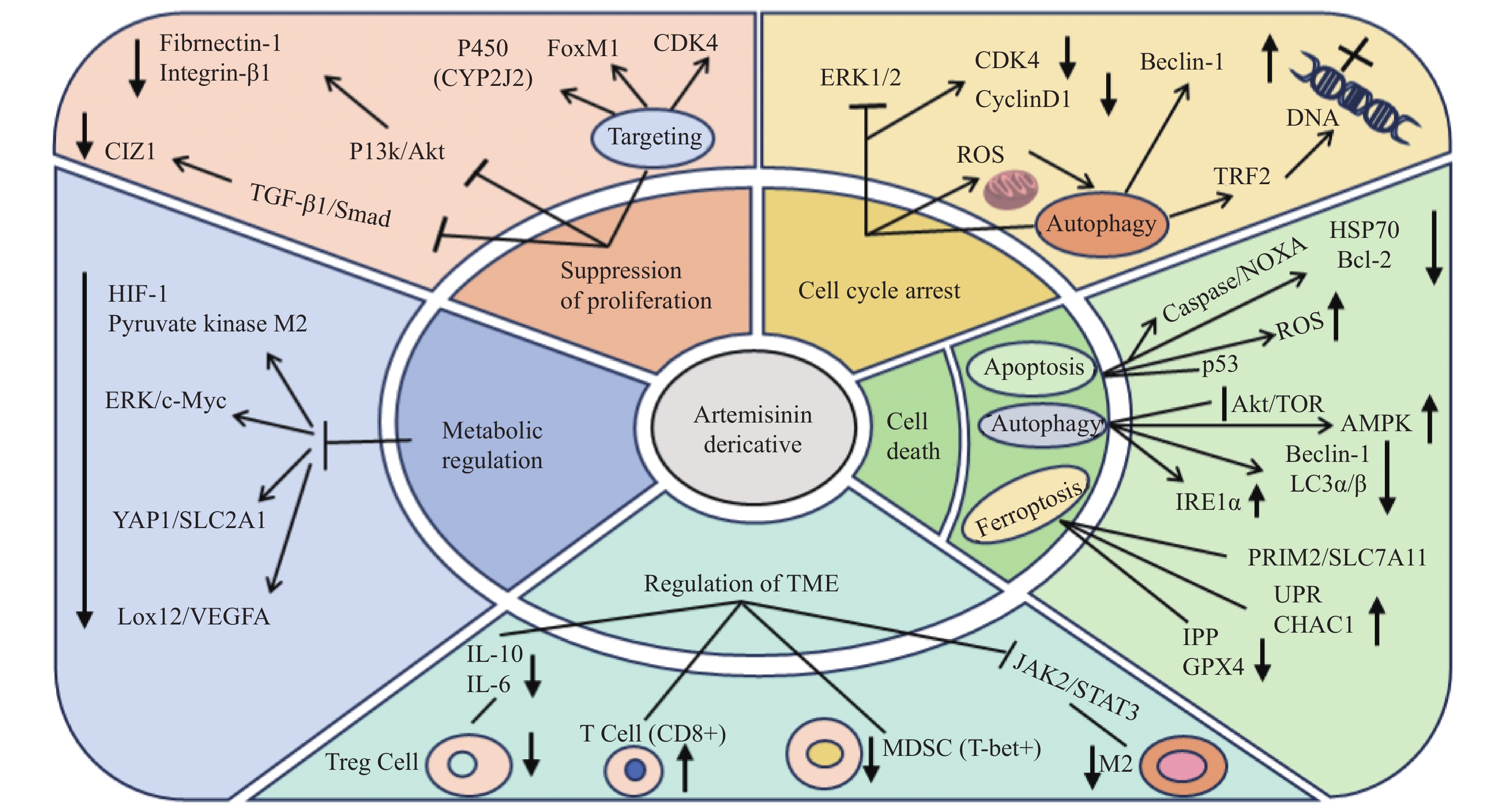
Research Progress on the Mechanisms of Action of Artemisinin and Its Derivatives in Cancer Therapy
-
摘要: 青蒿素及其衍生物由于其独特的过氧化桥结构,不仅对恶性疟疾显示出显著的疗效,也展现了强大的抗肿瘤能力。这些化合物通过多效机制干扰癌细胞生长,包括抑制细胞增殖、引起细胞周期阻滞、诱导多种细胞死亡模式、调节肿瘤微环境和调节肿瘤代谢等。临床试验已证实青蒿素类化合物具有显著的抗癌活性。本文归纳了近年来关于青蒿素及其衍生物作为潜在抗癌药物的最新进展和发现,为未来青蒿素类化合物的抗癌机制研究提供参考。Abstract: Due to their unique peroxide bridge structure, Artemisinin and its derivatives have demonstrated the remarkable efficacy in treating severe malaria and exhibited the potent anticancer properties. These compounds interfere with the cancer cell growth through the multiple mechanisms, including the inhibition of cell proliferation, induction of various forms of cell death, cell cycle arrest, suppression of angiogenesis, and modulation of the tumor microenvironment. Clinical trials have confirmed the significant anticancer activity of artemisinin-based compounds. This paper summarizes the recent advances and findings on artemisinin and its derivatives as the potential anticancer agents, providing valuable insights for future researches on the anticancer mechanisms of these compounds.
-
Key words:
- Artemisinin /
- Artemisinin derivatives /
- Anticancer /
- Mechanisms of action
-
我国2022年肺癌新发病例达106.06万例,死亡病例达73.33万例,男性和女性恶性肿瘤的发病率和死亡率均居首位[1],且患病人数仍在不断增加。云南省肺癌发病率较高,尤其是在宣威、富源地区[2],且具有死亡率高、发病率高、女性高发和地区聚集性高发的特征[3]。研究指出[4],云南省肺癌的发病年龄呈现年轻化趋势,这应引起医疗工作者的高度关注。病耻感(Stigma)是指个体因患某种疾病被社会污名化、隔离疏远及歧视贬低而产生的内心羞耻感受[5]。病耻感的存在易导致患者出现羞耻、自我认同感降低及自卑等不良情绪,这些情绪会进一步影响患者的疾病康复、预后、社会适应能力和生活质量。鉴于肺癌与生活习惯的密切关联,患者所经历的病耻感较其他癌症类型更为严重,已有研究[6−8]表明,肺癌患者病耻感水平明显高于乳腺癌、前列腺癌等其他类型癌症,这种高水平的病耻感会导致患者产生焦虑、抑郁等心理困扰[9],不利于其社会生活和疾病康复[10]。近年来,肺癌患者的病耻感已成为国际研究的热点[11],但国内相关研究起步较晚,多处于描述性研究阶段。目前尚缺少云南省肺癌患者病耻感的相关研究报道。因此,本研究旨在调查云南省肺癌患者病耻感现状,并分析其影响因素,以期为临床降低肺癌患者病耻感水平,改善其心理健康状态提供理论依据。
1. 资料与方法
1.1 调查对象
采用便利抽样法,选取2022年7月至2023年7月期间在云南省某三级甲等肿瘤专科医院住院治疗的250例肺癌患者为研究对象。所有患者均签署知情同意书,自愿参与调查研究。纳入标准[6−7]:(1)经病理学检查及纤支气管镜检查诊断为肺癌;(2)知晓自身诊断及病情;(3)年龄≥18岁;(4)具有独立完成或在研究者辅助下能顺利完成调查问卷的能力;(5)长期居住在云南省的患者。排除标准[6−7]:(1)存在语言障碍无法进行有效沟通者;(2)合并其他类型恶性肿瘤疾病;(3)神志不清或精神障碍者。根据样本量计算原则,分析有关变量的影响因素时,样本量应至少为变量数的5~10倍,再考虑20%的无效问卷,样本量应为126~252例。本研究经昆明医科大学医学伦理委员会批准通过(KMMU2021MEC117)。
1.2 调查工具
1.2.1 一般资料
调查表由研究者自行设计,包括患者类型(手术患者、复查患者)、年龄、性别、文化程度、职业、婚姻状态、长期居住地、医疗费用支付方式、民族、是否有宗教信仰、人均月收入、是否合并其他疾病、是否吸烟、是否有子女、家庭关系(与父母、配偶、子女间关系)、主要照顾者、主要照顾者健康情况、治疗方式等。
1.2.2 中文版病耻感量表
Cataldo肺癌患者病耻感量表[12]由美国加州大学Cataldo教授于2011年编制,中文版肺癌患者病耻感量表 (cataldo lung cancer stigma scale)由中国学者于媛等[13]于2017年引进汉化形成。该量表共31个条目,包括羞耻或羞愧(11个条目)、社会隔离(10个条目)、歧视(5个条目)、吸烟(5个条目)4个维度。量表每个条目均为单项选择,采用Likert 4级评分:非常不同意(1分),不同意(2分),同意(3分),非常同意(4分),得分区间为31~124分,得分越高表示患者病耻感水平越高。中文版肺癌患者病耻感总量表的内容效度为0.96,总Cronbach's α系数为0.932,各因子Cronbach's α系数为0.799~0.922,具有较好的信效度,适用于测量我国肺癌患者病耻感水平[13]。
1.3 资料收集及质量控制方法
本次调查采用问卷调查法,研究者对调查人员就本研究的调查目的、调查方式、问卷内容、资料收集方法、质量控制方法等进行统一培训。正式调查时由经过培训的调查人员使用统一指导语向患者解释调查目的及意义,并进行问卷填写说明。取得患者知情同意后,现场发放纸质问卷,当场填写并回收。本研究共发放纸质问卷250份,剔除无效问卷2份,有效回收率为99.2%。
1.4 统计学分析
采用SPSS26.0软件进行统计分析。以频数、百分比[n(%)]等对计数资料进行描述;以均数 ± 标准差($ \bar x \pm s $)表示计量资料,采用独立样本t检验进行两组比较,采用单因素方差分析或Kruskal-Wallis检验进行多组比较。使用多元线性回归对单因素分析结果中有统计学意义的变量进行统计分析。以双侧P < 0.05为差异有统计学意义。
2. 结果
2.1 肺癌患者病耻感总分及各维度得分
248例肺癌患者病耻感总分为(96.92 ± 14.87)分,得分范围为31~124分,各维度得分为:耻辱与羞愧(33.69 ± 5.36)分;社会隔离(32.08 ± 5.33)分;歧视(15.83 ± 2.74)分;吸烟(15.32 ± 2.84)分,见表1。
表 1 肺癌患者病耻感总分及各维度得分情况[n = 284,($ \bar x \pm s $)/分]Table 1. Total scores and dimensions of stigma among lung cancer patients [n = 284,($ \bar x \pm s $)/score]项目 条目数 得分范围 最小值 最大值 总分 病耻感总分 31 31~124 31 124 96.92 ± 14.87 羞耻或羞愧 11 11~44 11 44 33.69 ± 5.36 社会隔离 10 10~40 10 40 32.08 ± 5.33 歧视 5 5~20 5 20 15.83 ± 2.74 吸烟 5 5~20 5 20 15.32 ± 2.84 2.2 一般资料及肺癌患者病耻感的单因素分析
共248名患者参与调查,男性113名,女性135名,年龄25~80(55.26 ± 9.86)岁。单因素分析结果显示,患者类型、年龄、性别、民族、长期居住地、文化程度、家庭人均月收入、家庭关系(与父母、配偶、子女间关系)、是否吸烟、治疗方式对肺癌患者病耻感得分有影响(P < 0.05),一般资料及单因素分析结果见表2。
表 2 调查对象的一般资料及肺癌患者病耻感现状得分单因素分析结果[n = 248,n(%)/($ \bar x \pm s $)](1)Table 2. General data of the respondents and outcomes of univariate analysis of the current status of stigma among lung cancer patients [n = 248,n(%)/($ \bar x \pm s $)](1)项目 分类 n 构成比(%) 总分 t/F/χ2 P 患者类型 复查患者 52 20.97 89.35 ± 12.99 4.808 < 0.001* 手术患者 196 79.03 98.93 ± 14.71 年龄(岁) < 45 33 13.31 104.45 ± 12.74 11.155 0.004* 45~59 132 53.23 95.58 ± 15.18 ≥60 83 33.47 96.07 ± 14.43 性别 男 113 45.56 94.50 ± 13.02 3.104 0.002* 女 135 54.44 98.96 ± 16.03 文化程度 小学及以下 72 29.03 92.94 ± 15.12 25.390 < 0.001* 初中 76 30.65 94.67 ± 14.18 高中/中专 35 14.11 97.34 ± 14.50 专科 31 12.50 99.45 ± 12.14 本科及以上 34 13.71 107.65 ± 13.58 婚姻状况 已婚 237 95.56 96.85 ± 14.98 0.349 0.728 其他(未婚、分居、离异或丧偶) 11 4.44 98.45 ± 12.86 职业 农民 90 36.29 93.82 ± 14.39 12.466 0.052 工人 33 13.31 96.03 ± 12.32 干部(公务员/教师/军人) 27 10.89 106.52 ± 14.87 自由职业 29 11.69 97.48 ± 15.29 医务人员 10 4.03 102.00 ± 12.59 无业 22 8.87 99.05 ± 16.31 退休 37 14.92 95.19 ± 15.06 长期居住地 城市 110 44.35 91.76 ± 13.16 21.871 < 0.001* 农村 138 55.65 101.04 ± 14.92 民族 汉族 214 86.29 96.08 ± 14.86 4.312 0.038* 其他少数民族 34 13.71 102.21 ± 14.01 *P < 0.05。 表 2 调查对象的一般资料及肺癌患者病耻感现状得分单因素分析结果[n = 248,n(%)/($ \bar x \pm s $)](2)Table 2. General data of the respondents and outcomes of univariate analysis of the current status of stigma among lung cancer patients [n = 248,n(%)/($ \bar x \pm s $)](2)项目 分类 n 构成比(%) 总分 t/F/χ2 P 宗教信仰 无 233 93.95 96.82 ± 14.70 0.005 0.945 有 15 6.05 98.47 ± 17.82 家庭人均月收入(元) < 1000 34 13.71 91.76 ± 13.52 15.255 0.002* 1000 ~200055 22.18 95.56 ± 15.81 2001~ 4999 90 36.29 95.31 ± 12.50 > 5000 69 27.82 102.65 ± 16.11 医疗费用支付方式 自费 9 3.63 95.00 ± 19.97 15.865 0.124 省医保 15 6.05 90.73 ± 19.57 市医保 55 22.18 103.24 ± 14.38 新农合 78 31.45 94.32 ± 12.07 城镇居民医保 84 33.87 95.98 ± 15.17 商业保险 7 2.82 103.43 ± 12.07 是否合并其他疾病 是 88 35.48 96.74 ± 14.33 0.145 0.885 否 160 64.52 97.03 ± 14.33 是否吸烟 是 55 22.18 93.36 ± 11.98 2.331 0.022* 否 193 77.82 97.94 ± 15.47 是否有子女 有 245 98.79 96.82 ± 14.88 1.025 0.306 无 3 1.21 105.67 ± 13.05 家庭关系
(与父母、配偶、子女间关系)一般 26 10.48 93.04 ± 14.55 6.695 0.035* 较好 88 35.48 94.53 ± 12.78 很好 134 54.03 99.25 ± 15.87 主要照顾者 父母 10 4.03 103.00 ± 11.89 3.776 0.287 配偶 125 50.40 96.62 ± 14.95 子女 95 38.31 95.98 ± 14.96 其他(兄弟姐妹、朋友、护工/保姆等) 18 7.26 100.67 ± 15.09 主要照顾者健康情况 良好 191 77.02 97.98 ± 15.03 4.567 0.102 一般 55 22.18 93.09 ± 13.92 较差 2 0.81 101.00 ± 12.73 治疗方式 手术 203 81.85 98.79 ± 14.13 22.269 < 0.001* 化疗 39 15.73 88.69 ± 12.58 其他 6 2.42 87.20 ± 14.73 *P < 0.05。 2.3 肺癌患者病耻感的多因素分析
将肺癌患者病耻感得分作为因变量,将单因素分析结果中有统计学意义的11个变量作为自变量。测得R2为0.165~0.205,容差为0.354~0.970,方差膨胀因子为1.061~2.824,各个自变量之间相互独立、不存在多重共线性。自变量赋值情况,见表3。多元线性回归分析结果显示,文化程度、长期居住地、民族及家庭关系是肺癌患者病耻感得分的正向影响因素(P < 0.05),见表4。
表 3 肺癌患者病耻感得分的多元线性回归自变量赋值Table 3. Assignment of multiple linear regression independent variables for stigma scores among lung cancer patients自变量 赋值说明 患者类型 复查患者 = (0,0);手术患者 = (1,0) 年龄 < 45岁 = 1;45~59岁 = 2;≥60岁 = 3 性别 男 = 1,女 = 2 文化程度 小学及以下 = 1;初中 = 2;
高中/中专 = 3; 专科 = 4;
本科及以上 = 5长期居住地 城市 = 1;农村 = 2 民族 汉族 = 1,其他少数民族 = 2 家庭人均月收入 1000 元以下 = 1;1000 ~2000元 = 2;2001~4999 元 = 3;5000 元以上 = 4是否吸烟 不吸烟 = 1;吸烟 = 2 家庭关系
(与父母、配偶、
子女间关系)一般 = 1;较好 = 2;很好 = 3 治疗方式 手术 = (0,0);化疗 = (1.0);
其他 = (0,1)表 4 肺癌患者病耻感影响因素的线性回归分析Table 4. Linear regression analysis of stigma influencing factors among lung cancer patients变量 β SE β' t P 常量 68.569 8.968 − 7.646 < 0.001* 文化程度 1.808 0.880 0.168 2.054 0.041* 长期居住地 5.025 2.280 0.168 2.204 0.029* 民族 5.766 2.630 0.134 2.192 0.029* 家庭关系 2.690 1.339 0.122 2.009 0.046* R2 = 0.205,调整R2 = 0.164,F = 5.036;*P < 0.05。 3. 讨论
3.1 肺癌患者病耻感处于较高水平
本研究中,肺癌患者病耻感得分为(96.92 ± 14.87)分,显著高于国内常模的中位数(54分)水平[14]。此外,研究中涉及的各个维度条目的平均分均超过了量表的中位数分数。研究发现[15],云南省肺癌患者的病耻感得分高于北京地区肺癌患者的得分(49.17 ± 11.37)分,该得分属于中度水平,同时也高于广州地区报告的中度水平[16]以及广西地区的得分(71.11 ± 14.91)分[17],后者属于中等以上水平。表明云南省肺癌患者的病耻感水平处于中等偏高,且相较于北京、广州、广西等地区有所增加。以上数据不仅揭示了地区间肺癌患者病耻感水平的差异,也凸显了云南省在肺癌患者心理社会支持方面所面临的挑战,这一现状需引起医疗保健提供者、公共卫生专家以及社会支持系统的广泛关注。分析云南省肺癌患者病耻感水平处于中等偏高状态,可能的原因包括:(1)社会认知与偏见:研究[18]指出,公众的排斥和歧视是肺癌患者病耻感的主要来源之一。Occhipinti等[19]通过对28例肺癌患者及其护理人员的访谈发现,由于肺癌患者更多地被认为是由吸烟行为所引起,因此他们所经历的病耻感水平往往高于其他癌症患者。在社会认知中,肺癌与吸烟行为的紧密联系导致了对患者的偏见。实际上,并非所有肺癌患者均有吸烟史,但这种社会刻板印象给患者带来了显著的心理压力[20]。(2)文化背景与观念:中国传统文化中的“面子文化”对个体的社会行为和心理体验具有深远的影响,在此文化背景下,癌症,尤其是肺癌,常被视为一种“丢脸”的疾病,导致患者因担心失去“面子”而不愿公开病情[21]。(3)病情严重程度:肺癌的病情严重程度也会影响患者的病耻感。早期肺癌患者常有咳嗽、咳痰甚至咯血等症状,常会使人联想到呼吸道传染疾病,旁人因害怕被传染而躲避甚至排斥患者,易使患者产生耻辱感[22];处于中晚期阶段的患者,由于病情较重、症状更为显著,且预后较差,因此心理负担更重,病耻感也更为强烈。(4)治疗方案的影响:肺癌的治疗方案包括外科手术、化疗、放疗等,确诊后需要经历长期的治疗,这些治疗可能带来一系列危害身体健康的不良反应,如化疗引起的恶心、呕吐、脱发及放疗引起的皮肤色素沉着甚至溃烂等,患者躯体形象受损也可能对患者的心理造成负面影响,增加病耻感[23]。
3.2 肺癌患者病耻感的影响因素分析
3.2.1 文化程度
本研究结果显示,文化程度越高的肺癌患者病耻感水平越高。有研究[24]表明自身文化程度高的患者其病耻感水平也更高。本研究中,70.97%患者的文化程度处于初中及以上水平,文化程度较高。因此,所表现出的病耻感水平也相对较高。分析原因:首先,文化程度较高的患者通常对社会舆论和态度有着更高的感知能力,可能更加敏感于社会对肺癌的偏见和歧视;其次,文化程度更高的人群拥有更强的信息获取和处理能力,更容易通过多渠道获取关于肺癌的信息,包括可能增加病耻感的信息,如社会对肺癌患者的负面看法;再者,文化程度更高的人群社会期望与自我认同的冲突更加明显,高学历人群可能会更在意自己的社会形象和地位。最后,文化程度更高的人群可能存在心理需求的复杂性及社会支持的缺失,高学历患者可能对心理支持有更高的需求,对治疗效果有更高的期望,当这些需求及期望未能达到时,可能会增加挫败感和病耻感。
综上所述,病耻感是一个复杂的社会和心理现象,受到多种因素的影响。因此,对于文化程度与肺癌患者病耻感之间的关系,仍需要进一步的研究来支持。此外,无论文化程度如何,肺癌患者都应得到同等的关心和支持。医护人员和社会各界应共同努力,降低患者的病耻感,帮助其更好地应对疾病和康复过程。
3.2.2 长期居住地
本研究结果显示,长期居住在农村的肺癌患者病耻感水平更高,尽管现有学术文献尚未广泛探讨长期居住地对病耻感水平的影响,本研究的结果却在一定程度上与刘瑾等[25]在宫颈癌患者中的研究发现相呼应,该研究发现居住在农村地区的宫颈癌患者普遍经历了更高水平的病耻感。这可能指向了一个更广泛的社会现象,即在农村地区,由于信息闭塞、健康教育资源缺乏以及对疾病认知的偏见,患者更容易受到社会歧视和排斥,从而产生更强的病耻感。具体而言:首先,在某些地区,由于历史、经济和文化等原因,农村居民可能面临更多的地域偏见。这种偏见可能导致肺癌患者感到自己因居住在特定地区而受到歧视,进而增加病耻感;其次,云南农村地区可能面临医疗资源相对匮乏的问题,包括专业医生、先进治疗设备和药物等。农村居民在信息获取方面可能相对受限,包括对肺癌的认知、治疗方法和心理支持等方面的信息。这种信息不对称可能导致患者对疾病产生恐惧和误解,进而增加病耻感;此外,社会支持与经济压力也可能是导致农村地区肺癌患者病耻感水平增加的原因,农村地区由于社区结构和人际关系相对简单,肺癌患者可能难以获得足够的社会支持。这种孤立无援的状态可能让患者感到被排斥和孤立,从而加重病耻感。最后,农村居民通常面临更大的经济压力,包括治疗费用、药品费用以及因患病导致的收入减少等。这种经济压力可能让患者感到无助和绝望,进而增加病耻感。
综上所述,长期居住在云南农村地区的肺癌患者病耻感水平较高,可能受到地域与文化因素、医疗资源与信息获取、社会支持与经济压力以及文化观念与心理因素等多方面的影响。为了降低这些患者的病耻感,需要社会各界共同努力,提高医疗资源的可及性、加强信息传播与沟通、建立完善的社会支持系统以及推动文化观念的转变。
3.2.3 民族
本研究结果显示,除汉族外的其他少数民族肺癌患者病耻感水平高于汉族肺癌患者。分析原因:首先,受文化观念影响,少数民族往往有着独特的文化和信仰,这些文化和信仰可能影响他们对疾病的认知和态度。在某些少数民族文化中,可能存在对疾病的特定看法或禁忌,这可能导致肺癌患者在面对疾病时产生更强的病耻感;其次,受经济压力的影响,一些少数民族聚居地区相对较为偏远,经济发展水平可能较低,居民的经济压力相对较大。面对高昂的治疗费用,少数民族肺癌患者可能更加感到无助和焦虑,从而增加病耻感;此外,语言与沟通障碍也可能是导致少数民族肺癌患者病耻感水平增高的原因,在云南,许多少数民族有自己的语言,这可能导致在医疗沟通、信息获取等方面存在障碍。语言不通可能让患者感到更加孤立和无助,进而加重病耻感;最后,医疗资源不均、社会支持不足与歧视也可能会导致少数民族肺癌患者病耻感水平增高,在一些少数民族地区,由于地理位置偏远、社区结构相对简单,肺癌患者可能难以获得足够的社会支持,同时,由于文化差异和偏见,他们可能面临更多的歧视和排斥,这都会加重患者的病耻感。
综上所述,云南除汉族外的其他少数民族肺癌患者病耻感水平高于汉族肺癌患者的原因可能包括文化差异与信仰、社会经济地位、语言与沟通障碍、医疗资源分配以及社会支持与歧视等多方面因素。为了降低这些患者的病耻感,医护人员需要关注并尊重他们的文化差异和信仰,提高医疗资源的可及性,加强语言沟通与社会支持,并努力消除歧视和偏见。
3.2.4 家庭关系
本研究结果显示,家庭关系越好的肺癌患者病耻感水平越高,与李钰等[26]在乳腺癌患者中的研究结果相一致。从家庭关系的角度探讨肺癌患者的病耻感,是本研究的一个创新点。分析原因:首先,部分患者可能在家庭关系中感受到自己是负担,这反映出大多数患者内心对亲人支持的强烈渴望,家庭关系好的患者,往往对家庭有较强的归属感和责任感。当他们面临肺癌这样重大疾病时,可能会因为无法继续履行家庭责任、满足家庭期望而感到内疚和自责,从而产生更高的病耻感[27]。其次,良好的家庭关系意味着患者与家人之间有着深厚的情感纽带。患者在面对肺癌时,除担心自己的健康状况外,还可能担心自己的疾病给家人带去经济压力及负面情感等方面的负担,这种担忧可能转化为病耻感[28]。此外,家庭支持的反面效应也可能会导致肺癌患者病耻感水平增高,尽管家庭支持对患者来说是一种宝贵的资源,但有时过度的关心和支持可能让患者感到自己成为家庭的负担,进而产生病耻感。特别是在患者无法快速康复或病情反复时,这种感受可能更加强烈。最后,对家庭生活的渴望与现实的落差也可能是导致肺癌患者病耻感水平增加的原因,家庭关系好的患者,在患病前往往享受着幸福的家庭生活。然而,肺癌的诊断和治疗可能打破这种平静,让患者无法再像过去那样参与家庭生活。这种对过去幸福生活的渴望与现实之间的落差,可能让患者产生深深的挫败感和病耻感。
综上所述,家庭关系越好的肺癌患者病耻感水平越高,可能与他们对家庭的期望、责任感、担忧以及家庭支持带来的反面效应和对家庭生活的渴望与现实落差有关。为了降低肺癌患者的病耻感,医疗专业人员应当在提供治疗和护理的同时,关注并缓解患者在社会支持层面所承受的压力。医疗专业人员和家庭成员在肺癌患者的照护中扮演着互补的角色。因此,向患者家属提供关于病耻感的健康教育也至关重要,这不仅能够满足患者对家庭支持的心理需求,而且有助于构建一个支持性更强的家庭环境[29]。
3.3 本研究的局限性
肺癌患者的病耻感处于较高水平。影响肺癌患者病耻感水平的因素有:文化程度、长期居住地、民族及家庭关系。为降低肺癌患者病耻感水平,首先,建议医护人员和社会各界应共同努力,提高医疗资源的可及性、加强信息传播与沟通、建立完善的社会支持系统以及推动文化观念的转变;其次,建议医护人员关注并尊重肺癌患者的文化差异和信仰,加强语言沟通与社会支持,并努力消除歧视和偏见;最后,建议医护人员及肺癌患者的家人给予肺癌患者更多的理解、支持和鼓励,同时帮助他们调整心态、积极面对疾病,从而降低肺癌患者的病耻感水平,促进其身心健康。本研究只选取了一所三级甲等肿瘤专科医院肺癌患者进行横断面调查,样本代表性有待加强。且本研究开展形式为线下纸质问卷调查,虽有通过集中培训等方式进行质量控制,但仍无法保证数据完全真实,可能存在结果偏倚。另外,本研究未及时跟踪调查对象病耻感水平的发展轨迹变化。未来的研究可扩大样本量,在全国范围内开展大样本的肺癌患者病耻感水平调查,或开展纵向研究及质性研究,探究肺癌患者病耻感水平的轨迹变化,以便深入了解癌症患者的内心感受和需求,有助于建立标准化的照护干预方案。
-
-
[1] Ma L,Zhang M,Zhao R,et al. Plant natural products: promising resources for cancer chemoprevention[J]. Molecules (Basel,Switzerland),2021,26(4):933-955. [2] Sonkin D,Thomas A,Teicher B A. Cancer treatments: Past,present,and future[J]. Cancer Genetics,2024,286-287(5):18-24. [3] Guo M,Jin J,Zhao D,et al. Research advances on anti-cancer natural products[J]. Frontiers in Oncology,2022,12(5):866154-866170. [4] Marchesi E,Perrone D,Navacchia M L. Molecular hybridization as a strategy for developing artemisinin-derived anticancer candidates[J]. Pharmaceutics,2023,15(9):2185-2224. [5] Zeng Z W,Chen D,Chen L,et al. A comprehensive overview of Artemisinin and its derivatives as anticancer agents[J]. European Journal of Medicinal Chemistry,2023,247(4):115000-115030. [6] Trimble C L,Levinson K,Maldonado L,et al. A first-in-human proof-of-concept trial of intravaginal artesunate to treat cervical intraepithelial neoplasia 2/3 (CIN2/3)[J]. Gynecologic Oncology,2020,157(1):188-194. [7] Ferrall L,Lin K Y,Roden R B S,et al. Cervical cancer immunotherapy: Facts and hopes[J]. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research,2021,27(18):4953-4973. [8] Dong J,Chen Y,Yang W,et al. Antitumor and anti-angiogenic effects of artemisinin on breast tumor xenografts in nude mice[J]. Research in Veterinary Science,2020,129(2):66-69. [9] Li Y,Zhou X,Liu J,et al. Dihydroartemisinin inhibits the tumorigenesis and metastasis of breast cancer via downregulating CIZ1 expression associated with TGF-β1 signaling[J]. Life Sciences,2020,248(9):117454-117463. [10] Zhang Q,Yi H,Yao H,et al. Artemisinin derivatives inhibit non-small cell lung cancer cells through induction of ROS-dependent apoptosis/ferroptosis[J]. Journal of Cancer,2021,12(13):4075-4085. [11] Zhang Y,Wang Y,Li Y,et al. Dihydroartemisinin and artesunate inhibit aerobic glycolysis via suppressing c-myc signaling in non-small cell lung cancer[J]. Biochemical Pharmacology,2022,198(4):114941-114949. [12] Xiao X,Li Y,Wang Y,et al. Dihydroartemisinin inhibits Lewis Lung carcinoma progression by inducing macrophages M1 polarization via AKT/mTOR pathway[J]. International Immunopharmacology,2022,103(2):108427-108429. [13] Jia J,Qin Y,Zhang L,et al. Artemisinin inhibits gallbladder cancer cell lines through triggering cell cycle arrest and apoptosis[J]. Molecular Medicine Reports,2016,13(5):4461-4468. [14] Kandoth C,McLellan M D,Vandin F,et al. Mutational landscape and significance across 12 major cancer types[J]. Nature,2013,502(7471):333-339. [15] Zielińska K A,Katanaev V L. Information theory: New look at oncogenic signaling pathways[J]. Trends in Cell Biology,2019,29(11):862-875. [16] Tin A S,Sundar S N,Tran K Q,et al. Antiproliferative effects of artemisinin on human breast cancer cells requires the downregulated expression of the E2F1 transcription factor and loss of E2F1-target cell cycle genes[J]. Anti-Cancer Drugs,2012,23(4):370-379. [17] Nandi D,Cheema P S,Singal A,et al. Artemisinin mediates its tumor-suppressive activity in hepatocellular carcinoma through targeted inhibition of FoxM1[J]. Frontiers in Oncology,2021,11(1):751271-751289. [18] Liang R,Chen W,Chen X Y,et al. Dihydroartemisinin inhibits the tumorigenesis and invasion of gastric cancer by regulating STAT1/KDR/MMP9 and P53/BCL2L1/CASP3/7 pathways[J]. Pathology,Research and Practice,2021,218(2):153318-153330. [19] Li Y,Zhou X,Liu J,et al. Dihydroartemisinin inhibits the tumorigenesis and metastasis of breast cancer via downregulating CIZ1 expression associated with TGF-β1 signaling[J]. Life Sciences,2020,248(9):117454-117464. [20] Wu R,Gao Y,Wu J,et al. Semi-synthetic product dihydroartemisinin inhibited fibronectin-1 and integrin-β1 and interfered with the migration of HCCLM6 cells via PI3K-AKT pathway[J]. Biotechnology Letters,2020,42(6):917-926. [21] Zhu X,Yang M,Song Z,et al. Artemether inhibits proliferation,invasion and migration of hepatocellular carcinoma cells via targeting of CYP2J2[J]. Oncology Letters,2022,23(6):180-188. [22] Slezakova S,Ruda-Kucerova J. Anticancer activity of Artemisinin and its derivatives[J]. Anticancer Research,2017,37(11):5995-6003. [23] Willoughby J A,Sundar S N,Cheung M,et al. Artemisinin blocks prostate cancer growth and cell cycle progression by disrupting Sp1 interactions with the cyclin-dependent kinase-4 (CDK4) promoter and inhibiting CDK4 gene expression[J]. Journal of Biological Chemistry,2009,284(4):2203-2213. [24] Ma Q,Liao H,Xu L,et al. Autophagy-dependent cell cycle arrest in esophageal cancer cells exposed to dihydroartemisinin[J]. Chinese Medicine,2020,15(9):37-49. [25] Li B,Bu S,Sun J,et al. Artemisinin derivatives inhibit epithelial ovarian cancer cells via autophagy-mediated cell cycle arrest[J]. Acta Biochimica et Biophysica Sinica,2018,50(12):1227-1235. [26] Greenshields A L,Shepherd T G,Hoskin D W. Contribution of reactive oxygen species to ovarian cancer cell growth arrest and killing by the anti-malarial drug artesunate[J]. Molecular Carcinogenesis,2017,56(1):75-93. [27] Jia J,Qin Y,Zhang L,et al. Artemisinin inhibits gallbladder cancer cell lines through triggering cell cycle arrest and apoptosis[J]. Molecular Medicine Reports,2016,13(5):4461-4468. [28] Xu C,Zhang H,Mu L,et al. Artemisinins as anticancer drugs: Novel therapeutic approaches,molecular mechanisms,and clinical trials[J]. Frontiers in Pharmacology,2020,11(10):529881-529895. [29] Eskandari E,Eaves C J. Paradoxical roles of caspase-3 in regulating cell survival,proliferation,and tumorigenesis[J]. Journal of Cell Biology,2022,221(6):e202201159-e202201172. [30] Efferth T,Rücker G,Falkenberg M,et al. Detection of apoptosis in KG-1a leukemic cells treated with investigational drugs[J]. Arzneimittel Forschung,1996,46(2):196-200. [31] Lang S J,Schmiech M,Hafner S,et al. Antitumor activity of an artemisia annua herbal preparation and identification of active ingredients[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology,2019,62(12):152962-152971. [32] Noori S,Hassan Z M,Farsam V. Artemisinin as a Chinese medicine,selectively induces apoptosis in pancreatic tumor cell line[J]. Chinese Journal of Integrative Medicine,2014,20(8):618-623. [33] Mondal A,Chatterji U. Artemisinin represses telomerase subunits and induces apoptosis in HPV-39 infected human cervical cancer cells[J]. Journal of Cellular Biochemistry,2015,116(9):1968-1981. [34] Pirali M,Taheri M,Zarei S,et al. Artesunate,as a HSP70 ATPase activity inhibitor,induces apoptosis in breast cancer cells[J]. International Journal of Biological Macromolecules,2020,164(5):3369-3375. [35] Cabello C M,Lamore S D,Bair W B,et al. The redox antimalarial dihydroartemisinin targets human metastatic melanoma cells but not primary melanocytes with induction of NOXA-dependent apoptosis[J]. Investigational New Drugs,2012,30(4):1289-1301. [36] Chatterjee R,Shukla A,Chakrabarti K,et al. CLEC12A sensitizes differentially responsive breast cancer cells to the anti-cancer effects of artemisinin by repressing autophagy and inflammation[J]. Frontiers in Oncology,2023,13(12):1242432-1242449. [37] Huang Z,Gan S,Zhuang X,et al. Artesunate inhibits the cell growth in colorectal cancer by promoting ROS-dependent cell senescence and autophagy[J]. Cells,2022,11(16):2472-2492. [38] Zhou X,Chen Y,Wang F,et al. Artesunate induces autophagy dependent apoptosis through upregulating ROS and activating AMPK-mTOR-ULK1 axis in human bladder cancer cells[J]. Chemico-Biological Interactions,2020,331(17):109273-109284. [39] Chen X,He L Y,Lai S,et al. Dihydroartemisinin inhibits the migration of esophageal cancer cells by inducing autophagy[J]. Oncology Letters,2020,20(4):94-102. [40] Zhou Q,Meng Y,Li D,et al. Ferroptosis in cancer: From molecular mechanisms to therapeutic strategies[J]. Signal Transduction and Targeted Therapy,2024,9(1):55-84. [41] Chen F,Fan Y,Hou J,et al. Integrated analysis identifies TfR1 as a prognostic biomarker which correlates with immune infiltration in breast cancer[J]. Aging,2021,13(17):21671-21699. [42] Yuan B,Liao F,Shi Z Z,et al. Dihydroartemisinin inhibits the proliferation,colony formation and induces ferroptosis of lung cancer cells by inhibiting PRIM2/SLC7A11 axis[J]. OncoTargets and Therapy,2020,13(1):10829-10840. [43] Wang Z,Li M,Liu Y,et al. Dihydroartemisinin triggers ferroptosis in primary liver cancer cells by promoting and unfolded protein response‑induced upregulation of CHAC1 expression[J]. Oncology Reports,2021,46(5):240-253. [44] Roh J L,Kim E H,Jang H,et al. Nrf2 inhibition reverses the resistance of cisplatin-resistant head and neck cancer cells to artesunate-induced ferroptosis[J]. Redox Biology,2017,11(1):254-262. [45] Liang L,Liu Y,Wu X,et al. Artesunate induces ferroptosis by inhibiting the nuclear localization of SREBP2 in myeloma cells[J]. International Journal of Medical Sciences,2023,20(12):1535-1550. [46] Hartupee C,Nagalo B M,Chabu C Y,et al. Pancreatic cancer tumor microenvironment is a major therapeutic barrier and target[J]. Frontiers in Immunology,2024,15(2):1287459-1287475. [47] Zhang Q,Sioud M. Tumor-associated macrophage subsets: Shaping polarization and targeting[J]. International Journal of Molecular Sciences,2023,24(8):7493-7524. [48] Yu R,Jin L,Li F,et al. Dihydroartemisinin inhibits melanoma by regulating CTL/treg anti-tumor immunity and STAT3-mediated apoptosis via IL-10 dependent manner[J]. Journal of Dermatological Science,2020,99(3):193-202. [49] Wang C Z,Wan C,Luo Y,et al. Effects of dihydroartemisinin,a metabolite of artemisinin,on colon cancer chemoprevention and adaptive immune regulation[J]. Molecular Biology Reports,2022,49(4):2695-2709. [50] Mancuso R I,Olalla Saad S T,Azambuja J H. Artesunate switches monocytes to an inflammatory phenotype with the ability to kill leukemic cells[J]. International Journal of Molecular Sciences,2021,22(2):608-621. [51] Cao Y,Feng Y H,Gao L W,et al. Artemisinin enhances the anti-tumor immune response in 4T1 breast cancer cells in vitro and in vivo[J]. International Immunopharmacology,2019,70(5):110-116. [52] Li Z,Munim M B,Sharygin D A,et al. Understanding the Warburg effect in cancer[J]. Cold Spring Harbor Perspectives in Medicine,2024,14(9):a041532. [53] Wong Y K,Xu C,Kalesh K A,et al. Artemisinin as an anticancer drug: Recent advances in target profiling and mechanisms of action[J]. Medicinal Research Reviews,2017,37(6):1492-1517. [54] Wang M,Chen H,He X,et al. Artemisinin inhibits the development of esophageal cancer by targeting HIF-1α to reduce glycolysis levels[J]. Journal of Gastrointestinal Oncology,2022,13(5):2144-2153. [55] Peng Q,Hao L,Guo Y,et al. Dihydroartemisinin inhibited the Warburg effect through YAP1/SLC2A1 pathway in hepatocellular carcinoma[J]. Journal of Natural Medicines,2023,77(1):28-40. [56] Ding X,Zhang Y,Liang J,et al. Dihydroartemisinin potentiates VEGFR-TKIs antitumorigenic effect on osteosarcoma by regulating Loxl2/VEGFA expression and lipid metabolism pathway[J]. Journal of Cancer,2023,14(5):809-820. -






 下载:
下载:

 下载:
下载: