Analysis of Risk Factors for Chemotherapy Induced Myelosuppression and Construction of Prediction Models for Myelosuppression Based on Logistic Regression Analysis in Cancer Patients
-
摘要:
目的 恶性肿瘤患者化疗后骨髓抑制发生的相关高危因素,并根据高危因素建立Logistic回归预测模型。 方法 匿名收集昆明医科大学第一附属医院2020-2022年间化疗患者临床信息80人左右,将获取的临床资料应用SpSS19.0软件进行Logistic回归单因素分析,明确化疗后骨髓抑制的相关高危因素;将高危因素纳入Logistic多因素回归分析并建立Logistic回归分析预测模型。另外收集40例左右患者临床信息检验预测模型,获取ROC曲线、AUC值、约登指数等。 结果 经单因素Logistic回归分析,年龄、骨转移、谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清肌酐清除率(CCr)、血清肌酐(Cr)、同期放疗(CRT)、同期免疫治疗(IO)、近期手术等与化疗后骨髓抑制相关;将高危因素纳入多因素Logistic回归分析,建立相应的预测模型,相应模型的ROC曲线AUC值分别为0.745、0.755及0.791;提示当P值大于上述值时发生相应骨髓抑制的风险较高。相应模型的约登指数分别为0.677、0.713、0.769,提示模型预测效能较好。 结论 恶性肿瘤化疗患者的年龄、血肌酐、血清肌酐清除率、肝功能、近期手术、骨转移、同期放疗/免疫治疗等与化疗后骨髓抑制的发生存在相关性;采用我们的预测模型进行计算,当P≥0.745(白细胞)、P≥0.755(血小板)、P≥0.791(贫血)时,发生白细胞、血小板、贫血相关骨髓抑制的风险明显增加(≥95%),建议采用相应的预防措施。 -
关键词:
- 化疗 /
- 骨髓抑制 /
- 高危因素 /
- 预测模型 /
- Logistic回归分析
Abstract:Objective To study the risk factors of myelosuppression after chemotherapy in patients with malignant tumors, and to construct a Logistic regression prediction model based on the risk factors. Methods Clinical information of 80 chemotherapy patients from the First Affiliated Hospital of Kunming Medical University during 2020-2022 was anonymously collected, and the obtained clinical data were used for Logistic regression univariate analysis with the use of SpSS19.0 software to identify the risk factors related to chemotherapy induced myelosuppression. The risk factors were tested in Logistic multi-factor regression analysis and the Logistic regression analysis prediction models were constructed. In addition, clinical information of 40 patients was collected to test the prediction model, then the ROC curve, AUC value and Youden index were obtained. Results Univariate Logistic regression analysis showed that age, bone metastases, alanine aminotransferase (ALT), aspartate aminotransferase (AST), serum creatinine clearance (CCr), serum creatinine (Cr), concurrent radiotherapy (CRT), concurrent immunotherapy (IO), and recent surgery were associated with the bone marrow suppression after the chemotherapy. The AUC values of the ROC curves of the corresponding models were 0.745, 0.755 and 0.791, respectively, indicating that the risk of bone marrow suppression was higher when the p-value was greater than the above values. The Youden indices of the corresponding models were 0.677, 0.713 and 0.769, respectively, indicating that the prediction performance of the model was better. Conclusion Age, serum creatinine clearance, liver function, recent surgery, bone metastasis, concurrent radiotherapy/immunotherapy, and serum creatinine clearance were related to the incidence of chemotherapy induced myelosuppression. When P≥0.745 (leukocytes), P≥0.755 (platelets), and P≥0.791 (anemia) bycalculated from our predictive models, the risk of leukocyte, platelets, and anemia-related myelosuppression are significantly increased (≥95%), and appropriate preventive measures are recommended. -
Key words:
- Chemotherapy /
- Myelosuppression /
- High risk factors /
- Prediction model /
- Logistic regression analysisy
-
化疗的主要不良反应是骨髓抑制,据相关报道,Ⅳ度骨髓抑制患者的死亡率最高可达12%[1]。现临床化疗导致的严重骨髓抑制,多采用事后应用重组人白介素11、重组血小板生成素(thrombopoietin,TPO)、粒细胞集落刺激因子(granulocyte colony-stimulating Factor,G-CSF)、重组人促红细胞生成素(erythropoietin,EPO)等治疗。目前亦有在化疗后预防性应用相关药物以降低骨髓抑制的风险,然而,有研究表明,预防性应用 G-CSF 于化疗前,或许仅对部分高危群体(即骨髓抑制易感人群)的医疗费用有所减少,却可能加重低危群体(即骨髓抑制不易感人群)的经济负担[2]。因此,深入探究骨髓抑制的危险因素,并根据患者的临床症状评判其骨髓抑制发生的风险,是临床医生亟待解决的关键问题之一。
传统观念认为,引发骨髓抑制的关键因素是化疗方案,但即便在高剂量化疗后,仍有 30%~50% 的病人未出现Ⅳ°骨髓抑制, 而使用常规剂量化疗后却有2%~10% 的患者表现出严重粒细胞减少[3-5]。张龙等[6]研究指出,年龄是重度骨髓抑制的主要发生因素[7−8]。郭艳霞等[9]研究表明,化疗后发生骨髓抑制可能的风险因素涵盖:高毒性方案(即联合 2 种及以上具有强烈骨髓抑制副作用的化疗药)、高剂量方案(即至少2种化疗药物剂量均处于较高水平)、体力评分≤60 分、肿瘤侵犯骨或骨髓、化疗前白细胞计数不及正常水平。张昊等则强调,年龄超过60 岁、肿瘤侵犯骨或骨髓、体重指数(BMI)、肿瘤的分期和既往化疗周期数是与骨髓抑制发生最为相关的因素[10-12],但目前学界对此尚未达成共识。
目前国内鲜有关于构建化疗后骨髓抑制风险预测模型的报道。本研究通过收集昆明医科大学第一附属医院肿瘤放疗科近年来收治的癌症化疗患者的一般情况如性别、年龄、有无骨髓或骨转移、肿瘤分期、肝肾功能、有无吸烟史、既往化疗/放疗/免疫治疗、化疗前白细胞是否降低、以及化疗方案等,先进行单因素分析,预测与化疗后骨髓抑制发生可能相关的危险因素。然后采用 Logistic 多因素回归分析建立预测模型并前瞻性验证预测模型的预测效能并绘制ROC曲线。
1. 资料与方法
1.1 病例资料
根据入选标准及排除标准匿名收集昆明医科大学第一附属医院肿瘤放疗科2021年1月至2022年12月收治的化疗患者80例,收集的信息包括但不限于年龄、性别、体力状况评分、身高、体重、肝肾功能、是否有骨转移、是否同期放化疗、是否同期免疫治疗、化疗方案、化疗周期数、化疗前血常规、化疗后21 d内血常规。
纳入标准[13]:年龄18~80岁;有明确的病理诊断确诊为恶性肿瘤;有化疗前血常规、化疗后21 d内血常规;有化疗前肝功能及肾功能数据;ECOG评分0~2分。
排除标准:血液系统肿瘤的(如淋巴瘤、白血病、骨髓瘤);合并其他血液系统疾病可能影响研究结论的,如骨髓增生异常综合征、再生障碍性贫血、特发性血小板减少症等。
1.2 模型验证
另外匿名收集昆明医科大学第一附属医院肿瘤放疗科收治化疗患者30-40例,应用上述模型对骨髓抑制发生情况预测,并追踪患者发生骨髓抑制的实际情况,从而检验模型预测效能,绘制ROC曲线,计算曲线下面积、约登指数等。
1.3 统计学分析
对收集的数据应用SPSS 19.0统计软件进行单因素及多因素Lgistic回归分析,判定与化疗后骨髓抑制发生相关的危险因素,并应用Logistic回归分析建立预测模型。单因素Logistic回归分析以P < 0.1初步筛选相关因素,对初步相关的因素纳入多因素分析进一步分析建立Logistic回归方程及预测模型。
2. 结果
2.1 患者一般资料
根据入选及排除标准,共入选80例患者资料纳入建模组,其中男性45例,女性35例;年龄25~80岁,中位年龄52岁;存在骨转移患者27例非骨转移患者53例;吸烟28例,不吸烟52例;近期手术患者24例,非近期手术患者56例;化疗期间同步免疫治疗患者26例,未同步免疫治疗患者54例;同期放疗33例,非同期放疗47例。
2.2 单因素Logistic回归分析
2.2.1 化疗后白细胞相关骨髓抑制
单因素Logistic回归分析提示年龄(P = 0.03)、骨转移(P = 0.001)、AST(P =
0.0028 )、ALT(P = 0.028)、血清肌酐清除率CCr(P = 0.004)、同期放化疗CRT(P = 0.01)、同期免疫治疗(P = 0.02)、近期手术(P = 0.04)与化疗后白细胞相关骨髓抑制具有相关性,见表1。表 1 化疗后白细胞相关骨髓抑制单因素Logistic回归分析Table 1. Univariate Logistic regression analysis of leukocyte-associated bone marrow suppression after chemotherapy项目 B S.E. WALS df sig exp(B) 性别 −0.102 0.451 0.051 1 0.822 0.903 年龄 0.097 0.027 13.101 1 0.03 1.102 分期 0.111 0.334 0.111 1 0.739 1.118 骨转移 1.835 0.544 11.359 1 0.001 6.263 吸烟 0.442 0.472 0.875 1 0.35 1.556 谷丙转氨酶 0.024 0.017 1.928 1 0.165 1.025 谷草转氨酶 0.077 0.035 4.827 1 0.028 1.08 血肌酐 0.007 0.009 0.538 1 0.725 1.043 肌酐清除率 −0.082 0.019 17.771 1 0.004 0.922 血尿素氮 0.041 0.079 0.263 1 0.608 1.041 同期放化疗 2.17 0.532 16.631 1 0.01 8.755 同期免疫治疗 4.174 1.064 15.389 1 0.02 65 近期手术治疗 3.145 0.792 15.768 1 0.04 23.222 2.2.2 化疗后血小板相关骨髓抑制
单因素Logistic回归分析提示年龄(P = 0.001)、骨转移(P = 0.007)、血清肌酐清除率CCr(P = 0.023)、同期放化疗CRT(P < 0.001)、同期免疫治疗(P = 0.004)、近期手术(P < 0.001)与化疗后血小板相关骨髓抑制具有相关性,见表2。
表 2 化疗后血小板相关骨髓抑制单因素Logistic回归分析Table 2. Univariate Logistic regression analysis of platelet-related bone marrow suppression after chemotherapy项目 B S.E. WALS df sig exp(B) 性别 0.085 0.027 10.353 1 0.001 1.089 年龄 −0.056 0.473 0.014 1 0.906 0.946 分期 0.286 0.357 0.643 1 0.423 1.331 骨转移 1.347 0.502 7.203 1 0.007 3.846 吸烟 0.287 0.487 0.347 1 0.556 1.332 谷丙转氨酶 −0.028 0.021 1.778 1 0.182 0.972 谷草转氨酶 −0.007 0.012 0.361 1 0.548 0.993 血肌酐 0.003 0.006 0.238 1 0.625 1.003 肌酐清除率 −0.035 0.016 5.179 1 0.023 0.965 血尿素氮 −0.047 0.096 0.244 1 0.621 0.954 同期放化疗 2.43 0.672 13.065 1 0 11.364 同期免疫治疗 1.459 0.509 8.22 1 0.004 4.301 近期手术治疗 2.988 0.62 23.188 1 0 19.844 2.2.3 化疗后贫血相关骨髓抑制
单因素Logistic回归分析提示年龄(P = 0.001)、骨转移(P = 0.005)、血肌酐Cr(P = 0.001)、血清肌酐清除率CCr(P < 0.001)、同期免疫治疗(P = 0.002)、近期手术(P = 0.001)与化疗后贫血相关骨髓抑制具有相关性,见表3。
表 3 化疗后贫血相关骨髓抑制单因素Logistic回归分析Table 3. Univariate Logistic regression analysis of anemia-related bone marrow suppression after chemotherapy项目 B S.E. WALS df sig exp(B) 性别 0.084 0.025 11.298 1 0.001 1.088 年龄 0.486 0.454 1.143 1 0.285 1.625 分期 0.287 0.338 0.72 1 0.396 1.332 骨转移 1.447 0.51 8.062 1 0.005 4.25 吸烟 −0.288 0.472 0.372 1 0.542 0.75 谷丙转氨酶 0.002 0.011 0.046 1 0.831 1.002 谷草转氨酶 0.034 0.025 1.903 1 0.168 1.034 血肌酐 0.038 0.011 10.708 1 0.001 1.038 肌酐清除率 −0.078 0.019 17.123 1 0 0.925 血尿素氮 0.203 0.166 1.493 1 0.222 1.225 同期放化疗 0.773 0.466 2.755 1 0.197 2.167 同期免疫治疗 1.609 0.526 9.362 1 0.002 5 近期手术治疗 2.001 0.576 12.055 1 0.001 7.4 2.3 多因素Logistic回归分析
2.3.1 化疗后白细胞相关骨髓抑制
多因素Logistic回归分析提示,同期放化疗(P = 0.047)、同期免疫治疗(P = 0.007)、血清肌酐清除率CCr(P = 0.036)及年龄(P = 0.021)与化疗后白细胞相关骨髓抑制相关,见表4。
表 4 化疗后白细胞相关骨髓抑制多因素Logistic回归分析Table 4. Multivariate logistic regression analysis of leukocyte-associated bone marrow suppression after chemotherapy项目 B S.E. WALS df sig exp(B) 近期手术治疗 1.226 1.233 0.989 1 0.32 3.408 同期放化疗 1.801 0.982 3.359 1 0.047 6.054 同期免疫治疗 3.34 1.246 7.183 1 0.007 28.227 肌酐清除率 −0.046 0.05 0.838 1 0.036 0.955 血肌酐 0.014 0.035 0.17 1 0.681 1.015 谷草转氨酶 0.136 0.081 2.825 1 0.093 1.146 骨转移 0.751 1.042 0.519 1 0.047 2.118 年龄 0.052 0.046 1.263 1 0.021 1.053 常量 −6.356 7.722 0.677 1 0.41 0.002 依据多因素Logistic回归分析建立的化疗后白细胞相关骨髓抑制Logistic回归分析预测模型如下:
$$ {\mathit{p}=\frac{\mathit{e}\mathit{x}\mathit{p}(-6.356+1.226\mathit{*}\mathit{s}\mathit{u}\mathit{r}\mathit{g}\mathit{e}\mathit{r}\mathit{y}+3.34\mathit{*}\mathit{I}\mathit{O}+1.801\mathit{*}\mathit{C}\mathit{R}\mathit{T}-0.046\mathit{*}\mathit{C}\mathit{C}\mathit{r}+0.014\mathit{*}\mathit{C}\mathit{r}+0.136\mathit{*}\mathit{A}\mathit{S}\mathit{T}+0.751\mathit{*}\mathit{B}\mathit{o}\mathit{n}\mathit{e}\mathit{m}\mathit{e}\mathit{t}\mathit{a}+0.052\mathit{*}\mathit{a}\mathit{g}\mathit{e})}{1+\mathit{e}\mathit{x}\mathit{p}(-6.356+1.226\mathit{*}\mathit{s}\mathit{u}\mathit{r}\mathit{g}\mathit{e}\mathit{r}\mathit{y}+3.34\mathit{*}\mathit{I}\mathit{O}+1.801\mathit{*}\mathit{C}\mathit{R}\mathit{T}-0.046\mathit{*}\mathit{C}\mathit{C}\mathit{r}+0.014\mathit{*}\mathit{C}\mathit{r}+0.136\mathit{*}\mathit{A}\mathit{S}\mathit{T}+0.751\mathit{*}\mathit{B}\mathit{o}\mathit{n}\mathit{e}\mathit{m}\mathit{e}\mathit{t}\mathit{a}+0.052\mathit{*}\mathit{a}\mathit{g}\mathit{e})} 。} $$ (注:surgery、IO、CRT、bonemeta取1或0,分别表示有或无;CCr的单位为mL/min;Cr的单位为μmoL/L;AST单位为u/L;年龄单位为岁)
2.3.2 化疗后血小板相关骨髓抑制
多因素Logistic回归分析提示,同期放化疗(P = 0.037)、血清肌酐清除率CCr(P = 0.046)及近期手术化疗(P = 0.004)与化疗后血小板相关骨髓抑制相关,见表5。
表 5 化疗后血小板相关骨髓抑制多因素Logistic回归分析Table 5. Multivariate logistic regression analysis of platelet-related bone marrow suppression after chemotherapy项目 B S.E. WALS df sig exp(B) 近期手术治疗 2.121 0.745 8.097 1 0.004 8.338 同期免疫治疗 −0.008 0.748 0 1 0.992 0.992 同期放化疗 1.632 0.781 4.369 1 0.037 5.114 肌酐清除率 0.004 0.023 0.034 1 0.044 1.004 骨转移 0.727 0.667 1.191 1 0.275 2.069 年龄 0.032 0.033 0.906 1 0.341 1.032 常量 −4.751 2.772 2.939 1 0.086 0.009 依据多因素Logistic回归分析建立的化疗后血小板相关骨髓抑制Logistic回归分析预测模型如下:
$$ \mathit{p}=\frac{\mathit{e}\mathit{x}\mathit{p}(-4.751+2.121\mathit{*}\mathit{s}\mathit{u}\mathit{r}\mathit{g}\mathit{e}\mathit{r}\mathit{y}-0.008\mathit{*}\mathit{I}\mathit{O}+1.632\mathit{*}\mathit{C}\mathit{R}\mathit{T}+0.004\mathit{*}\mathit{C}\mathit{C}\mathit{r}+0.727\mathit{*}\mathit{B}\mathit{o}\mathit{n}\mathit{e}\mathit{m}\mathit{e}\mathit{t}\mathit{a}+0.032\mathit{*}\mathit{a}\mathit{g}\mathit{e})}{1+\mathit{e}\mathit{x}\mathit{p}(-4.751+2.121\mathit{*}\mathit{s}\mathit{u}\mathit{r}\mathit{g}\mathit{e}\mathit{r}\mathit{y}-0.008\mathit{*}\mathit{I}\mathit{O}+1.632\mathit{*}\mathit{C}\mathit{R}\mathit{T}+0.004\mathit{*}\mathit{C}\mathit{C}\mathit{r}+0.727\mathit{*}\mathit{B}\mathit{o}\mathit{n}\mathit{e}\mathit{m}\mathit{e}\mathit{t}\mathit{a}+0.032\mathit{*}\mathit{a}\mathit{g}\mathit{e})} 。 $$ (注:surgery、IO、CRT、bonemeta取1或0,分别表示有或无;CCr的单位为mL/min;年龄单位为岁)
2.3.3 化疗后贫血相关骨髓抑制:
多因素Logistic回归分析提示,血清肌酐清除率CCr(P = 0.043)、年龄(P = 0.013)及骨转移(P = 0.049)与化疗后贫血相关骨髓抑制相关,见表6。
表 6 化疗后贫血相关骨髓抑制多因素Logistic回归分析Table 6. Multivariate logistic regression analysis of anemia-associated myelosuppression after chemotherapy项目 B S.E. WALS df sig exp(B) 近期手术治疗 0.542 0.74 0.538 1 0.463 1.72 同期免疫治疗 0.14 0.703 0.039 1 0.843 1.15 肌酐清除率 −0.061 0.03 4.094 1 0.043 0.941 血肌酐 0.004 0.015 0.09 1 0.764 1.004 骨转移 1.251 0.689 3.295 1 0.049 3.495 年龄 0.039 0.028 2.041 1 0.013 1.04 常量 1.214 3.636 0.111 1 0.738 3.367 依据多因素Logistic回归分析建立的化疗后贫血相关骨髓抑制Logistic回归分析预测模型如下:依据多因素Logistic回归分析建立的化疗后白细胞相关骨髓抑制Logistic回归分析预测模型如下:
$$ \mathit{p}=\frac{\mathit{e}\mathit{x}\mathit{p}(1.214+0.542\mathit{*}\mathit{s}\mathit{u}\mathit{r}\mathit{g}\mathit{e}\mathit{r}\mathit{y}+0.14\mathit{*}\mathit{I}\mathit{O}-0.061\mathit{*}\mathit{C}\mathit{C}\mathit{r}+0.004\mathit{*}\mathit{C}\mathit{r}+1.251\mathit{*}\mathit{B}\mathit{o}\mathit{n}\mathit{e}\mathit{m}\mathit{e}\mathit{t}\mathit{a}+0.039\mathit{*}\mathit{a}\mathit{g}\mathit{e})}{1+\mathit{e}\mathit{x}\mathit{p}(1.214+0.542\mathit{*}\mathit{s}\mathit{u}\mathit{r}\mathit{g}\mathit{e}\mathit{r}\mathit{y}+0.14\mathit{*}\mathit{I}\mathit{O}-0.061\mathit{*}\mathit{C}\mathit{C}\mathit{r}+0.004\mathit{*}\mathit{C}\mathit{r}+1.251\mathit{*}\mathit{B}\mathit{o}\mathit{n}\mathit{e}\mathit{m}\mathit{e}\mathit{t}\mathit{a}+0.039\mathit{*}\mathit{a}\mathit{g}\mathit{e})} 。 $$ (注:surgery、IO、CRT、bonemeta取1或0,分别表示有或无;CCr的单位为mL/min;Cr的单位为μmol/L;年龄单位为岁)
2.4 ROC曲线及AUC值
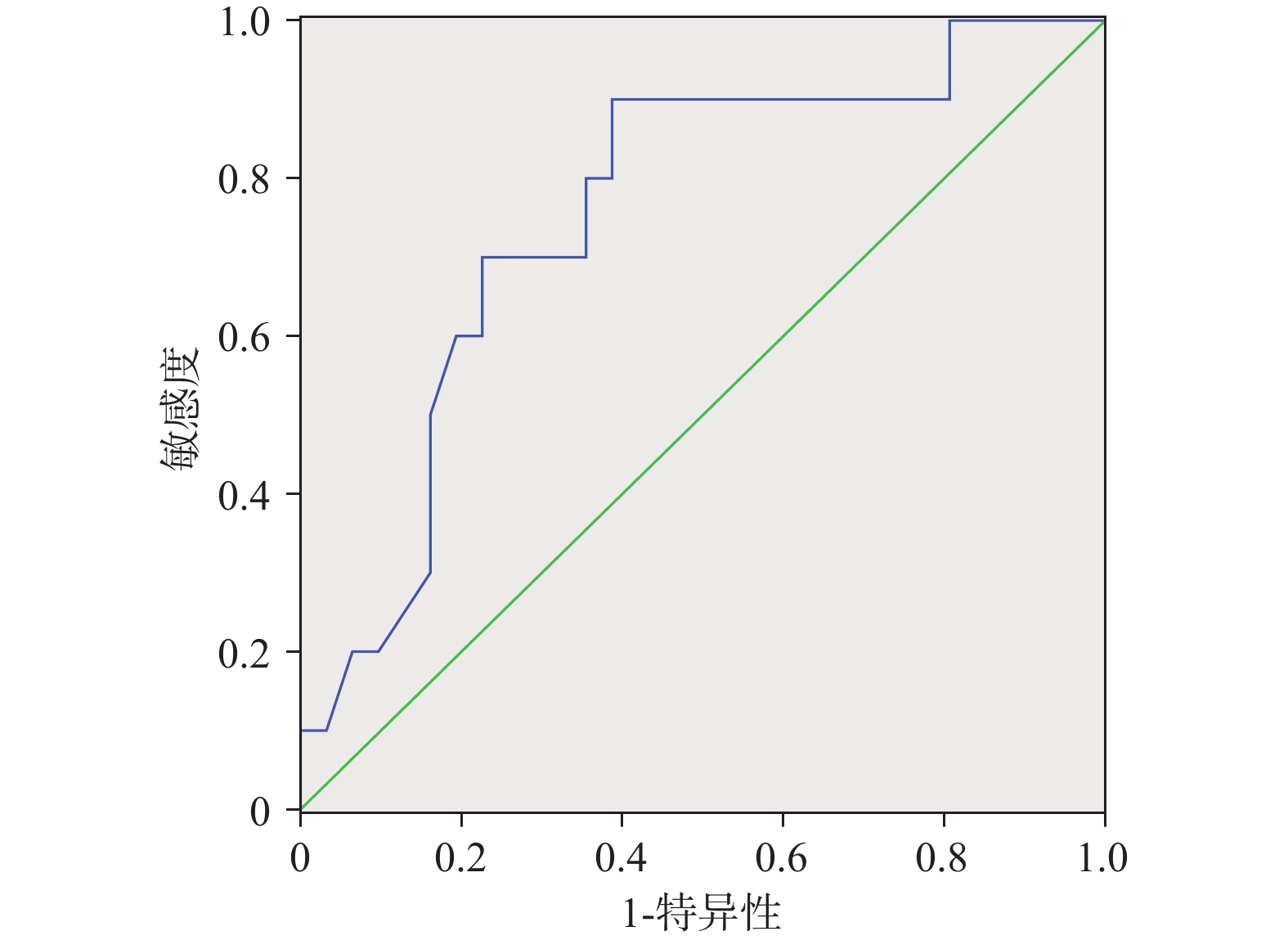
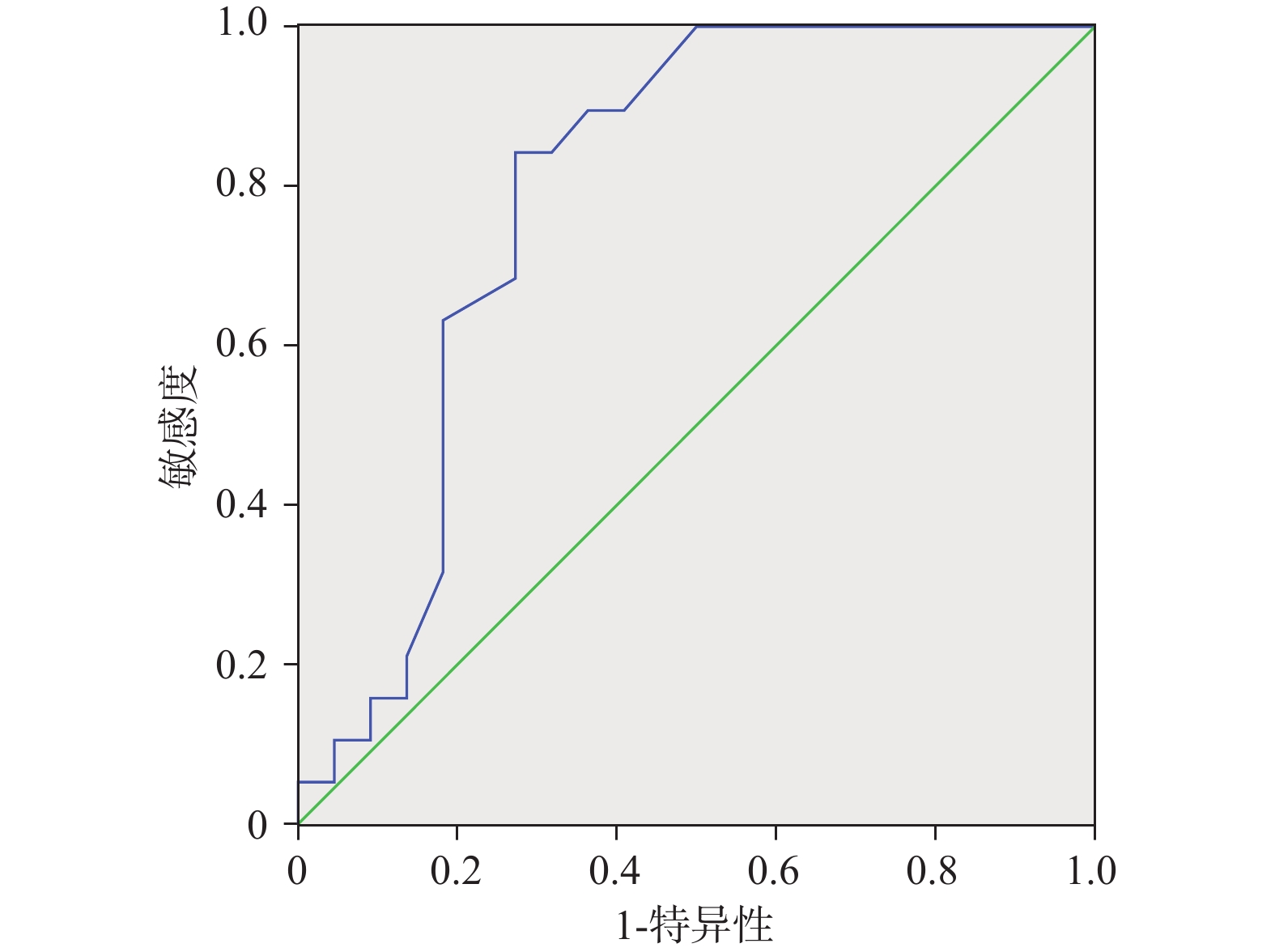
另外匿名收集41例患者上述临床数据,并将临床数据代入上述方程计算骨髓抑制发生概率P值,与临床骨髓抑制发生情况进行对比验证,分别绘制相应的ROC曲线,并计算曲线下面积AUC值、约登指数如下,见图2−4、表7。
表 7 预测模型的预测效能Table 7. Predictive performance of the prediction model项目 面积 标准误 渐进 Sig 95% 置信区间 约登指数 下限 上限 白细胞 0.745 0.081 0.021 0.587 0.903 0.677 血小板 0.755 0.086 0.016 0.586 0.924 0.713 血红蛋白 0.791 0.074 0.001 0.645 0.936 0.769 3. 讨论
恶性肿瘤患者最常面临的一种剂量限制性毒性即为骨髓抑制,其发生会导致患者治疗周期延长、治疗费用增加、治疗延迟,严重的骨髓抑制包括粒细胞缺乏、血小板缺乏及重度贫血可以导致患者出现感染、出血、贫血甚至危及生命[14−16]。故而,精准预测恶性肿瘤患者化疗后骨髓抑制的风险及严重程度,对于恶性肿瘤化疗的患者减少并发症、降低死亡率、降低治疗成本等具有重要意义。当前,国内外指南及专家共识均倡导采取事前预防+事后治疗的模式。《中国临床肿瘤学会(chinese society of clinical oncology,CSCO)肿瘤化疗相关中性粒细胞减少症规范化管理指南(2021)》依据患者的不同临床特征,将化疗患者区分为一级及二级预防两类[17],仅仅针对粒细胞减少进行相应的预防及治疗措施,且该共识仅将患者根据高危因素如化疗方案、年龄、肝肾功能等进行大体分类进行预防处理,并不能进行个体化评分进行评估,存在一定偏倚,可能导致过度预防增加患者的经济负担。因此,采用预测模型对化疗患者骨髓抑制风险进行精准评分来指导临床预防及治疗具有重要意义。
在本研究中,采用Logistic回归分析对80例患者的临床资料进行单因素及多因素分析,发现患者年龄、血肌酐、血清肌酐清除率、肝功能、近期手术、骨转移、同期放疗/免疫治疗等与化疗后骨髓抑制的发生存在相关性。进一步的分析后建立了白细胞、血小板、贫血等相关骨髓抑制的预测模型的Logistic回归方程,根据方程可以计算每一位患者发生白细胞、血小板、贫血相关骨髓抑制风险的概率P值,通过41例患者的临床资料对模型的预测效能进行检验,当P≥0.745(白细胞)、P≥0.755(血小板)、P≥0.791(贫血)时,发生白细胞、血小板、贫血相关骨髓抑制的风险明显增加(≥95%),建议采用相应的预防措施降低治疗后骨髓抑制的风险。相应预测模型的约登指数分别为0.677、0.713、0.769,预测效能较好。国内外也有部分学者采用不同的模型来预测化疗相关骨髓抑制。Friberg LE等[18]通过药代动力学-药效学模型,能较好的预测化疗相关骨髓抑制;Li M等[19]建立了一项基于机器学习的儿童肾母细胞瘤化疗相关骨髓抑制的极限梯度预测模型,对于2级及以上骨髓抑制预测具有较好的预测性能和稳定性;Dong 等[20]采用随机森林算法构建肺癌化疗患者骨髓抑制辅助评分模型,其敏感性和特异性分别为84.00%和81.40%。上述研究构建的模型均针对特殊瘤种,而本预测模型则适用于所有瘤种,应用更为广泛。
然而,本研究仍然存在一定局限。首先,采用的是单中心回顾性分析,这可能导致结果存在一定的选择性偏倚;其次我们的研究中,样本量仍然偏少,导致模型的约登指数仍偏低,对于模型的训练及建立存在一定误差。基于以上原因,对于我们的模型推广应用建议结合患者的其他临床资料谨慎评估。在后续的研究中,我们将继续扩大样本量、增加分中心等措施完善预测模型,力争为临床提供更为精准的指导建议。尽管存在上述不足,笔者的模型在现阶段仍然具有一定的临床指导意义,值得进一步推广应用。
恶性肿瘤化疗患者的年龄、血肌酐、血清肌酐清除率、肝功能、近期手术、骨转移、同期放疗/免疫治疗等与化疗后骨髓抑制的发生存在相关性;采用本预测模型进行计算,当P≥0.745(白细胞)、P≥0.755(血小板)、P≥0.791(贫血)时,发生白细胞、血小板、贫血相关骨髓抑制的风险明显增加(≥95%),建议采用相应的预防措施。
-
表 1 化疗后白细胞相关骨髓抑制单因素Logistic回归分析
Table 1. Univariate Logistic regression analysis of leukocyte-associated bone marrow suppression after chemotherapy
项目 B S.E. WALS df sig exp(B) 性别 −0.102 0.451 0.051 1 0.822 0.903 年龄 0.097 0.027 13.101 1 0.03 1.102 分期 0.111 0.334 0.111 1 0.739 1.118 骨转移 1.835 0.544 11.359 1 0.001 6.263 吸烟 0.442 0.472 0.875 1 0.35 1.556 谷丙转氨酶 0.024 0.017 1.928 1 0.165 1.025 谷草转氨酶 0.077 0.035 4.827 1 0.028 1.08 血肌酐 0.007 0.009 0.538 1 0.725 1.043 肌酐清除率 −0.082 0.019 17.771 1 0.004 0.922 血尿素氮 0.041 0.079 0.263 1 0.608 1.041 同期放化疗 2.17 0.532 16.631 1 0.01 8.755 同期免疫治疗 4.174 1.064 15.389 1 0.02 65 近期手术治疗 3.145 0.792 15.768 1 0.04 23.222 表 2 化疗后血小板相关骨髓抑制单因素Logistic回归分析
Table 2. Univariate Logistic regression analysis of platelet-related bone marrow suppression after chemotherapy
项目 B S.E. WALS df sig exp(B) 性别 0.085 0.027 10.353 1 0.001 1.089 年龄 −0.056 0.473 0.014 1 0.906 0.946 分期 0.286 0.357 0.643 1 0.423 1.331 骨转移 1.347 0.502 7.203 1 0.007 3.846 吸烟 0.287 0.487 0.347 1 0.556 1.332 谷丙转氨酶 −0.028 0.021 1.778 1 0.182 0.972 谷草转氨酶 −0.007 0.012 0.361 1 0.548 0.993 血肌酐 0.003 0.006 0.238 1 0.625 1.003 肌酐清除率 −0.035 0.016 5.179 1 0.023 0.965 血尿素氮 −0.047 0.096 0.244 1 0.621 0.954 同期放化疗 2.43 0.672 13.065 1 0 11.364 同期免疫治疗 1.459 0.509 8.22 1 0.004 4.301 近期手术治疗 2.988 0.62 23.188 1 0 19.844 表 3 化疗后贫血相关骨髓抑制单因素Logistic回归分析
Table 3. Univariate Logistic regression analysis of anemia-related bone marrow suppression after chemotherapy
项目 B S.E. WALS df sig exp(B) 性别 0.084 0.025 11.298 1 0.001 1.088 年龄 0.486 0.454 1.143 1 0.285 1.625 分期 0.287 0.338 0.72 1 0.396 1.332 骨转移 1.447 0.51 8.062 1 0.005 4.25 吸烟 −0.288 0.472 0.372 1 0.542 0.75 谷丙转氨酶 0.002 0.011 0.046 1 0.831 1.002 谷草转氨酶 0.034 0.025 1.903 1 0.168 1.034 血肌酐 0.038 0.011 10.708 1 0.001 1.038 肌酐清除率 −0.078 0.019 17.123 1 0 0.925 血尿素氮 0.203 0.166 1.493 1 0.222 1.225 同期放化疗 0.773 0.466 2.755 1 0.197 2.167 同期免疫治疗 1.609 0.526 9.362 1 0.002 5 近期手术治疗 2.001 0.576 12.055 1 0.001 7.4 表 4 化疗后白细胞相关骨髓抑制多因素Logistic回归分析
Table 4. Multivariate logistic regression analysis of leukocyte-associated bone marrow suppression after chemotherapy
项目 B S.E. WALS df sig exp(B) 近期手术治疗 1.226 1.233 0.989 1 0.32 3.408 同期放化疗 1.801 0.982 3.359 1 0.047 6.054 同期免疫治疗 3.34 1.246 7.183 1 0.007 28.227 肌酐清除率 −0.046 0.05 0.838 1 0.036 0.955 血肌酐 0.014 0.035 0.17 1 0.681 1.015 谷草转氨酶 0.136 0.081 2.825 1 0.093 1.146 骨转移 0.751 1.042 0.519 1 0.047 2.118 年龄 0.052 0.046 1.263 1 0.021 1.053 常量 −6.356 7.722 0.677 1 0.41 0.002 表 5 化疗后血小板相关骨髓抑制多因素Logistic回归分析
Table 5. Multivariate logistic regression analysis of platelet-related bone marrow suppression after chemotherapy
项目 B S.E. WALS df sig exp(B) 近期手术治疗 2.121 0.745 8.097 1 0.004 8.338 同期免疫治疗 −0.008 0.748 0 1 0.992 0.992 同期放化疗 1.632 0.781 4.369 1 0.037 5.114 肌酐清除率 0.004 0.023 0.034 1 0.044 1.004 骨转移 0.727 0.667 1.191 1 0.275 2.069 年龄 0.032 0.033 0.906 1 0.341 1.032 常量 −4.751 2.772 2.939 1 0.086 0.009 表 6 化疗后贫血相关骨髓抑制多因素Logistic回归分析
Table 6. Multivariate logistic regression analysis of anemia-associated myelosuppression after chemotherapy
项目 B S.E. WALS df sig exp(B) 近期手术治疗 0.542 0.74 0.538 1 0.463 1.72 同期免疫治疗 0.14 0.703 0.039 1 0.843 1.15 肌酐清除率 −0.061 0.03 4.094 1 0.043 0.941 血肌酐 0.004 0.015 0.09 1 0.764 1.004 骨转移 1.251 0.689 3.295 1 0.049 3.495 年龄 0.039 0.028 2.041 1 0.013 1.04 常量 1.214 3.636 0.111 1 0.738 3.367 表 7 预测模型的预测效能
Table 7. Predictive performance of the prediction model
项目 面积 标准误 渐进 Sig 95% 置信区间 约登指数 下限 上限 白细胞 0.745 0.081 0.021 0.587 0.903 0.677 血小板 0.755 0.086 0.016 0.586 0.924 0.713 血红蛋白 0.791 0.074 0.001 0.645 0.936 0.769 -
[1] 白建红. 不同时机营养干预对Ⅳ度骨髓抑制肿瘤患者的影响分析[J]. 临床研究,2019,27(4):19-20. [2] Zhang Q L,Wu T T,Han Y,et al. Chemotherapy-induced myelosuppression in esophageal cancer patients: Risks and suggestions for its management[J]. Curr Med Sci,2022,42(3):530-537. doi: 10.1007/s11596-022-2587-3 [3] Boccia R,Glaspy J,Crawford J,Aapro M. Chemotherapy-induced neutropenia and febrile neutropenia in the US: A beast of burden that needs to be tamed?[J]Oncologist,2022,27(1): 625-636. [4] 高艳,江启安,李敬国,等. 实体瘤化疗引起Ⅳ度骨髓抑制的临床分析[J]. 现代肿瘤医学,2019,27(1):111-116 [5] Lyman G_H,Abella E,pettengell R. Risk factors for febrile neutropenia among patients with cancer receiving chemotherapy: A systematic review[J]. Crit Rev Oncol Hematol,2014,90(3):190-199. doi: 10.1016/j.critrevonc.2013.12.006 [6] 张龙. 乳腺癌术后化疗诱发重度骨髓抑制相关影响因素探讨[J]. 中外医研究,2014,12(26):42-43. [7] 庄晓明,刘莉冬. 早期乳腺癌保乳手术的疗效观察[J]. 中国医学创新,2013,10(7):121-122. [8] 郑建晓. 归脾汤防治乳腺癌术后辅助化疗骨髓抑制的临床观察[J]. 亚太传统医药,2011,7(7):139-140. [9] 郭艳霞,于成宝,刘秋菊. 化疗后骨髓抑制预测性模型的建立[J]. 吉林医学,2005,12(26):1257-1258. [10] 辛志泳,陈超爽,许鹏,等. 高龄晚期结肠癌患者术后化疗影响预后的因素分析[J]. 实用癌症杂志,2018,33(2):311-313. [11] 徐世林,卢冰,苏胜发,等. Ⅳ期非小细胞肺癌化疗同期胸部三维适形放疗基于常规血液学指标建立的预后评分模型探讨[J]. 川北医学院学报,2019,34(4):329-334. [12] Wang X F,Huang W F,Nie J,et al. Toxicity of chemotherapy regimens in advanced and metastatic pancreatic cancer therapy: A network meta-analysis[J]. J Cell Biochem,2018,119(7):5082-5103. doi: 10.1002/jcb.26266 [13] 朱蓓琳,骨肿瘤化疗致骨髓抑制的风险因素分析及药学监护模式探索[D]. 上海: 上海交通大学,2020. [14] Li R,Zhang T,Yan S_H,et al. Chinese medicine combined with adjuvant chemotherapy for improving myelosuppression in colorectal cancer patients: A systematic review and network meta-analysis[J]. Chin J Integr Med,2024,30(7):643-652. doi: 10.1007/s11655-023-3558-7 [15] Epstein R S,Weerasinghe R K,parrish A S,et al. Real-world burden of chemotherapy-induced myelosuppression in patients with small cell lung cancer: A retrospective analysis of electronic medical data from community cancer care providers[J]. J Med Econ,2022,25(1):108-118. doi: 10.1080/13696998.2021.2020570 [16] Hart L,Ogbonnaya A,Boykin K,et al. Burden of chemotherapy-induced myelosuppression among patients with extensive-stage small cell lung cancer: A retrospective study from community oncology practices[J]. Cancer Med.,2023,12(8):10020-10030. doi: 10.1002/cam4.5738 [17] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)肿瘤化疗相关中性粒细胞减少症规范化管理指南(2021)[J]. 临床肿瘤学杂志,2021,26(7):638-648. doi: 10.3969/j.issn.1009-0460.2021.07.011 [18] Friberg L E,Henningsson A,Maas H,et al. Model of chemotherapy-induced myelosuppression with parameter consistency across drugs[J]. J Clin Oncol,2002,20(24):4713-21. doi: 10.1200/JCO.2002.02.140 [19] Li M,Wang Q,Lu P,et al. Development of a machine learning-based prediction model for chemotherapy-induced myelosuppression in children with wilms' tumor[J]. Cancers(Basel),2023,15(4):1078. [20] Dong Y,Hu C,Liu J,et al. Construction of an auxiliary scoring model for myelosuppression in patients with lung cancer chemotherapy based on random forest algorithm[J]. Am J Transl Res,2023,15(6):4155-4163. -






 下载:
下载:

 下载:
下载:

