CD147 Mediates Cervical Cancer Cell Pyroptosis and Proliferation through AIM2 Inflammasome
-
摘要:
目的 探讨跨膜蛋白CD147表达量变化对AIM2炎症小体介导的宫颈癌细胞焦亡及增殖的影响。 方法 采用Western blot 实验检测 CD147 在宫颈癌细胞 SiHa(HPV+)、C33a(HPV-) 和正常宫颈上皮细胞 H8(HPV+) 、HCer Epic(HPV-)中的表达水平;通过慢病毒转染 SiHa细胞下调CD147的表达,根据不同处理分为SiHa组、阴性对照组(shCD147-NON)、敲低组1(shCD147-1)和敲低组2(shCD147-2),通过Western blot、RT-qPCR和观察细胞绿色荧光表达验证转染效果;通过Western blot 和 RT-qPCR 检测CD147和AIM2炎症小体相关因子 AIM2、Caspase-1、IL-18、GSDMD蛋白和 mRNA 的表达;检测细胞培养上清中乳酸脱氢酶(LDH) 释放度,荧光倒置显微镜下观察细胞的形态;CCK-8 实验检测细胞的增殖能力;细胞克隆实验检测细胞集落形成能力。 结果 Western blot 结果显示,与 HCerEpic细胞比较,SiHa 细胞中 CD147 蛋白表达最高(P < 0.05) ; CD147低表达慢病毒有效下调了SiHa细胞 CD147表达水平(P < 0.05);Western blot 及 RT-qPCR实验结果表明,与SiHa组相比, shCD147-1 组和 shCD147-2 组AIM2、Caspase-1、IL-18、GSDMD蛋白和 mRNA 表达明显升高(P < 0.05);乳酸脱氢酶(LDH)释放实验显示,与SiHa组相比,shCD147组LDH释放度明显升高(P < 0.05);荧光倒置显微镜下显示,shCD147组出现肿胀和空泡化,表现出典型的细胞焦亡现象;与SiHa组相比,shCD147-1组和shCD147-2组细胞增殖能力和集落形成能力明显降低(P < 0.05)。 结论 CD147低表达有效上调宫颈癌 SiHa 细胞AIM2炎症相关因子的表达,诱发细胞焦亡,抑制细胞的增殖和克隆。 Abstract:Objective To investigate the effect of transmembrane protein CD147 expression on AIM2 inflammasome-mediated pyroptosis and proliferation of cervical cancer cells. Methods Western Blot was used to detect the expression of CD147 in cervical cancer cell lines SiHa(HPV+) and C33a(HPV-) and normal cervical epithelial cells H8(HPV+) and HCer Epic(HPV-). SiHa cells were transfected with lentivirus to down-regulate the expression of CD147. According to the different treatments, SiHa cells were divided into SiHa group, negative control group(shCD147-NON), knockdown group 1(shCD147-1) and knockdown group 2(shCD147-2). The transfection effect was verified by Western Blot, RT-qPCR and green fluorescence expression. The protein and mRNA expressions of AIM2, Caspase-1, IL-18 and GSDMD were detected by Western Blot and RT-qPCR. The lactate dehydrogenase(LDH) release was measured in the cell culture supernatant, and the cell morphology was observed under the fluorescence inverted microscope; the proliferation ability of cells was measured by CCK-8 and the colony formation ability was measured by cell cloning experiments. Results Western Blot results showed that CD147 protein expression in SiHa cells was the highest compared with that in HCerEpic cells. CD147 low expression lentivirus effectively down-regulated the expression of CD147 in SiHa cells. The results of Western Blot and RT-qPCR experiments showed that the expression of AIM 2, Caspase-1, IL-18, GSDMD protein and mRNA increased in shCD147-1 and shCD147-2 group(P < 0.05). Lactate dehydrogenase(LDH) release assay showed that compared with the SiHa group, the shCD147 group had a significant increase in LDH release(P < 0.05). Fluorescence inverted microscope showed that the shCD147 group had swelling and vacuolization, showing typical pyroptosis. Compared with the SiHa group, the shCD147-1 and shCD147-2 groups had significantly reduced the cell proliferation and colony formation ability(P < 0.05). Conclusion Low expression of CD147 effectively up-regulates the expression of AIM2 inflammation-related factors in cervical cancer SiHa cells, induces the pyroptosis, and inhibits the cell proliferation and cloning. -
Key words:
- Cervical cancer /
- CD147 /
- AIM2inflammasome /
- Pyroptosis /
- Proliferation
-
宫颈癌(cervical cancer ,CC)仍然是目前女性在生殖系统中最常见的恶性肿瘤之一,同时是女性第四大癌症死亡病因,虽然人乳头瘤病毒(human papillomavirus,HPV)疫苗已经问世,对宫颈癌的有效防治也提供了新机遇,但目前宫颈癌的发病人群仍日趋年轻化,2020年全球约有34.2万死亡病例和60.4万新发病例[1],这意味着宫颈癌仍然是一个重大的世界公共卫生问题。
细胞外基质金属蛋白酶诱导因子(cluster of differentiation 147 ,CD147)是原发性肿瘤中最常见的表达蛋白之一,它是一种高度糖基化的I型跨膜蛋白,属于免疫球蛋白超家族( immunoglobulin superfamily ,IgSF)成员,在促进肿瘤细胞上皮转化、炎症发生、细胞增殖、加速肿瘤细胞糖酵解、调节肿瘤细胞自噬等方面有着重要作用[2-3]。炎症小体是由细胞质中的模式识别受体组装的多蛋白复合体,可介导炎症和焦亡的发生[4]。焦亡是一种程序性细胞死亡方式,也是一种由炎症小体介导的炎症细胞死亡[5-6] 。炎症小体黑色素瘤缺乏因子2(absent in melanome 2,AIM2)是介导细胞焦亡的关键上游起始蛋白,是免疫系统的一种非特异性受体因子,属于经典炎症小体家族[7]。研究表明AIM2炎症小体在细菌感染、自身免疫性疾病及肿瘤的发生和发展中有重要作用[8]。CD147在多种恶性肿瘤中均表达升高,本课题组前期实验结果证明,与正常宫颈细胞相比CD147 在宫颈癌细胞中的表达显著升高[9],但CD147对肿瘤的作用是否与炎症小体有关,尚未见相关研究 。本研究以SiHa宫颈癌细胞为研究对象,探究CD147对宫颈癌的作用机制是否与AIM2炎症通路调控焦亡有关,为宫颈癌发病机制及新靶点的治疗研究提供思路。
1. 材料与方法
1.1 细胞与主要试剂
人宫颈癌细胞SiHa细胞株购于武汉普诺赛公司,CD147-siRNA慢病毒由吉凯公司构建。Trizol试剂、乳酸脱氢酶释放检测试剂盒、RIPA组织细胞裂解液均购自塞维尔生物科技有限公司抗体 CD147(Ab217319)购自美国Abcam公司,AIM2(sc-515514)购自美国Santa Cruz公司,caspase-1(22915-1-AP)、 IL-18(60070-1-lg)、GSDMD(20770-1-AP)、GAPDH(60004-1-lg)购自三鹰生物技术有限公司,DMEM 培养基购于普诺赛公司;逆转录和荧光定量试剂盒均购买于TaKaRa公司。
1.2 实验方法
1.2.1 细胞培养与处理
宫颈癌SiHa细胞培养于 DMEM(10%胎牛血清+1%青链霉素双抗)培养基中,在37 ℃、5%CO2细胞培养箱内培养。慢病毒转染前,在6孔板中种100000个细胞,并按照吉凯公司的说明书进行转染。根据慢病毒不同干扰序列,将实验分组为SiHa组、阴性对照组(shCD147-NON)、敲低组1(shCD147-1)和敲低组2(shCD147-2)。荧光倒置显微镜下观察各组细胞感染状况,以绿色荧光蛋白表示细胞感染率。
1.2.2 实时荧光定量PCR实验
选取状态良好的细胞提RNA,按照试剂盒(Takara生物科技公司)说明书方法对内参(GAPDH)及目的基因(CD147、AIM2、Caspase-1、IL-18、GSDMD)进行反转录合成cDNA、PCR扩增及逆转录。统计相应基因CT值,运用2-ΔΔCT的计算公式计算mRNA的相对表达量。本研究中所涉及的PCR引物,见表1。
表 1 RT-qPCR检测基因的引物序列Table 1. Primer sequences of genes detected by RT-qPCR基因 引物序列 CD147 F-TGTTCGTGCTGCTGGGATTCG
R-GAGCCAAGGTCTTCTACGGTAGTGAIM2 F-TATCGGCACAGTGGTTTCTTAGAGG
R-GGGCTGAGTTTGAAGCGTGTTGCaspase-1 F-CCCACATCCTCAGGCTCAGAAG
R-TGCGGCTTGACTTGTCCATTATTGIL-18 F-TGGCTGCTGAACCAGTAGAAGAC
R-GAGGCCGATTTCCTTGGTCAATGGSDMD F-CCAGAAGAAGACGGTCACCATCC
R-TGGAACGCTTGTGGCCTGTCGAPDH F-TGCACCACCAACTGCTTAGC
R-GGCATGGACTGTGGTCATGAG1.2.3 Western blot实验
收集处理后的SiHa细胞裂解蛋白,检测 CD147、AIM2、Caspase-1、IL-18、GSDMD的蛋白相对表达量,将提取后的蛋白进行上样、电泳、电转、5%脱脂牛奶封闭1 h、TBST洗膜3次、一抗 4 ℃孵育16 h,TBST洗膜3次,二抗杂交1.5 h,再次TBST洗膜3次后加上化学发光剂(ECL)显色,上机检测。抗体稀释如下:CD147(1∶10000) 、AIM2(1∶5000)、Caspase-1(1∶1500)、IL- 18(1∶5000)、GSDMD(1∶5000)、GAPDH(1∶8000)。
1.2.4 平板克隆实验
以1000个/孔的密度将各组细胞接种在6孔板中培养,继续培养2周,观察细胞集落形成的大小和数量,PBS洗涤3遍、固定后染液染色,并采集各组细胞集落图像。
1.2.5 CCK-8实验
细胞接种到96孔板,每孔2000个细胞,每组6个复孔。培养12、24、36、48 h后,将20 µL CCK-8试剂避光加入每孔200 µL培养基中。3 h后,在450 nm处用酶标仪测定吸光度值。
1.2.6 乳酸脱氢酶(LDH)释放实验
先收集细胞到离心管内离心,8000 g 4 ℃离心10 min,弃上清,超声波破碎细胞。根据乳酸脱氢酶活性检测试剂盒的说明书制备样品和标准品,并将制备好的样品转移到 96 孔板中,使用酶标仪检测 450 nm 波长下的吸光度值,计算乳酸脱氢酶活性。
1.2.7 细胞焦亡形态学观察
细胞培养皿置于荧光倒置显微镜的载物台上,分别观测SiHa细胞和对照组细胞形态变化,拍照记录,荧光倒置显微镜下观察细胞的形态学变化。
1.3 统计学处理
采用GraphPad Prism 9.0 软件进行统计分析。组间多重比较统计分析使用LSD-t法;组间统计学分析使用单因素方差分析;2组间统计学分析使用t检验进行统计分析,P < 0.05 为差异有统计学意义。
2. 结果
2.1 CD147在宫颈癌细胞中的表达水平及慢病毒转染效率的测定
Western blot检测 CD147在宫颈癌细胞 SiHa (HPV+)、C33a(HPV-) 和正常宫颈上皮细胞 H8(HPV+)、HCerEpic(HPV-)中的表达水平,结果显示:蛋白CD147在HPV阳性细胞中表达水平高于HPV阴性细胞,且在宫颈癌SiHa细胞中表达水平最高(F = 975.2,P < 0.0001),见图1A,故选取SiHa细胞进行CD147低表达慢病毒的转染。RT-qPCR和Western blot实验检测 SiHa组、shCD147-NON组、shCD147-1 组和shCD147-2组细胞中CD147 mRNA和蛋白的表达情况,RT-qPCR实验结果显示,与SiHa组相比,shCD147-1 组和shCD147-2 组 CD147 mRNA表达均显著降低(F = 240.4,P < 0.0001),见图1B。Western blot检测结果与RT-qPCR结果一致(F = 457.1,P < 0.0001),见图1C。荧光倒置显微镜下观察可见细胞中多含有绿色荧光,提示CD147慢病毒转染成功,见图1D。结果表明CD147在宫颈癌细胞中的高表达且慢病毒介导的CD147低表达载体构建成功。
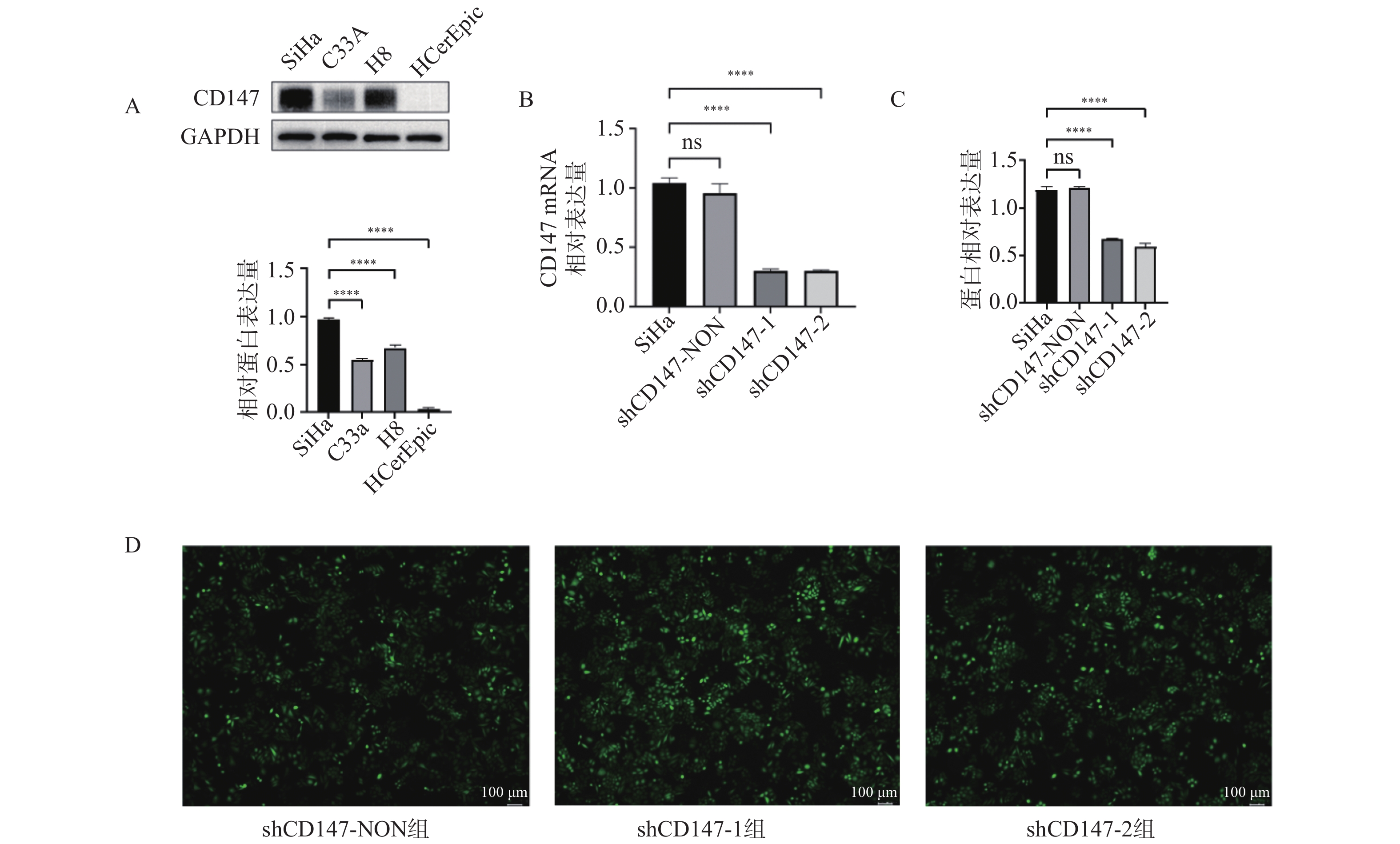 图 1 检测 CD147在宫颈癌细胞中的表达水平及慢病毒转染效率A:CD147蛋白在宫颈癌及正常宫颈上皮细胞中的相对表达量;B:转染慢病毒后CD147的 mRNA 的表达情况;C:转染慢病毒后CD147蛋白的相对表达量;D:慢病毒转染CD147细胞后绿色荧光表达情况 ( 标尺为100 μm);ns:差异无统计学意义;****P < 0.0001。Figure 1. The expression level of CD147 in cervical cancer cells and the transfection efficiency of lentivirus were detected
图 1 检测 CD147在宫颈癌细胞中的表达水平及慢病毒转染效率A:CD147蛋白在宫颈癌及正常宫颈上皮细胞中的相对表达量;B:转染慢病毒后CD147的 mRNA 的表达情况;C:转染慢病毒后CD147蛋白的相对表达量;D:慢病毒转染CD147细胞后绿色荧光表达情况 ( 标尺为100 μm);ns:差异无统计学意义;****P < 0.0001。Figure 1. The expression level of CD147 in cervical cancer cells and the transfection efficiency of lentivirus were detected2.2 下调CD147对AIM2炎症小体信号通路的影响
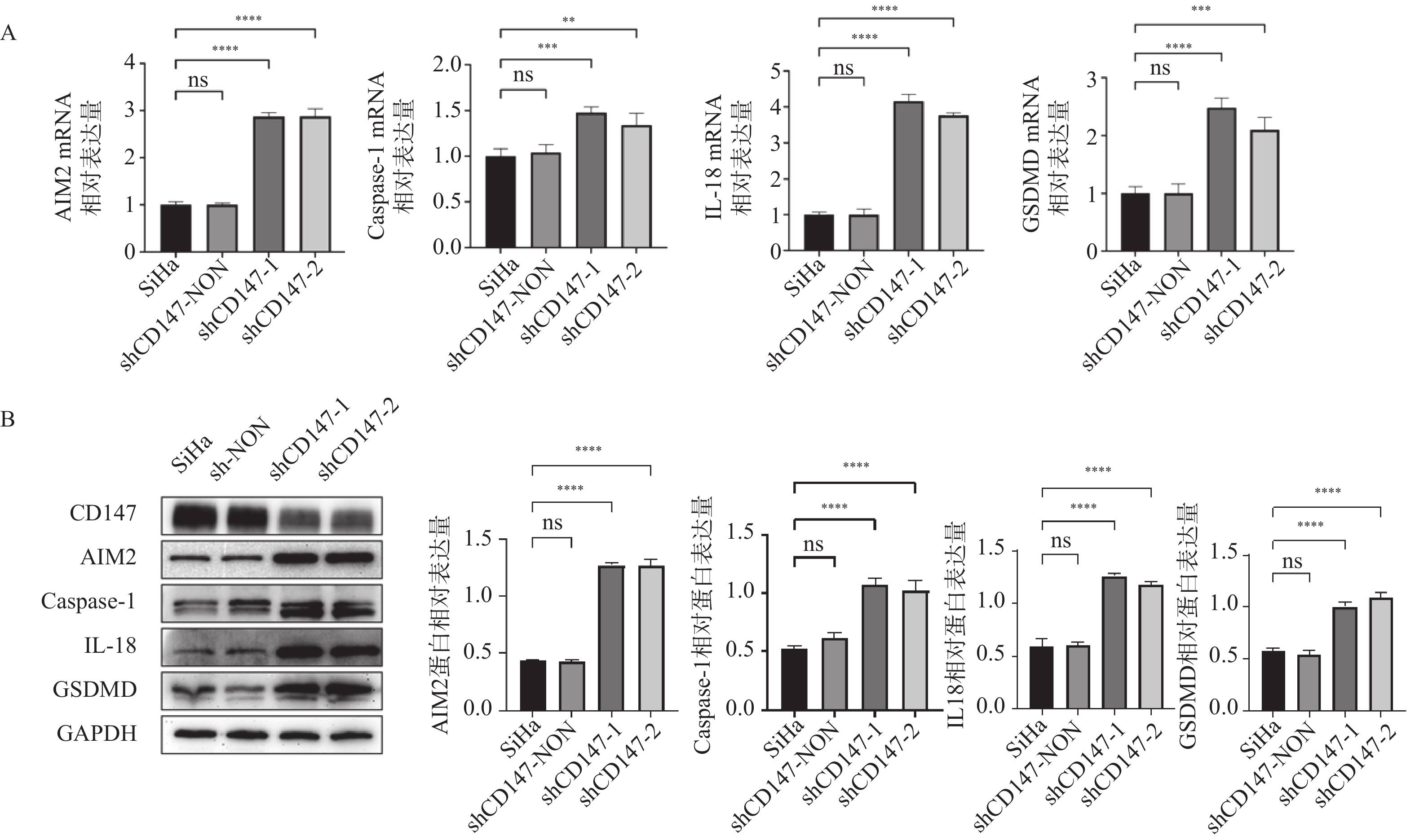
RT-qPCR和Western blot实验检测AIM2炎症小体相关因子的mRNA及蛋白的表达。RT-qPCR结果显示,与SiHa组相比,shCD147-1 组和 shCD147-2 组细胞中AIM2(F = 363.3,P < 0.0001)、Caspase-1(F = 18.47,P < 0.0001)、IL-18(F = 476.1,P < 0.0001)、GSDMD(F = 59.35,P < 0.0001)表达升高,见图2A。Western blot检测结果显示,与SiHa组相比,shCD147-1 组和 shCD147-2 组细胞中AIM2(F = 580.2,P < 0.0001)、Caspase-1(F = 66.67,P < 0.0001)、IL-18(F = 210.9,P < 0.0001)、GSDMD(F = 124.0,P < 0.0001)表达升高,见图2B,结果提示下调CD147可激活AIM2炎症小体信号通路。
2.3 下调CD147对宫颈癌细胞焦亡的影响
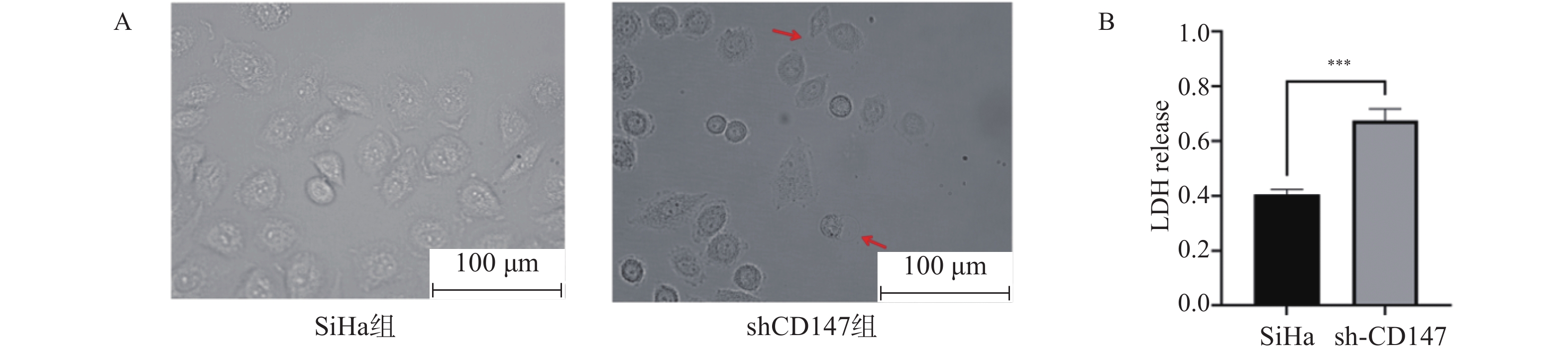
荧光倒置显微镜下观察细胞的形态,与SiHa组相比,shCD147组出现细胞焦亡典型形态,主要表现为细胞明显的肿胀和空泡化的现象,见图3A,且乳酸脱氢酶(LDH)释放度明显升高(t = 11.13,P < 0.001),见图3B。结果提示下调CD147可促进细胞焦亡的发生。
2.4 下调CD147对宫颈癌细胞增殖克隆能力的影响
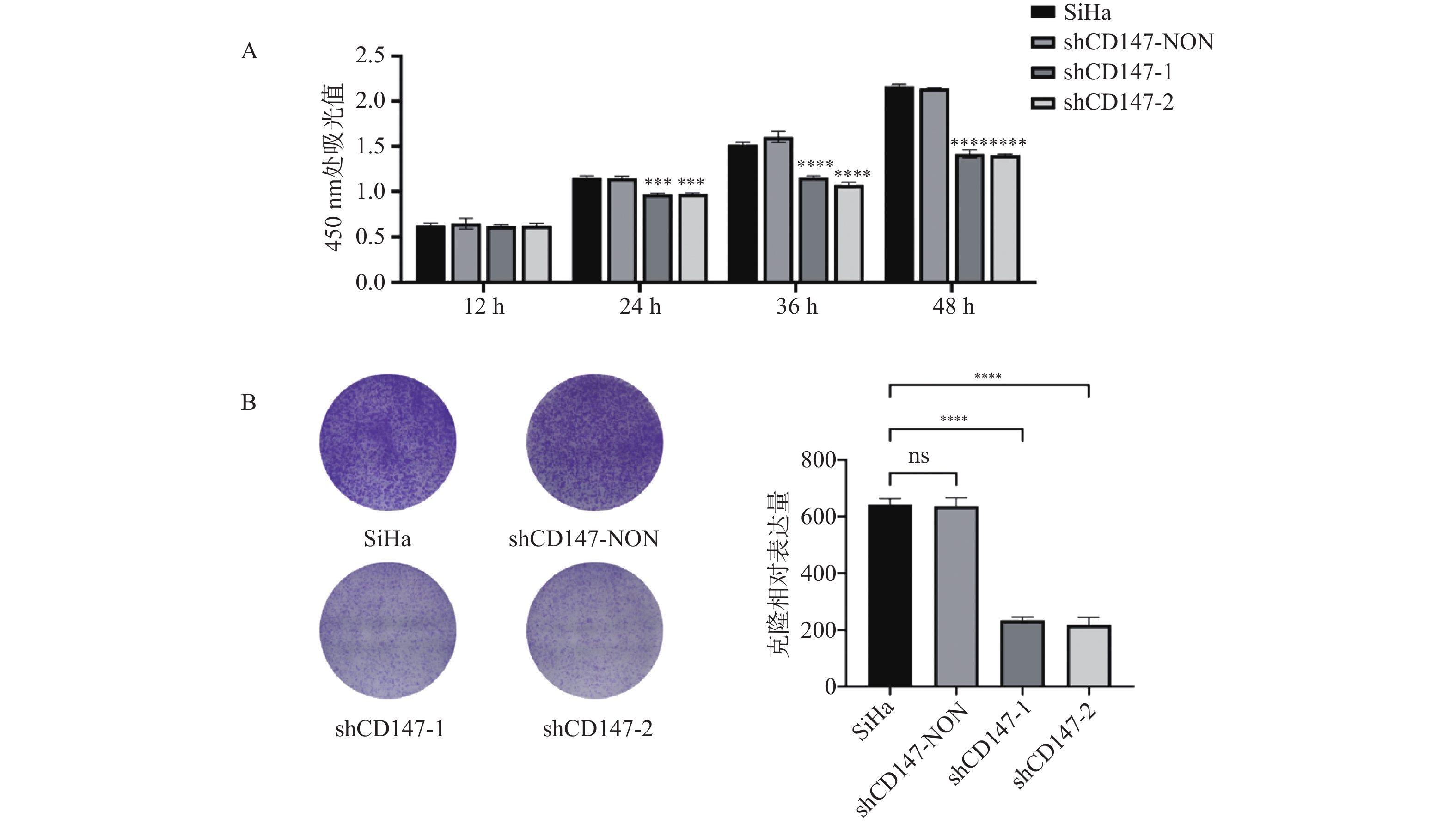
CCK-8实验结果表明,与SiHa组相比,shCD147-1 组和 shCD147-2 组细胞增殖能力减弱(24 h:F = 105.9,P < 0.0001;36 h:F = 2847,P < 0.0001;48 h:F = 489.2,P < 0.0001),见图4A。平板克隆实验结果表明,与SiHa组相比,shCD147-1 组和 shCD147-2 组细胞集落形成能力显著降低(F = 309.0,P < 0.0001),见图4B。结果提示下调CD147表达可抑制SiHa细胞的增殖克隆能力。
3. 讨论
细胞焦亡在肿瘤发生发展中具有促进或抑制的双重作用。一方面,细胞焦亡引起的长期炎症反应有利于肿瘤细胞生长微环境的构建,促进正常细胞向肿瘤细胞的转化,帮助肿瘤细胞实现免疫逃逸,加快肿瘤的发生发展;另一方面,作为促炎性细胞死亡方式之一,细胞焦亡激活后通过促进肿瘤细胞发生焦亡,进而发挥对肿瘤细胞的杀伤作用。CD147作为免疫球蛋白超家族中的一个重要成员[10],因其诱导邻近成纤维细胞或肿瘤细胞产生基质金属蛋白酶(matrix metalloproteinase,MMPs),促进肿瘤细胞迁移和侵袭,又被命名为细胞外基质金属蛋白酶诱导剂(extracellular matrix metalloproteinase inducer,EMMPRIN),越来越多的证据表明,CD147 在正常组织或细胞中表达降低,而在多种肿瘤中表达升高,包括肝癌、黑色素瘤、肺癌等[11]。目前对于晚期宫颈癌患者并没有较好的解决方案,而炎症常常与癌症的发生密切相关,宫颈炎就是宫颈癌发生和发展重要病因之一,因此炎症是癌症预防和治疗的一个重要策略。CD147与多种炎症性疾病具有相关性,包括类风湿性关节炎、多发性硬化、间质性肺炎、系统性红斑狼疮等,CD147可能参与这些炎性疾病反应的调节。近年来随着国内外学者的进一步研究,炎症小体在调节肿瘤的发生、生长、侵袭和转移中发挥着重要作用[12]。AIM2炎症小体是炎症小体家族的重要一员,AIM2炎症小体可作为一种细胞质传感器来识别外来双链DNA,其通过细胞外囊泡进行细胞间的传播[13]。当AIM2炎症小体受到病原体信号刺激后,其复合体中的Caspase-1被进一步激活释放促炎细胞因子,诱导细胞发生焦亡[14]。细胞焦亡是一种由消皮素介导的细胞程序性死亡形式,它是细胞不断扩增,直到细胞膜破裂导致细胞内容物释放,从而激活强烈的炎症和免疫反应[15],细胞焦亡可由多种影响因素激活炎性小体而触发[16]。宫颈癌与炎症之间的机制非常复杂,尚不完全清楚,需要进一步阐明,为其靶向治疗提供方向和思路。
本研究通过Western blot 实验发现CD147在宫颈癌细胞中高表达,且在HPV阳性的细胞中表达相对较高,在HPV阴性的细胞中表达相对较低,提示 CD147 的表达与 HPV 病毒感染有关,有研究发现CD147分子在HIV-1宿主细胞上高表达,抑制CD147发挥可拮抗HIV-1感染宿主细胞的作用[17],说明CD147和病毒感染有相关性。过去普遍认为肿瘤细胞的死亡方式是凋亡,而凋亡的机制一直是研究的热点。然而越来越多的证据表明,肿瘤细胞的死亡方式是多样化的,程序性坏死可分为细胞凋亡、细胞焦亡及铁死亡等[18]。CD147不仅可以通过凋亡,还可通过自噬、铁死亡等方式影响肿瘤的发生[19]。研究发现CD147作用机制与激活Caspase酶有关,沉默CD147后,Caspase-3表达升高,从而使细胞进入凋亡阶段[20]。本研究采用 shRNA 技术沉默其表达后,通过RT-qPCR和Western blot实验发现,下调 CD147后,AIM2炎症相关因子AIM2、Caspase-1、IL-18、GSDMD明显上调,荧光倒置显微镜下观察到下调 CD147细胞出现典型的细胞焦亡形态,且乳酸脱氢酶(LDH)释放度明显升高,证明CD147诱导细胞死亡可能通过AIM2炎症小体途径来实现,也说明CD147诱导细胞死亡是多通路的。本研究通过CCK-8和平板克隆实验发现下调CD147表达后,实验组细胞增殖能力、集落形成能力显著降低,与曹勋荣等研究结果相一致[21]。
综上所述,本研究发现CD147在宫颈癌细胞中呈高表达趋势,下调CD147可通过介导AIM2炎症小体诱发细胞焦亡,抑制宫颈癌SiHa细胞增殖克隆,进而抑制肿瘤的发生发展。CD147 的表达量与HPV病毒感染有关,但其具体机制尚不完全明确,需进一步研究,本课题组后续将进一步分析CD147与HPV的相关性及之间的具体分子机制,为宫颈癌机制及新靶点的治疗研究提供了新思路。
-
图 1 检测 CD147在宫颈癌细胞中的表达水平及慢病毒转染效率
A:CD147蛋白在宫颈癌及正常宫颈上皮细胞中的相对表达量;B:转染慢病毒后CD147的 mRNA 的表达情况;C:转染慢病毒后CD147蛋白的相对表达量;D:慢病毒转染CD147细胞后绿色荧光表达情况 ( 标尺为100 μm);ns:差异无统计学意义;****P < 0.0001。
Figure 1. The expression level of CD147 in cervical cancer cells and the transfection efficiency of lentivirus were detected
表 1 RT-qPCR检测基因的引物序列
Table 1. Primer sequences of genes detected by RT-qPCR
基因 引物序列 CD147 F-TGTTCGTGCTGCTGGGATTCG
R-GAGCCAAGGTCTTCTACGGTAGTGAIM2 F-TATCGGCACAGTGGTTTCTTAGAGG
R-GGGCTGAGTTTGAAGCGTGTTGCaspase-1 F-CCCACATCCTCAGGCTCAGAAG
R-TGCGGCTTGACTTGTCCATTATTGIL-18 F-TGGCTGCTGAACCAGTAGAAGAC
R-GAGGCCGATTTCCTTGGTCAATGGSDMD F-CCAGAAGAAGACGGTCACCATCC
R-TGGAACGCTTGTGGCCTGTCGAPDH F-TGCACCACCAACTGCTTAGC
R-GGCATGGACTGTGGTCATGAG -
[1] Sung H,Ferlay J,Siegel R L,et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660 [2] Kendrick A A,Schafer J,Dzieciatkowska M,et al. Cd147: A small molecule transporter ancillary protein at the crossroad of multiple hallmarks of cancer and metabolic reprogramming[J]. Oncotarget,2017,8(4):6742-6762. doi: 10.18632/oncotarget.14272 [3] Dana P,Kariya R,Vaeteewoottacharn K,et al. Upregulation of cd147 promotes metastasis of cholangiocarcinoma by modulating the epithelial-to-mesenchymal transitional process[J]. Oncol Res,2017,25(7):1047-1059. doi: 10.3727/096504016X14813899000565 [4] Schroder K,Tschopp J. The inflammasomes[J]. Cell,2010,140(6):821-832. doi: 10.1016/j.cell.2010.01.040 [5] Shi J,Gao W,Shao F. Pyroptosis: Gasdermin-mediated programmed necrotic cell death[J]. Trends Biochem Sci,2017,42(4):245-254. doi: 10.1016/j.tibs.2016.10.004 [6] Rao Z,Zhu Y,Yang P,et al. Pyroptosis in inflammatory diseases and cancer[J]. Theranostics,2022,12(9):4310-4329. doi: 10.7150/thno.71086 [7] Kumari P,Russo A J,Shivcharan S,et al. Aim2 in health and disease: Inflammasome and beyond[J]. Immunol Rev,2020,297(1):83-95. doi: 10.1111/imr.12903 [8] Fidler T P,Xue C,Yalcinkaya M,et al. The aim2 inflammasome exacerbates atherosclerosis in clonal haematopoiesis[J]. Nature,2021,592(7853):296-301. doi: 10.1038/s41586-021-03341-5 [9] 郭文涛. Cd147调控srebps影响宫颈癌细胞脂肪酸合成及侵袭迁移能力的实验研究[D]. 乌鲁木齐: 新疆医科大学硕士学位论文, 2020. [10] Lee C L,Lam M P,Lam K K,et al. Identification of cd147 (basigin) as a mediator of trophoblast functions[J]. Hum Reprod,2013,28(11):2920-2929. doi: 10.1093/humrep/det355 [11] Yang H,Chen B. Cd147 in ovarian and other cancers[J]. Int J Gynecol Cancer,2013,23(1):2-8. doi: 10.1097/IGC.0b013e3182749139 [12] Poli G,Fabi C,Bellet M M,et al. Epigenetic mechanisms of inflammasome regulation[J]. Int J Mol Sci,2020,21(16):5758. doi: 10.3390/ijms21165758 [13] Wang L,Sun L,Byrd K M,et al. Aim2 inflammasome's first decade of discovery: Focus on oral diseases[J]. Front Immunol,2020,11(8):1487. [14] Lee S,Karki R,Wang Y,et al. Aim2 forms a complex with pyrin and zbp1 to drive panoptosis and host defence[J]. Nature,2021,597(7876):415-419. doi: 10.1038/s41586-021-03875-8 [15] Du T,Gao J,Li P,et al. Pyroptosis,metabolism,and tumor immune microenvironment[J]. Clin Transl Med,2021,11(8):e492. doi: 10.1002/ctm2.492 [16] Yu P,Zhang X,Liu N,et al. Pyroptosis: Mechanisms and diseases[J]. Signal Transduct Target Ther,2021,6(1):128. doi: 10.1038/s41392-021-00507-5 [17] Pushkarsky T,Zybarth G,Dubrovsky L,et al. Cd147 facilitates hiv-1 infection by interacting with virus-associated cyclophilin A[J]. Proc Natl Acad Sci USA,2001,98(11):6360-6365. doi: 10.1073/pnas.111583198 [18] Majno G,Joris I. Apoptosis,oncosis,and necrosis. An overview of cell death[J]. Am J Pathol,1995,146(1):3-15. [19] Butera A,Quaranta M T,Crippa L,et al. Cd147 targeting by ac-73 induces autophagy and reduces intestinal fibrosis associated with tnbs chronic colitis[J]. J Crohns Colitis,2022,16(11):1751-1761. doi: 10.1093/ecco-jcc/jjac084 [20] Kulyar M F,Yao W,Ding Y,et al. Cluster of differentiation 147 (cd147) expression is linked with thiram induced chondrocyte's apoptosis via bcl-2/bax/caspase-3 signalling in tibial growth plate under chlorogenic acid repercussion[J]. Ecotoxicol Environ Saf,2021,213(4):112059. [21] 曹勋荣,吕桂雪,魏雯雯. Rna干扰抑制cd147表达对宫颈癌细胞增殖、转移和侵袭能力的影响[J]. 中国免疫学杂志,2023,39(2):349-353,358. doi: 10.3969/j.issn.1000-484X.2023.02.023 -






 下载:
下载:
 下载:
下载:

