Scutellarin Ameliorates Liver Fibrosis in Nonalcoholic Fatty Liver Disease by Inhibiting NOX Expression
-
摘要:
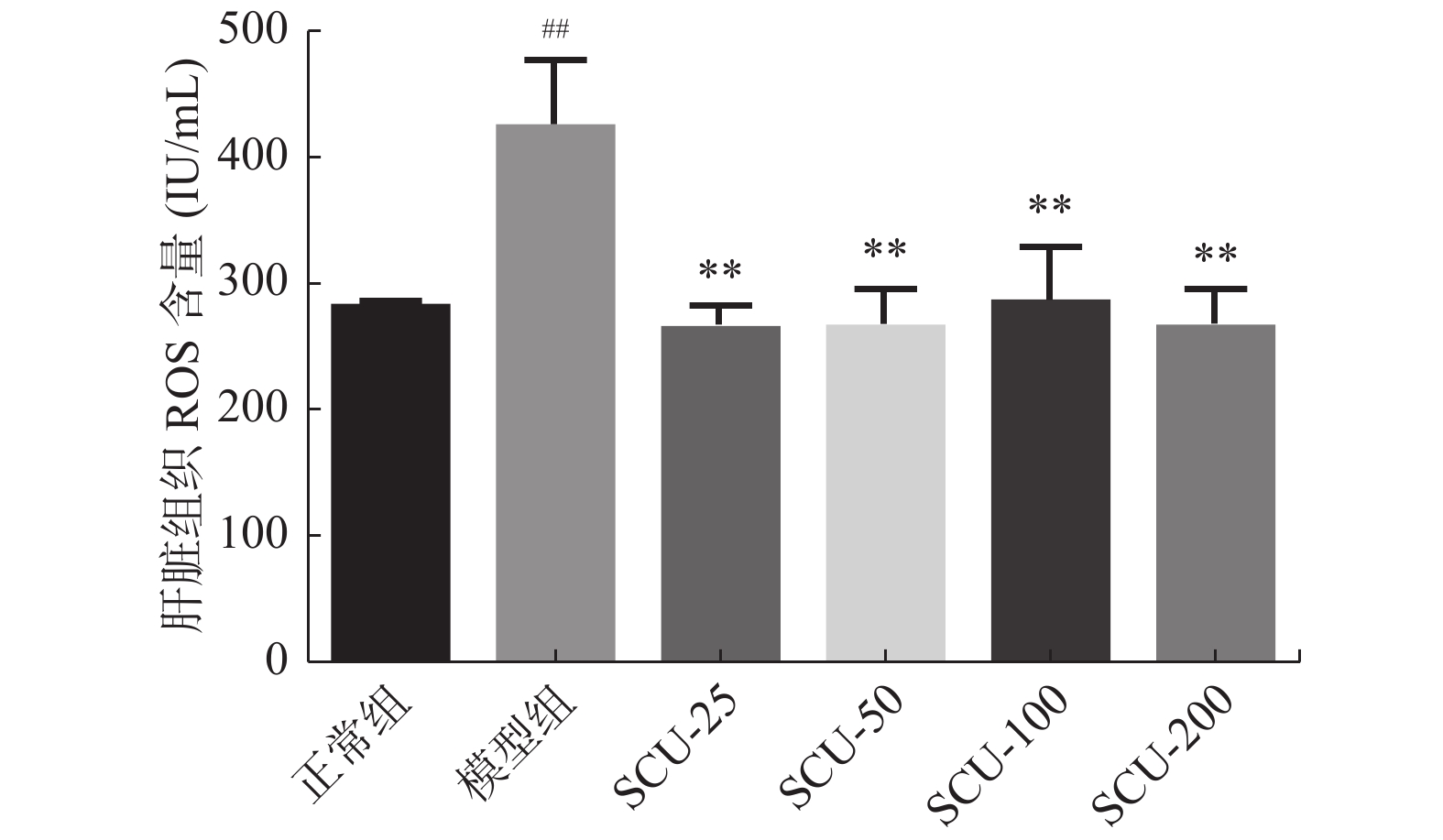
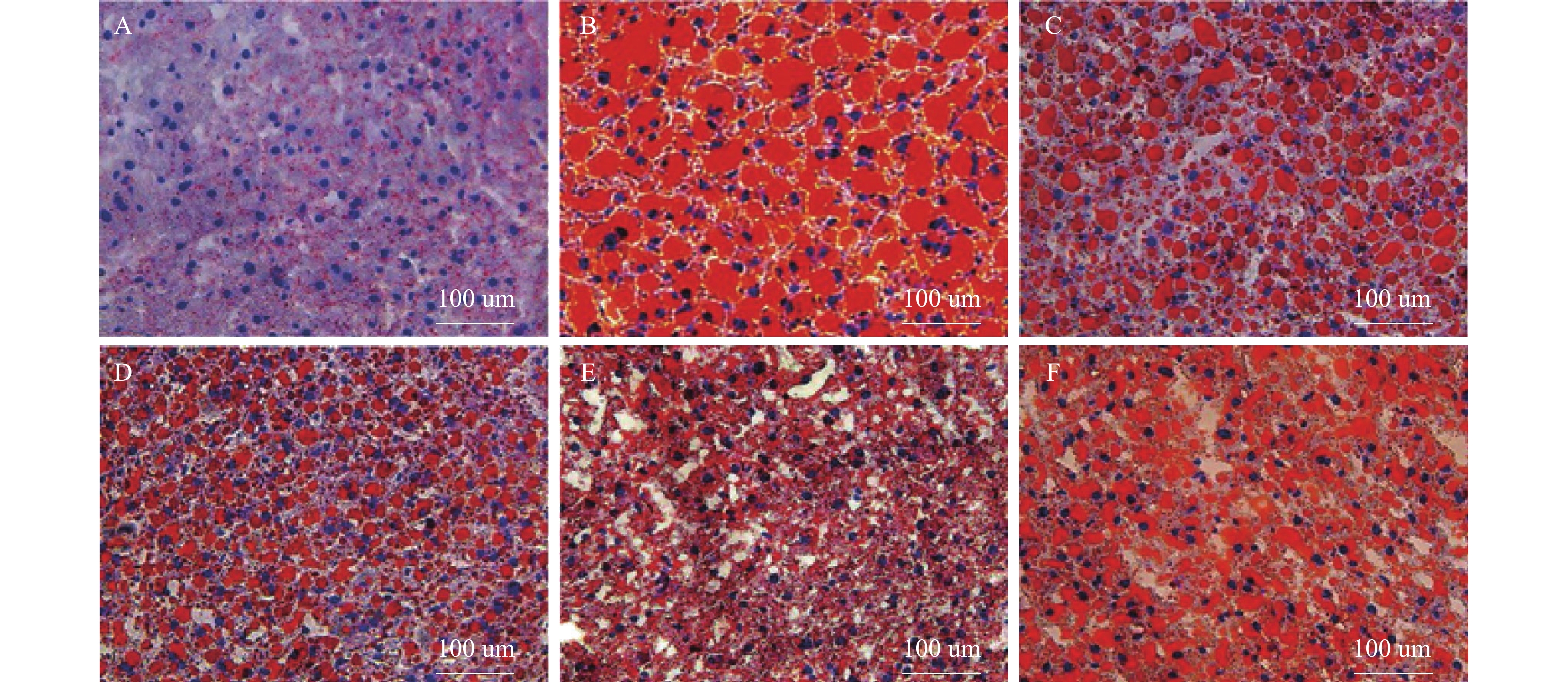
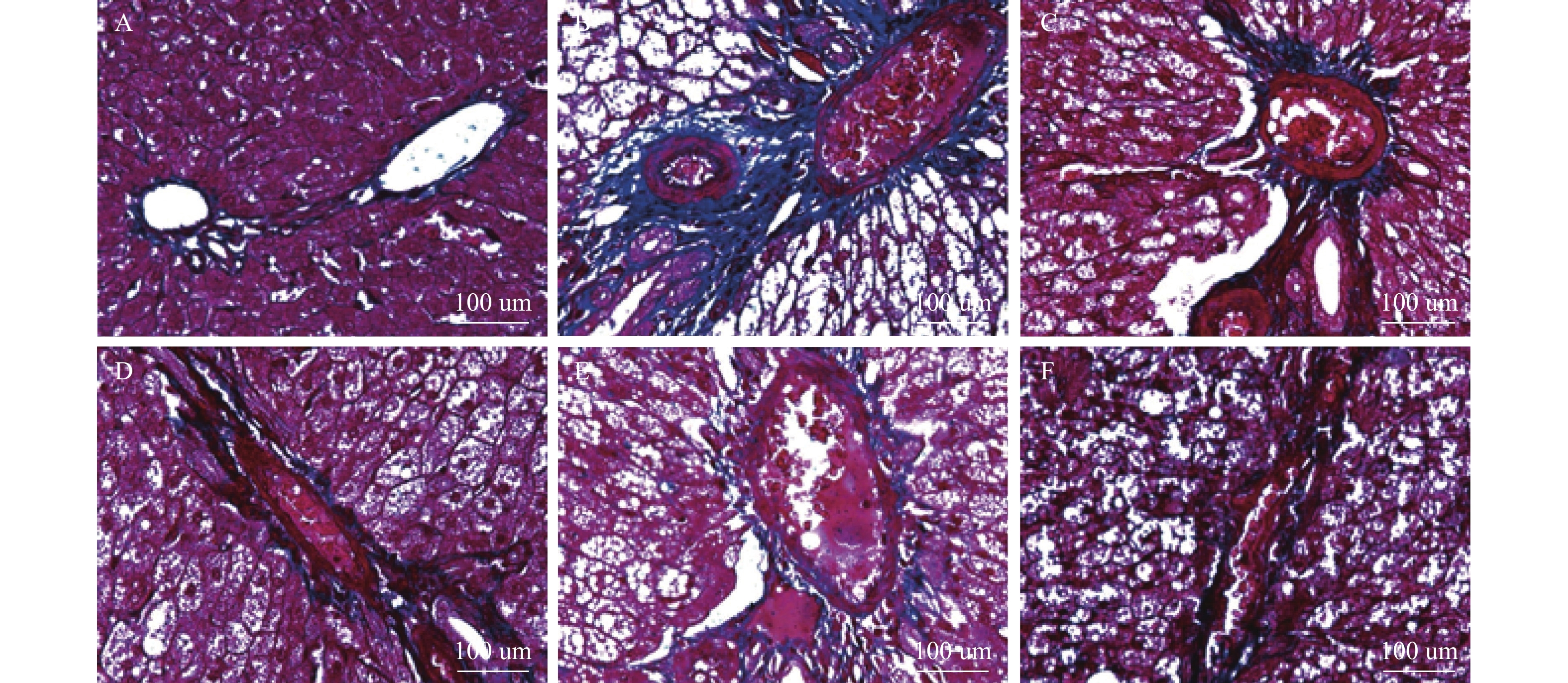
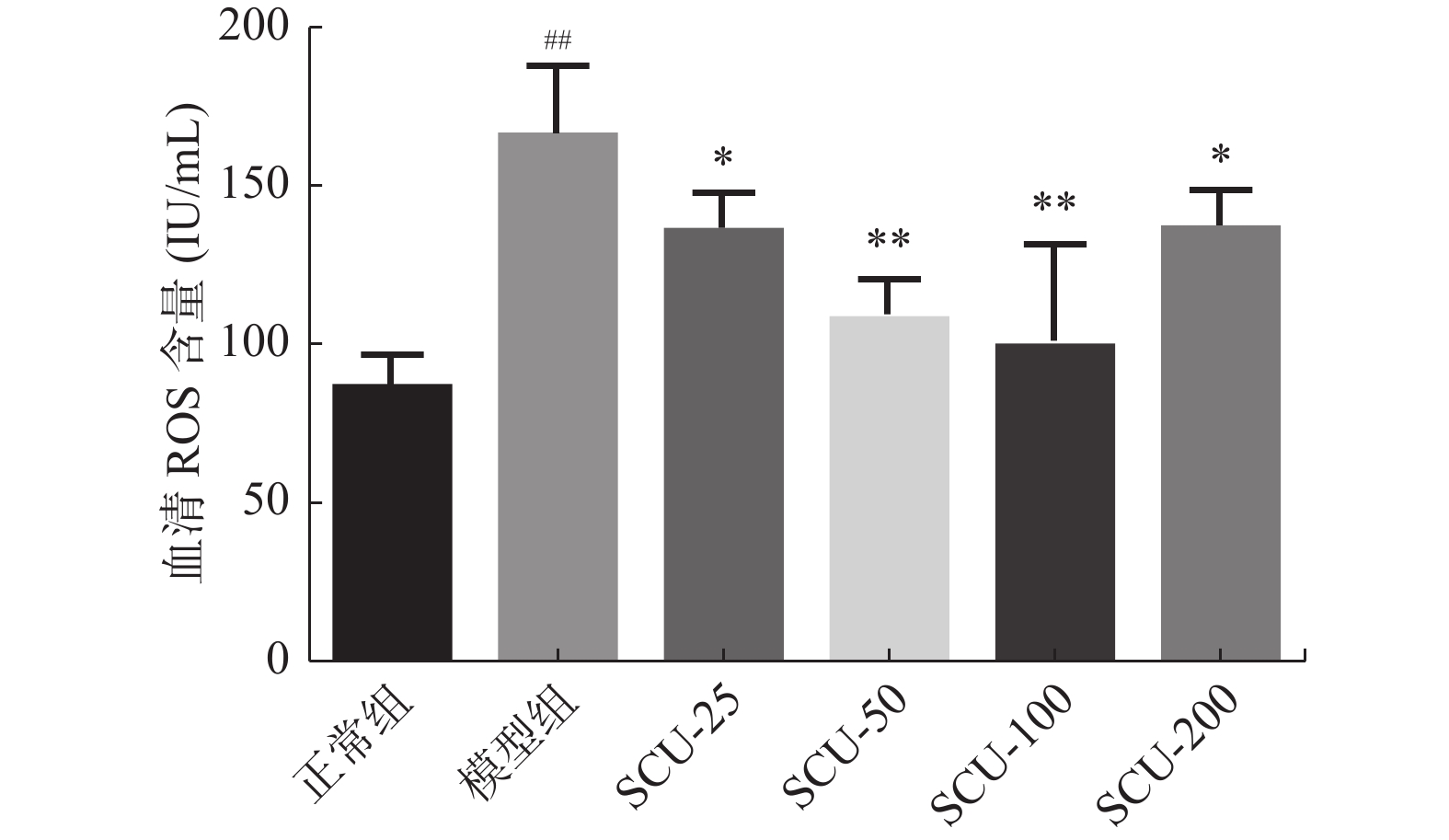
目的 探讨灯盏乙素(SCU)抑制NOX(NOX2、NOX4)的表达,改善高脂高糖诱导的非酒精性脂肪性肝病(NAFLD)肝脏纤维化程度。 方法 60只大鼠随机分为:正常组、模型组、SCU-25低剂量治疗组[25 mg/(kg·d)]、SCU-50中剂量治疗组[50 mg/(kg·d)]SCU-100高剂量治疗组[100 mg/(kg·d)]和姜黄素阳性药物治疗组[200 mg/(kg·d)],每组10只。正常组给予普通饲料喂养24+8周,其余各组采用高脂高糖饲料喂养SD大鼠24周建立NAFLD动物模型后,给予不同浓度的SCU和姜黄素灌胃治疗8周。治疗完成后,称取大鼠的体重,麻醉状态下取大鼠血清和肝脏组织,称取肝脏的重量,计算肝脏指数;通过ELISA法检测血清和组织中ROS的含量;采用油红“O”染色检测肝脏组织脂质沉积,Masson染色检测肝脏组织的纤维化程度;Western blot和免疫组织化学法检测肝脏组织中NOX2、NOX4蛋白的表达。 结果 模型组大鼠体重、肝重及肝脏指数增加(P < 0.01),不同剂量的SCU和姜黄素治疗后体重、肝重及肝脏指数降低,SCU-100高剂量治疗组和姜黄素阳性药物治疗组对体重和肝重降低的影响较为明显( P < 0.01)。模型组血清和肝脏组织ROS含量增加( P < 0.01),不同剂量的SCU和姜黄素治疗后ROS含量降低( P < 0.05)。在肝脏组织中,模型组出现大量的脂质沉积和组织的纤维化表现,不同剂量的SCU和姜黄素治疗后,脂质沉积减少,肝脏的纤维化程度改善。在肝脏组织细胞中,模型组的NOX2、NOX4蛋白表达上调( P < 0.05),不同剂量的SCU和姜黄素治疗后NOX2、NOX4的蛋白表达下调( P < 0.05),但剂量依赖不明显。 结论 SCU可能通过抑制肝脏NOX2、NOX4蛋白的表达,降低ROS的产生,从而改善NAFLD的肝脏纤维化程度。 Abstract:Objective To investigate the effect of scutellarin (SCU) on the expression of NOX (NOX2, NOX4) and the degree of liver fibrosis induced by high fat and high sugar in non-alcoholic fatty liver disease (NAFLD). Methods Sixty rats were randomly divided into normal group, model group, SCU-25 lower dose treatment group[25 mg/(kg·d), SCU-50 dose in the treatment group[50 mg/(kg·d)], SCU-100 high dose treatment group [100 mg/(kg·d) and curcumin positive drug treatment group[200 mg/(kg·d)], 10 in each group. The normal group was fed with ordinary diet for 24+8 weeks, and the other groups were fed with high-fat and high- sugar diet for 24 weeks to establish NAFLD animal model, and then given Different concentrations of SCU and curcumin intragastric treatment for 8 weeks. After the treatment, the weight of the rats was measured, and the serum samples and liver tissues of the rats were collected under anesthesia. The weight of theliver was measured and the liver index was calculated. ROS content in serum and tissues was detected by ELISA. Using oil red "O" Dyeing, detection of liver lipid deposition and Masson staining to detect the degree of fibrosis of liver tissue; Western blot and immunohistochemistry were used to detect the expression of NOX2 and NOX4 proteins in liver tissues. Results Body weight, liver weight and liver index increased in model group ( P < 0.01), body weight, liver weight and liver index decreased after different doses of SCU and curcumin treatment group, while body weight and liver weight were significantly decreased in SCU-100 high-dose treatment group and curcumin positive drug treatment group ( P < 0.01). ROS content in serum and liver tissues of model group was significantly increased ( P < 0.01), and ROS content was decreased after treatment with different doses of SCU and curcumin ( P < 0.05). In the liver tissue, the model group showed a large amount of lipid deposition and tissue fibrosis. After treatment with different doses of SCU and curcumin, the lipid deposition was reduced and the degree of liver fibrosis wasimproved. In liver tissue cells, the protein expressions of NOX2 and NOX4 were up-regulated in the model group ( P < 0.05), but down-regulated in differentdoses of SCU and curcumin ( P < 0.05), but not dose-dependent. Conclusion SCU may reduce ROS production by inhibiting the expression of NOX2 and NOX4 proteins in liver, thus alleviating the degree of liver fibrosis in NAFLD. -
非小细胞肺癌(non-small cell lung cancer,NSCLC)已连续多年位列全球癌症致死率榜首[1-2],而其中的肺腺癌亚型(lungadenocarcinoma,LUAD)也是非小细胞肺癌中占比最多的一类[3]。近些年,随着精准医疗的研究推进,尤其在肺腺癌领域鉴定出多个中国人群常见的驱动突变基因[4],其中以EGFR以及ALK为代表的驱动基因均已有相应的小分子抑制剂研发成功,并用于临床延缓肺腺癌患者的复发以及死亡。但是整体的肺癌患者的5 a生存率仍然较低,因此寻找更多的针对不同患者的精准治疗的靶点仍然是一个非常迫切的临床需求。
癌症通常是由基因的突变或者功能异常而驱动的,寻找到不同患者的不同异常基因,降为后续的治疗手段选择提供非常有指导意义的参考。基于EGFR驱动突变以及ALK融合变异的靶向治疗,以及通过检测PDL1表达[5-6]或者肿瘤突变负荷(Tumormutationburden)[7]而选择使用免疫治疗。这些精准诊疗精准用药的手段在临床上确实大大改善了患者的生存状态和生存率。
PLA2G1B(Phospholipase A2 group 1B)基因可以编码一种蛋白酶,其功能主要为调控细胞内的钙离子结合以及A2亚型的磷脂酶活性[8]。并且既往研究已发现肝癌中该基因会发生显著的表达上调,并且该表达上调与肝癌患者的预后相关[9]。但是在肺癌中该基因的表达模式以及与患者的预后关系尚不清楚,本研究主要通过公共数据对PLA2G1B基因全面的生物信息学分析,以解释PLA2G1B基因在肺腺癌中的表达特征、预后指导意义,并寻找潜在的治疗靶点。
1. 数据和方法
1.1 TCGA以及GEO中肺腺癌数据
本研究纳入TCGA数据库(数据下载自https://xena.ucsc.edu/)中共计490例肺腺癌原发灶的RNAseq表达量数据,其中表达量信息包含测序得到的原始序列计数(Readscount)以及定量之后的TPM(Transcriptpermillion)信息。该490例患者均具有完整的预后OS数据用于生存分析。并且纳入来自GEO(Gene expression omnibus,https://www.ncbi.nlm.nih.gov/geo/)数据库的GSE11969[10]以及GSE72094[11]两个数据集,分别包含了90以及398例肺腺癌患者的表达量数据以及临床信息。选用的数据集中患者平均年龄均大于60岁,且分期偏早期,性别分布相同,数据对比见表1、表2。
表 1 GSE11969、TCGA的年龄、分期、性别分布情况Table 1. GSE11969、TCGA age,stage,gender distribution项目 合计(n = 580) GSE11969(n = 90) TCGA(n = 490) 年龄 平均值 64.55 (10.08) 61.02 (9.80) 65.21 (10.01) 中位值 65.00(59.00、72.00) 62.00(55.00、67.00) 66.00(59.00、72.00) 不详 10 (1.72%) 0 (0.00%) 10 (2.04%) 分期n(%) Ⅰ 315 (54.31) 52 (57.78) 263 (53.67) Ⅱ 128 (22.07) 13 (14.44) 115 (23.47) Ⅲ 104 (17.93) 25 (27.78) 79 (16.12) Ⅳ 25 (4.31) 0 (0.00) 25 (5.10) 不详 8 (1.38) 0 (0.00) 8 (1.63) 性别n(%) 女 305 (52.59) 43 (47.78) 262 (53.47) 男 275 (47.41) 47 (52.22) 228 (46.53) 表 2 GSE72094、TCGA的年龄、分期、性别分布情况Table 2. GSE72094、TCGA age,stage,gender distribution overall项目 合计(n = 888) GSE72094(n = 398) TCGA(n = 490) 年龄 平均值 67.09 (9.97) 69.36 (9.45) 65.21 (10.01) 中位值 68.00(60.25、74.00) 70.00(64.00、76.00) 66.00(59.00、72.00) 不详 10 (1.13%) 0 (0.00%) 10 (2.04%) 分期n(%) Ⅰ 517 (58.22) 254 (63.82) 263 (53.67) Ⅱ 182 (20.50) 67 (16.83) 115 (23.47) Ⅲ 136 (15.32) 57 (14.32) 79 (16.12) Ⅳ 40 (4.50) 15 (3.77) 25 (5.10) 不详 13 (1.46) 5 (1.26) 8 (1.63) 性别n(%) 女 484 (54.40) 222 (55.78) 262 (53.47) 男 404 (45.50) 176 (44.22) 228 (46.53) 1.2 方法
1.2.1 数据集定义
其中来自TCGA的490例肺腺癌数据用于本研究的训练数据集(Trainingdataset),而GSE11969以及GSE72094两个数据集作为本研究的2个独立验证数据集(Independentvalidationcohort)。
1.2.2 基因表达量分析
TCGA中490例患者其中48例既有原发灶肿瘤样本的表达量,同时检测了癌旁正常肺组织的表达量信息。通过wilcoxontest检验方法对比490例肺癌样本与48例癌旁样本之间的PLA2G1B基因表达量。Pvalue小于0.05则定义为该基因在肿瘤以及癌种之间的表达量差异有统计学意义。
1.2.3 基因与患者的预后生存分析
在训练数据集以及验证数据集中,分别按照PLA2G1B基因的表达量排序,并取每个数据集中排名最低的四分之一样本为低表达量组,其余为高表达量组。然后通过log-ranktest检验分析高低表达两组患者之间的预后总生存(overall survival,OS)差异。然后同时纳入数据集中提供的患者年龄、性别、分期信息通过Coxregressiontest检验进行多因素生存分析已确定PLA2G1B的表达量高低为肺腺癌患者的独立预后因素。
1.2.4 免疫浸润分析
通过CIBERSORT算法[12]分析490例TCGA中肺腺癌患者的共计20个免疫细胞类型的浸润程度,然后分别对比每一种免疫细胞在PLA2G1B低表达和高表达两组之间的显著差异。
1.2.5 药物敏感性分析
根据PLA2G1B表达量分成低表达和高表达2组之后,使用pRRophetic算法[13]分析2组患者之间的化疗药物敏感性,该算法集合了来自CCLE的不同细胞系经过不同药物处理之后的IC50信息。通过对比不同组别之间的IC50信号差异,IC50越低则说明该药物对该类细胞的抑制作用越强。
2. 结果
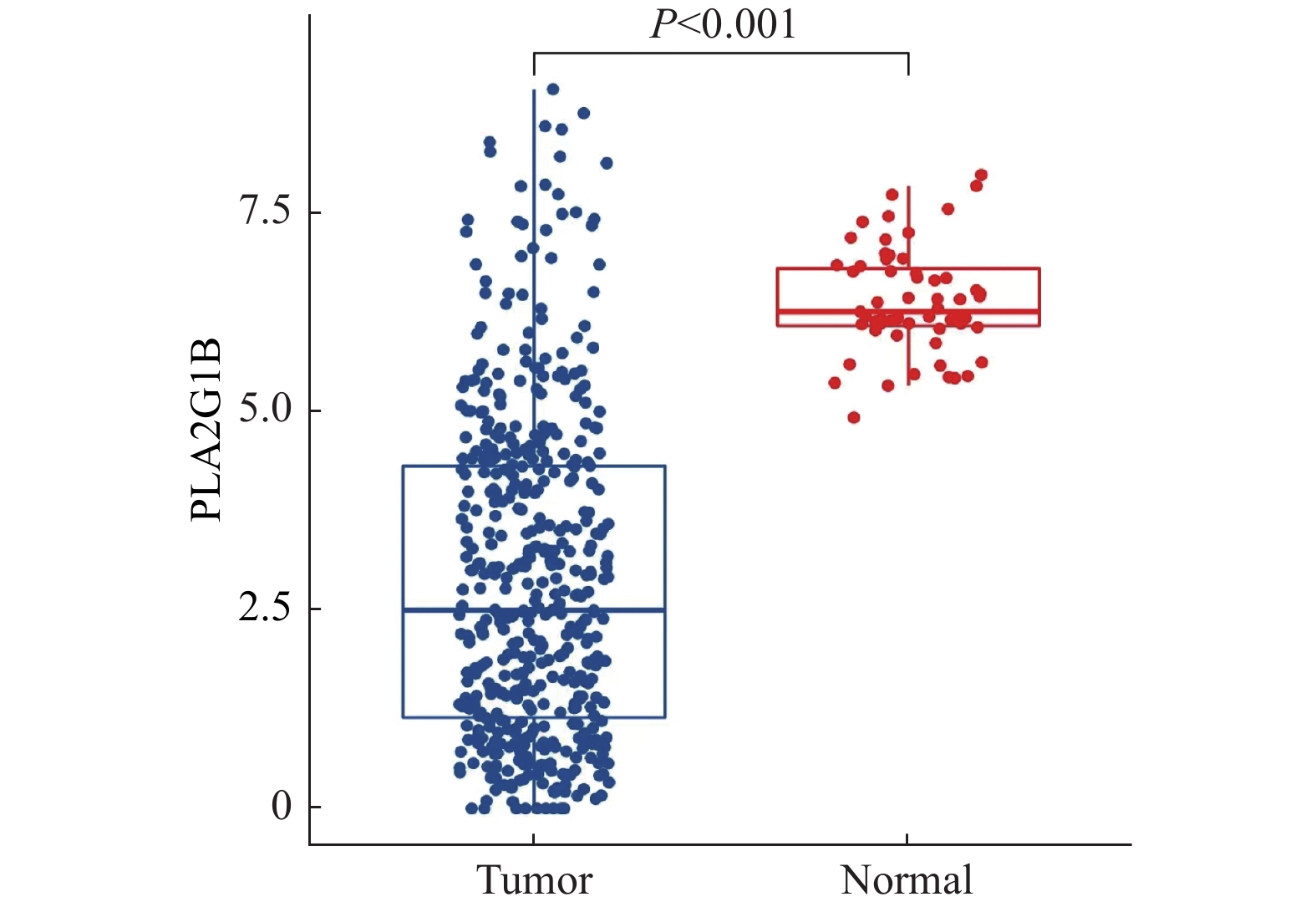
2.1 PLA2G1B基因在肺腺癌组织中表达量显著下调
通过对TCGA中490例肺癌组织样本以及48例癌旁组织样本中的PLA2G1B基因表达量进行对比分析发现,在肺腺癌样本中该基因的表达量发生了显著下调(P < 0.001),见图1。
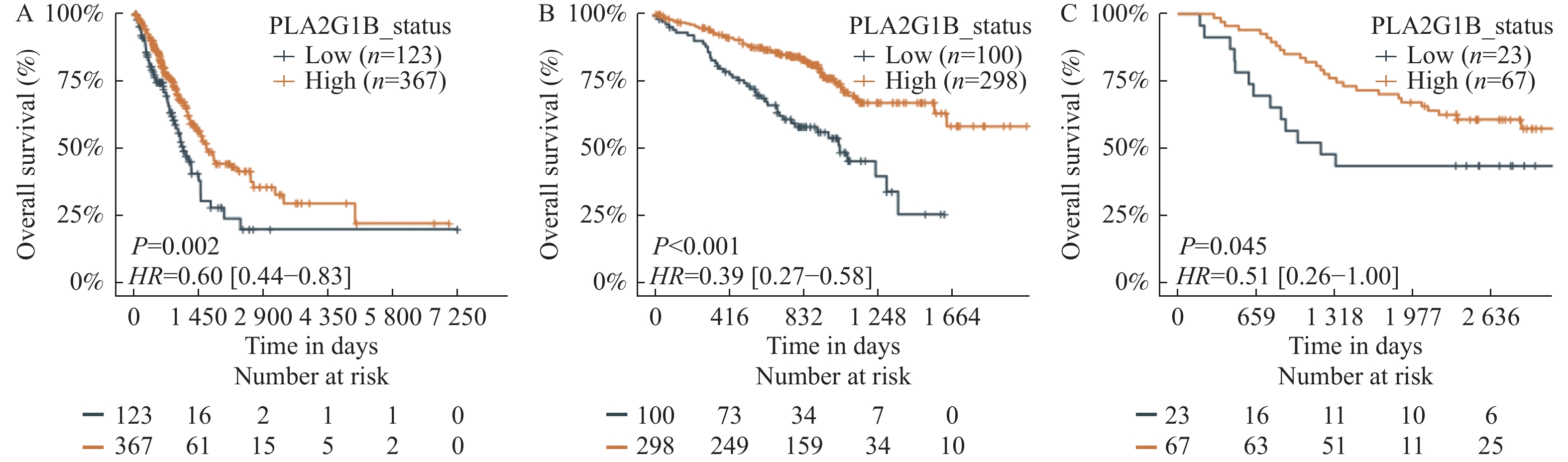
2.2 PLA2G1B表达量越低肺腺癌患者的预后越差
在TCGA的490例训练集数据中,PLA2G1B高表达组367例,低表达组123例;高表达组生存人数为247例低表达组生存人数为65例;中位生存期高表达组为1632 d,低表达组1115 d;中位随访期高表达组为670 d,低表达组为656 d。PLA2G1B基因低表达的患者其整体生存率显著低于高表达组的患者(P = 0.002,HR = 0.60,图2A),在两个独立验证数据集中同样呈现出了低表达组预后差的一致结果。GSE72094以及GSE11969中的HR分别为0.39和0.51,P<0.05,差异有统计学意义,见图2B,图2C。
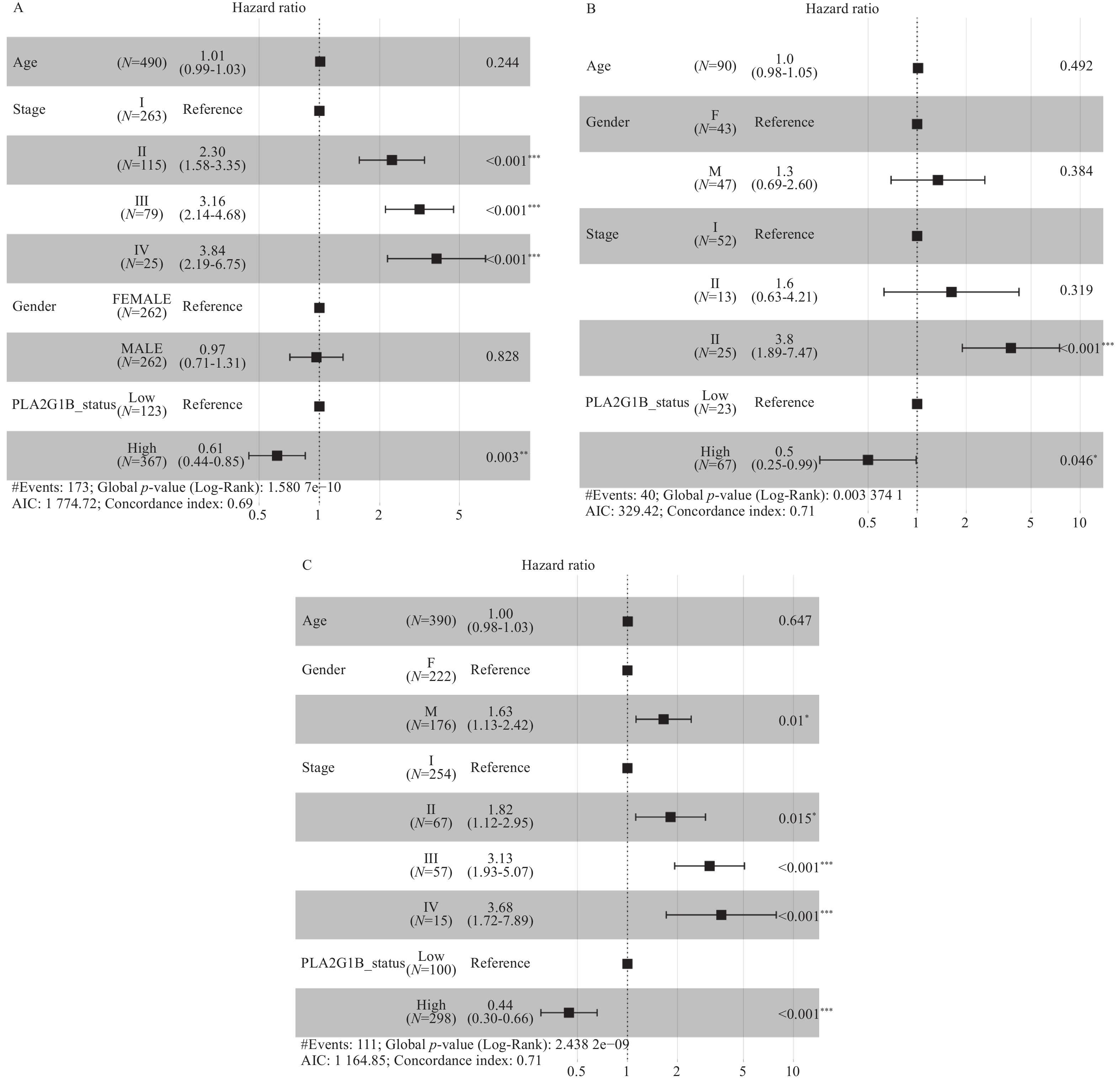
2.3 多因素生存分析发现PLA2G1B基因为独立预后因素
在TCGA以及来自GEO的2个独立验证数据集中均提供了患者年龄、性别、分期信息,将三个临床潜在影响患者预后的因素以及PLA2G1B基因的表达量一起纳入多因素预后分析模型中发现,经过多因素校正之后PLA2G1B基因的表达量依然为显著影响预后的因素。在训练集以及两个独立验证数据集中均达到了差异有统计学意义(P < 0.05),结果如图3(A-TCGA训练集P = 0.003,B-验证集1GSE11969 P = 0.046,C-验证集2GSE72094P < 0.001)。
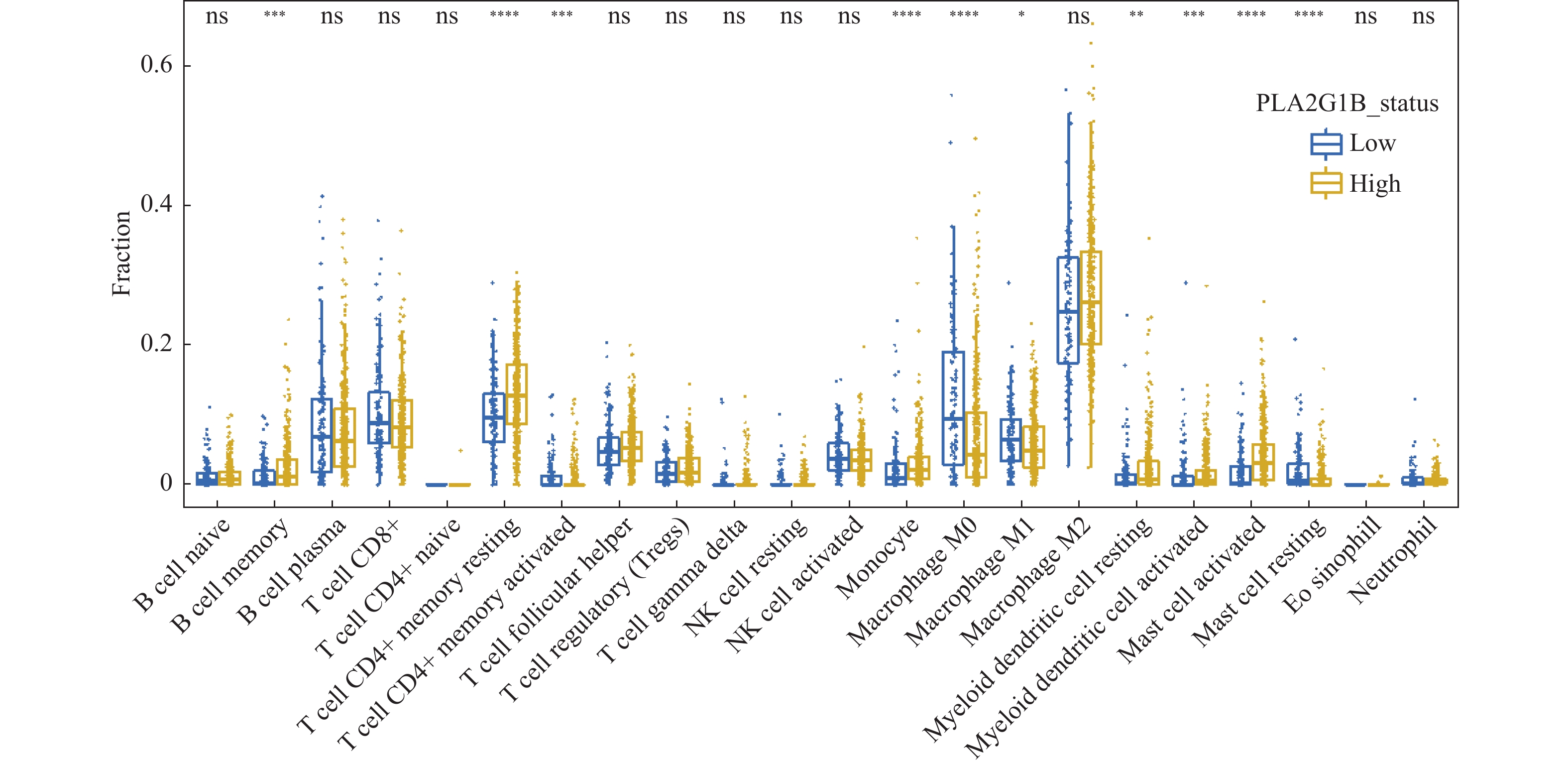
2.4 免疫细胞浸润程度分析提示PLA2G1B不同组之间免疫浸润程度有差异
通过对CIBERSORT得到的22类免疫细胞浸润程度对比分析发现,在PLA2G1B基因高表达组的患者中相比低表达组的患者显著富集Bcellmemory,Tcell CD4+ memoryresting,Monocyte,Myeloiddendriticcell,Mastcellactivated。而在低表达组中则表现为Macrophage M0/M1,Mastcellresting更为富集。该结果说明在PLA2G1B表达量不同的2组之间呈现了不同的免疫浸润类型以及浸润程度,见图4。
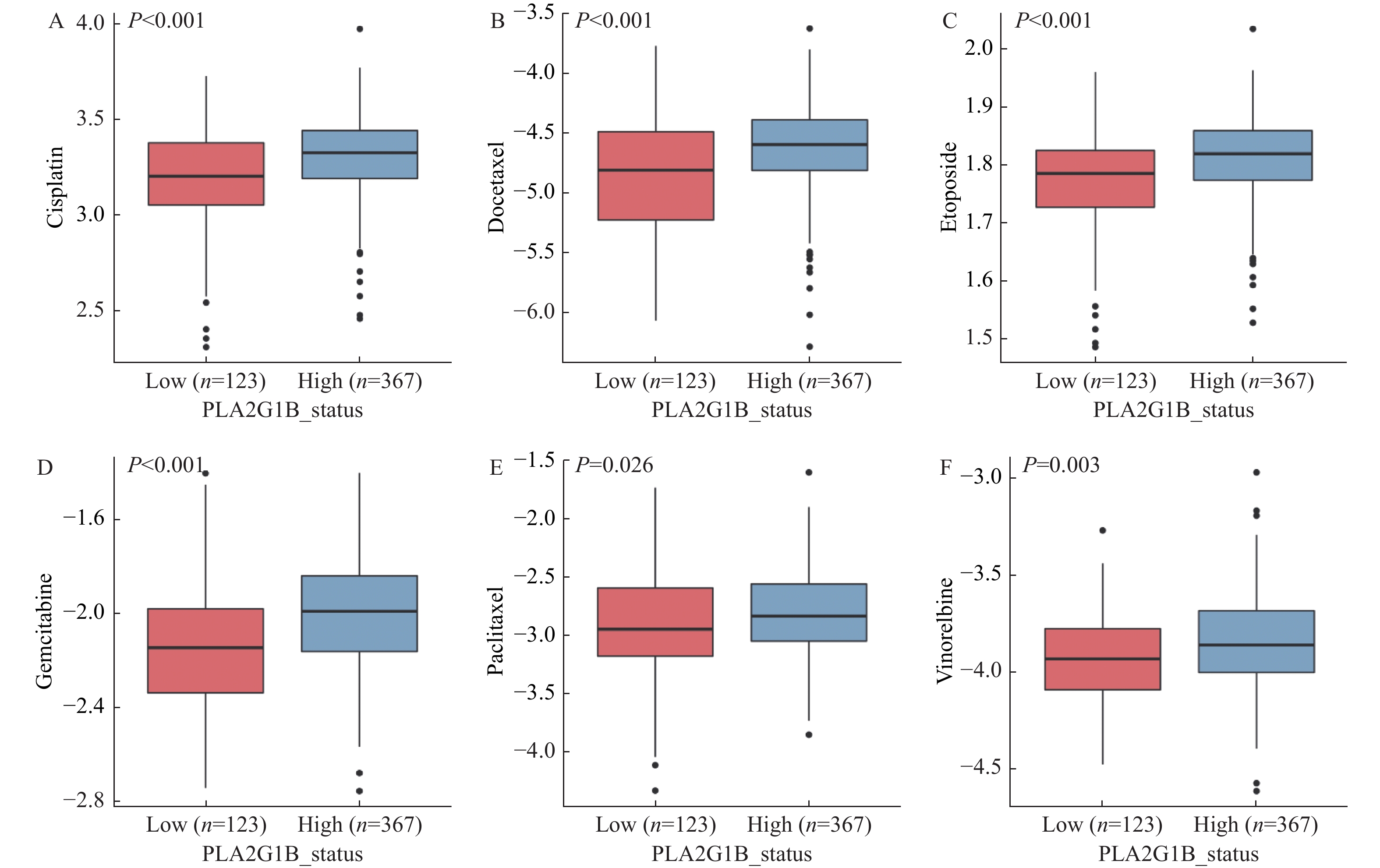
2.5 药物敏感性分析
为进一步研究PLA2G1B表达量不同的两组患者之间是否有药物敏感性的不同,已探索后续针对预后显著不同的这两类人群采用不同的临床治疗方案。本研究通过pRRophetic算法分析发现,在PLA2G1B低表达(即患者预后表现更差的肺腺癌患者)的细胞系中,其对铂类化合物(Cisplatin),见图5A,多西他赛(Docetaxel),见图5B,依托泊苷(Etoposide),见图5C,吉西他滨(Gemcitabine),图5D,紫杉醇(Paclitaxel),见图5E,长春瑞滨(Vinorelbine),见图5F等常见化疗药物的敏感性均更好,表现为IC50显著更低(P < 0.05)。该结果也提示临床上表现为PLA2G1B基因低表达的肺腺癌患者相比高表达的患者,有更高的可能取得临床获益。
3. 讨论
本研究基于数据挖掘对肺腺癌中PLA2G1B基因的表达特征、预后特征、免疫特征以及药物敏感性特征进行了全面分析。并发现在肺腺癌中患者的PLA2G1B基因发生了显著下调,该基因表达量的下调同时关联了肺腺癌患者的整体更差的生存表现,提示该基因的表达量越低患者的肿瘤恶性程度也存在更高的可能性。该发现不仅了490例的TCGA中大样本发现,并且在两个独立的验证数据集中进一步证实该结果的可靠性。当纳入更多的潜在影响患者临床预后表现的年龄、性别以及患者临床分期之后,该基因的预后指导作用依然显著,且同样在多个独立数据集中得到验证,进一步证明该基因的独立提示预后作用。
在既往研究中多次证明患者整体的预后表现与患者的免疫浸润程度息息相关。杀伤性免疫细胞浸润程度越高的患者其在整体的预后表现中则更好,这与免疫细胞的协助杀伤肿瘤功能相一致。而在本研究中为了解释PLA2G1B低表达的患者预后更差的潜在因素,同样进行了免疫浸润程度的分析。结果发现在低表达差预后的患者中仅有Macrophage M0/M1,Mastcellresting细胞更为富集,而在高表达好预后的患者中显著富集的免疫细胞较多,包括Bcellmemory,Tcell CD4+ memoryresting,Monocyte,Myeloiddendriticcell,Mastcellactivated。其中尤其B细胞以及CD4+T细胞均已被多次证实[14],该细胞越多越容易激活免疫反应,并行使对肿瘤细胞的杀伤功能。该结果也为PLA2G1B低表达的患者表现出较差的预后提供了一种解释,即为低表达的患者呈现较强的免疫排斥现象,有较少的免疫细胞浸润,进而免疫杀伤功能不足,影响到患者的整体预后表现。
为了进一步协助临床为低表达差预后的患者选择更为有效的治疗测序,本研究通过细胞系的药物敏感性数据分析发现,在PLA2G1B低表达的患者中其对化疗药物如铂类化合物(Cisplatin),多西他赛(Docetaxel),依托泊苷(Etoposide),吉西他滨(Gemcitabine),紫杉醇(Paclitaxel),长春瑞滨(Vinorelbine)的敏感性更好,IC50更低,该结果也为进一步的临床治疗选择提供了一定的依据。但因缺少真实患者样本的数据验证,因此该结果具有一定的局限性。
-
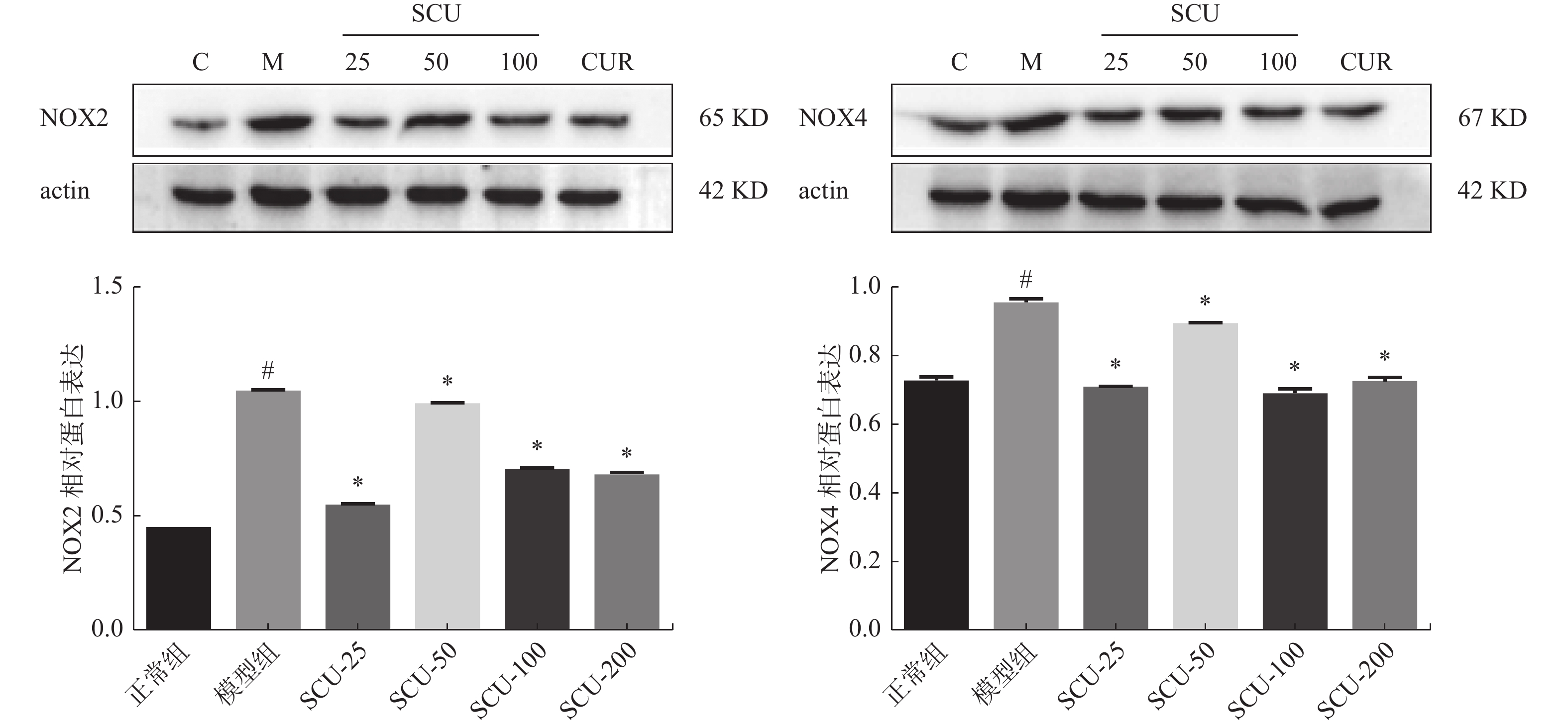
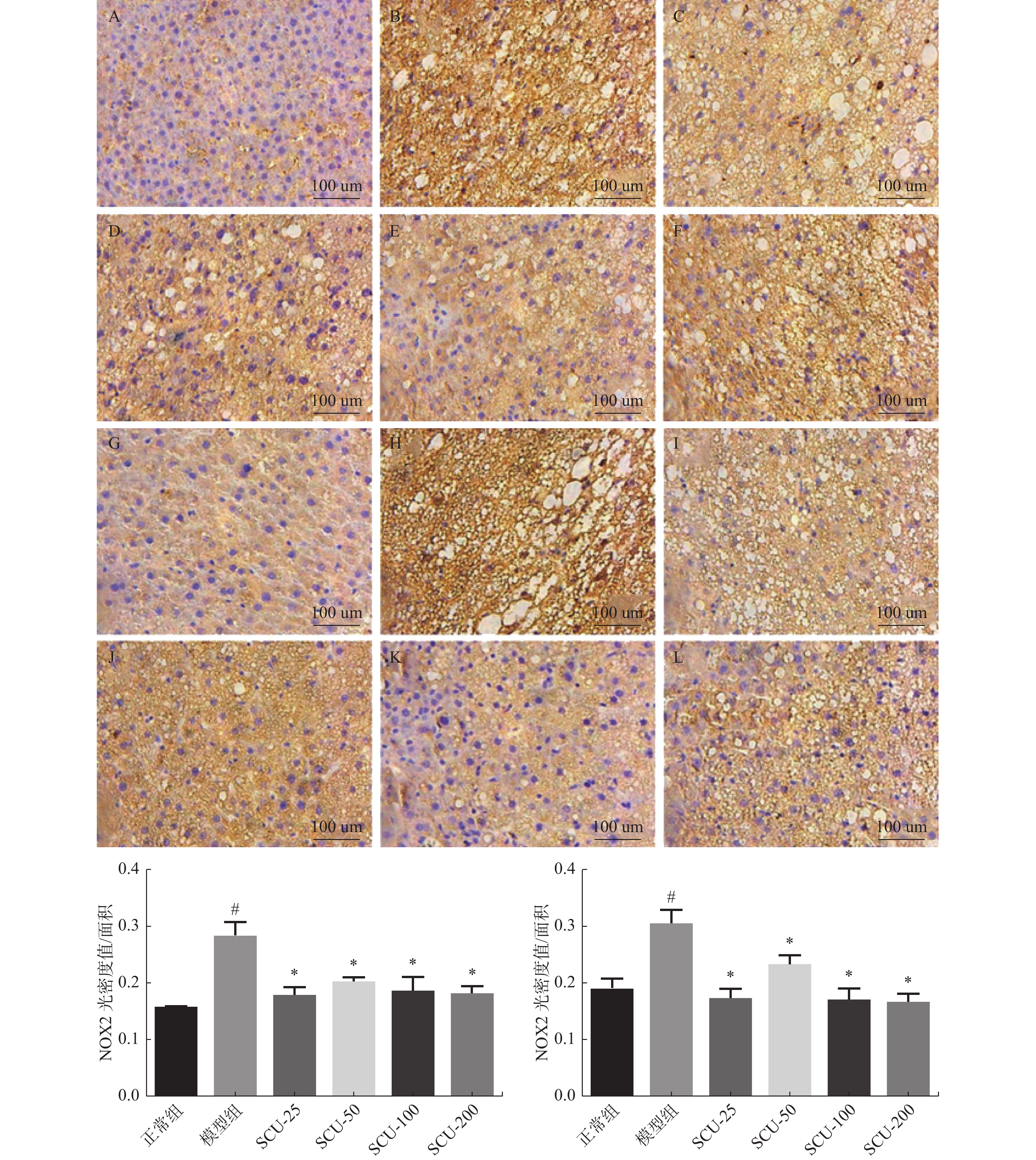
图 6 肝脏组织中NOX2、NOX4蛋白的表达(×400)
A:正常组NOX2表达;B:模型组NOX2表达;C:SCU-25 NOX2表达;D:SCU-50 NOX2表达;E:SCU-100 NOX2表达;F:CUR-200 NOX2表达;G:正常组NOX4表达;H:模型组NOX4表达;I:SCU-25 NOX4表达;J:SCU-50 NOX4表达;K:SCU-100 NOX4表达;L:CUR-200 NOX4表达。与正常组比较,#P < 0.05,与模型组比较,*P < 0.05。
Figure 6. Expression of NOX2 and NOX4 proteins in liver tissue (×400)
表 1 大鼠体重、肝重及肝脏指数(
$\bar x \pm s $ )Table 1. Body weight,liver weight and liver index of rats (
$\bar x \pm s $ )项目 正常组 模型组 Scu-25 Scu-50 Scu-100 Cur-200 体重(g) 547.60 ± 38.71 888.00 ± 75.16 ## 852.40 ± 56.86 801.40 ± 19.51 702.00 ± 38.39 ** 725.60 ± 45.24 ** 肝重(g) 14.03 ± 1.36 39.04 ± 3.09 ## 35.80 ± 7.01 30.70 ± 3.23 ** 28.03 ± 2.24 ** 26.43 ± 2.03 ** 肝脏指数 2.571 ± 0.268 4.415 ± 0.381 ## 4.184 ± 0.662 3.825 ± 0.333 4.016 ± 0.005 3.639 ± 0.078 * 与正常组比较, ## P < 0.01,与模型组比较, *P < 0.01, **P < 0.01。 -
[1] Liu Y,Nong L,Jia Y,et al. Aspirin alleviates hepatic fibrosis by suppressing hepatic stellate cells activation via the TLR4/NF-kappaB pathway[J]. Aging (Albany NY),2020,12(7):6058-6066. doi: 10.18632/aging.103002 [2] Zhao Z B,Ji K,Shen X Y,et al. Di(2-ethylhexyl) phthalate promotes hepatic fibrosis by regulation of oxidative stress and inflammation responses in rats[J]. Environ Toxicol Pharmacol,2019,68(5):109-119. [3] Du J J,Sun J C,Li N,et al. beta-Arrestin2 deficiency attenuates oxidative stress in mouse hepatic fibrosis through modulation of NOX4[J]. Acta Pharmacol Sin,2021,42(7):1090-1100. doi: 10.1038/s41401-020-00545-9 [4] Wang T,Zhou X,Kuang G,et al. Paeoniflorin modulates oxidative stress,inflammation and hepatic stellate cells activation to alleviate CCl4-induced hepatic fibrosis by upregulation of heme oxygenase-1 in mice[J]. J Pharm Pharmacol,2021,73(3):338-346. doi: 10.1093/jpp/rgaa042 [5] Liang S,Kisseleva T,Brenner D A. The role of NADPH oxidases (NOXs) in liver fibrosis and the activation of myofibroblasts[J]. Front Physiol,2016,7(2):17. [6] 王银辉,耿玲,李辉. 灯盏乙素抗大鼠肝纤维化作用的研究[J]. 中国中药杂志,2015,40(10):1999-2003. [7] Zhang X,Ji R,Sun H,et al. Scutellarin ameliorates nonalcoholic fatty liver disease through the PPARgamma/PGC-1alpha-Nrf2 pathway[J]. Free Radic Res,2018,52(2):198-211. doi: 10.1080/10715762.2017.1422602 [8] Peng L,Wen L,Shi Q F,et al. Scutellarin ameliorates pulmonary fibrosis through inhibiting NF-kappaB/NLRP3-mediated epithelial-mesenchymal transition and inflammation[J]. Cell Death Dis,2020,11(11):978. doi: 10.1038/s41419-020-03178-2 [9] Su Y,Fan X,Li S,et al. Scutellarin improves type 2 diabetic cardiomyopathy by regulating cardiomyocyte autophagy and apoptosis[J]. Dis Markers,2022,2022(5):3058354. [10] Xue L J,Han J Q,Zhou Y C,et al. Untargeted metabolomics characteristics of nonobese nonalcoholic fatty liver disease induced by high-temperature-processed feed in Sprague-Dawley rats[J]. World J Gastroenterol,2020,26(46):7299-7311. doi: 10.3748/wjg.v26.i46.7299 [11] Videla L A,Pettinelli P. Misregulation of PPAR functioning and its pathogenic consequences associated with nonalcoholic fatty liver disease in human obesity[J]. PPAR Res,2012,2012(11):107434. [12] Yu H M,Chung H K,Park K S. The PDE5 inhibitor udenafil ameliorates nonalcoholic fatty liver disease by improving mitochondrial function[J]. Biochem Biophys Res Commun,2021,558(6):57-63. [13] 江静,李虎,彭宗根. 肝内巨噬细胞在肝纤维化发展中的双重作用及其靶向治疗研究进展[J]. 中国药学杂志,2021,56(23):1869-1873. [14] Kong D,Zhang Z,Chen L,et al. Curcumin blunts epithelial-mesenchymal transition of hepatocytes to alleviate hepatic fibrosis through regulating oxidative stress and autophagy[J]. Redox Biol,2020,36(5):101600. [15] Ren L,Qi K,Zhang L,et al. Glutathione might attenuate cadmium-induced liver oxidative stress and hepatic stellate cell activation[J]. Biol Trace Elem Res,2019,191(2):443-452. doi: 10.1007/s12011-019-1641-x [16] Dai W,Qin Q,Li Z,et al. Curdione and schisandrin c synergistically reverse hepatic fibrosis via modulating the tgf-beta pathway and inhibiting oxidative stress[J]. Front Cell Dev Biol,2021,9(11):763864. [17] 蔡菁,葛亚强,许丽娟,等. 蒿属香豆素对MCD饮食诱导的非酒精性脂肪性肝纤维化小鼠保护性作用的研究[J]. 陕西中医,2021,42(11):1511-1516. [18] Gao J,Chen G,He H,et al. Therapeutic effects of breviscapine in cardiovascular diseases:A review[J]. Front Pharmacol,2017,8(5):289. [19] Liu Q,Li X,Ouyang X,et al. Dual effect of glucuronidation of a pyrogallol-type phytophenol antioxidant:A comparison between scutellarein and scutellarin[J]. Molecules,2018,23(12):3225. doi: 10.3390/molecules23123225 [20] Algandaby M M,Al-Sawahli M M,Ahmed O,et al. Curcumin-zein nanospheres improve liver targeting and antifibrotic activity of curcumin in carbon tetrachloride-induced mice liver fibrosis[J]. J Biomed Nanotechnol,2016,12(9):1746-1757. doi: 10.1166/jbn.2016.2270 [21] Zheng W,Song Z,Li S,et al. Protective effects of sesamol against liver oxidative stress and inflammation in high-fat diet-induced hepatic steatosis[J]. Nutrients,2021,13(12):4484. doi: 10.3390/nu13124484 [22] He H,Xiong L,Jian L,et al. Role of mitochondria on UV-induced skin damage and molecular mechanisms of active chemical compounds targeting mitochondria[J]. J Photochem Photobiol B,2022,232(5):112464. [23] Mortezaee K. Nicotinamide adenine dinucleotide phosphate (NADPH) oxidase (NOX) and liver fibrosis:A review[J]. Cell Biochem Funct,2018,36(6):292-302. doi: 10.1002/cbf.3351 期刊类型引用(2)
1. 陈鑫如,韩瑞,徐锦程. 基于生物信息学分析纤维蛋白1在舌癌中的表达及临床意义. 中华全科医学. 2024(08): 1317-1320+1343 .  百度学术
百度学术2. 王丽媛,杨振廷,李青玲,李海雯,赵智蓉,杨永锐,李树德. 灯盏乙素对长期高脂高糖饮食诱导的肥胖大鼠慢性肝损伤中肝脏组织MMP2、MMP9及TIMP-1蛋白表达的影响. 昆明医科大学学报. 2023(04): 9-15 .  本站查看
本站查看其他类型引用(0)
-






 下载:
下载:
 下载:
下载: