The Correlation between the Morphological Features of Aortic Root Image and New Left Bundle Branch Block after TAVR
-
摘要:
目的 于影像学方法分析主动脉根部形态学特征与经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)后新发左束支传导阻滞(new left bundle branch block,new-LBBB)的相关性,找寻这一并发症的危险因素及可靠的定量评价方法。 方法 顾性分析昆明医科大学附属延安医院2023年6月-2024年8月症状性重度主动脉瓣狭窄或关闭不全并行TAVR患者资料,共计65例。根据术后是否出现new-LBBB将样本分为病例组(n = 27)和对照组(n = 38);分析两组患者临床资料、 CT及超声心动图结果的差异。 结果 病例组窦管结合部平均内径及周长、瓣环水平面夹角及经心尖TAVR(transapical transcatheter aortic valve replacement,TA-TAVR)数量大于对照组(P < 0.05),病例组膜部长度、膜部长度与支架置入深度差值小于对照组,差异均有统计学差异(P < 0.05)。 结论 瓣环水平面夹角、支架置入深度与膜部长度的差值及经心尖入路是TAVR术后new-LBBB的独立危险因素。 -
关键词:
- 经导管主动脉瓣置换术 /
- 新发左束支传导阻滞 /
- 形态学特征 /
- 危险因素
Abstract:Objective To analyze the correlation between the morphological characteristics of aortic root and new left bundle branch block (New-LBBB) after transcatheter aortic valve replacement (TAVR) based on imaging methods, and to find the risk factors for this complication and a reliable quantitative evaluation method. Methods Data of 65 patients with symptomatic severe aortic stenosis or regurgitation and concurrent TAVR at Yan 'an Hospital Affiliated to Kunming Medical University from June 2023 to August 2024 were retrospectively analyzed. According to the presence or absence of new-LBBB, these patients were divided into the case group (27 cases) and control group (38 cases) respectively. Clinical data, CT and echocardiography results were analyzed. Results The mean inner diameter and circumference of the sinus canal junction, the Angle of the annulus and the number of TA-TAVR in the case group were greater than those in the control group, and the membrane length, membrane length and stent insertion depth in new-LBBB group were smaller than those in the control group, and the differences were statistically significant (P < 0.05). Conclusion The angle between the horizontal plane of the valve annulus, the difference between the depth of stent placement and the length of the membrane, and the transapical approach are independent risk factors for new LBBB after TAVR surgery.. -
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)的出现极大地解救了部分高龄、高危及外科手术禁忌的主动脉瓣病变患者,甚至是其唯一解决手段[1],其主要是通过输送系统将人工主动脉瓣送达主动脉根部并替代主动脉瓣功能。TAVR直接适用范围主要包括高危外科手术风险的主动脉瓣重度狭窄,或主动脉瓣关闭不全患者,现TAVR主流人群正由高危、高龄患者逐渐向低危、低龄患者倾斜[2−4]。尽管随着器械的更新、技术的完备,术后并发症的发生率逐步降低,但术后心脏传导阻滞仍是最常见的问题,TAVR术后常见的心脏传导阻滞包括左/右束支传导阻滞、高度或完全性房室传导阻滞等,其中以TAVR术后新发左束支传导阻滞(new left bundle branch block,new-LBBB)发生率最高[5],同时广泛认为高度房室传导阻滞、完全性房室传导阻滞需行永久起搏器植入(permanent pacemaker implantation,PPI)[6]。左束支传导阻滞(left bundle branch block,LBBB)一方面导致心室非同步化而造成左心射血分数显著下降[7],另一方面预示着心力衰竭和心源性猝死发生率的增加。对于TAVR术后new-LBBB与主动脉根部影像形态学特征的相关性及其危险因素尚无确切定论,国内相关研究较短缺,临床尚处于探索阶段,经验借鉴较欠缺。因此进行相关探究是临床所关切,找寻TAVR术后new-LBBB的相关危险因素,为临床提供经验借鉴,这对预防TAVR术后new-LBBB发生、管理new-LBBB患者、改善预后具有重要价值。本研究主要基于影像学方法分析手术前、后主动脉根部形态学特征,解析术前、术中及术后的临床资料,找寻TAVR术后new-LBBB相关危险因素并探讨其独立危险因素。
1. 资料与方法
1.1 研究对象
本研究回顾性连续收集2023年6月至2024年8月在昆明医科大学附属延安医院接受TAVR手术治疗的高危外科手术风险的症状性主动脉瓣重度狭窄或关闭不全患者影像、临床资料。
纳入标准[8]:(1)经胸超声心动图 (transthoracic echocardiography,TTE)或经食道超声心动图(transesophageal echocardiography,TEE)确诊为重度主动脉瓣狭窄[平均主动脉瓣跨瓣压差(mean aortic valve transmitral pressure gradient, AVPG-Mean≥ 50 mmHg(1 mmHg=0.133 kPa)或主动脉瓣口面积(aortic valve area,AVA)≤ 1.00 cm2;或经超声心动图确诊为重度主动脉瓣重度关闭不全(反流容积≥60mL或反流分数≥50%或有效反流面积≥0.3 cm2)(2)纽约心脏协会(new york heart association,NYHA)心功能分级Ⅱ级[8]及以上;(3)外科主动脉瓣置换术(surgical aortic valve replacement,SAVR)高危或存在禁忌证;(4)围手术期临床资料完整。排除标准:(1)术前已行永久起搏器植入(permanent pacemaker implantation,PPI)或病史;(2)术前有高度房室传导阻滞(high-grade atrioventricular block,HAVB)、完全性右或左束支传导阻滞(LBBB);(3)TAVR手术失败;(4)术后持续呈现高度房室传导阻滞(high-grade atrioventricular block,HAVB)或完全起搏依赖。本研究已经过昆明医科大学附属延安医院医学伦理委员会审批。
1.2 资料收集
行TAVR的重度主动脉瓣狭窄或关闭不全患者共计75例,排除不符合入组标准患者10例(术后III度房室传导阻滞8例,手术失败1例,术前已行永久起搏器植入1例),最终纳入65例。
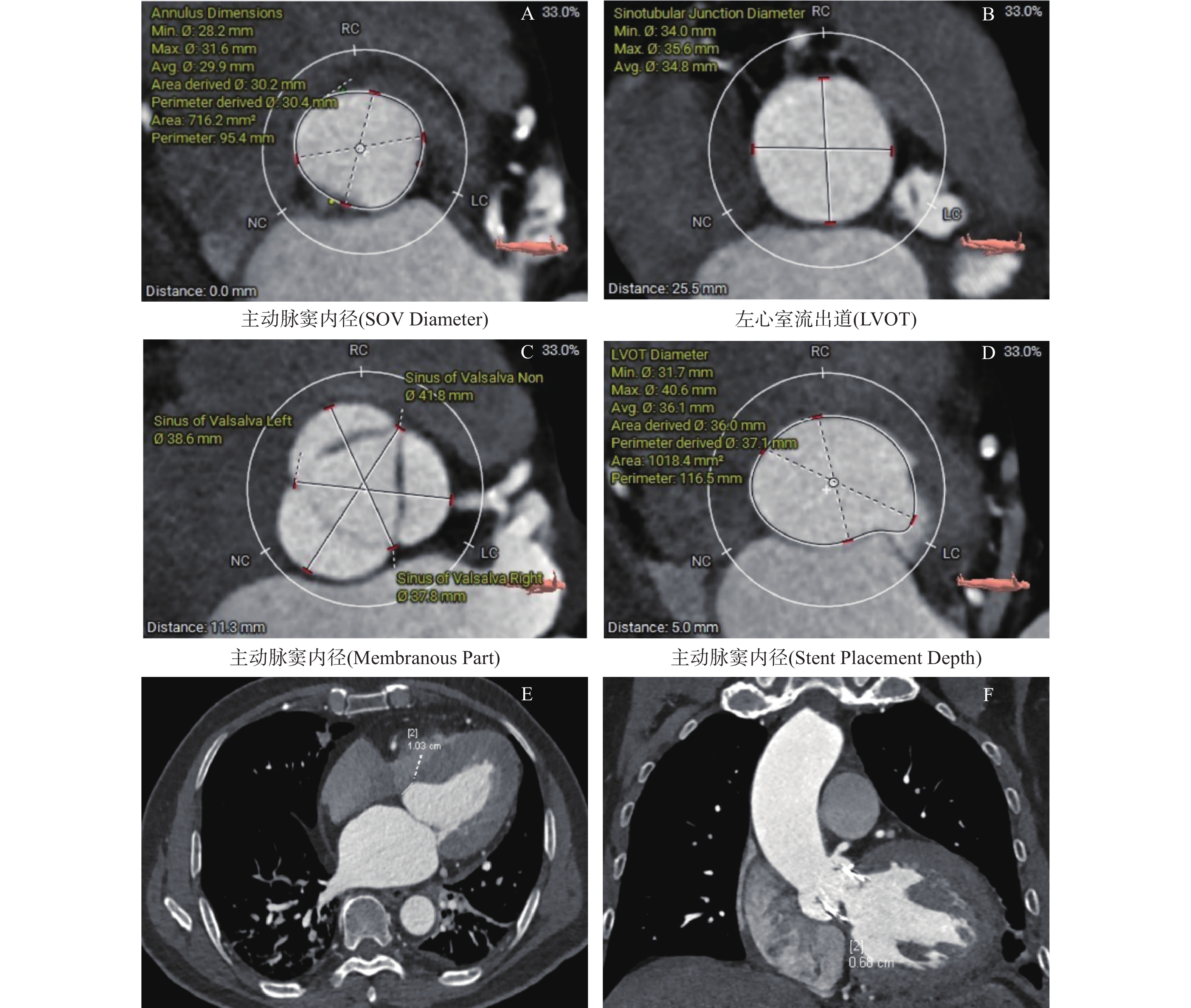
收集患者基线资料[年龄、性别、身高、体重、身体质量指数(body mass index,BMI)及是否吸烟]、实验室相关指标:肌酸激酶、乳酸脱氢酶、N末端前B型钠尿肽(N-terminal pro-brain natriuretic peptide,NT-proBNP);NYHA心功能分级、心电图、基础疾病、经胸超声心动图或经食道超声心动图[室间隔厚度(interventricular septum thickness,IVST)、室间隔收缩期增厚率、左室后壁收缩期增厚率、左室短轴收缩期增厚率、左室射血分数(left ventricular ejection fractions,LVEF)等]、手术入路、瓣叶类型、瓣膜尺寸、窦管结合部(sinotubular junction,STJ)径线及面积、虚拟瓣环径线及面积、左心室流出道(left ventricular outflow tract,LVOT)径线、面积及是否钙化、室间隔膜部长度、支架置入深度、支架置入深度与室间隔膜部长度的差值、主动脉瓣环水平面夹角及主动脉窦部平均内径等。
1.3 分组标准
新发左束支传导阻滞(new-LBBB)被定义为患者术前无LBBB存在,而术中或术后存在LBBB [(1)QRS间期(QRS duration, QRSd)≥140 ms(男性), QRS间期(QRSd)≥130 ms(女性);(2)V1、V2 导联 QS型或rS型;(3)V1、V2、V5、V6、Ⅰ、aVL 导联至少2个导联出现 QRS波切迹]。根据术中或术后是否存在LBBB,将65名患者分为new-LBBB组(n = 27)和对照组(n = 38),分析两组术前、术中及术后的影像学特征、相关信息及两组间差异。
1.4 影像学方法
患者利用西门子双源64排电子计算机断层扫描(computed tomography,CT)行心脏大血管计算机体层血管成像(computed tomography angiography,CTA)检査,采用回顾性心电门控序列进行扫描,取仰卧位,扫描方向头先进,扫描范围自胸廓入口至双侧股骨头以下层面,扫描参数为层厚 0.6 mm,0.28 s,120 kV;高压注射器通过肘静脉三期注射对比剂,首先以 5.0 mL/s 流率先后注射对比剂75 mL,对比剂、生理盐水混合液 ( 3∶7) 30 mL和生理盐水 30 mL。回顾性心电门控选择在30%~45%的 RR 间期,选择最佳收缩期(30%)重建图像。
对于TAVR术前CT影像应用3mensio软件进行精准评估;对于TAVR术后CT影像,两位高年资放射科医生独立进行分析,通过三维重建对相应影像进行定量分析,对术后瓣膜置入深度及室间隔膜部长度等进行测量和分析,见图1。
1.5 手术方式
经心尖TAVR患者全麻后,床旁TEE评估(主动脉瓣叶及反流情况),结合CT,选择合适尺寸瓣膜。起搏器调控,经股动脉穿刺置入鞘管,透视下置入造影管至主动脉窦部;左侧腋前线肋间开胸,行左室心尖部六边形双荷包缝合,行主动脉根部造影,使3个主动脉瓣窦底位于同一水平,确定双侧冠状动脉显影良好,标记主动脉瓣窦最低点水平线;透视下经心尖穿刺以MPA导管引导导丝至降主动脉肾动脉水平,交换加硬导丝,经导丝置入输送器转载瓣膜至主动脉瓣上2 cm;释放定位器、回拉,确认进入窦部,将人工瓣膜后退至瓣环水平,再次主动脉根部造影,确认瓣膜深度及同轴性良好,释放瓣膜。透视及TEE确认瓣膜位置、形态、反流及左右冠状动脉情况,撤除输送器,结扎缝合,手术完毕。
1.5.2 经股动脉TAVR
患者全麻后,床旁TEE评估(主动脉瓣叶及狭窄情况),结合CT,选择合适尺寸瓣膜。经股动脉穿刺送入导管至无冠窦标识,行造影对冠脉及主动脉瓣膜情况再次评估;经股静脉置入临时起搏导线。穿刺另一侧股动脉送入“J”头导丝至主动脉弓附近,沿导丝送入大鞘。经股动脉鞘,将塑形导丝送入左心室建立轨道,沿导丝送入球囊跨瓣,超速起搏预扩球囊,评估主动脉造影及瓣叶距冠脉开口情况,退出预扩球囊;根据CT及球囊预扩结果,选择合适主动脉瓣,将人工主动脉瓣送入主动脉根部,造影定位、释放瓣膜,根据瓣膜形态,评估是否需要球囊后扩,退出输送系统;行主动脉根部造影及TEE观察瓣膜位置、形态、反流情况及冠脉有无受累。撤出导管、导线,缝合切口、加压包扎。
1.6 统计学分析
采用SPSS 27.0软件进行数据分析。计数资料采用构成比[n(%)]表示,应用χ2 检验分析计数资料;计量资料进行正态性检验,若正态分布以平均值±标准差($\bar x \pm s $)表示;计量资料若偏态分布则以M(P25,P75)表示;计量资料差异性运用独立样本t检验或Mann-WhitneyU 检验进行分析;运用多因素Logistic回归(logistic regression,LR)方法筛选new-LBBB的独立危险因素。所有检验均采用双侧检验,α=0.05为检验水准,P < 0.05为差异具有统计学意义。
2. 结果
2.1 基线资料比较
本研究纳入65例患者,其中男42例,女23例,平均年龄(70.57±6.46)岁,平均BMI(22.24±3.16)kg/m2。两组患者年龄、性别、BMI、吸烟史、基础疾病(高血压、糖尿病)、NYHA心功能分级、术前肌酸激酶、乳酸脱氢酶、NT-proBNP差异均无统计学意义(P > 0.05),见表1。
表 1 研究人群的临床基线特征[n(%),M(P25,P75),($\bar x \pm s $)]Table 1. Baseline characteristics of the study population [n(%),M(P25,P75),($\bar x \pm s $)]项目 病例组(n=27) 对照组(n=38) χ2/t/Z P 男/女(例) 18/9 24/14 0.085 0.771 年龄(岁) 70.41±5.04 70.68±7.37 −0.169 0.866 BMI(kg/m2) 21.77±2.87 22.57±3.36 −0.996 0.323 高血压 11(45.8) 13(54.2) 0.289 0.591 糖尿病 0(0.0) 3(7.9) 2.235 0.135 吸烟史 3(11.1) 4(10.5) 0.006 0.940 NYHA分级 Ⅱ级 3(11.1) 12(31.6) Ⅲ级 22(81.5) 26(68.4) Ⅳ级 2(7.4) 0(0.0) 肌酸激酶(U/L) 67.00(59.00,83.00) 71.00(57.00,97.00) −1.049 0.298 乳酸脱氢酶(U/L) 185.00(157.00,208.00) 189.50(172.00,244.50) −0.248 0.805 NT-proBNP(pg/mL) 1016.00 (403.00,2149.00 )549.50(360.75, 2565.25 )−0.276 0.784 2.2 围手术期情况比较
围术期CTA资料显示;两组患者瓣叶类型、瓣膜尺寸、LVOT长短径、面积及钙化情况、STJ高度及面积、虚拟瓣环平均内径、周长及面积、置入深度、主动脉窦平均内径均无统计学差异(P > 0.05),见表2;病例组STJ平均内径及周长、瓣环水平面夹角及经心尖TAVR(TA-TAVR)数量大于对照组(P < 0.05),病例组膜部长度、支架置入深度与膜部长度的差值小于对照组,差异具有统计学意义(P < 0.05),见表2。围术期超声心动图资料显示两组患者术前LVEF、IVST、室间隔收缩期增厚率、左室后壁收缩期增厚率及左室短轴收缩期增厚率均无统计学差异(P > 0.05),见表3;而术后1周病例组左室短轴收缩期增厚率低于对照组具有统计学差异(P < 0.05),见表3。
表 2 研究人群围术期CTA资料比较[例(%),M(P25,P75),($\bar x \pm s $)]Table 2. Comparison of perioperative CTA data in the study population [例(%),M(P25,P75),($\bar x \pm s $)]变量 病例组(n=27) 对照组(n=38) χ2/t/Z P 瓣叶类型(二叶瓣) 6(22.2) 15(39.5) 2.148 0.143 瓣膜尺寸(mm) 26.78±1.908 26.18±2.967 0.980 0.331 入路(经心尖) 17(63.0) 12(31.6) 6.292 0.012* LVOT钙化 1(3.7) 5(13.2) 1.684 0.194 LVOT长径(mm) 28.79±3.37 28.19±4.40 0.588 0.559 LVOT短径(mm) 23.36±3.67 22.70±3.91 0.689 0.494 LVOT周长(mm) 86.14±8.49 83.20±12.79 1.041 0.302 LVOT面积(cm2) 5.08±1.07 4.89±1.40 0.613 0.542 STJ平均内径(mm) 33.95±4.79 31.01±5.14 2.334 0.023* STJ周长(mm) 107.40±15.36 99.00±16.31 2.104 0.039* STJ高度(mm) 18.27±3.72 17.72±3.24 0.630 0.531 STJ面积(cm2) 8.93±2.55 7.67±2.54 1.977 0.052 虚拟瓣环平均内径(mm) 24.64±2.59 24.15±3.40 0.633 0.529 虚拟瓣环周长(mm) 81.93±8.27 79.59±9.69 1.017 0.313 虚拟瓣环面积(cm2) 4.59±0.98 4.52±1.12 0.275 0.784 瓣环水平面夹角(°) 56.33±8.38 50.00±7.86 3.115 0.003* 膜部长度(mm) 5.89±1.48 7.13±1.61 −3.168 0.002* 置入深度(mm) 6.59±2.58 5.46±2.92 1.615 0.111 膜部长度与支架置入深度差值(mm) −1.00(−3.00,0.00) 1.00(−1.00,3.25) −3.086 0.003* 主动脉窦平均内径(mm) 35.74±4.67 33.29±5.77 1.821 0.073 *P < 0.05。 表 3 研究人群围术期超声心动图资料比较Table 3. Comparison of perioperative echocardiographic data in the study population变量 术前超声心动图 术后1周超声心动图 术前P 术后P 病例组(n=27) 对照组(n=38) 病例组(n=27) 对照组(n=38) LVEF(%) 54.78±12.22 57.92±11.45 52.04±12.09 57.76±11.21 0.293 0.054 IVS(mm) 11.41±1.74 11.21±1.80 11.00±1.54 11.13±1.98 0.661 0.774 室间隔收缩期增厚率(%) 28.22±8.31 27.37±7.95 23.00±8.01 23.13±7.78 0.677 0.947 左室后壁收缩期增厚率(%) 30.15±8.94 31.63±10.10 27.70±8.07 29.97±8.00 0.543 0.266 左室短轴收缩期增厚率(%) 28.89±7.36 30.37±6.82 26.96±7.59 30.66±6.87 0.403 0.045* *P < 0.05。 2.3 危险因素分析
以new-LBBB为因变量,将2组患者基线资料及围手术期中P < 0.05的因素为自变量,并进行共线性分析,排除STJ平均内径、STJ周长及膜部长度,最终纳入瓣环水平面夹角、支架置入深度与膜部长度差值及经心尖入路3个危险因素,多因素logistic回归分析结果显示,校正其他因素后, 瓣环水平面夹角、支架置入深度与膜部长度差值及经心尖入路是TAVR术后new-LBBB的独立危险因素 (P < 0.05),见表4。
表 4 多因素Logistic回归分析Table 4. Multi-factor logistic regression analysis变量 β SE Wald P OR 95%CI 支架置入深度与膜部长度差值/(mm) 0.291 0.113 6.599 0.010 1.338 1.071~1.670 瓣环水平面夹角/° 0.082 0.039 4.400 0.036 1.085 1.005~1.172 入路(经心尖) −1.618 0.643 6.333 0.012 0.198 0.056~0.699 3. 讨论
TAVR是近年来治疗中老年人症状性主动脉瓣狭窄或关闭不全的新兴介入手段,因其创伤小、恢复快、疗效显著的优势,TAVR在主动脉瓣病变治疗中扮演者愈发重要的角色,国外大型研究显示在中低危患者中其疗效、并发症及远期预后与手术主动脉瓣置换持平[9]。新发传导异常的发生仍然是一个棘手的问题,特别是左束支传导阻滞[10]。经过前期研究,部分学者认为new-LBBB可能与植入人工瓣膜后,主动脉根部形态学发生改变,导致紧邻的房室结受压,从而引起左束支损伤水肿有关[8]。常见的原因包括自膨式瓣膜的置入、 瓣膜尺寸过大、瓣膜置入过深、室间隔膜部长度较短、LVOT钙化、导丝/导管的损伤等相关[11-12]。
文献报道第一代瓣膜的TAVR中,左束支传导阻滞新发率可达25%,自膨式瓣膜可达18%~65%[13], 新一代瓣膜中LBBB的发生率高达77%[14],本研究中应用自膨式瓣膜的新发左束支传导阻滞27例(41.5%),符合既往研究情况。本研究中病例组主动脉瓣环水平面夹角大于对照组具有统计学意义,主要考虑当主动脉瓣环水平面夹角较大,可能导致人工主动脉瓣置入位置较深,从而损伤左束支所在区域,增加了new-LBBB的风险[12]。既往研究表明,存在过短的膜部长度时,置入瓣膜更容易压迫传导系统,这可能导致TAVR过程中手术创伤引起new-LBBB的可能性更高[15],本研究中病例组室间隔膜部长度(5.89±1.48)mm短于对照组(7.13±1.61)mm,结果与相关研究一致。本研究结果显示病例组STJ平均内径及周长大于对照组,考虑STJ越大越不利于人工瓣膜的高位固定,致使人工瓣膜置入位置过深,引起左束支区域机械损伤。LVOT 钙化及瓣膜挤压致使左束支走行区局部应力增加,尤其LVOT 钙化出现无冠窦及左冠窦下时,这是TAVR后新发左束支传导阻滞的独立危险因素[16]。若支架置入过深或膜部长度过短造成支架下端距离位于室间隔膜部下份的左束支压过近或直接覆盖于左束支之上导致对左束支压迫过重或直接损伤,从而引起左束支水肿、炎症因子聚集等,增加术后new-LBBB的风险[17],本研究中也指出支架置入深度与膜部长度的差值是TAVR术后new-LBBB的危险因素。本研究中病例组经心尖TAVR(TA-TAVR)数量多于对照组,这可能是由于经心尖输送导丝/导管及输送系统过程中需经过室间隔膜部区域,更易直接损伤传导系统,致使新发左束支传导阻滞的发生[18]。
既往研究提出对于行TAVR患者,人群基线LVEF≤50%伴new-LBBB患者LVEF恢复较new-onset LBBB患者更差,甚至基线LVEF >50%的患者出现new-LBBB或PPI需求时,LVEF会有所下降[7]。本研究中TAVR术前两组之间左室短轴收缩期增厚率无明显差异,术后1周病例组左室短轴收缩期增厚率低于对照组,考虑为左束支传导阻滞时心室正常除极和复极顺序发生改变,心室除极完全依赖右束支传导。左心室心肌除极由右心室经室间隔传入,致使除极时间显著延长,左心室游离壁收缩延迟,室间隔矛盾运动及搏幅低平,导致心室收缩不同步,造成左室短轴收缩期增厚率降低[19]。
综上所述,经心尖TAVR(TA-TAVR)是TAVR术后new-LBBB的独立危险因素,新发传导阻滞是 TAVR 术后突出且棘手的并发症,在TAVR收益人群逐步落实到低危低龄患者的征程中,需要更精准的术前评估、更成熟的手术技术及更合理的术后管理。本研究仍然存在局限性:(1)样本量小,需要更大样本量支持本研究结果,以期为TAVR术后new-LBBB的研究提供更丰富证据;(2)本研究暂无中远期随访结果,无法对TAVR术后中远期预后提供更多研究;(3)本研究主要探究了 TAVR术后左束支传导阻滞的危险因素,其他类型传导阻滞将在下一步研究中细化完善。
-
表 1 研究人群的临床基线特征[n(%),M(P25,P75),($\bar x \pm s $)]
Table 1. Baseline characteristics of the study population [n(%),M(P25,P75),($\bar x \pm s $)]
项目 病例组(n=27) 对照组(n=38) χ2/t/Z P 男/女(例) 18/9 24/14 0.085 0.771 年龄(岁) 70.41±5.04 70.68±7.37 −0.169 0.866 BMI(kg/m2) 21.77±2.87 22.57±3.36 −0.996 0.323 高血压 11(45.8) 13(54.2) 0.289 0.591 糖尿病 0(0.0) 3(7.9) 2.235 0.135 吸烟史 3(11.1) 4(10.5) 0.006 0.940 NYHA分级 Ⅱ级 3(11.1) 12(31.6) Ⅲ级 22(81.5) 26(68.4) Ⅳ级 2(7.4) 0(0.0) 肌酸激酶(U/L) 67.00(59.00,83.00) 71.00(57.00,97.00) −1.049 0.298 乳酸脱氢酶(U/L) 185.00(157.00,208.00) 189.50(172.00,244.50) −0.248 0.805 NT-proBNP(pg/mL) 1016.00 (403.00,2149.00 )549.50(360.75, 2565.25 )−0.276 0.784 表 2 研究人群围术期CTA资料比较[例(%),M(P25,P75),($\bar x \pm s $)]
Table 2. Comparison of perioperative CTA data in the study population [例(%),M(P25,P75),($\bar x \pm s $)]
变量 病例组(n=27) 对照组(n=38) χ2/t/Z P 瓣叶类型(二叶瓣) 6(22.2) 15(39.5) 2.148 0.143 瓣膜尺寸(mm) 26.78±1.908 26.18±2.967 0.980 0.331 入路(经心尖) 17(63.0) 12(31.6) 6.292 0.012* LVOT钙化 1(3.7) 5(13.2) 1.684 0.194 LVOT长径(mm) 28.79±3.37 28.19±4.40 0.588 0.559 LVOT短径(mm) 23.36±3.67 22.70±3.91 0.689 0.494 LVOT周长(mm) 86.14±8.49 83.20±12.79 1.041 0.302 LVOT面积(cm2) 5.08±1.07 4.89±1.40 0.613 0.542 STJ平均内径(mm) 33.95±4.79 31.01±5.14 2.334 0.023* STJ周长(mm) 107.40±15.36 99.00±16.31 2.104 0.039* STJ高度(mm) 18.27±3.72 17.72±3.24 0.630 0.531 STJ面积(cm2) 8.93±2.55 7.67±2.54 1.977 0.052 虚拟瓣环平均内径(mm) 24.64±2.59 24.15±3.40 0.633 0.529 虚拟瓣环周长(mm) 81.93±8.27 79.59±9.69 1.017 0.313 虚拟瓣环面积(cm2) 4.59±0.98 4.52±1.12 0.275 0.784 瓣环水平面夹角(°) 56.33±8.38 50.00±7.86 3.115 0.003* 膜部长度(mm) 5.89±1.48 7.13±1.61 −3.168 0.002* 置入深度(mm) 6.59±2.58 5.46±2.92 1.615 0.111 膜部长度与支架置入深度差值(mm) −1.00(−3.00,0.00) 1.00(−1.00,3.25) −3.086 0.003* 主动脉窦平均内径(mm) 35.74±4.67 33.29±5.77 1.821 0.073 *P < 0.05。 表 3 研究人群围术期超声心动图资料比较
Table 3. Comparison of perioperative echocardiographic data in the study population
变量 术前超声心动图 术后1周超声心动图 术前P 术后P 病例组(n=27) 对照组(n=38) 病例组(n=27) 对照组(n=38) LVEF(%) 54.78±12.22 57.92±11.45 52.04±12.09 57.76±11.21 0.293 0.054 IVS(mm) 11.41±1.74 11.21±1.80 11.00±1.54 11.13±1.98 0.661 0.774 室间隔收缩期增厚率(%) 28.22±8.31 27.37±7.95 23.00±8.01 23.13±7.78 0.677 0.947 左室后壁收缩期增厚率(%) 30.15±8.94 31.63±10.10 27.70±8.07 29.97±8.00 0.543 0.266 左室短轴收缩期增厚率(%) 28.89±7.36 30.37±6.82 26.96±7.59 30.66±6.87 0.403 0.045* *P < 0.05。 表 4 多因素Logistic回归分析
Table 4. Multi-factor logistic regression analysis
变量 β SE Wald P OR 95%CI 支架置入深度与膜部长度差值/(mm) 0.291 0.113 6.599 0.010 1.338 1.071~1.670 瓣环水平面夹角/° 0.082 0.039 4.400 0.036 1.085 1.005~1.172 入路(经心尖) −1.618 0.643 6.333 0.012 0.198 0.056~0.699 -
[1] Vahanian A,Beyersdorf F,Praz F,et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease[J]. Eur Heart J,2022,43(7):561-632. doi: 10.1093/eurheartj/ehab395 [2] 孔祥权,高晓飞,张娟,等. 经导管主动脉瓣置换术相关新瓣膜的研究进展[J]. 华西医学.,2023,38(9):1309-1313. [3] Mack M J,Leon M B,Thourani V H,et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients[J]. N Engl J Med,2019,380(18):1695-1705. doi: 10.1056/NEJMoa1814052 [4] Siontis G C M,Overtchouk P,Cahill T J,et al. Transcatheter aortic valve implantation vs. surgical aortic valve replacement for treatment of symptomatic severe aortic stenosis: an updated meta-analysis[J]. Eur Heart J,2019,40(38):3143-3153. doi: 10.1093/eurheartj/ehz275 [5] Muntané-carol G,Guimaraes L,Ferreira-neto A N,et al. How does new-onset left bundle branch block affect the outcomes of transcatheter aortic valve repair?[J]. Expert Rev Med Devices,2019,16(7):589-602. doi: 10.1080/17434440.2019.1624161 [6] 戴晗怡,朱齐丰,刘先宝. 经导管主动脉瓣置换术后传导阻滞的研究现状[J]. 华西医学.,2021,36(9):1167-1171. [7] Dolci G,Singh G K,Wang X,et al. Effects of left bundle branch block and pacemaker implantation on left ventricular systolic function after transcatheter aortic valve implantation[J]. Am J Cardiol,2022,179:64-69. doi: 10.1016/j.amjcard.2022.06.014 [8] 张文杰,孟哲,李黎,等. 经导管主动脉瓣置入术后新发左束支传导阻滞危险因素分析及对左心室功能的影响[J]. 临床心血管病杂志.,2022,38(6):495-500. [9] Howard C,Jullian L,Joshi M,et al. TAVI and the future of aortic valve replacement[J]. J Card Surg,2019,34(12):1577-1590. doi: 10.1111/jocs.14226 [10] Zhang J,Pan Y,Wang B,et al. Current opinions on new-onset left bundle branch block after transcatheter aortic valve replacement and the search for physiological pacing[J]. Rev Cardiovasc Med,2022,23(3):90-102. doi: 10.31083/j.rcm2303090 [11] 党梦秋,范嘉祺,朱齐丰,等. 《经导管主动脉瓣置换术中国专家共识(2020更新版)》解读[J]. 心电与循环.,2021,40(01):1-5. [12] Zhang X,Liang C,Zha L,et al. Predictors for new-onset conduction block in patients with pure native aortic regurgitation after transcatheter aortic valve replacement with a new-generation self-expanding valve (VitaFlow Liberty (™)): A retrospective cohort study[J]. BMC Cardiovasc Disord,2024,24(1):77-92. doi: 10.1186/s12872-024-03735-z [13] Auffret V,Puri R,Urena M,et al. Conduction disturbances after transcatheter aortic valve replacement: current status and future perspectives[J]. Circulation,2017,136(11):1049-1069. doi: 10.1161/CIRCULATIONAHA.117.028352 [14] Zaman S,Mccormick L,Gooley R,et al. Incidence and predictors of permanent pacemaker implantation following treatment with the repositionable Lotus™ transcatheter aortic valve[J]. Catheter Cardiovasc Interv,2017,90(1):147-154. doi: 10.1002/ccd.26857 [15] Zaid S,Sengupta A,Okoli K,et al. Novel anatomic predictors of new persistent left bundle branch block after evolut transcatheter aortic valve implantation[J]. Am J Cardiol,2020,125(8):1222-1229. doi: 10.1016/j.amjcard.2020.01.008 [16] Sammour Y,Krishnaswamy A,Kumar A,et al. Incidence,predictors,and implications of permanent pacemaker requirement after transcatheter aortic valve replacement[J]. JACC Cardiovasc Interv,2021,14(2):115-134. doi: 10.1016/j.jcin.2020.09.063 [17] Boonyakiatwattana W,Maneesai A,Chaithiraphan V,et al. Preprocedural and procedural variables that predict new-onset conduction disturbances after transcatheter aortic valve replacement[J]. BMC Cardiovasc Disord,2022,22(1):135-147. doi: 10.1186/s12872-022-02576-y [18] Agha A M,Burt J R,Beetler D,et al. The association between transcatheter aortic valve replacement (tavr) approach and new-onset bundle branch blocks[J]. Cardiol Ther,2019,8(2):357-364. doi: 10.1007/s40119-019-0137-2 [19] 尹立雪. 现代超声心脏电生理学[M]. 北京: 人民军医出版社,2007: 359-364. -






 下载:
下载:
 下载:
下载:

