Pyrotosis Participates in the Pathogenesis of Necrotizing Enterocolitis in Early Offspring Rats
-
摘要:
目的 通过建立坏死性小肠结肠炎的小鼠模型,检测新生子鼠发生NEC早期时血清中细胞焦亡的关键蛋白分子,从而初步判断细胞焦亡是否参与早期新生儿坏死性小肠结肠炎的发病。 方法 将新出生的子鼠随机分为实验组和对照组,实验组的子鼠诱导为NEC的动物模型,抽取2组子鼠血液,用Elisa试剂盒检测所有子鼠血清中IL-18、Gasdermin D、Caspase-1的浓度,运用秩和检验统计学方法,比较2组血清中目标蛋白的浓度,检验水准α = 0.05。 结果 2组子鼠血清中Gasdermin D、Caspase-1的浓度差异有统计学意义,P值分别为0.017、< 0.001,可认为实验组子鼠血清中Gasdermin D、Caspase-1的浓度高于对照组,2组血清中IL-18的浓度无明显差异,P = 0.755。 结论 由Gasdermin D介导的细胞焦亡可能参与早期NEC的发病。 -
关键词:
- Gasdermin D /
- 细胞焦亡 /
- 坏死性小肠结肠炎 /
- 新生儿
Abstract:Objective To establish a mouse model of necrotizing enterocolitis and detect the key protein molecules in serum of neonatal rats with early NEC, so as to preliminatively determine whether necrotizing enterocolitis is involved in early neonatal necrotizing enterocolitis. Methods The NEC mouse model was established and randomly divided into the experimental group and control group with 12 newborn rats in each group. The neonatal rats in the experimental group were induced into NEC animal models. Blood samples were extracted and the concentrations of IL-18, Gasdermin D and Caspase-1 in serum of all rats were detected by Elisa kit. The concentration of target protein in serum of the two groups was compared, α = 0.05. Results The concentrations of Gasdermin D and Caspase-1 in serum of rats in the two groups were significantly different, with P values of 0.017 and < 0.001, respectively. It could be considered that the concentrations of Gasdermin D and caspase-1 in serum of rats in the experimental group were higher than those in the control group. There was no significant difference in serum IL-18 concentration between the two groups (P = 0.755). Conclusion Gasdermin D mediated pyroptosis may be involved in the pathogenesis of early NEC. -
Key words:
- Gasdermin D /
- Pyroptosis /
- Necrotizing enterocolitis /
- Neonatal
-
新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是新生儿常见的消化道疾病,临床上以腹胀、呕吐、便血为主要表现,严重者可发生消化道穿孔、弥漫性腹膜炎、休克、多器官功能衰竭[1-3]。NEC发病的基本机制是肠道炎症反应,近年来关于NEC发病机制的研究成为热点,但至今尚未阐述清楚。有研究者发现,细胞焦亡(Pyroptosis)的关键分子在NEC中会明显升高,如白细胞介素(interleukin,IL)-1β、白细胞介素(interleukin,IL)-18、天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)-1、消皮素 D(gasdermin D,GSDMD)等,从而证实了细胞焦亡参与NEC的发病[4-6]。但是这些关键分子蛋白是否会在早期NEC中明显升高,值得进一步实验论证。
1. 材料与方法
1.1 NEC动物模型建立及分组
以新出生的子鼠为研究对象,买怀孕14 d的SD孕鼠,购自昆明理工大学动物实验中心,孕鼠在动物房适应7 d左右后待其自然生产。将新出生的子鼠按照完全随机分组方法,分为实验组和对照组。对照组子鼠15只,与母鼠同笼,由母鼠以鼠乳喂养,待其自然生长,不做任何处理。最终选取12只正常子鼠纳入实验对象。
实验组子鼠20只, 运用缺氧、喂养不当、寒冷刺激等处理诱导子鼠发病,将子鼠放置在缺氧培育箱中,缺氧箱内气体是5%氧气混合95%氮气,每天缺氧处理3次,每次10 min,连续处理3 d,间隔期将子鼠放置4 ℃的冰箱进行寒冷刺激,同样是每天进行3次,每次10 min,连续处理3 d,诱导过程中以鼠乳代用品人工喂养[7-8]。排除死亡子鼠,将实验组出现活动能力减少、反应变差、摄食减少、腹胀、胃潴留的子鼠定义为早期NEC模型子鼠,共计12只,并纳入实验对象。
1.2 诊断标准
本次研究早期NEC小鼠模型的定义参考新生儿早期NEC的诊断标准[9-10],前期通过对临床上早期NEC患儿粪便隐血阳性率统计,研究结果提示早期NEC出现粪便隐血的阳性率不高[11],故建模中无论子鼠粪便有无肉眼血丝均视为建模成功,上述子鼠的症状与临床中新生儿早期NEC症状基本一致。
1.3 蛋白浓度的测定
将所有建模成功的子鼠处以安乐死,立即抽取处以安乐死子鼠的血液于收集管中,小心分离出血清,置于-80 ℃冰箱中保存。Elisa试剂盒由睿信生物公司提供,分别是IL-18、Gasdermin D、Caspase-1等3个试剂盒,按照试剂盒的说明书步骤测定血清中目标蛋白分子的吸光度,通过样本的吸光度(OD值),利用方程计算血清中蛋白分子的浓度。
1.4 统计学处理
本次研究采用随机对照的研究方法,用SPSS 22.0 进行统计学分析,由于蛋白分子浓度总体分布不明,需进行正态性检验,经S-W检验以及直方图结果显示,各组数据不服从正态分布,因此数据不满足正态分布,故运用秩和检验对上述蛋白分子进行统计分析,检验水准α = 0.05。
2. 结果
2.1 实验组与对照组子鼠肠道形态变化
2组子鼠肠道组织肉眼观察所示:实验组子鼠的肠道在开腹时呈现出肠管 明显积气增粗,取出后如图1A所示部分肠壁颜色变暗,出现缺血样改变,肠腔内有较多血性液体积聚,肠曲形态自然,肠壁光滑,并未出现明显坏死及串珠样改变;对照组子鼠的肠道在开腹时并无积气表现,取出后如图1B所示肠管呈淡黄色,肠腔内无血性液体积聚,肠曲形态自然,肠壁光滑。
2.2 血清中Gasdermin D的浓度分析
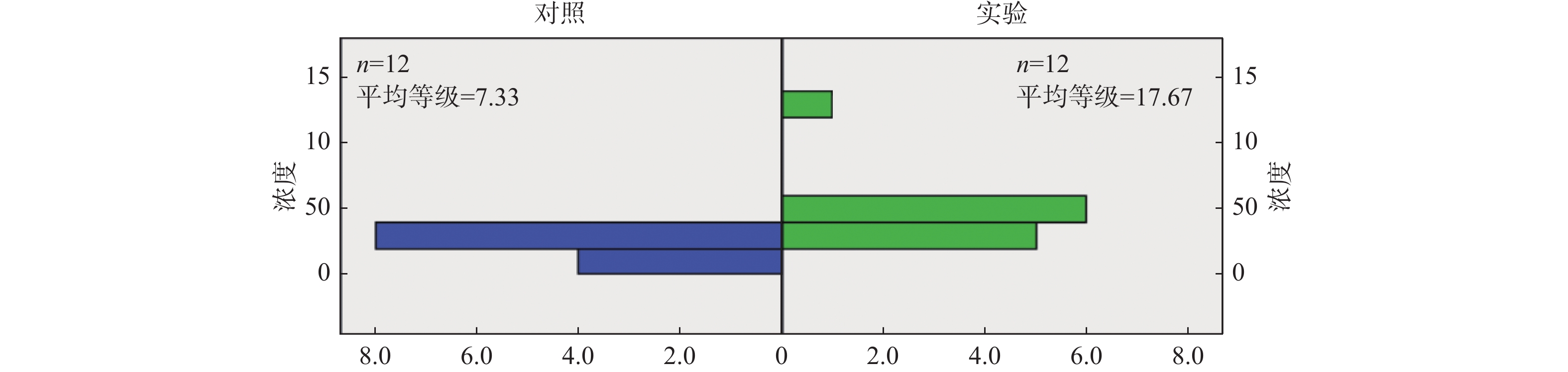
用Gasdermin D Elisa试剂盒检测2组子鼠血清中Gasdermin D蛋白分子的浓度,实验组Gasdermin D浓度的中位数为1.2000 (1.0600,1.5225),对照组中位数为1.0100 (0.7625,1.0925),运用秩和检验统计分析方法,结果提示P为0.017,差异有统计学意义,可认为实验组子鼠血清中Gasdermin D的浓度高于对照组,见表1,图2。
表 1 2组子鼠血清中Gasdermin D浓度差异比较[M(P25,P75)]Table 1. Comparison of serum Gasdermin D concentration difference between two groups of rats [M(P25,P75)]组别 Gasdermin D浓度 Z P 实验组 1.2000 (1.0600,1.5225) −2.369 0.017* 对照组 1.0100 (0.7625,1.0925) *P < 0.05。 2.3 血清中Caspase-1的浓度分析
2组子鼠血清中Caspase-1蛋白分子的浓度,实验组Caspase-1浓度的中位数为4.0900 (3.1175,4.9175),对照组中位数为2.2550 (1.9925,2.9000),运用秩和检验统计分析方法,结果提示P < 0.001,差异有统计学意义,可认为实验组子鼠血清中Caspase-1的浓度高于对照组,见表2,图3。
表 2 2组子鼠血清中Caspase-1浓度差异比较[M(P25,P75)]Table 2. Comparison of Caspase-1 concentration difference between two groups of rats [M(P25,P75)]组别 Caspase-1浓度 Z P 实验组 4.0900 (3.1175,4.9175) −3.580 < 0.001* 对照组 2.2550 (1.9925,2.9000) *P < 0.05。 2.4 血清中IL-18的浓度分析
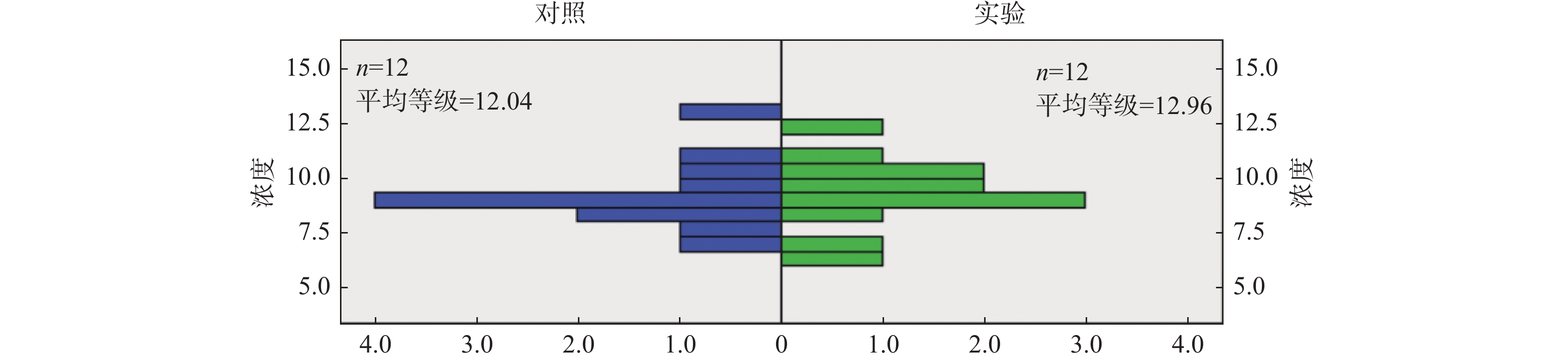
与上述Gasdermin D及Caspase-1统计结果不同,用试剂盒检测两组子鼠血清中IL-18蛋白分子的浓度,实验组IL-18浓度的中位数为 9.3050 (8.3350,10.2000),对照组中位数为8.9100 (8.1475,10.0425),秩和检验统计分析结果提示P为0.755,差异无统计学意义,即实验组子鼠血清中IL-18的浓度与对照组无明显差异,见表3,图4。
表 3 2组子鼠血清中IL-18浓度差异比较[M(P25,P75)]Table 3. Comparison of IL-18 concentration difference between two groups of rats [M(P25,P75)]组别 IL-18浓度 Z P 实验组 9.3050 (8.3350,10.2000) −0.318 0.755 对照组 8.9100 (8.1475,10.0425) *P < 0.05。 3. 讨论
NEC是新生儿最严重的消化道疾病,实质是肠道炎症反应,与肠道菌群失调、喂养不耐受、肠道粘膜屏障受损、免疫力低下、感染、缺血缺氧等因素密切相关[12-15],主要累及远端小肠和近端结肠[16],中性粒细胞广泛浸润导致穿孔、腹膜炎、全身性脓毒症和多器官衰竭等危及患儿生命,发病机制过于复杂,目前认为是免疫系统的过度炎症反应,引起剧烈的炎症风暴,导致肠道通透性增加、细菌移位和炎症,但是具体机制尚不明确[17-18]。
近年来,NEC的炎症机制已然成为国内外学者的研究热点,有研究者发现细胞焦亡这一特殊的细胞死亡方式,参与NEC的发病。细胞焦亡是一种细胞程序性死亡的方式,而Gasdermin D是炎症细胞死亡的核心蛋白分子,Gasdermin D发挥有赖于被活化的Caspase-1、Caspase-11及人类同源的Caspase-4/5等切割成有活性的N-端结构域和无活性的C-端结构域,有活性的N-端结构与细胞膜上特定的磷脂分子结合,介导非离子选择性孔道的形成,将细胞内IL-18等炎症介质释放至细胞外[19-23]。因此,当机体发生细胞焦亡时,血清中IL-18、Gasdermin D、Caspase-1等蛋白分子的浓度会出现升高。
既往研究者通过建立动物模型探讨NEC的发病机制[24],致力于发现对NEC诊断具有较高敏感度及特异性的生物蛋白分子[25-26],在研究过程中证实细胞焦亡参与NEC的发病,但是具体的信号通路仍在进一步研究,同时提出Gasdermin D、Caspase-1的发现有望为NEC的抗炎治疗提供新的方向[27-28]。本次研究着力于早期NEC的发病机制,通过建立与早期临床症状相符的动物模型,探讨IL-18、Gasdermin D、Caspase-1等细胞焦亡的关键分子蛋白是否会在早期NEC中明显升高,并且希望通过本次研究,发现适用于NEC早期诊断的特异性分子蛋白,从而达到提高早期诊断率、及时进行干预的目的[29-30]。
由于早期NEC患儿肠道炎症较轻,诊断依据主要为临床表现及体征,而实验室检查及影像学检查均无明显特异性,在治疗上通常采取内科治疗方式,因此本次研究基于与临床相符原则,参照早期NEC的临床症状建立早期NEC动物模型,以症状为主要建模成功标准,并未对肠道组织进行组织病理学形态分析。在建模过程中,新生子鼠的活动能力、喂养情况、一般反应均变差,并出现腹胀症状,在下一次喂养之前进行胃液回抽可见胃液残留增多,将处以安乐死的子鼠剖开腹部可见肠管明显充气扩张,临床上早期NEC患儿的影像学征象主要以肠管积气扩张为主,因此本次研究中的动物模型与早期新生儿NEC临床表现基本一致,并且从图1中A图所示,肉眼观实验组子鼠肠腔内可见血性液体增多,部分肠壁呈现缺血样改变,也证实了实验组子鼠肠道已经出现炎症性损伤。
本次研究发现,Gasdermin D、Caspase-1作为细胞焦亡的关键蛋白分子,在实验组动物模型血清中的浓度出现升高,推断这两种蛋白分子在早期NEC中就会出现升高,因此细胞焦亡在早期就参与NEC的发病。Gasdermin D、Caspase-1可能通过介导炎症分子的逐级激活,参与炎症的发生,导致肠道上皮细胞炎症性损伤,并且可能成为NEC靶向治疗的特异性蛋白分子[31-32],通过抑制这两种蛋白分子活性,从而达到抑制炎症逐级激活,减轻NEC肠道炎症反应。通常IL-18作为Gasdermin D的下游炎症分子,理论上实验组血清中的浓度应该高于对照组,而本次研究中IL-18在两组血清中的浓度无明显差异,由于各炎症分子之间相互激活途径比较复杂,因此有待进一步深入研究证实。
综上所述,本研究通过建立早期NEC的动物模型,检测血清中Gasdermin D、Caspase-1等在早期NEC中明显升高,从而证实了细胞焦亡参与早期NEC的发病,但是具体的参与机制有待以后各位学者继续研究探索,并且Gasdermin D及Caspase-1在新生儿血清中正常的参考值范围值得进一步明确,为临床上早期NEC的诊断及治疗提供新的方向。
-
表 1 2组子鼠血清中Gasdermin D浓度差异比较[M(P25,P75)]
Table 1. Comparison of serum Gasdermin D concentration difference between two groups of rats [M(P25,P75)]
组别 Gasdermin D浓度 Z P 实验组 1.2000 (1.0600,1.5225) −2.369 0.017* 对照组 1.0100 (0.7625,1.0925) *P < 0.05。 表 2 2组子鼠血清中Caspase-1浓度差异比较[M(P25,P75)]
Table 2. Comparison of Caspase-1 concentration difference between two groups of rats [M(P25,P75)]
组别 Caspase-1浓度 Z P 实验组 4.0900 (3.1175,4.9175) −3.580 < 0.001* 对照组 2.2550 (1.9925,2.9000) *P < 0.05。 表 3 2组子鼠血清中IL-18浓度差异比较[M(P25,P75)]
Table 3. Comparison of IL-18 concentration difference between two groups of rats [M(P25,P75)]
组别 IL-18浓度 Z P 实验组 9.3050 (8.3350,10.2000) −0.318 0.755 对照组 8.9100 (8.1475,10.0425) *P < 0.05。 -
[1] Meister A L,Doheny K K,Travagli R A. Necrotizing enterocolitis: It’s not all in the gut[J]. Exp Biol Med (Maywood),2020,245(2):85-95. doi: 10.1177/1535370219891971 [2] Thänert R, Keen E C, Dantas G, et al. Necrotizing enterocolitis and the microbiome: Current status and future directions[J]. J Infect Dis, 2021, 223(12 Suppl 2): S257-S263. [3] Neu J. Necrotizing enterocolitis: The future[J]. Neonatology,2020,117(2):240-244. doi: 10.1159/000506866 [4] 胡刘宏,余加林,艾青,等. 细胞焦亡在新生儿坏死性小肠结肠炎中的致病作用[J]. 第三军医大学学报,2017,39(14):1440-1444. [5] Gao W,Li Y,Liu X,et al. TRIM21 regulates pyroptotic cell death by promoting gasdermin D oligomerization[J]. Cell Death Differ,2022,29(2):439-450. doi: 10.1038/s41418-021-00867-z [6] Zhang K,Fang H,Ye Q,et al. Epithelial gasdermin D shapes the host-microbial interface by driving mucus layer formation[J]. Sci Immunol,2022,7(68):eabk2092. doi: 10.1126/sciimmunol.abk2092 [7] 刘斌,阎静江,李晓霞. 新生鼠坏死性小肠结肠炎动物模型建立方法改进[J]. 中国现代医生,2015,53(35):22-25,161. [8] Corsini I,Polvani S,Tarocchi M,et al. Peroxisome proliferator-activated receptor-γ agonist pioglitazone reduces the development of necrotizing enterocolitis in a neonatal preterm rat model[J]. Pediatr Res,2017,81(2):364-368. doi: 10.1038/pr.2016.214 [9] 于广军, 陈津津, 程茜, 等. 高危儿管理[M]. 第1版. 北京: 人民卫生出版社, 2020: 59-60. [10] Patel R M,Ferguson J,McElroy S J,et al. Defining necrotizing enterocolitis: Current difficulties and future opportunities[J]. Pediatr Res,2020,88(Suppl 1):10-15. [11] 王静,唐莲芳,顾美群,等. 新生儿坏死性小肠结肠炎的危险因素及早期临床特点[J]. 昆明医科大学学报,2021,42(11):99-104. doi: 10.12259/j.issn.2095-610X.S20211118 [12] Duchon J,Barbian M E,Denning P W. Necrotizing enterocolitis[J]. Clin Perinatol,2021,48(2):229-250. doi: 10.1016/j.clp.2021.03.002 [13] Nolan L S,Wynn J L,Good M. Exploring clinically-relevant experimental models of neonatal shock and necrotizing enterocolitis[J]. Shock,2020,53(5):596‐604. [14] Ganji N,Li B,Ahmad I,et al. Remote ischemic conditioning in necrotizing enterocolitis: Study protocol of a multi-center phase II feasibility randomized controlled trial[J]. Pediatr Surg Int,2022,38(5):679-694. doi: 10.1007/s00383-022-05095-1 [15] Perrone S,Cremonini I,Marinelli F,et al. New strategies for necrotizing enterocolitis diagnosis and prevention in newborns[J]. Curr Pediatr Rev,2021,17(3):191-200. [16] Hwang M,Tierradentro-García L O,Dennis R A,et al. The role of ultrasound in necrotizing enterocolitis[J]. Pediatr Radiol,2022,52(4):702-715. doi: 10.1007/s00247-021-05187-5 [17] De Fazio L,Beghetti I,Bertuccio S N,et al. Necrotizing enterocolitis: Overview on in vitro models[J]. Int J Mol Sci,2021,22(13):6761. doi: 10.3390/ijms22136761 [18] Duci M,Fascetti-Leon F,Erculiani M,et al. Neonatal independent predictors of severe NEC[J]. Pediatr Surg Int,2018,34(6):663‐669. [19] Nagai H,Kirino Y,Nakano H,et al. Elevated serum gasdermin D N-terminal implicates monocyte and macrophage pyroptosis in adult-onset still's disease[J]. Rheumatology (Oxford),2021,60(8):3888-3895. doi: 10.1093/rheumatology/keaa814 [20] Zheng J,Wang D,Chen Q,et al. Hypertonic saccharide solution delays pyroptosis in murine macrophages regardless of the membrane binding of gasdermin D N-terminal[J]. Eur J Immunol,2020,50(3):464-467. doi: 10.1002/eji.201948230 [21] Bibo-Verdugo B,Snipas S J,Kolt S,et al. Extended subsite profiling of the pyroptosis effector protein gasdermin D reveals a region recognized by inflammatory caspase-11[J]. J Biol Chem,2020,295(32):11292-11302. doi: 10.1074/jbc.RA120.014259 [22] Cheng Q,Pan J,Zhou Z L,et al. Caspase-11/4 and gasdermin D-mediated pyroptosis contributes to podocyte injury in mouse diabetic nephropathy[J]. Acta Pharmacol Sin,2021,42(6):954-963. doi: 10.1038/s41401-020-00525-z [23] 王静,米弘瑛. 新生儿坏死性小肠结肠炎发病机制的研究进展[J]. 重庆医学,2021,50(4):694-697. [24] Nolan L S,Wynn J L,Good M. Exploring clinically-relevant experimental models of neonatal shock and necrotizing enterocolitis[J]. Shock,2020,53(5):596-604. [25] Hosfield B D,Drucker N A,Pecoraro A R,et al. The assessment of microbiome changes and fecal volatile organic compounds during experimental necrotizing enterocolitis[J]. J Pedia -tr Surg,2021,56(6):1220-1225. doi: 10.1016/j.jpedsurg.2021.02.043 [26] Griffiths V,Al Assaf N,Khan R. Review of claudin proteins as potential biomarkers for necrotizing enterocolitis[J]. Ir J Med Sci,2021,190(4):1465-1472. [27] Gao L,Dong X,Gong W,et al. Acinar cell NLRP3 inflammasome and gasdermin D (GSDMD) activation mediates pyroptosis and systemic inflammation in acute pancreatitis[J]. Br J Pharmacol,2021,178(17):3533-3552. doi: 10.1111/bph.15499 [28] Booty L M,Bryant C E. Gasdermin D and beyond - gasdermin-mediated pyroptosis in bacterial infections[J]. J Mol Biol,2022,434(4):167409. doi: 10.1016/j.jmb.2021.167409 [29] Evidence-Based Medicine Group. Clinical guidelines for the diagnosis and treatment of neonatal necrotizing enterocolitis (2020)[J]. Zhongguo Dang Dai Er Ke Za Zhi,2021,23(1):1-11. [30] Neu J. Prevention of necrotizing enterocolitis[J]. Clin Perinatol,2022,49(1):195-206. [31] Pandeya A,Li L,Li Z,et al. Gasdermin D (GSDMD) as a new target for the treatment of infection[J]. Medchemcomm,2019,10(5):660-667. doi: 10.1039/C9MD00059C [32] Kambara H,Liu F,Zhang X,et al. Gasdermin D exerts anti-inflammatory effects by promoting neutrophil death[J]. Cell Rep,2018,22(11):2924-2936. doi: 10.1016/j.celrep.2018.02.067 期刊类型引用(1)
1. 刘云蓉,席作武,史登辉,李天硕. 白芍苷对新生大鼠坏死性小肠结肠炎肠道菌群及屏障功能的影响. 现代消化及介入诊疗. 2023(08): 986-991 .  百度学术
百度学术其他类型引用(0)
-







 下载:
下载:

 下载:
下载:

