The Prognostic Value of Preoperative Peripheral Blood Inflammatory Markers Combined with Tumor Markers in Resectable Colon Cancer Patients
-
摘要:
目的 分析术前外周血相关炎性指标中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)联合肿瘤标记物癌胚抗原(carcinoembryonic antigen,CEA)、糖蛋白抗原19-9 (glycoprotein antigen19-9,CA19-9)对结肠癌患者的预后价值。 方法 选取2018年5月至2020年10月在昆明医科大学第一附属医院就诊的158例结肠癌患者病例资料进行回顾性研究,受试者工作特征曲线(receiver operating characteristic curve,ROC)确定各项指标的临界值并进行分组,使用Kaplan-Meier法分析NLR、CEA、CA19-9及联合检测不同指标与患者生存预后的关系,通过多变量Cox回归分析影响患者预后因素。 结果 患者术前NLR水平(P = 0.035)、联合检测组(P = 0.008)及术后病理N分期(P < 0.001)为结肠癌患者的独立危险因素,且术前指标中联合检测组风险比最高(P = 0.008,HR= 2.664,95%CI 1.503~4.315)。 结论 术前外周血中NLR、CEA、CA19-9联合检测对结肠癌患者具有独立的预后价值。 -
关键词:
- 中性粒细胞/淋巴细胞比值 /
- 癌胚抗原(CEA) /
- 糖蛋白抗原(CA19-9) /
- 预后 /
- 结肠癌
Abstract:Objective To analyze the prognostic value of preoperative peripheral blood inflammatory markers neutrophil to lymphocyte ratio (NLR) combined with tumor markers carcinoembryonic antigen (CEA) and glycoprotein antigen CA19-9 in patients with colon cancer. Methods A retrospective study was conducted on 158 cases of colon cancer patients who visited the 1st Affiliated Hospital of Kunming Medical University from May 2018 to October 2020. The receiver operating characteristic curve (ROC) was used to determine the critical values of various indicators and group them. The Kaplan Meier method was used to analyze the relationship between NLR, CEA, CA19-9, and combined detection of different groups and patient survival prognosis. Multivariate Cox regression analysis was used to analyze the factors affecting patient prognosis. Results The preoperative NLR level (P = 0.035), combined testing group (P = 0.008), and postoperative pathological N stage (P < 0.001) were independent risk factors for OS, and the joint testing group had the highest risk ratio among preoperative indicators (P = 0.008, HR = 2.664, 95%CI 1.503~4.315). Conclusion The combined detection of NLR, CEA, and CA19-9 in peripheral blood before surgery has independent prognostic value for patients with colon cancer. -
结直肠癌一直被认作是消化道常见恶性肿瘤,其发病率居全球第4位,死亡率居全球第5位[1],随着结肠癌发病率越来越高,患者经济负担也一直居高不下[2]。以往的研究表明,术前外周血中性粒与淋巴细胞比率(Neutrophil to lymphocyte ratio,NLR)可能在肿瘤微环境中发生重大作用[3−4],可以作为诊断结直肠癌预后的重要指标[5];血清中癌胚抗原(Carcinoembryonic antigen,CEA)、糖蛋白抗原19-9(CA19-9)也与结肠癌患者淋巴结转移及其预后存在明显关系[6]。
然而,关于术前血清炎性指标及其比值与肿瘤标记物联合检测对于结肠癌患者预后价值的研究相对较少。因此,进行了1项回顾性研究,以此评估NLR、CEA、CA19-9联合检测对于结肠癌病人的预后价值,为临床医生对结肠癌患者的日常评估和治疗提供一定的参考。
1. 资料与方法
1.1 研究对象
收集2018年5月至2020年10月在昆明医科大学第一附属医院就诊的158例行结肠癌根治术患者病例资料,所有患者签署知情同意书,本研究经昆明医科大学第一附属医院伦理委员会批准[(2024)伦审L第100号]。
1.2 纳入标准[7]
(1)所有接受结肠癌切除术或结肠癌切除+区域淋巴结清扫术;(2)经肠镜取材活检或术后病理证实为结肠恶性肿瘤;(3)术前各类检查均未发现有腹腔或远处转移;(4)术前未发现有慢性炎症或自身免疫性相关疾病;(5)术前未进行放化疗及免疫治疗;(6)全身未存在其他恶性肿瘤。
1.3 排除标准[8]
(1)术前合并心血管系统、循环系统、内分泌系统等其他方面的严重疾病;(2)术前缺乏NLR和肿瘤标志物;(3)术中或术后出现严重并发症或死亡。
1.4 调查方法及内容
通过医院住院系统及病案室进行数据收集,观察指标除年龄性别外,还包括血清学检查(NLR、CEA、CA19-9)、肿瘤大小、T分期、N分期、肿瘤分化程度。以术后复查登记和电话咨询方式进行随访。每6个月随访1次,直至术后2 a,随访内容包括实验室检查(血常规血生化)、影像学检查(胸腹部增强CT)、消化内镜等,之后每1年随访1次或直到死亡,计算术后任意时间死亡或到末次随访时间的总生存时间(overall survival rate,OS)及从手术切除到局部复发的时间(disease free survival,DFS)。末次随访于2023年5月进行,最终随访158例患者,失访21例。
1.5 统计学处理
使用SPSS25.0软件进行统计学分析,计量资料以均数$ \pm $标准差($ \bar x \pm s $)来表示,其他计数资料以例数和百分比表示。采用Kaplan-Meier法进行单因素分析,并使用Log-Rank检验评估各组间差异。通过Graphpad Prism9.0绘图并得出风险比(hazardsratio,HR)。利用Cox风险比例模型进行多因素分析。以P < 0.05为差异具有统计学意义。
2. 结果
2.1 一般情况
本研究共纳入158例可切除结肠癌患者资料,其中男性96例,女性62例,年龄为23~80(60.54±8.35)岁;根据UICC/AJCC第8版进行TNM分期,其中T1~T2共26例、T3~T4共132例、淋巴结N0共93例、N1共39例、N2共26例;术后肿瘤超过4.5 cm共85例,小于4.5 cm共73例;高分化肿瘤共43例、中分化肿瘤共96例、低分化肿瘤共19例;术前血清学NLR(2.72±0.53)109/L、CEA(8.42±3.43)ng/mL、CA19-9(52.12±15.46)U/mL,患者5 a生存率为73%。
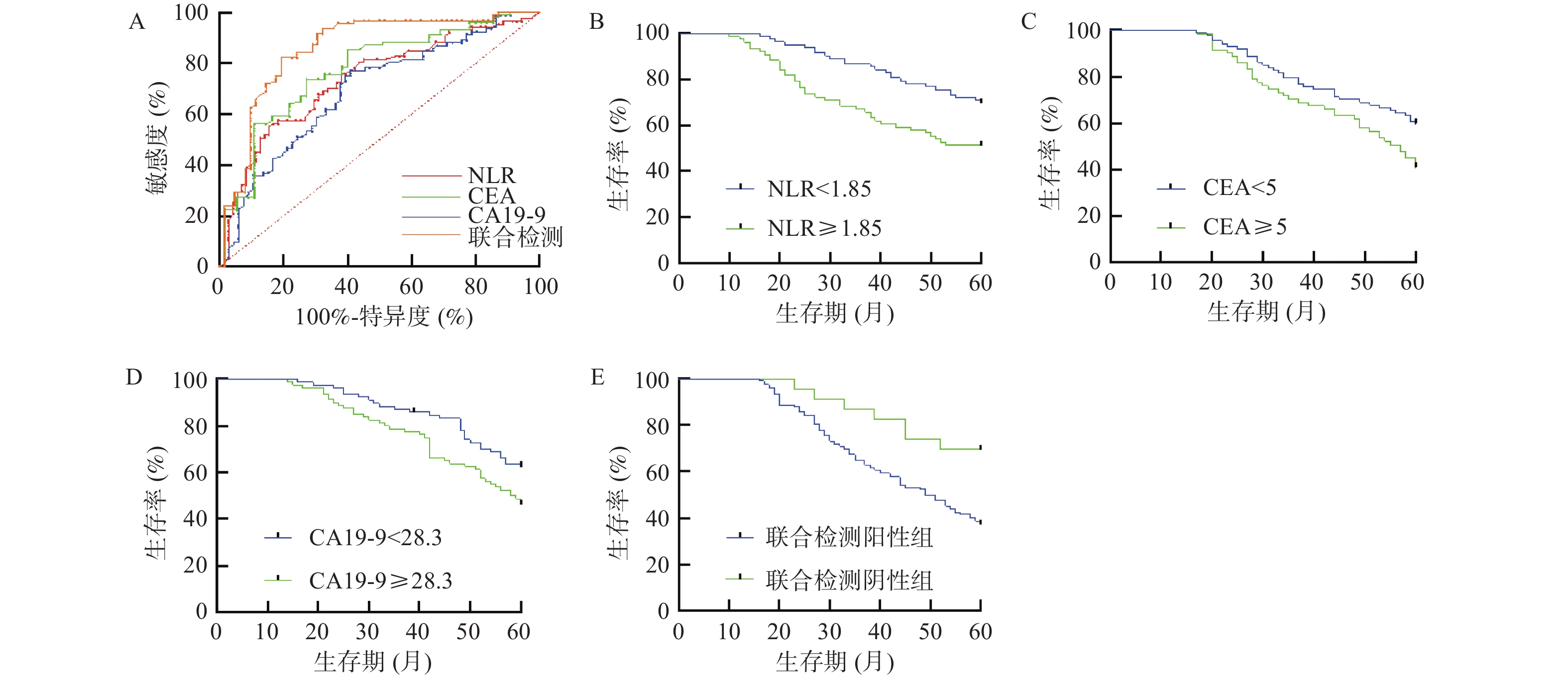
2.2 NLR、CEA、CA19-9及联合检测指标预测OS的ROC曲线分析
结果显示,NLR曲线下面积为0.737(95%CI:0.659~0.815),最佳截断值为1.85(灵敏度=57.4%,特异度=80.2%);CEA曲线下面积为0.692(95%CI:0.609~0.776),最佳截断值为5(灵敏度=43.2%,特异度=78.5%);CA19-9曲线下面积为0.712(95%CI:0.696~0.851),最佳截断值为28.3(灵敏度=58.5%,特异度=84.6%);联合检测曲线下面积为0.783(95%CI:0.795~0.924),见图1A。根据最佳截断值,将NLR、CEA、CA19-9分为阳性组及阴性组,阳性率分别为53%、41%、50%。3项指标有1项阳性即为联合检测阳性组,其阳性率为85%。联合检测指标AUC及阳性率高于单一指标。
2.3 结肠癌预后危险因素
Kaplan-Meier单因素分析结果显示,除性别、肿瘤分化程度外,其余各项指标均与OS及DFS具有相关性(P < 0.05),但年龄、术前血清CA19-9与OS具有相关性,而与DFS无相关性(P > 0.05),见表1。Cox多因素分析显示,术前NLR、NLR+CEA+CA19-9联合检测及术后病理N分期为结肠癌患者OS和DFS的独立危险因素,见表2。
表 1 结肠癌患者单因素分析Table 1. Single factor analysis of colon cancer patients类别 n 总生存 无病生存 生存率(%) P 生存率(%) P 性别 0.223 0.437 男 96 64.3 59.2 女 62 57.8 55.8 年龄(岁) 0.002* 0.083 ≤60 82 68.4 62.9 >60 76 53.8 45.5 肿瘤大小(cm) 0.001* 0.021* ≤4.5 73 66.4 60.7 >4.5 85 44.6 42.3 N分期 <0.001* <0.001* N0 93 70.4 68.6 N1 39 62.4 52.7 N2 26 40.2 37.3 T分期 0.329 0.089 T1-T2 26 60.7 53.4 T3-T4 132 48.3 44.6 分化程度 0.083 0.633 高分化 43 68.1 62.8 中分化 96 56.4 53.2 低分化 19 40.7 36.7 NLR 0.007* 0.015* <1.85 75 69.5 62.2 ≥1.85 83 51.3 46.1 CEA(ng/ml) 0.023* 0.010* <5 93 59.8 53.2 ≥5 65 40.8 38.1 CA19-9(U/ml) 0.035* 0.266 <28.3 78 62.8 56.4 ≥28.3 80 56.3 47.2 NLR+CEA+CA19-9 0.008* 0.008* 阴性组 23 69.6 62.6 阳性组 135 37.0 33.3 注:*P < 0.05。 表 2 结肠癌患者多因素分析Table 2. Multivariate analysis of colon cancer patients因素 总生存 无病生存 HR值(95%CI) P HR值(95%CI) P 年龄 1.004(0.529~1.904) 0.271 1.200(0.743~1.939) 0.456 肿瘤大小 1.454(0.837~2.194) 0.106 0.801(0.411~1.563) 0.515 N分期 2.804(1.373-5.724) <0.001* 2.514(1.627~3.882) <0.001* NLR 1.577(1.074~2.283) 0.035* 1.678(1.084~1.598) 0.021* CEA 1.088(0.871~1.493) 0.353 1.442(0.940~2.211) 0.094 CA19-9 0.860(0.774~1.249) 0.761 1.287(0.828~2.000) 0.262 NLR+CEA+CA19-9 2.664(1.503~4.315) 0.008* 1.927(1.211~2.908) 0.009* 注:*P < 0.05。 2.4 生存分析
NLR阳性组患者OS低于阴性组患者(P < 0.001,χ2=7.353,HR=1.984,95%CI =1.199~3.281),见图1B;CEA阳性组患者OS低于阴性组(P < 0.05,χ2=5.138,HR= 1.662,95% CI =1.057~2.614),见图1C;CA19-9阳性组患者OS低于阴性组(P < 0.05,χ2=4.609,HR= 1.660,95% CI =1.036~2.659),图1D;联合检测阳性组患者OS显著低于阴性组(P < 0.01,χ2=6.970,HR= 2.680,95% CI =1.576~4.557),见图1E。
3. 讨论
尽管目前手术、放化疗等手段提高了结肠癌的生存率,但其仍是全球死亡的常见病因之一,且近半数结肠癌表现为术后复发[9],本着早发现、早治疗为原则,有必要找到更加经济、便捷、方便的术前生化指标以改善患者预后提高生存率。越来越多的研究表明,肿瘤自身微环境的变化、相关炎症的发生在肿瘤的产生、发生、转移中起着重大作用[10],如中性粒细胞、淋巴细胞即可反映肿瘤激活因子与调控因子的变化从而导致恶性肿瘤的发生[11−12]。肿瘤相关中性粒细胞(Tumor associated neutrophils,TAN)主要通过细胞因子和趋化因子改变肿瘤微环境,在肿瘤微环境中,中性粒细胞大致分为2类,TAN(N1)主要作用为抑制肿瘤活性,TAN(N2)作用为促进肿瘤生长、转移[13]。众所周知,淋巴细胞为免疫细胞,但淋巴细胞会在肿瘤微环境及免疫作用相关的机制下产生功能障碍及疲惫[14],这就进一步导致了恶性肿瘤的进展。故结肠癌患者术前外周血会产生较高的NLR。
此外,虽然相关研究表明CEA、CA19-9为预测结肠癌风险的重要指标[15],但其作为结肠癌独立预后因素及风险筛查方面仍存在争议[16−17],且由于结肠癌的高度异质性,采用单一指标检测存在局限性,多种指标联合检测已被证实可以提高患者的生存预测[18]。
本次研究中,笔者采用1种炎症指标(NLR)+2种肿瘤标记物(CEA、CA19-9)来综合评估结肠癌患者的预后水平,发现与其他单一指标相比,NLR+CEA+CA19-9联合检测具有更高的阳性率及AUC面积,因此其作为预测结肠癌预后指标中拥有更高的诊断价值。此外,笔者还发现,通过Kaplan-Meier分析方法进行单因素分析时,NLR+CEA+CA19-9联合检测阳性组患者OS明显低于阴性组且HR较高,通过Cox风险比例模型进行多因素分析,术前血清中只有NLR及联合检测组为结肠癌患者预后的独立危险因素,而术前CEA、CA19-9似乎并不是结肠癌患者的预后独立危险因素,这与Wang等[19]究结果类似,笔者分析造成此种原因可能与样本量、不同的截断值有关,并且笔者发现CEA、CA19-9往往在Ⅰ期、Ⅱ期升高不明显,而在Ⅲ期升高较明显,这可能也是造成CEA、CA19-9在本研究中不是结肠癌患者预后独立危险因素的原因。总之,与单个血清学指标或肿瘤标记物相比,使用多种指标联合检测具有更高的预后价值。
本研究中可能存在一些不足,首先,本研究中纳入样本量可能存在不足,所有病人资料均来自同一家医院,患者资料可能存在不同型号机器误差,然而,本研究可作为扩展区域中心研究的理论基础;其次,本研究虽纳入患者诸多资料,如N分期、T分期,但未进行详细分类与分析,但这并不影响最终讨论结果。
综上所述,术前外周血中NLR+CEA+CA19-9是结肠癌的独立预后因素,因其具有快捷、经济、简便等多种优点,可作为结肠癌患者评估预后的参考指标。
-
表 1 结肠癌患者单因素分析
Table 1. Single factor analysis of colon cancer patients
类别 n 总生存 无病生存 生存率(%) P 生存率(%) P 性别 0.223 0.437 男 96 64.3 59.2 女 62 57.8 55.8 年龄(岁) 0.002* 0.083 ≤60 82 68.4 62.9 >60 76 53.8 45.5 肿瘤大小(cm) 0.001* 0.021* ≤4.5 73 66.4 60.7 >4.5 85 44.6 42.3 N分期 <0.001* <0.001* N0 93 70.4 68.6 N1 39 62.4 52.7 N2 26 40.2 37.3 T分期 0.329 0.089 T1-T2 26 60.7 53.4 T3-T4 132 48.3 44.6 分化程度 0.083 0.633 高分化 43 68.1 62.8 中分化 96 56.4 53.2 低分化 19 40.7 36.7 NLR 0.007* 0.015* <1.85 75 69.5 62.2 ≥1.85 83 51.3 46.1 CEA(ng/ml) 0.023* 0.010* <5 93 59.8 53.2 ≥5 65 40.8 38.1 CA19-9(U/ml) 0.035* 0.266 <28.3 78 62.8 56.4 ≥28.3 80 56.3 47.2 NLR+CEA+CA19-9 0.008* 0.008* 阴性组 23 69.6 62.6 阳性组 135 37.0 33.3 注:*P < 0.05。 表 2 结肠癌患者多因素分析
Table 2. Multivariate analysis of colon cancer patients
因素 总生存 无病生存 HR值(95%CI) P HR值(95%CI) P 年龄 1.004(0.529~1.904) 0.271 1.200(0.743~1.939) 0.456 肿瘤大小 1.454(0.837~2.194) 0.106 0.801(0.411~1.563) 0.515 N分期 2.804(1.373-5.724) <0.001* 2.514(1.627~3.882) <0.001* NLR 1.577(1.074~2.283) 0.035* 1.678(1.084~1.598) 0.021* CEA 1.088(0.871~1.493) 0.353 1.442(0.940~2.211) 0.094 CA19-9 0.860(0.774~1.249) 0.761 1.287(0.828~2.000) 0.262 NLR+CEA+CA19-9 2.664(1.503~4.315) 0.008* 1.927(1.211~2.908) 0.009* 注:*P < 0.05。 -
[1] Sung H,Ferlay J,Siegel R L,et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660 [2] 王红,曹梦迪,刘成成,等. 中国人群结直肠癌疾病负担: 近年是否有变?[J]. 中华流行病学杂志,2020,41(10):1633-1642. doi: 10.3760/cma.j.cn112338-20200306-00273 [3] Mazaki J,Katsumata K,Sujino H,et al. Neutrophil-to-lymphocyte ratio as a prognostic factor for colon cancer in elderly patients: A Propensity Score Analysis[J]. Anticancer Res,2021,41(9):4471-4478. doi: 10.21873/anticanres.15256 [4] Iaciu C I,Emilescu R A,Cotan H T,et al. Systemic neutrophil-to-lymphocyte ratio as a prognostic biomarker for colon cancer[J]. Chirurgia (Bucur),2023,118(3):260-271. doi: 10.21614/chirurgia.2023.v.118.i.3.p.260 [5] Yamamoto T,Kawada K ,Obama K. Inflammation-related biomarkers for the prediction of prognosis in colorectal cancer patients[J]. Int J Mol Sci,2021,22(15):8002-8009. [6] Vural S,Muhtaroğlu A ,Uygur FA. The relationship between preoperative CEA and CA19-9 status and patient characteristics and lymph node involvement in early-stage colon cancer[J]. Eur Rev Med Pharmacol Sci,2023,27(10): 4563-4569. [7] Ramesh S K, Swain S K, Munikrishnan V, et al. Can the inflammatory cell ratio NLR and PLR be used as a reliable marker in colon cancer? A prospective study[J]. Euroasian J Hepatogastroenterol,2023,13(2):61-65. [8] Mizuno H, Miyake H, Nagai H, et al. Optimal cutoff value of preoperative CEA and CA19-9 for prognostic significance in patients with stage II/III colon cancer[J]. Langenbecks Arch Surg,2021,406(6):1987-1997. [9] Gupta R,Bhatt L K,Johnston T P,et al. Colon cancer stem cells: Potential target for the treatment of colorectal cancer[J]. Cancer Biol Ther,2019,20(8):1068-1082. doi: 10.1080/15384047.2019.1599660 [10] Khandia R ,Munjal A. Interplay between inflammation and cancer[J]. Adv Protein Chem Struct Biol,2020,119(0):199-245. [11] Zhong J,Zong S,Wang J,et al. Role of neutrophils on cancer cells and other immune cells in the tumor microenvironment[J]. Biochim Biophys Acta Mol Cell Res,2023,1870(7):119493. doi: 10.1016/j.bbamcr.2023.119493 [12] Wang S,Sun J,Chen K,et al. Perspectives of tumor-infiltrating lymphocyte treatment in solid tumors[J]. BMC Med,2021,19(1):140-147. doi: 10.1186/s12916-021-02006-4 [13] Masucci M T,Minopoli M,Carriero M V. Tumor associated neutrophils. Their role in tumorigenesis,metastasis,prognosis and therapy[J]. Front Oncol,2019,9(1):1146. [14] Farhood B,Najafi M ,Mortezaee K. CD8(+) cytotoxic T lymphocytes in cancer immunotherapy: A review[J]. J Cell Physiol,2019,234(6): 8509-8521. [15] Hou S, Jing J, Wang Y, et al. Evaluation of clinical diagnostic and prognostic value of preoperative serum carcinoembryonic antigen, CA19-9, and CA24-2 for colorectal cancer[J]. Altern Ther Health Med,2023,29(6):192-197. [16] 侯文运,吴斌,林国乐,等. 术前外周血白细胞相关炎性指标预测结肠癌预后价值分析[J]. 中国实用外科杂志,2021,41(4):433-437,442. [17] Sekiguchi M ,Matsuda T. Limited usefulness of serum carcinoembryonic antigen and carbohydrate antigen 19-9 levels for gastrointestinal and whole-body cancer screening[J]. Sci Rep,2020,10(1): 18202. [18] Guo L,Wang Q,Chen K,et al. Prognostic value of combination of inflammatory and tumor markers in resectable gastric cancer[J]. J Gastrointest Surg,2021,25(10):2470-2483. doi: 10.1007/s11605-021-04944-z [19] Wang R,Xu B,Sun M,et al. Dynamic monitoring of serum CEA and CA19-9 predicts the prognosis of postoperative stage II colon cancer[J]. Eur J Surg Oncol,2023,49(12):107138. -






 下载:
下载:
 下载:
下载:

