miR-125b-5p Regulates HK2 to Inhibit Proliferation and Glycolysis of Gallbladder Cancer Cells
-
摘要:
目的 研究miR-125b-5p通过HK2调控人胆囊癌细胞增殖和糖酵解的作用机制。 方法 分别在人胆囊癌细胞GBC-SD中转染NC mimic、miR-125b-5p mimic、miR-125b-5p mimic+pcDNA-NC、miR-125b-5p mimic+pcDNA-HK2。实时荧光定量聚合酶链式反应(Real Time Quantitative Polymerase Chain Reaction,RT-qPCR)检测miR-125b-5p和HK2 mRNA的表达,Western blot检测HK2和LDHA、PDK1的蛋白表达。细胞计数试剂盒-8(cell countingKit-8,CCK-8)检测细胞增殖活力,糖酵解相关试剂盒检测乳酸生成、葡萄糖消耗以及ATP生成。双荧光素酶报告基因实验对miR-125b-5p和HK2的靶向关系进行验证。 结果 miR-125b-5p在胆囊癌细胞系GBC-SD和NOZ(P < 0.001)以及组织(P < 0.01)中表达降低,且在GBC-SD细胞中低于NOZ细胞中。过表达miR-125b-5p可显著抑制GBC-SD细胞的增殖(P < 0.05)、葡萄糖消耗(P < 0.05)、乳酸(P < 0.001)和ATP的生成(P < 0.01)以及LDHA(P < 0.01)、PDK1(P < 0.001)、HK2(P < 0.0001)表达。starBase数据库和双荧光素酶报告基因实验证实miR-125b-5p靶向负调控HK2。过表达miR-125b-5p和HK2组中细胞的增殖(P < 0.01)、葡萄糖摄取(P < 0.05)、乳酸(P < 0.01)和ATP(P < 0.05)的生成以及LDHA(P < 0.05)、PDK1(P < 0.05)、HK2(P < 0.05)表达显著高于仅过表达miR-125b-5p组。 结论 过表达miR-125b-5p靶向HK2,抑制人胆囊癌细胞GBC-SD的增殖和有氧糖酵解。 -
关键词:
- 胆囊癌 /
- miR-125b-5p /
- 增殖 /
- 糖酵解 /
- HK2
Abstract:Objective To investigate the mechanism of miR-125b-5p regulating the proliferation and glycolysis of gallbladder cancer cells by HK2. Methods NC mimic, miR-125b-5p mimic, miR-125b-5p mimic+pcDNA-NC and miR-125b-5p mimic+pcDNA-HK2 were transfected into human gallbladder carcinoma GBC-SD cells, respectively. Real Time Quantitative Polymerase Chain Reaction (RT-qPCR) was used to detect the expression of miR-125b-5p and HK2 mRNA. The protein expressions of HK2, LDHA and PDK1 were detected by Western blot. Cell counting Kit-8 (CCK-8) was used to measure cell proliferation activity, and the glycolysis kit was used to measure lactic acid production, glucose consumption, and ATP production. Dual luciferase reporter assay was used to verify the targeting relationship between miR-125b-5p and HK2. Results The expression of miR-125b-5p was reduced in gallbladder carcinoma cell lines GBC-SD, NOZ (P < 0.0001) and tissues (P < 0.01), and was lower in GBC-SD cells than in NOZ cells. Overexpression of miR-125b-5p significantly inhibited the proliferation of GBC-SD cells (P < 0.05), glucose intake (P < 0.05), the production of lactic acid (P < 0.001) and ATP production (P < 0.01), and the expression of LDHA (P < 0.01), PDK1 (P < 0.001), and HK2 (P < 0.0001). starBase database and dual luciferase experiments confirmed that miR-125b-5p targeted HK2 and negatively regulated its expression. Cell proliferation rate (P < 0.01), glucose consumption (P < 0.05), lactic acid (P < 0.01) and ATP production (P < 0.05), and the expression of LDHA (P < 0.05), PDK1 ( P < 0.05)、HK2 (P < 0.05)were significantly higher in the miR-125b-5p and HK2 overexpression groups. Conclusion Overexpression of miR-125b-5p inhibited the proliferation and aerobic glycolysis in human gallbladder carcinoma cell GBC-SD through targeting HK2. -
Key words:
- Gallbladder cancer /
- miR-125b-5p /
- Proliferation /
- Glycolysis /
- HK2
-
胆囊癌是常见的胆道恶性肿瘤。由于早期表现为腹痛和不适等非特异性症状,患者多于晚期才被确诊,错过了最佳的治疗时间,预后较差。据报道,胆囊癌患者的5 a生存率仅为4.1%[1]。因此,寻找胆囊癌的生物标志物对其临床诊断和治疗十分关键。miRNA是短链非编码RNA,通过与靶基因结合,调节转录和转录后水平的基因表达,进而参与多种生物过程。例如:过表达miR-1231可促进胆囊癌细胞的多西紫杉醇敏感性,减轻胆囊癌的恶性进展[2]。有氧糖酵解是肿瘤的标志,与肿瘤细胞的恶性生物学行为有关[3]。研究发现,miRNA与有氧糖酵解密切相关[4-5]。mR-153通过靶向抑制E3F3抑制甲状腺癌的糖酵解[6]。miR-142可糖酵解,抑制结直肠癌的转移[7]。miR-125b-5p被报道在包括乳腺癌[8]、食管鳞状细胞癌[9]、肝细胞癌[10]在内的多种肿瘤中表达降低。然而,关于miR-125b-5p在胆囊癌中的研究鲜有报道。因此,本研究将探讨miR-125b-5p调控胆囊癌细胞增殖和糖酵解的作用机制。
1. 材料与方法
1.1 实验材料
1.1.1 细胞
人永生化胆囊上皮细胞(Human gallbladder epithelial cells,HGBEC,货号:CL-416h)、人胆囊癌细胞系GBC-SD(货号:CL-365h)、NOZ(货号:CL-315h)、HEK-293T(货号:CL-209h)细胞购自武汉赛奥斯生物科技有限公司。
1.1.2 主要试剂
DMEM培养基(货号:MED-1001)购自武汉赛奥斯生物科技有限公司。RPMI 1640(货号:PM150110B)培养基购自武汉Pricella。NC mimic、miR-125b-5p mimic和miR-125b-5p mimic+pcDNA-NC和miR-125b-5p mimic+pcDNA-HK2引物序列是由广州锐博生物科技有限公司合成。兔抗HK2、LDHA、PDK1、GAPDH抗体以及山羊抗兔二抗购自Abcam。葡萄糖检测试剂盒(货号:ml095040)、乳酸含量试剂盒(货号:ml077360)、ATP含量试剂盒(货号:ml092826)购自上海Mlbio。BCA蛋白浓度测定试剂盒(货号:PC0020)、CCK-8试剂盒(货号:CA1210)购自北京Solarbio。TRIzol试剂(货号:R0016)和RIPA试剂(货号:P0013C)购自上海Beyotime。双荧光素酶试剂盒购自美国普洛麦格。
1.2 实验方法
1.2.1 细胞培养
HGBEC细胞培养在完全培养基中,GBC-SD细胞培养在含10%胎牛血清、1%双抗的RMPI 1640,NOZ细胞接种在DMEM培养基(10%胎牛血清和1%双抗)中。HEK-293T细胞培养在含10%胎牛血清、1% L-谷氨酰胺、1% NEAA和1%双抗的DMEM培养基中。将培养基置于37 ℃、5% CO2的细胞培养箱中。
1.2.2 细胞转染
取对数生长期的GBC-SD细胞,根据Lipofectamine 2000试剂盒说明书,分别将NC mimic、miR-125b-5p mimic和miR-125b-5p mimic+pcDNA-NC和miR-125b-5p mimic+pcDNA-HK2转染至GBC-SD细胞中。转染48 h后,通过实时荧光定量聚合酶链式反应(real time quantitative polymerase chain reaction,RT-qPCR)和Western blot检测转染效率。
1.2.3 RT-qPCR
TRIzol试剂用于提取细胞中的总RNA,通过逆转录试剂盒合成cDNA,SYBR™ Green PCR Master Mix用于qPCR测定。反应条件为:95 ℃ 15 s,95 ℃ 5 s,60 ℃ 30 s,共进行40个循环。U6作为miR-125b-5p的内参,GAPDH作为HK2的内参。2-ΔΔCt法计算目标基因的相对表达水平。引物序列,见表1。
表 1 引物序列Table 1. Primer sequences基因名 引物序列 (F:上游引物,R:下游引物,5′-3′) miR-125b-3p F:TCCCTGAGACCCTAACTTGTGA R:TCACAAGTTAGGGTCTCAGGGA U6 F:CGCTTCGGCAGCACATATAC R:AATATGGAACGCTTCACGA 1.2.4 Western blot
收集各组中的细胞,通过RIPA缓冲液裂解细胞,BCA试剂盒测定蛋白质浓度。将蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶进行分离,随后将蛋白质转移至聚偏二氟乙烯膜上,在5%脱脂牛奶溶液中封闭1 h。使用稀释后的一抗(HK2(1∶2000)、LDHA(1∶2000)、PDK1(1∶2000)、GAPDH(1∶2500))4 ℃过夜孵育,洗涤后加入二抗(1∶5000)在室温中孵育1 h。ECL化学发光试剂显示蛋白条带。化学发光信号凝胶成像仪采集图像,Image J软件分析蛋白条带灰度值。GAPDH作为实验内参。
1.2.5 细胞计数试剂盒-8(cell counting kit-8,CCK-8)
采用CCK-8试剂盒检测蛋白质的增殖活力。收集转染后的各组细胞,以6×103个/孔的密度接种至96孔板中,在细胞培养箱中培养适当时间(0、24、48、72 h),并在对应时间点向每孔中加入CCK-8试剂20 μL。孵育2 h后通过酶标仪检测450 nm处吸光度值。
1.2.6 葡萄糖摄取、乳酸生成以及ATP水平检测
以1×105的密度将细胞接种至12孔板中,过夜培养后弃去细胞培养基,用PBS洗涤细胞两地。将细胞接种至37 ℃含74~148 kBq/mL 18F-FDG的葡萄糖细胞培养基中培养1h,PBS洗涤细胞2次,并加入0.5 M NaOH 1mL用于裂解细胞。γ计数器用于检测裂解物中的放射性。细胞内18F-FDG摄取标准化为相应细胞数的放射性读数[11]。
通过乳酸含量试剂盒和ATP含量试剂盒用于测定乳酸生成量和ATP的水平。根据试剂盒说明书,收集细胞上清液用于乳酸浓度测定,下层细胞沉淀裂解后用于测量ATP的含量。
1.2.7 双荧光素酶报告基因实验
将与miR-125b-5p具有结合序列的野生型HK2和突变型HK2克隆到pGL3-control载体中。将细胞接种至24孔板中,分别将NC mimic、miR-125b-5pmimic和HK2-WT或HK2-MUT转染至HEK-293T细胞中。转染48 h后收集细胞,利用双荧光素酶报告基因检测试剂盒通过TD-20/20发光计检测双荧光素酶活性,以海肾荧光素酶活性作为内参。
1.3 统计学处理
所有数据均采用GraphPad Prism 8.0分析和作图。数据表示为“均值±标准差”($\bar x \pm s $)。2组间比较采用t检验,多组间比较采用单因素方差分析。所有实验均进行3次重复。P < 0.05表示差异有统计学意义。
2. 结果
2.1 miR-125b-5p在胆囊癌组织和细胞中表达降低
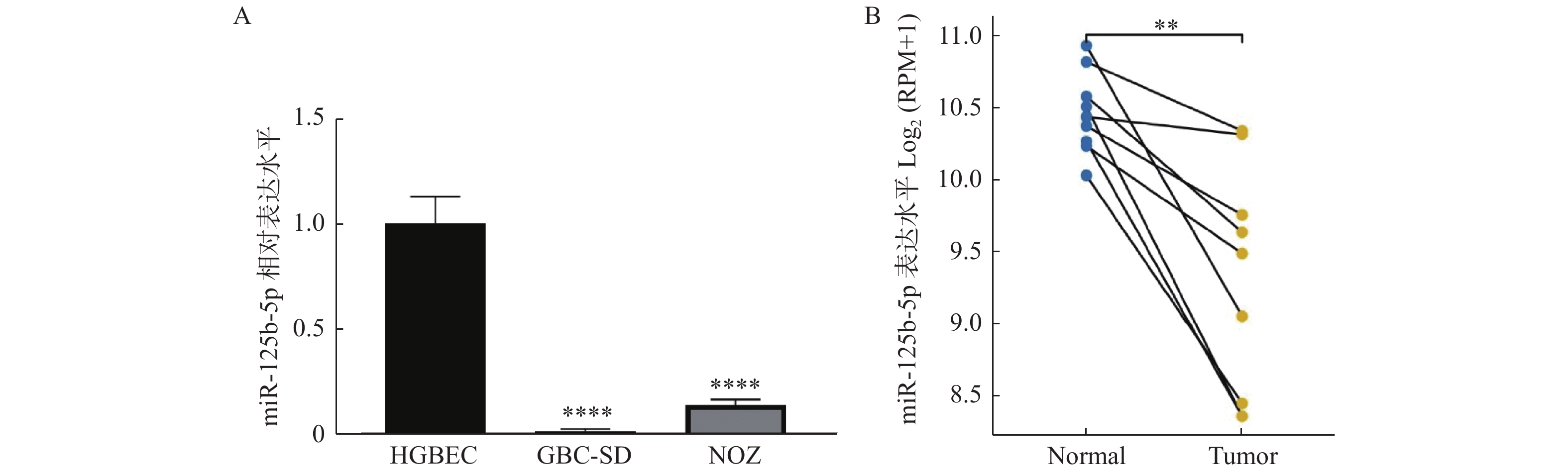
收集人胆囊上皮细胞HGBEC和胆囊癌细胞GBC-SD、NOZ,分别提取RNA,通过RT-qPCR测定miR-125b-5p的表达,发现miR-125b-5p在GBC-SD和NOZ细胞中表达低于HGBEC细胞(P < 0.0001),见图1A,且在GBC-SD细胞中表达更低。进一步通过TCGA数据库预测发现,miR-125b-5p在胆囊癌组织中的表达低于对应的癌旁组织(P < 0.01),见图1B。因此,推断miR-125b-5p的低表达与胆囊癌的发生密切相关,且选择GBC-SD细胞作为实验细胞进一步研究。
2.2 过表达miR-125b-5p抑制GBC-SD细胞增殖和有氧糖酵解
为进一步探索miR-125b-5p在胆囊癌中的调控作用,分别在GBC-SD细胞中转染NC mimic和miR-125b-5p mimic,通过RT-qPCR检测发现,NC mimic组中miR-125b-5p的表达与NC组相比无统计学差异(P > 0.05),见图2A。转染miR-125b-5pmimic组中miR-125b-5p的表达明显高于NC mimic组(P < 0.01)。CCK-8显示,过表达miR-125b-5p可明显抑制细胞的增殖活力(P < 0.05),见图2B。糖酵解相关指标检测表明,过表达miR-125b-5p组GBC-SD细胞中乳酸生成量(P < 0.001),见图2C、葡萄糖消耗量(P < 0.05),见图2D以及ATP生成减少(P < 0.01),见图2E,LDHA(P < 0.01),见图2F和G、PDK1(P < 0.001)和HK2(P < 0.0001),见图2F和图2G蛋白表达降低。综上可知,过表达miR-125b-5p显著抑制GBC-SD细胞增殖以及有氧糖酵解。
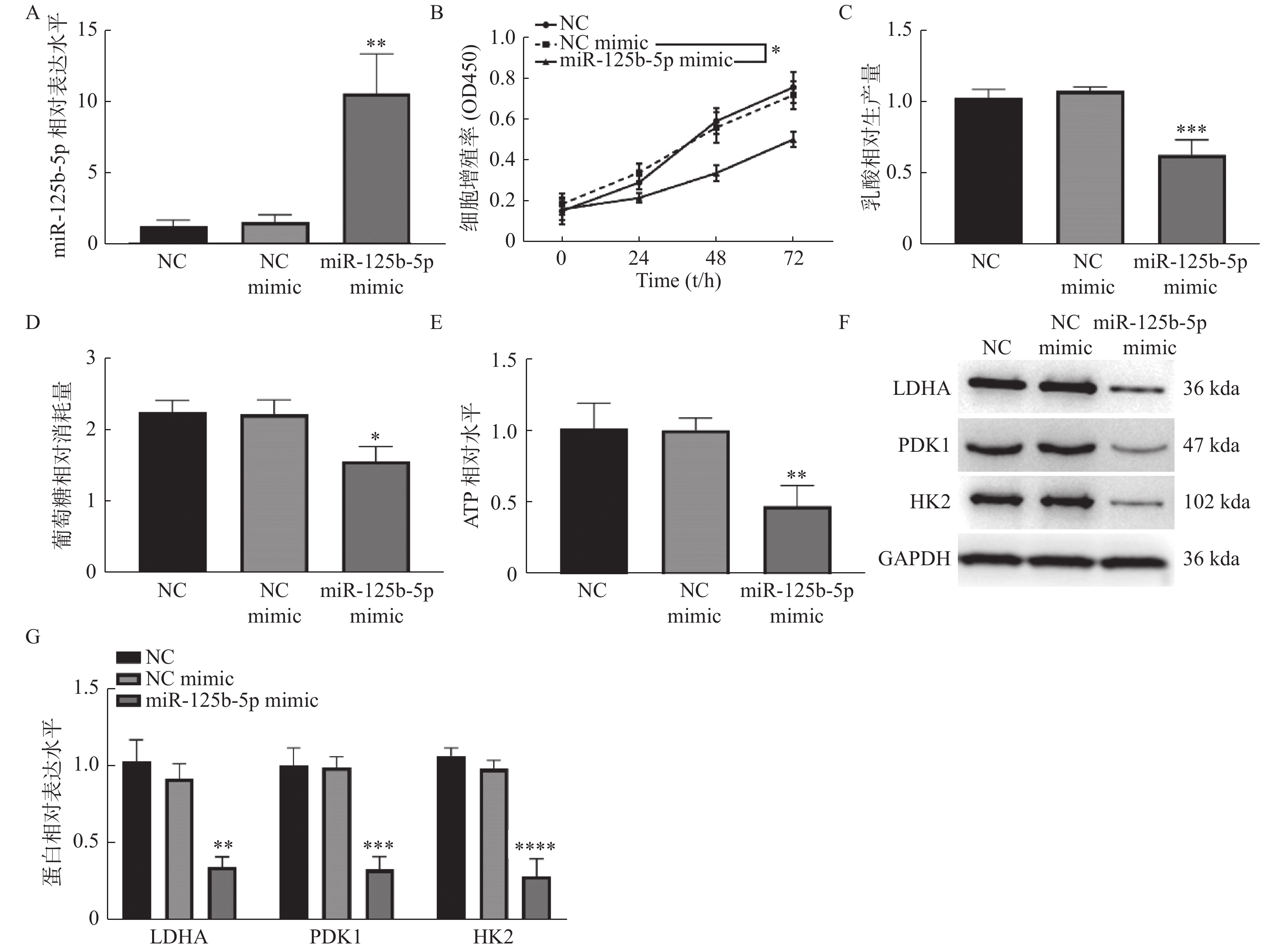 图 2 过表达miR-125b-5p抑制GBC-SD细胞增殖和有氧糖酵解A:RT-qPCR检测miR-125b-5pmimic的转染效率;B:CCK-8检测细胞增殖活力;C:乳酸生成量检测;D:葡萄糖消耗量检测;E:ATP水平检测;F:Western blot检测LDHA、PDK1和的蛋白表达。HK2与NC mimic组相比,*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001。Figure 2. Over-expression of miR-125b-5p inhibited the proliferation and aerobic glycolysis in GBC-SD cell
图 2 过表达miR-125b-5p抑制GBC-SD细胞增殖和有氧糖酵解A:RT-qPCR检测miR-125b-5pmimic的转染效率;B:CCK-8检测细胞增殖活力;C:乳酸生成量检测;D:葡萄糖消耗量检测;E:ATP水平检测;F:Western blot检测LDHA、PDK1和的蛋白表达。HK2与NC mimic组相比,*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001。Figure 2. Over-expression of miR-125b-5p inhibited the proliferation and aerobic glycolysis in GBC-SD cell2.3 miR-125b-5p靶向负调控HK2
通过starBase数据库预测发现HK2与miR-125b-5p存在靶向结合位点,见图3A,双荧光素酶实验结果表明过表达miR-125b-5p可显著抑制HK2野生型载体的荧光素酶活性(P < 0.01),见图3B,而对突变型HK2载体的荧光素酶活性无明显作用(P > 0.05)。RT-qPCR和Westernblot检测发现,HK2 mRNA(P < 0.0001),见图3C和蛋白(P < 0.0001),见图3D和图3E,水平在胆囊癌细胞系GBC-SD和NOZ中表达高于胆囊上皮细胞HGBEC,且过表达miR-125b-5p显著抑制HK2 mRNA(P < 0.01),见图3F和蛋白(P < 0.001),见图3G和图3H表达。由此说明miR-125b-5p靶向HK2,且负调控HK2的表达。
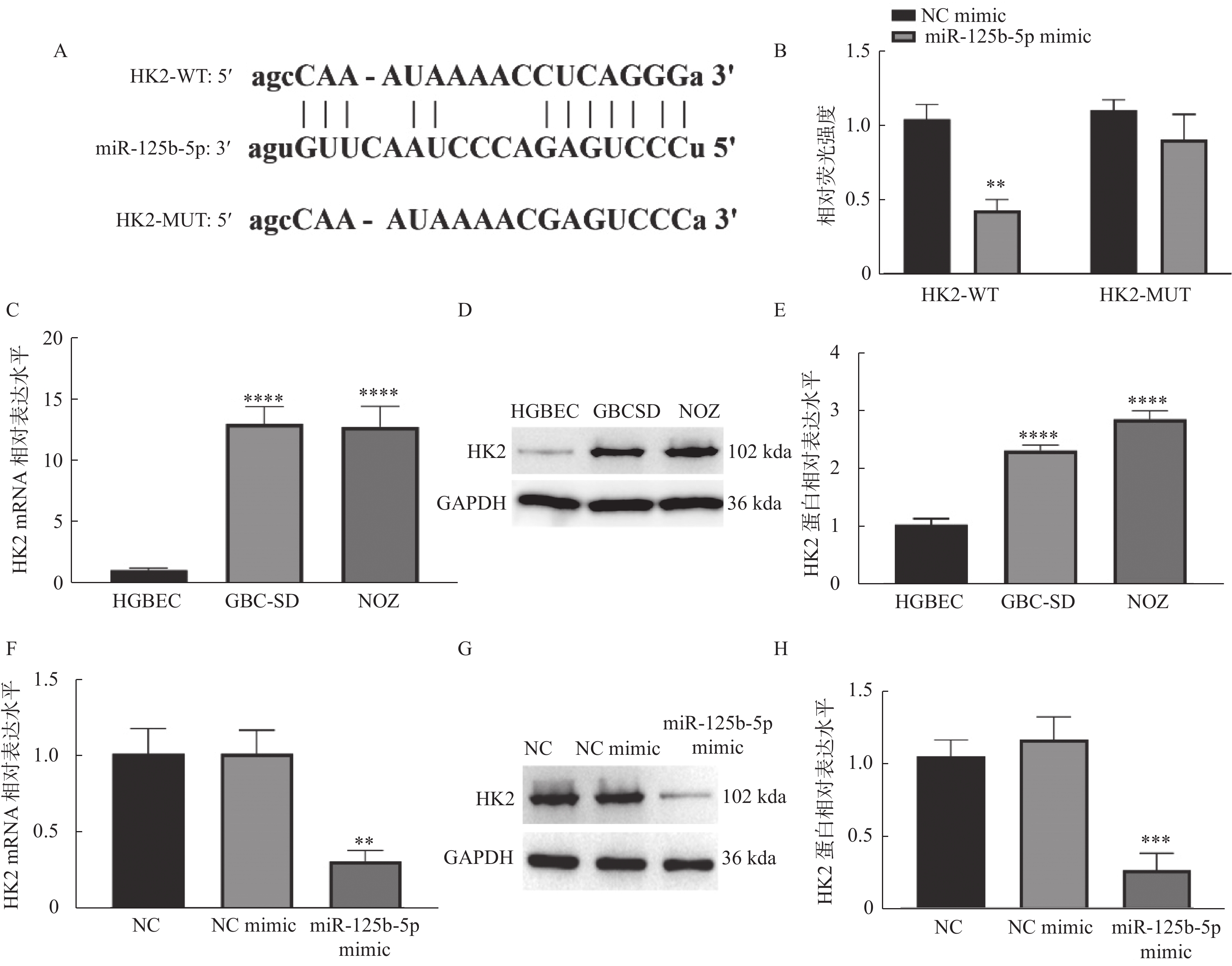 图 3 miR-125b-5p靶向负调控HK2A:starBase数据数据库预测miR-125b-5p和HK2的靶向结合位点;B:双荧光素酶实验验证靶向关系,与NC mimic组相比,**P < 0.01;C:RT-qPCR检测HK2在胆囊癌和胆囊上皮细胞系中的mRNA水平,与HGBEC组相比,****P < 0.0001;D:Western blot检测HK2在胆囊癌和胆囊上皮细胞系中的蛋白水平,与HGBEC组相比,****P < 0.0001;E:RT-qPCR检测过表达miR-125-5p对HK2 mRNA水平的影响,与NC mimic组相比,**P < 0.01;F:Western blot检测过表达miR-125-5p对HK2蛋白水平的影响,与NC mimic组相比,***P < 0.001;G-H:Western blot检测过表达miR-125-5p对HK2蛋白水平的影响,与NC mimic组相比,***P < 0.001。Figure 3. miR-125b-5p targeted and negatively regulated HK2
图 3 miR-125b-5p靶向负调控HK2A:starBase数据数据库预测miR-125b-5p和HK2的靶向结合位点;B:双荧光素酶实验验证靶向关系,与NC mimic组相比,**P < 0.01;C:RT-qPCR检测HK2在胆囊癌和胆囊上皮细胞系中的mRNA水平,与HGBEC组相比,****P < 0.0001;D:Western blot检测HK2在胆囊癌和胆囊上皮细胞系中的蛋白水平,与HGBEC组相比,****P < 0.0001;E:RT-qPCR检测过表达miR-125-5p对HK2 mRNA水平的影响,与NC mimic组相比,**P < 0.01;F:Western blot检测过表达miR-125-5p对HK2蛋白水平的影响,与NC mimic组相比,***P < 0.001;G-H:Western blot检测过表达miR-125-5p对HK2蛋白水平的影响,与NC mimic组相比,***P < 0.001。Figure 3. miR-125b-5p targeted and negatively regulated HK22.4 miR-125b-5p靶向HK2抑制GBC-SD细胞增殖和有氧糖酵解
进一步研究胆囊癌细胞中miR-125b-5p对HK2的调控机制,分别在GBC-SD细胞中转染NC mimic、miR-125b-5p mimic、miR-125b-5p mimic+pcDNA-NC以及miR-125b-5p mimic+pcDNA-HK2,RT-qPCR检测发现,转染miR-125b-5p mimic+pcDNA-NC组中HK2 mRNA水平与miR-125b-5p mimic组相比,差异无统计学意义(P > 0.05),转染miR-125b-5p mimic+pcDNA-HK2组中HK2的表达高于miR-125b-5p mimic组(P < 0.05)。CCK-8和糖酵解相关检指标测发现,同时过表达miR-125b-5p和HK2组中细胞增殖活力(P < 0.01),见图4B、乳酸生成(P < 0.01),见图4C、葡萄糖消耗(P < 0.05),见图4D、ATP生成(P < 0.05),见图4E,LDHA(P < 0.001),见图4F和图4G、PDK1(P < 0.001),见图4F和图4G,HK2(P < 0.0001),见图4F和图4G,蛋白表达显著高于miR-125b-5p mimic+pcDNA-NC组。综上可知,过表达HK2可逆转过表达miR-125b-5p对细胞增殖和有氧糖酵解的抑制作用。
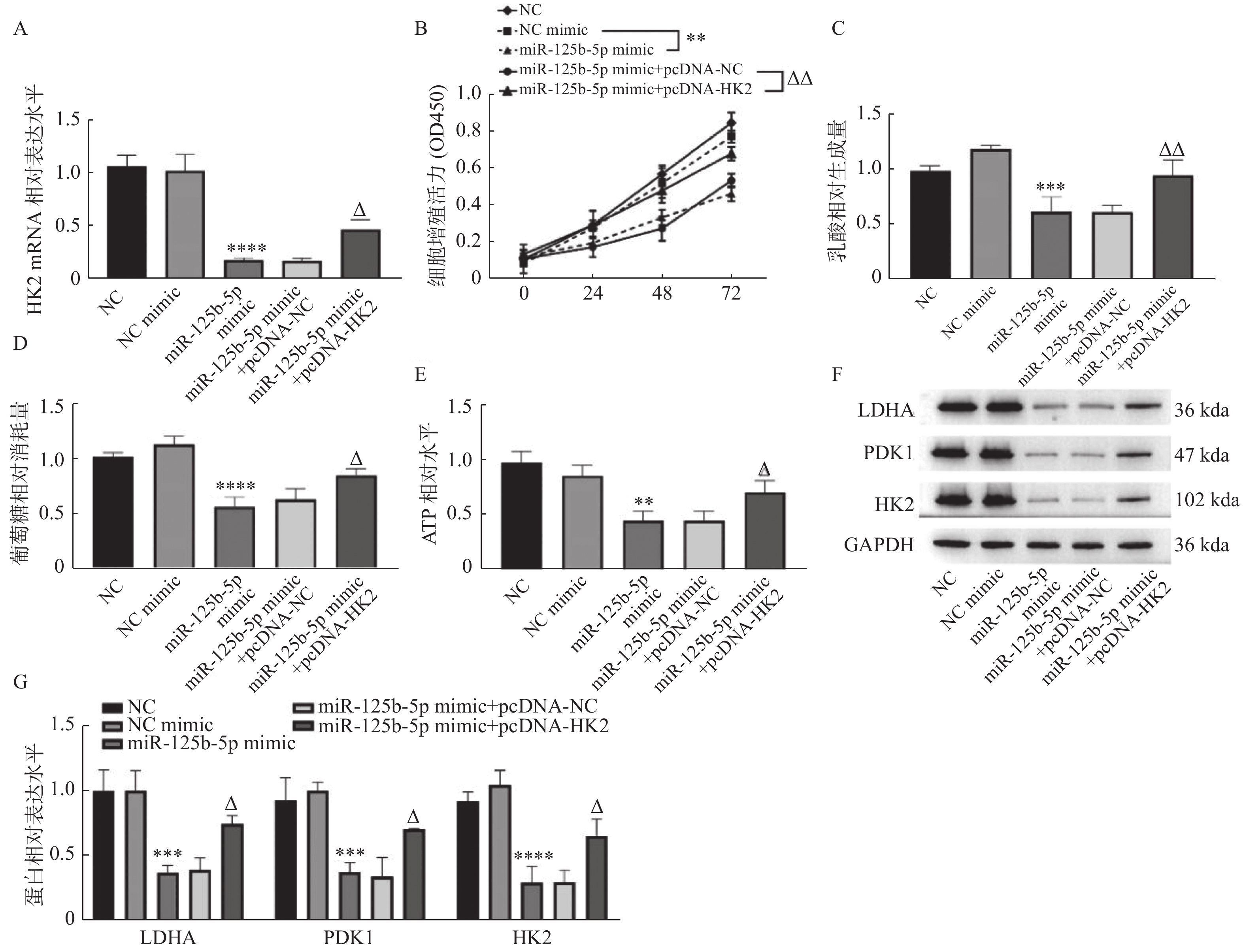 图 4 miR-125b-5p靶向HK2抑制GBC-SD细胞增殖和有氧糖酵解A:RT-qPCR检测HK2 mRNA表达;B:CCK-8检测细胞增殖活力;C:乳酸含量检测;D:葡萄糖消耗量检测;E:ATP水平检测;F和G:LDHA、PDK1和HK2的蛋白水平测定。与NC mimic组相比,**P < 0.01,***P < 0.001,****P < 0.0001;与miR-125b-5p mimic+pcDNA-NC组相比,△P < 0.05,△△P < 0.01。Figure 4. miR-125b-5p inhibited theproliferationandaerobic glycolysis in GBC-SD cellby targeting HK2
图 4 miR-125b-5p靶向HK2抑制GBC-SD细胞增殖和有氧糖酵解A:RT-qPCR检测HK2 mRNA表达;B:CCK-8检测细胞增殖活力;C:乳酸含量检测;D:葡萄糖消耗量检测;E:ATP水平检测;F和G:LDHA、PDK1和HK2的蛋白水平测定。与NC mimic组相比,**P < 0.01,***P < 0.001,****P < 0.0001;与miR-125b-5p mimic+pcDNA-NC组相比,△P < 0.05,△△P < 0.01。Figure 4. miR-125b-5p inhibited theproliferationandaerobic glycolysis in GBC-SD cellby targeting HK23. 讨论
胆囊癌是常见的胃肠道癌症,具有明显的地域差异。在高发地区,女性的发病率明显高于男性[12]。尽管诊断技术和治疗管理方面取得了很大的进步,但胆囊癌患者的预后仍然较差。研究可靠的生物标志物对胆囊癌患者的临床诊断和治疗至关重要。有氧糖酵解增强是肿瘤细胞的一个显著特征。虽然有氧糖酵解在产生ATP方面效率低于无氧糖酵解,但它能促进增殖、抑制凋亡,产生信号代谢物,进而促进细胞在分子压力下的生存率。因此,研究胆囊癌中糖酵解的产生机制十分重要。
miRNA在调节生长发育及其他重要的生物学功能中发挥重要作用。目前,大量miRNA已被作为疾病的诊断生物标志物、癌症亚型的生物标志物以及治疗靶点进行研究[13]。miR-125b-5p已被报道参与多种疾病的调控。例如:Jin等[14]报道,敲降miR-125b-5p可抑制RYBP的表达,抑制胃癌细胞恶性生物学行为。骨髓间充质干细胞外泌体来源的miR-125b-5p通过靶向抑制缺血性急性肾损伤中肾小管上皮细胞的P53表达,从而促进肾小管修复[15]。本研究发现miR-125b-5p在胆囊癌细胞中表达降低,过表达b可显著抑制胆囊癌细胞GBC-SD的增殖、乳酸生成、葡萄糖消耗、ATP生成以及LDHA、PDK1和HK2蛋白表达。这与Yang等[16]报道的结果一致,同时,证明过表达miR-125b-5p可增加顺铂处理后的胆囊癌细胞的死亡,促进癌细胞的化疗敏感性。
己糖激酶2(hexokinase 2,HK2)是一种糖酵解酶,促进细胞中葡萄糖代谢,进而催化Warburg效应。已经在多种癌症中观察到HK2上调,促进肿瘤细胞的增殖、转移和耐药性[17-18]。在结直肠癌细胞中,上调HK2可促进结直肠癌细胞的葡萄糖消耗和乳酸生成及癌细胞的耐药性[19]。在卵巢癌中,抑制HK2表达可拮抗卵巢癌细胞的Warburg效应,抑制卵巢癌发展进程[20]。过表达miR-9-1显著降低HK2蛋白水平,抑制了鼻咽癌细胞的增殖和糖酵解[21]。本研究中,发现HK2是miR-125b-5p的靶基因,且负调控HK2的表达。过表达HK2可逆转过表达miR-125b-5p对胆囊癌细胞增殖和糖酵解的抑制作用。此外,HK2也被报道在胆囊癌细胞中作为miR-143的靶基因,与lncRNA PVT1共同竞争和miR-143的结合位点,促进胆囊癌细胞的增殖和转移[22]。
综上所述,胆囊癌组织和细胞中miR-125b-5p低表达,过表达miR-125b-5p靶向抑制HK2的表达,进而抑制人胆囊癌细胞GBC-SD的增殖和有氧糖酵解,miR-125b-5p/HK2分子轴的调控作用可为胆囊癌的临床诊断和治疗提供新的理论依据。
-
图 2 过表达miR-125b-5p抑制GBC-SD细胞增殖和有氧糖酵解
A:RT-qPCR检测miR-125b-5pmimic的转染效率;B:CCK-8检测细胞增殖活力;C:乳酸生成量检测;D:葡萄糖消耗量检测;E:ATP水平检测;F:Western blot检测LDHA、PDK1和的蛋白表达。HK2与NC mimic组相比,*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001。
Figure 2. Over-expression of miR-125b-5p inhibited the proliferation and aerobic glycolysis in GBC-SD cell
图 3 miR-125b-5p靶向负调控HK2
A:starBase数据数据库预测miR-125b-5p和HK2的靶向结合位点;B:双荧光素酶实验验证靶向关系,与NC mimic组相比,**P < 0.01;C:RT-qPCR检测HK2在胆囊癌和胆囊上皮细胞系中的mRNA水平,与HGBEC组相比,****P < 0.0001;D:Western blot检测HK2在胆囊癌和胆囊上皮细胞系中的蛋白水平,与HGBEC组相比,****P < 0.0001;E:RT-qPCR检测过表达miR-125-5p对HK2 mRNA水平的影响,与NC mimic组相比,**P < 0.01;F:Western blot检测过表达miR-125-5p对HK2蛋白水平的影响,与NC mimic组相比,***P < 0.001;G-H:Western blot检测过表达miR-125-5p对HK2蛋白水平的影响,与NC mimic组相比,***P < 0.001。
Figure 3. miR-125b-5p targeted and negatively regulated HK2
图 4 miR-125b-5p靶向HK2抑制GBC-SD细胞增殖和有氧糖酵解
A:RT-qPCR检测HK2 mRNA表达;B:CCK-8检测细胞增殖活力;C:乳酸含量检测;D:葡萄糖消耗量检测;E:ATP水平检测;F和G:LDHA、PDK1和HK2的蛋白水平测定。与NC mimic组相比,**P < 0.01,***P < 0.001,****P < 0.0001;与miR-125b-5p mimic+pcDNA-NC组相比,△P < 0.05,△△P < 0.01。
Figure 4. miR-125b-5p inhibited theproliferationandaerobic glycolysis in GBC-SD cellby targeting HK2
表 1 引物序列
Table 1. Primer sequences
基因名 引物序列 (F:上游引物,R:下游引物,5′-3′) miR-125b-3p F:TCCCTGAGACCCTAACTTGTGA R:TCACAAGTTAGGGTCTCAGGGA U6 F:CGCTTCGGCAGCACATATAC R:AATATGGAACGCTTCACGA -
[1] Sharma A,Sharma K L,Gupta A,et al. Gallbladder cancer epidemiology,pathogenesis and molecular genetics:Recent update[J]. World J Gastroenterol,2017,23(22):3978-3998. doi: 10.3748/wjg.v23.i22.3978 [2] Gong Y Q,Ni J L,Fang Q,et al. MiR-1231 enhances docetaxel sensitivity to gallbladder carcinoma cells by downregulating FOXC2[J]. Eur Rev Med Pharmacol Sci,2020,24(23):12116-12123. [3] Zheng Y,Liu P,Wang N,et al. Betulinic acid suppresses breast cancer metastasis by targeting GRP78-mediated glycolysis and ER stress apoptotic pathway[J]. Oxid Med Cell Longev,2019,2019:8781690. [4] Li J,Hu Z Q,Yu S Y,et al. CircRPN2 inhibits aerobic glycolysis and metastasis in hepatocellular carcinoma[J]. Cancer Res,2022,82(6):1055-1069. doi: 10.1158/0008-5472.CAN-21-1259 [5] Arora S,Singh P,Tabassum G,et al. miR-16-5p regulates aerobic glycolysis and tumorigenesis of NSCLC cells via LDH-A/lactate/NF-κB signaling[J]. Life Sci,2022,304:120722. doi: 10.1016/j.lfs.2022.120722 [6] Zhu Y,Li F,Wan Y,et al. Cancer-secreted exosomal miR-620 inhibits ESCC aerobic glycolysis via FOXM1/HER2 pathway and promotes metastasis[J]. Front Oncol,2022,12:756109. doi: 10.3389/fonc.2022.756109 [7] Ren J,Li W,Pan G,et al. miR-142-3p modulates cell invasion and migration via PKM2-mediated aerobic glycolysis in colorectal cancer[J]. Anal Cell Pathol (Amst),2021,2021:9927720. [8] Zhai D,Li T,Ye R,et al. LncRNA LGALS8-AS1 promotes breast cancer metastasis through miR-125b-5p/SOX12 feedback regulatory network[J]. Front Oncol,2021,11:711684. doi: 10.3389/fonc.2021.711684 [9] Mei L L,Wang W J,Qiu Y T,et al. miR-125b-5p functions as a tumor suppressor gene partially by regulating HMGA2 in esophageal squamous cell carcinoma[J]. PLoS One,2017,12(10):e0185636. doi: 10.1371/journal.pone.0185636 [10] Hu B,Yang X B,Yang X,et al. LncRNA CYTOR affects the proliferation,cell cycle and apoptosis of hepatocellular carcinoma cells by regulating the miR-125b-5p/KIAA1522 axis[J]. Aging (Albany NY),2020,13(2):2626-2639. [11] Hua Q,Jin M,Mi B,et al. LINC01123,a c-Myc-activated long non-coding RNA,promotes proliferation and aerobic glycolysis of non-small cell lung cancer through miR-199a-5p/c-Myc axis[J]. J Hematol Oncol,2019,12(1):91. doi: 10.1186/s13045-019-0773-y [12] Randi G,Franceschi S,La Vecchia C. Gallbladder cancer worldwide:Geographical distribution and risk factors[J]. Int J Cancer,2006,118(7):1591-602. doi: 10.1002/ijc.21683 [13] Sharma Y,Saini A K,Kashyap S,et al. Host miRNA and immune cell interactions:Relevance in nano-therapeutics for human health[J]. Immunol Res,2022,70(1):1-18. doi: 10.1007/s12026-021-09247-8 [14] Jin F E,Xie B,Xian H Z,et al. Knockdown of miR-125b-5p inhibits the proliferation and invasion of gastric carcinoma cells by targeting RYBP[J]. Kaohsiung J Med Sci,2021,37(10):863-871. doi: 10.1002/kjm2.12425 [15] Cao J Y,Wang B,Tang T T,et al. Exosomal miR-125b-5p deriving from mesenchymal stem cells promotes tubular repair by suppression of p53 in ischemic acute kidney injury[J]. Theranostics,2021,11(11):5248-5266. doi: 10.7150/thno.54550 [16] Yang D,Zhan M,Chen T,et al. miR-125b-5p enhances chemotherapy sensitivity to cisplatin by down-regulating Bcl2 in gallbladder cancer[J]. Sci Rep,2017,7:43109. doi: 10.1038/srep43109 [17] Wang J,Huang Q,Hu X,et al. Disrupting circadian rhythm via the PER1-HK2 axis reverses trastuzumab resistance in gastric cancer[J]. Cancer Res,2022,82(8):1503-1517. [18] Guo D,Tong Y,Jiang X,et al. Aerobic glycolysis promotes tumor immune evasion by hexokinase2-mediated phosphorylation of IκBα[J]. Cell Metab,2022,34(9):1312-1324.e6. doi: 10.1016/j.cmet.2022.08.002 [19] Shi T,Ma Y,Cao L,et al. B7-H3 promotes aerobic glycolysis and chemoresistance in colorectal cancer cells by regulating HK2[J]. Cell Death Dis,2019,10(4):308. [20] Lu J, Zhen S, Tuo X, et al. Downregulation of DNMT3A attenuates the warburg effect, proliferation, and invasion via promoting the inhibition of miR-603 on HK2 in ovarian cancer[J]. Technol Cancer Res Treat, 2022, 21: 15330338221110668. [21] Xu Q L,Luo Z,Zhang B,et al. Methylation-associated silencing of miR-9-1 promotes nasopharyngeal carcinoma progression and glycolysis via HK2[J]. Cancer Sci,2021,112(10):4127-4138. doi: 10.1111/cas.15103 [22] Chen J,Yu Y,Li H,et al. Long non-coding RNA PVT1 promotes tumor progression by regulating the miR-143/HK2 axis in gallbladder cancer[J]. Mol Cancer,2019,18(1):33. doi: 10.1186/s12943-019-0947-9 期刊类型引用(5)
1. 梁锦玲. 经腹部与经阴道彩超联合检查对剖宫产子宫瘢痕妊娠的诊断价值. 影像研究与医学应用. 2024(05): 169-171 .  百度学术
百度学术2. 丁洁. 经阴道三维超声在早期剖宫产瘢痕妊娠中的应用价值研究. 影像研究与医学应用. 2023(10): 141-143 .  百度学术
百度学术3. 吕显玉,朱武银,姚奇. 经阴道超声在剖宫产术后子宫瘢痕妊娠诊断中的效果分析. 世界复合医学. 2023(06): 46-49 .  百度学术
百度学术4. 林晓艺,吴延华,陈艺珠. 经腹部超声联合经阴道超声诊断瘢痕妊娠的临床价值分析. 临床医学工程. 2023(08): 1045-1046 .  百度学术
百度学术5. 安雅楠,王珺,饶克宇,陈素文. 瘢痕部位血管微循环参数联合子宫内膜容受性标志物诊断早孕期瘢痕妊娠价值. 中国计划生育学杂志. 2023(09): 2157-2159+2165 .  百度学术
百度学术其他类型引用(0)
-






 下载:
下载:
 下载:
下载:

